多重实时荧光PCR检测禽网状内皮组织增生症病毒方法的建立以及初步应用
2015-12-30鲍衍清邵红霞秦爱建
缪 佶,鲍衍清,邵红霞,钱 琨,秦爱建
(1.教育部禽类预防医学省部共建重点实验室,扬州225009;2.扬州大学 江苏省动物预防医学重点实验室,扬州225009)
·研究论文·
多重实时荧光PCR检测禽网状内皮组织增生症病毒方法的建立以及初步应用
缪 佶1,2,鲍衍清1,2,邵红霞1,2,钱 琨1,2,秦爱建1,2
(1.教育部禽类预防医学省部共建重点实验室,扬州225009;2.扬州大学 江苏省动物预防医学重点实验室,扬州225009)
本文建立了一种快速、灵敏、特异性强的禽网状内皮组织增生症病毒(Reticuloendotheliosis virus,REV)检测方法,并对REV在鸡胚成纤维细胞(chick embryo fi broblast,CEF)上的增殖动态规律进行研究。分别针对gag、env以及LTR基因的保守序列设计3对引物,利用重组质粒作为模板,绘制3种不同基因的标准曲线。检测结果显示,本研究建立了多重实时荧光PCR检测方法,所制备的标准品模板在108~ 101copies范围内与Ct值之间呈现良好的线性关系,且最低检出量为101copies。REV感染CEF后gag、env、LTR基因的拷贝数均先减少后增多。通过实时荧光PCR技术与间接免疫荧光方法检测,发现REV在CEF上复制的初始阶段呈现病毒适应过程,此后病毒大量复制,表现出明显的增长趋势。该研究不仅为REV的诊断技术提供了一种新的方法,同时也为深入研究REV的感染机制和致病机理奠定了基础。
禽网状内皮组织增生症病毒;鸡胚成纤维细胞;实时荧光PCR;复制
禽网状内皮组织增生症病毒(Reticuloendotheliosis virus,REV)最初于1958年从火鸡脾脏中分离出,属于反转录病毒科,能引起鸡、鸭、鹅、火鸡和其他禽类发生免疫抑制、肿瘤形成和矮小综合征[1]。该病毒所引起的网状内皮组织增生症在英国、德国、澳大利亚、匈牙利等国均有报道,中国于20世纪80年代在南京首次分离到[2]。目前已分离到的不同毒株虽致病力不同,但均属于同一血清型,具有相似的抗原性。REV在我国家禽中的流行越来越严重,感染率已达20%~30%[3]。该病毒不仅能垂直传播,亦可通过接触水平传播。另一方面,REV在疫苗等生物制品中的污染和传播也是引起感染和流行的重要因素[4-6]。此外,REV与其他免疫抑制病毒在鸡群中的混合感染已严重危害当前养禽业的发展[7,8]。
目前,对于REV分子流行病学以及致病机理的研究尚有不足。随着分子生物学技术更广泛地应用于病毒学研究,实时荧光定量PCR技术以其快速、敏感、特异性强等优点在病毒定性和定量检测以及基因表达水平分析等方面取得迅猛的发展[9,10]。本研究针对REV的gag基因、env基因以及LTR基因,分别建立了SYBR Green I实时荧光PCR检测方法,并首次应用于该病毒的体外复制动力学研究,与传统方法相比更加快速、敏感,为REV的检测以及致病机理、免疫抑制等方面研究提供了一种有效的手段。
1 材料与方法
1.1 病毒与细胞禽网状内皮组织增生症病毒(REV)、禽白血病J亚群病毒(Avian leukosis virus-J subgroup, ALV-J)、鸡传染性贫血病毒(Chicken infectious anemia virus,CAV)以及鸡马立克氏病毒(Marek' s disease virus,MDV)均由本实验室自主分离与保存;SPF鸡胚由北京梅里亚维通实验动物技术有限公司提供,经常规方法制备成鸡胚成纤维细胞。
1.2 主要试剂总RNA提取试剂盒、胶回收试剂盒以及小量质粒抽提试剂盒均为Axygen公司产品;pGEM-T Easy载体购自Promega公司;cDNA反转录试剂盒以及SYBR Green荧光定量PCR通用试剂盒等购自TaKaRa公司;基础培养基:DMEM粉(Gibco公司)13.4 g、NaHCO33.7 g、超纯水1000 mL,用盐酸调节pH至7.2~7.4,过滤除菌后于4℃保存;5%生长液:95 mL基础培养基加5 mL胎牛血清(Gibco公司);1%维持液:40 mL基础培养基中加入10 mL 的5%生长液。
1.3 引物设计通过DNAStar软件对GenBank中已公布的参考序列进行分析,并根据其中gag基因、env基因以及LTR基因中的保守序列,利用Primer Premier 5.0软件设计特异性引物(表1),由上海英骏生物技术有限公司合成。
1.4 RNA的提取与cDNA合成感染病毒的细胞用RNA提取试剂盒中溶液重悬,并按照试剂盒说明提取基因组RNA,最终将提取的总RNA溶于50 μLTE缓冲液中,-70℃保存。取上述所提总RNA(1 μg)进行反转录,按照试剂盒中提供反应体系进行反转录,总体积为20 μL。
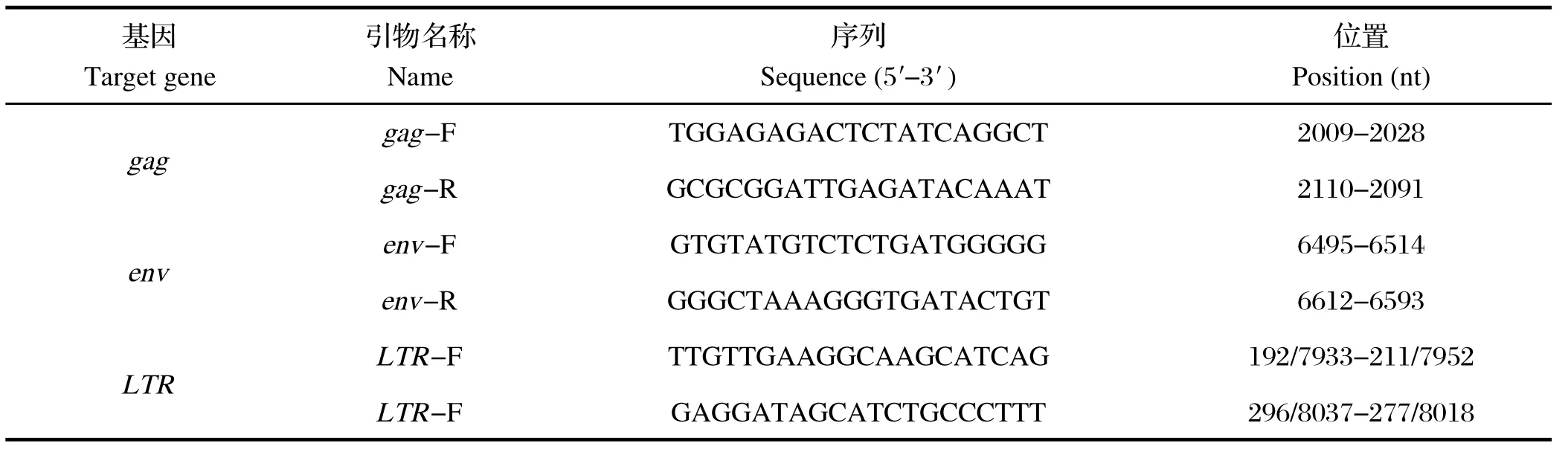
表1 荧光定量PCR引物Table1 Primers used for real-time PCR in this study
1.5 标准品的制备以上述提取并合成的cDNA为模板,利用常规RT-PCR方法扩增REV基因组中gag基因、env基因以及LTR基因,其中完整gag基因组长度为627 bp,完整env基因组长度为1321 bp,部分LTR基因组长度为330 bp。回收目的片段后与pGEM-T Easy载体连接、转化,挑选阳性菌鉴定并送至上海生物工程技术有限公司测序,序列验证为阳性的重组质粒经纯化后用紫外分光光度计测OD260,再换算成摩尔浓度,通过以下公式计算质粒拷贝数[11]:
以上3个重组质粒分别稀释为8个不同的稀释度(108~101copies/μL)作为标准品,稀释后的标准品-20℃保存备用。
1.6 荧光定量PCR检测方法的建立本研究所有荧光定量PCR均基于ABI 7500系统。以上述标准品为模板进行荧光定量PCR反应,总体积为20 μL,其中SYBR Green I实时荧光PCR反应液10 μL,上、下游引物(10 μmol/mL)各0.8 μL,0.4 μL Rox校正染料,质粒模板2 μL,补水至20 μL。反应条件为95℃预变性30 s;95℃变性5 s,60℃退火并延伸34 s,共扩增40个循环,延伸时收集荧光,最后在70℃~90℃过程中制作溶解曲线。阳性的判定标准为:1.35个循环以前检测到荧光信号;2.35~40个循环内检测到荧光信号,重复3次,且均能检测到荧光信号。反之,则判定为阴性。对于gag、env、LTR基因的荧光定量PCR检测方法中,所有的反应体系和反应条件均相同,以便3个不同基因可以同时进行实验。
1.7 荧光定量特异性、敏感性及重复性实验将倍比稀释为108~101copies/μL的3种基因的标准品作为模板,分别进行常规RT-PCR扩增以及SYBR Green I实时荧光PCR,以确定两种方法所检测的最低拷贝数,从而对常规RT-PCR和荧光定量PCR的敏感性进行比较。
以REV、ALV-J的RNA反转录得到的cDNA,CAV、MDV的DNA以及保存的3种基因的标准品为模板,分别进行SYBR Green I实时荧光PCR,以此验证所建立方法的特异性。
分别取gag、env以及LTR基因的标准品中106、104、102copies/μL3个稀释度作为模板连续扩增3次,以测定批内重复性。
1.8 荧光定量方法在REV感染复制过程中的初步应用原代CEF细胞以1×105个/孔的密度在24孔板中用5%生长液培养,按MOI为1的比例感染REV病毒悬液并孵育2 h,细胞洗涤3次后加入1%维持液,37℃、5% CO2。分别在1、2、3、4、5、6、7、10 d收集感染细胞并按照之前所述方法提取RNA,再进行cDNA合成。
以上述cDNA作为SYBR Green I 实时荧光PCR的模板。其中,反转录时RNA均定量为1 μg,荧光定量PCR时所加入模板体积也均相同,设立3个重复,最后根据标准曲线计算拷贝数。此外,选择鸡18S rRNA作为内参基因,采用实时定量PCR和2-△△CT相对表达法进行基因的表达量分析[12],进而比较两种方法的检测结果。
1.9 间接免疫荧光方法检测REV在CEF中的复制间接免疫荧光检测方法(indired fimmunfluorescene, IFA)参考崔治中等[13]的报道。具体方法如下:原代CEF细胞以1×105个/孔的密度在24孔板中培养,感染REV后,在相应时间点弃去上清,PBS洗涤1次,室温下用预冷的丙酮∶乙醇(3∶2)固定10 min,PBS洗涤1次,自然干燥后于-20℃保存备用。
将REV单抗腹水作为一抗,用PBS进行1∶500稀释,与上述REV感染的细胞在37℃水浴作用45 min,PBS洗涤3次,再加入工作浓度的FITC标记的羊抗鼠IgG,37℃避光孵育30 min,PBS洗涤5次后用50%甘油覆盖,在OLYMPUS IX50荧光显微镜下观察,同时设置阴、阳性对照。
2 结果
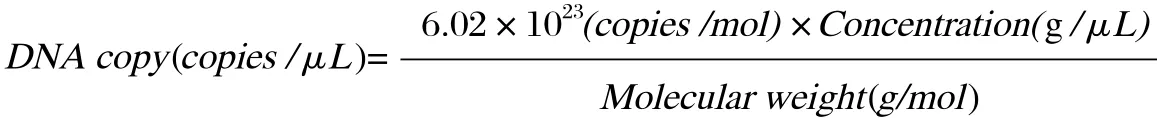
2.1 标准曲线的建立为建立gag基因、env基因以及LTR基因的标准曲线,重组质粒pGEM-gag,pGEM-env和pGEM-LTR纯化后测其含量并计算拷贝数,分别取108~101copies/μL共8个不同稀释度,以此为模板进行荧光定量PCR扩增。ABI 7500系统自动生成扩增动力曲线(图1);以Ct值为纵坐标,以模板拷贝数为横坐标生成相应的标准曲线(图2)。从图中可见,gag、env、LTR gene 3个标准品所建立的荧光定量PCR方法的最低检测限均为101copies,且都在101~108copies/μL范围内有很好的线性关系。其中,gag基因检测的Ct值为7.92~29.75,相关系数R2=0.999,扩增效率为109.2%;env基因检测的Ct值为8.55~30.66,相关系数R2=0.998,扩增效率为107.4%;LTR基因检测的Ct值为9.73~32.11,相关系数R2=0.998,扩增效率为105.4%。此外,3个基因的熔解曲线的波峰均单一,其熔解温度分别为83.92℃± 0.10℃(gag)、83.92℃± 0.09℃(env)、82.61℃± 0.13℃(LTR),无引物二聚体及非特异性产物。

图1 荧光定量PCR检测标准品的扩增曲线Fig.1 Amplifi cation curve profi les of gag, env g and LTR gene by quantitation real-time PCR
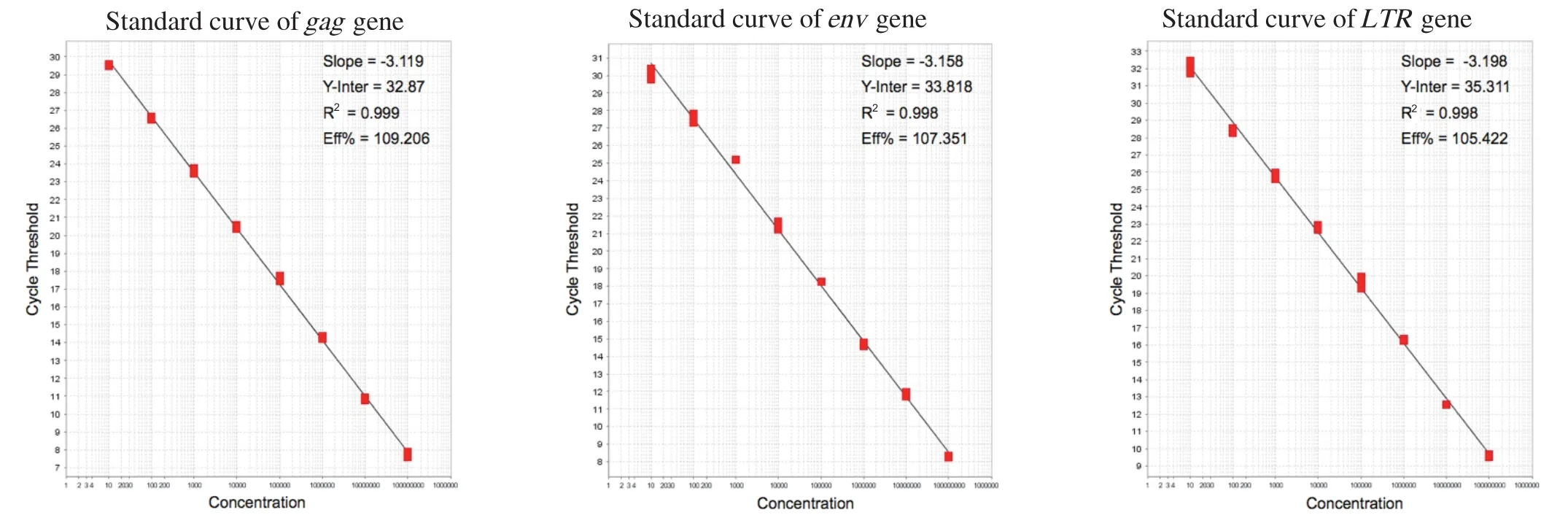
图2 荧光定量PCR检测标准品的标准曲线Fig.2 Standard curve of gag, env and LTR gene by quantitation real-time PCR
2.2 敏感性比较以及特异性、重复性实验将10倍倍比稀释的gag基因、env基因和LTR基因的标准品作为模板,利用常规RT-PCR方法进行检测(图3),最小检出量均为104copies。而荧光定量PCR方法的最小检出量为101copies,敏感性比常规的RT-PCR方法高1000倍。
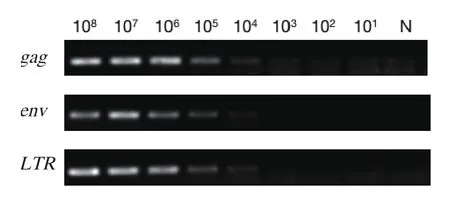
图3 常规RT-PCR方法对不同稀释浓度的标准品的检测结果Fig.3 RT-PCR amplifi cation result of serial dilutions of standard plasmids
以REV、ALV-J的RNA反转录得到的cDNA,CAV、MDV的DNA以及保存的3种基因的标准品为模板,分别进行SYBR Green I 实时荧光PCR试验,并设立阴性对照。结果表明,3种基因的荧光定量PCR方法在分别检测的过程中,仅REV反转录得到的cDNA以及相应的阳性标准品出现扩增曲线,其他病毒样品以及阴性对照的检测结果均为阴性(图4)。
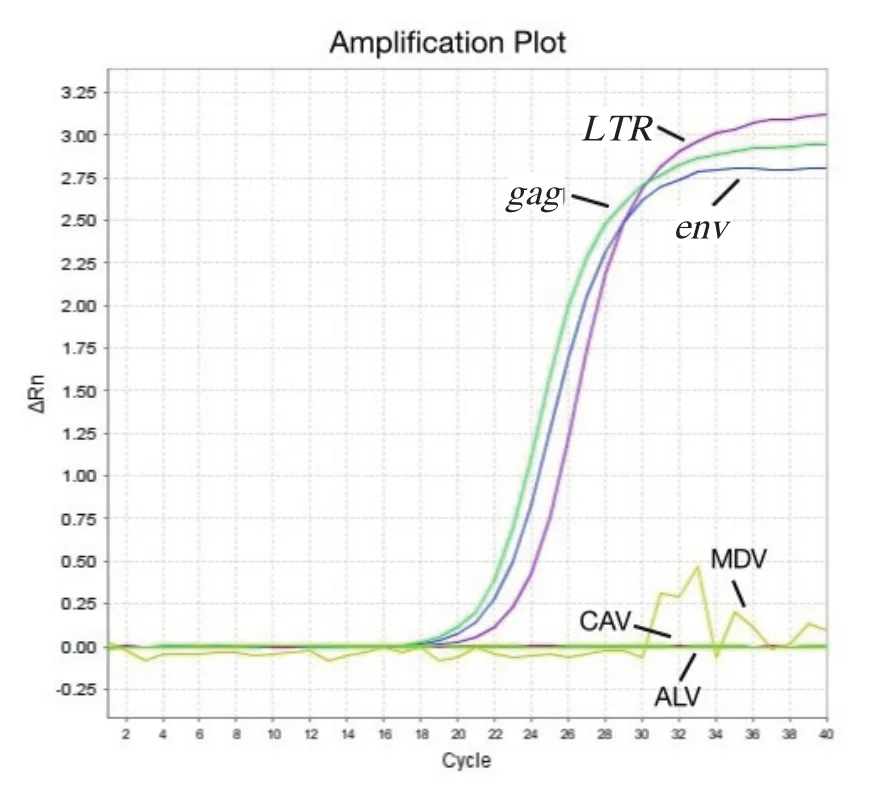
图4 荧光定量PCR检测REV的特异性试验Fig.4 Specifi city of fl uorescent quantitative PCR for detection of Reticuloendotheliosis virus
分别取gag、env、LTR基因的标准品中106、104、102copies/μL三个稀释度作为模板连续扩增3次,且重复扩增3次的变异系数均小于0.005(图5)。结果表明,本研究所建立的REV 3种基因的荧光定量PCR方法具有较高的可重复性。

图5 荧光定量PCR重复性试验扩增动力曲线Fig.5 The amplifi cation dynamic curve of repetitive test for fl uorescent quantitative PCR
2.3 检测REV在CEF中的复制过程
2.3.1 绝对定量实时荧光PCR方法 对感染后不同时间点的CEF细胞进行总RNA提取以及反转录成cDNA,作为模板分别进行gag基因、env基因以及LTR基因的荧光定量PCR试验,并得到相应的Ct值。通过此前所建立的gag基因的回归方程:y= 32.87- 3.119x、env基因的回归方程:y= 33.818- 3.158x、LTR基因的回归方程:y= 35.311-3.198x,计算得到REV感染CEF过程中3个基因各自在不同时间点的拷贝数(图6)。由图中可见,REV 的gag、env及LTR 三个基因的拷贝数均呈现先减少后增多的趋势,且在d3时的拷贝数为最低值,随后拷贝数逐渐增多。
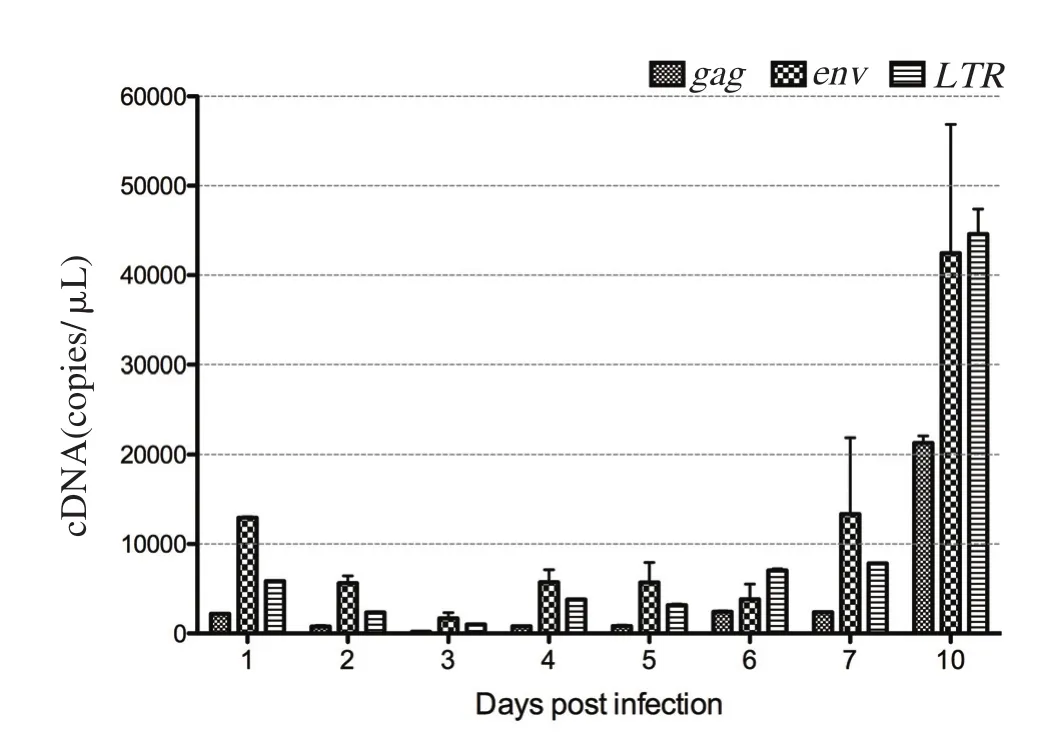
图6 绝对定量实时荧光PCR方法检测REV在细胞中的复制Fig.6 Detection of replication kinetics for REV in CEFs using quantitative SYBR green I real-time PCR
2.3.2 相对定量实时荧光PCR方法 采用实时定量PCR和2-△△CT相对表达法进行基因的表达量分析,选择鸡18S rRNA作为内参基因,分别得到gag基因、env基因和LTR 3个基因的相对表达变化倍数(图7)。3个基因的表达量均在早期下降,d3的表达量最低,随后呈现表达量逐渐升高的整体趋势。与绝对定量方法相比,两种方法的结果所反映出病毒在细胞中的复制过程基本一致。
2.3.3 间接免疫荧光方法 由于CEF感染REV时无明显细胞病变,因而利用间接免疫荧光方法对REV核心蛋白进行检测。病毒感染原代CEF细胞,感染量MOI为1,37℃作用2 h后移去病毒,清洗后添加维持液进行培养,分别在d1、d2、d3、d4、d5、d6、d7、d10进行IFA(图8)。结果显示,病毒感染细胞后,最早在d4出现阳性反应,且在d7时阳性反应最强。
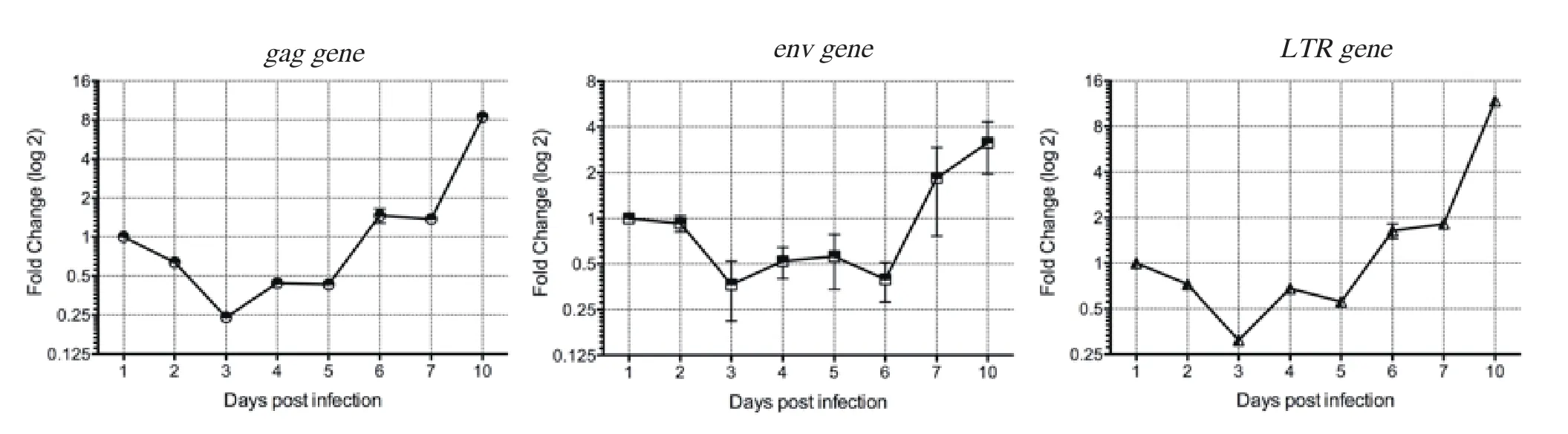
图7 实时荧光PCR相对表达法检测REV感染后基因表达变化Fig.7 The variation curve of REV replication by using quantitative real-time PCR and the 2-△△CTmethod
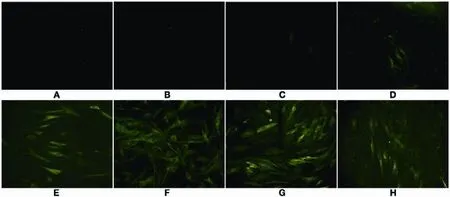
图8 感染后不同时间点的间接免疫荧光结果Fig.8 Analysis of REV infection at different time points by indirect immunofl uorescence(IFA)
3 讨论
禽网状内皮组织增生症是禽类重要的免疫抑制性和病毒致瘤性疾病之一,不仅能够引发肿瘤形成,还能造成感染禽类的胸腺、法氏囊等免疫组织器官萎缩,使其免疫功能下降甚至丧失,从而导致免疫抑制,致使感染禽类极易继发感染其他病原微生物[14]。REV属于反转录病毒科禽类C型反转录病毒,基因组为单股RNA,含有gag、pol、env等结构基因以及长末端重复序列(LTR)。群抗原(gag)基因编码p30、p10、pp18、pp20、p12等结构蛋白,其中p30是群主要特异性抗原,在病毒粒子装配过程中发挥作用[15]。囊膜蛋白(env)基因编码gp20 和gp90两种糖蛋白,其中gp90是病毒的免疫原性蛋白,具有顺式构象表位[16]。由于REV各基因在病毒复制过程中的不同特性与功能,本研究设计了分别针对gag基因、env基因、LTR基因的引物来进行特异性的检测。
目前,国内外已有将实时荧光PCR技术应用于REV定性和定量的报道。宋丽等[17]针对REV的LTR序列设计引物并建立了SYBR Green Ⅰ实时荧光PCR方法检测临床疑似病例。Sun等[18]通过建立双重实时PCR方法分别检测血样中的env基因以及LTR基因,在提取基因组DNA时采用苯酚-氯仿抽提以及微球顺磁珠试剂盒两种不同方式。Li等[19]针对env基因保守区建立了Taqman荧光定量RT-PCR检测方法,但这种方法需要合成昂贵的探针,从而增加了成本。目前所报道的实时荧光PCR检测REV方法中尚无关于REV在细胞中复制的研究,对于REV体外复制研究还是主要通过传统的TCID50法[20]。已有研究表明荧光定量PCR方法更适合用于禽类病毒在细胞上复制的动力学研究,相比传统的TCID50法更加快速、敏感[21,22]。本研究首次应用所建立的多重实时荧光RT-PCR方法对REV在CEF上增殖动态进行了初步研究。针对REV的gag基因、env基因以及LTR基因保守区设计特异性的引物所建立的SYBR Green Ⅰ实时荧光PCR方法,重复性好且特异性强,比常规RT-PCR方法的敏感性高出1000倍,最小检出量为101copies。同时检测REV中的3个基因,可以更准确且全面的衡量评价病毒在细胞上的复制过程,从而避免只检测病毒单一基因所带来的缺陷。
从绝对定量实时荧光PCR方法检测结果中可以看出,gag基因、env基因以及LTR基因的拷贝数从d1至d3均逐渐减少,并在d3达到最低值,随后从d4开始逐渐增多。另外,通过引入鸡18S rRNA作为内参基因,采用实时定量PCR和2-△△CT相对表达法进行基因的表达量分析对比,3个基因的表达倍数变化的总体趋势均呈现先下降后上升的过程。由此表明,两种实时荧光方法所反映的结果基本一致,病毒在复制过程中先经过适应期,病毒量逐渐减少,随后病毒开始大量复制,并随着时间的延长而病毒量增加。此外,在同一时间点所检测到的不同基因的拷贝数并不相等,gag基因的拷贝数要小于env基因以及LTR基因。出现这一现象,可能是由于病毒复制过程中不同基因及其蛋白所表现的不同功能特性,并发挥不同作用影响的原因[23,24]。可见作为检测REV的方法而言,针对env或者LTR基因建立SYBR Green Ⅰ实时荧光PCR方法应该是较好的选择。
REV在培养过程中可长期与CEF细胞共存,不断地进行复制,但由于无明显细胞病变(cytopathic effect, CPE)而不易观察[25]。利用针对REV核心蛋白的抗体,IFA检测结果表明病毒在d4时出现荧光,d7荧光强度最强,d10仍可见大量荧光但细胞状态不佳。通过比较,可以看出IFA检测REV复制过程时,并不能反映出利用实时荧光PCR方法所表现出病毒先减少后增多的趋势。这两种方法分别从蛋白水平以及基因水平丰富了REV的病毒检测方法和体外复制研究手段。
本研究所建立的方法,实现了对REV在细胞上快速、灵敏、特异的实时监控,为REV的快速诊断、流行病学调查以及禽源疫苗污染的检测提供了新的思路与方法,同时也为REV的感染机制、免疫抑制致病机理和预防措施等方面的研究奠定了基础。
[1] Witter R L, Johnson D C.Epidemiology of reticuloendotheliosis virus in broiler breeder flocks[J].Avian Dis, 1985, 29(4)∶1140-1154.
[2] 马春霞, 郑世民.禽网状内皮组织增生病病毒分子生物学特性与免疫抑制[J].动物医学进展, 2007, 28(4)∶ 120-122.
[3] 张志, 王锡乐, 庄国庆, 等.用单抗介导的免疫荧光试验检测组织切片中的禽网状内皮组织增生病病毒[J].中国兽医学报, 2005, 25(3)∶ 122- 124.
[4] Wei K, Sun Z, Zhu S, et al.Probable congenital transmission of reticuloendotheliosis virus caused by vaccination with contaminated vaccines[J].PLoS One, 2012, 7(8)∶ e43422.
[5] Lupiani B, Lee L F, Kreager K S, et al.Insertion of reticuloendotheliosis virus long terminal repeat into the genome of CVI988 strain of Marek's disease virus results in enhanced growth and protection[J].Avian Dis, 2013, 57(2 Suppl)∶ 427-431.
[6] Moore K M, Davis J R, Sato T , et al.Reticuloendotheliosis virus (REV) long terminal repeats incorporated in the genomes of commercial fowl poxvirus vaccines and pigeon poxviruses without indication of the presence of infectious REV[J].Avian Dis, 2000, 44(4)∶ 827-841.
[7] 金文杰, 崔治中.传染性法氏囊病病料中MDV、CAV、REV的共感染检测[J].中国兽医学报, 2001, 21(4)∶ 6-9.
[8] 姜世金, 孟珊珊, 崔治中, 等.我国自然发病鸡群中MDV、REV和CAV共感染的检测[J].中国病毒学, 2005, 20(4)∶ 164-167.
[9] Tadese T S, Fitzgerald, Reed W M.Detection and differentiation of re-emerging fowlpox virus (FWPV) strains carrying integrated reticuloendotheliosis virus (FWPV-REV) by real-time PCR[J].Vet Microbiol, 2008, 127(1-2)∶ 39-49.
[10] Hauck R, prusasc, Hafez H M, et al.Quantitative PCR as a tool to determine the reticuloendotheliosis virus-proviral load of fowl poxvirus[J].Avian Dis, 2009, 53(2)∶ 211-215.
[11] Zhou G, Cai W, Liu X C, et al.A duplex real-time reverse transcription polymerase chain reaction for the detection and quantitation of avian leukosis virus subgroups A and B[J].J Virol Methods, 2011, 173(2)∶ 275-279.
[12] Livak K J, Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J].Methods, 2001, 25(4)∶402-408.
[13] Cui Z Z, Lee L F, Silva R F.Monoclonal antibodies against avian reticuloendotheliosis virus∶ identification of strain-specific and strain-common epitopes[J].J Immunol, 1986, 136(11)∶ 4237-4442.
[14] 马春霞, 郑世民.禽网状内皮组织增生病病毒分子生物学特性及其免疫抑制机理[J].中国家禽, 2007, 29(22)∶35-37.
[15] 葛兆宏, 陆广富.禽网状内皮组织增殖病病毒PCR及RTPCR检测方法的研究和p30主要抗原域的原核表达[J].中国预防兽医学报, 2006, 28(4)∶ 441-445.
[16] 王锡乐, 张志, 姜世金, 等.昆虫细胞表达的网状内皮组织增殖症病毒囊膜糖蛋白及其免疫性[J].微生物学报, 2005, 45(4)∶ 593-597.
[17] 宋丽, 汤承.SYBR Green Ⅰ实时荧光PCR检测网状内皮增生症病毒方法的建立[J].中国动物检疫, 2008, 25(8)∶26-29.
[18] Sun F, Ferro P J, Lupiani B.A duplex real-time polymerase chain reaction assay for the simultaneous detection of long terminal repeat regions and envelope protein gene sequences of Reticuloendotheliosis virus in avian blood samples[J].J Vet Diagn Invest, 2011, 23(5)∶937-941.
[19] Li K, Gao H, Gao L, et al.Development of TaqMan real-time PCR assay for detection and quantitation of reticuloendotheliosis virus[J].J Virol Methods, 2012, 179(2)∶ 402-408.
[20] 邓小芸, 祁小乐, 王笑梅.禽网状内皮组织增生病病毒的分离鉴定及其体外复制研究[J].中国动物传染病学报, 2010, 18(1)∶ 23-27.
[21] Zhou X, Yang X, Zhao J, et al.The development and application of a SYBR Green I real-time PCR assay for detection of infectious bursal disease virus[J].Bing Du Xue Bao, 2012, 28(4)∶ 424-430.
[22] Wang Y, Qi X, Gao H, et al.Comparative study of the replication of infectious bursal disease virus in DF-1 cell line and chicken embryo fibroblasts evaluated by a new real-time RT-PCR[J].J Virol Methods, 2009, 157(2)∶205-210.
[23] Temin H M, Kassner V K.Replication of reticuloendotheliosis viruses in cell culture∶ chronic infection[J].J Gen Virol, 1975, 27(3)∶ 267-274.
[24] Davidson I, Yang H, Witter R L.The immunodominant proteins of reticuloendotheliosis virus[J].Vet Microbiol, 1996, 49(3-4)∶ 273-284.
[25] 崔治中.禽网状内皮增生病病毒在鸡成纤维细胞培养上的长期无细胞病变感染[J].病毒学杂志, 1988, (2)∶ 226-228.
DEVELOPMENT AND PRELIMINARY APPLICATION OF A SYBR GREEN I BASED MULTIPLE REAL-TIME PCR ASSAY FOR DETECTION OF RETICULOENDOTHELIOSIS VIRUS IN CHICKEN EMBRYO FIBROBLASTS
MIAO Ji1,2, BAO Yan-qing1,2, SHAO Hong-xia1,2, QIAN Kun1,2, QIN Ai-jian1,2
(1.Ministry of Education Key Laboratory for Avian Preventive Medicine, Yangzhou 225009, China; 2.Key Laboratory of Jiangsu Preventive Veterinary Medicine, Yangzhou University, Yangzhou 225009, China)
The objective of the present study was to develop a rapid, sensitive and specifi c method for detection of Reticuloendotheliosis virus (REV) in host cells and evaluation of replication kinetics for REV in chicken embryo fibroblasts (CEFs).Real-time PCR was developed using SYBR Green I and three pairs of primers specific to the conserved regions of gag, env and LTR genes and used to measure copies of viral genes at different days post infection.The results showed real-time PCR assay detected REV in the range of 108to 101copies with the detection limit at 101copies.The copy numbers of these viral genes were detected in low level at initial infection stage followed by abundant increase.As compared with indirect immunofl uorescence assay (IFA), real-time PCR demonstrated the presence of REV in CEFs at early infection immediately following by massive virus replication.In conclusion, development of real-time PCR provided a new method for REV detection and further research on mechanisms of infection and pathogenesis.
Reticuloendotheliosis virus (REV); chicken embryo fi broblasts (CEF); real-time PCR; replication
S852.659.3
:A
:1674-6422(2015)01-0001-08
2014-08-29
江苏省动物重要疫病与人兽共患病防控协同创新中心;江苏高校优势学科建设工程资助项目;国家科技基础性工作专项(2013FY113300-4)
缪佶,男,博士研究生,预防兽医学专业
秦爱建,E-mail:aijian@yzu.edu.cn
