银合欢果皮总黄酮含量测定及抗氧化活性
2015-12-29杨静毅喻玲玲刘纪成张雨杰
杨静毅,喻玲玲,2,*,吴 梅,刘纪成,张雨杰,江 凯,王 毕
银合欢果皮总黄酮含量测定及抗氧化活性
杨静毅1,喻玲玲1,2,*,吴 梅1,刘纪成1,张雨杰1,江 凯1,王 毕1
(1.三峡大学医学院,湖北 宜昌 443002;2.三峡大学 天然产物研究与利用湖北省重点实验室,湖北 宜昌 443002)
目的:建立测定银合欢果皮中总黄酮含量的方法,研究其体外抗氧化活性。方法:运用NaNO2-Al(NO3)3显色法,检测总黄酮含量,并采用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)法和还原力分析其抗氧化活性。结果:芦丁在0.01~0.05 mg/mL(r=0.999 1)质量浓度范围内,吸光度与质量浓度之间呈良好线性关系,平均回收率为99.35%(相对标准偏差为1.37%),总黄酮含量为1.76 mg/g;银合欢果皮具有显著的抗氧化活性,且呈剂量依赖性,其抑制DPPH自由基的半数抑制浓度(IC50)为0.32 mg/mL,还原力IC50为70.12 μg/mL。结论:所建立的方法简单快捷、准确、灵敏、重复性好,适合银合欢果皮中总黄酮含量的测定。银合欢果皮中含有丰富的黄酮类化合物,且具有良好的体外抗氧化活性。
银合欢果皮;黄酮;抗氧化活性
银合欢(Leucaena leucocephala (Lam.) de Wait)又名白合欢,为多年生豆科木本植物,广泛分布于热带亚热带地区,在我国南部分布很广[1]。银合欢生长快,适应性强,是荒山绿化的先锋树种。叶片干物质中粗蛋白质含量达22%~29%,还含有丰富的氨基酸、胡萝卜素、多种维生素和微量元素,其枝叶和豆荚都是牛、羊的好饲料,被联合国粮农组织的饲料专家誉为“蛋白质仓库”[2]。银合欢叶具有清热解毒、消食解渴开胃的功效,在海南及广西民间,银合欢叶可作为保健茶泡饮,其保健作用与茶叶相当,并且不含咖啡因[3]。
文献调研发现,银合欢叶和种子中主要含有黄酮、生物碱、萜类、香豆素、甾体和脂肪酸类化合物[4-14]。在广西壮族民间银合欢种子可用于治疗糖尿病[15],现代药理实验亦发现银合欢种子和叶均具有显著的降血糖、保肝、抑菌、利尿等活性,且其主要的有效成分为黄酮[16-24]。黄酮是具有较强清除自由基和抗氧化能力的一种物质,而黄酮因其结构不同以及含量不同,有的表现出生物活性,有的则没有生物活性[25-27]。姜建辉等[28]测得银合欢叶中总黄酮含量为2.05%。
综上所述,目前关于银合欢的研究大多集中于其叶和种子,而针对其果皮的研究鲜有报道,为更加充分利用银合欢资源,对其果皮进行化学成分 及药理活性研究非常有必要。如果能够对银合欢果皮进行开发利用,不仅能够保护环境,还能使资源利用最大化,并产生巨大的经济效益和社会效益。因此本实验对银合欢果皮中总黄酮的含量测定方法和抗氧化活性进行研究,拟建立银合欢果皮中总黄酮的含量测定方法,同时对其体外抗氧化活性进行探讨,为银合欢果皮的进一步研究与开发提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
银合欢果皮采自云南省西双版纳傣族自治州勐腊县,经三峡大学生物与制药学院陈发菊教授鉴定为豆科含羞草亚科银合欢属银合欢的果皮。
芦丁对照品(批号:161985) 华顺生物技术有限公司;其余所有试剂均为分析纯。
1.2 仪器与设备
BS210S电子分析天平 北京赛多利斯仪器有限公司;旋转蒸发仪 日本东京理化有限公司;SHZ-D(Ⅲ)型循环水式真空泵 巩义市英峪予华仪器厂;DZF-2B真空减压干燥箱 北京市永光明医疗仪器有限公司;WGL-65B电热恒温鼓风干燥箱 天津市泰斯特仪器有限公司;Infinite M200 PRO酶标仪 瑞士Tecan公司;SZ-93自动双重水蒸馏器 上海雅荣生化仪器设备有限公司。
1.3 方法
1.3.1 标准曲线的绘制[29-30]
精密称取在120 ℃条件下减压干燥至恒质量的芦丁标准品5.0 mg于50 mL容量瓶中,甲醇定容至刻度,即得0.1 mg/mL芦丁对照品溶液。精密取对照品溶液0、0.50、1.00、1.50、2.00、2.50 mL于6 个5 mL容量瓶中,加质量分数5% NaNO2溶液0.15 mL,混匀,放置6 min;加10% Al(NO3)3溶液0.15 mL,摇匀,放置6 min;加4% NaOH溶液2 mL,再加甲醇定容至刻度,摇匀,放置15 min。用酶标仪于波长510 nm处测定吸光度。
1.3.2 总黄酮含量测定
银合欢果皮粉末0.046 g,用质量分数95%乙醇溶液超声提取3 次,每次0.5 h。过滤、浓缩,加入甲醇溶解,制成1 mg/mL供试品溶液。精密取供试品溶液1 mL按1.3.1节方法测定其总黄酮含量。
1.3.3 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)法测定抗氧化活性[31-32]
用无水乙醇定容VC,配成1.58 mg/mL的标准溶液,并用乙醇稀释成系列标准溶液。取60 μL待测液标准溶液,加60 μL 1 mmol/L DPPH乙醇溶液,充分混合,室温避光静置30 min,于波长517 nm处测其吸光度(A实验)。对照组用60 μL无水乙醇代替DPPH溶液(A对照),空白组用60 μL无水乙醇代替样品(A空白),各组平行测定3 次,按下式计算DPPH自由基清除率。
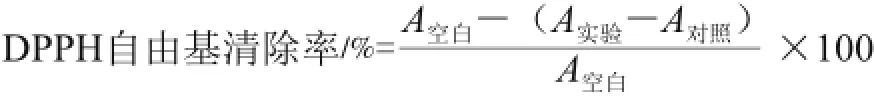
1.3.4 还原能力的测定[33-34]
准确称取33 mg银合欢果皮粉末,用体积分数95%乙醇溶液定容至10 mL,配成3.3 mg/mL的待测液。在1.5 mL Ep管中分别加入不同质量浓度待测液100 μL,加入磷酸盐缓冲溶液(0.2 mol/L,pH 6.6)100 μL和质量分数1%铁氰化钾溶液100 μL,置于50 ℃水浴中反应20 min,然后加入质量分数10%三氯乙酸溶液100 μL,摇匀。吸取上清液50 μL,在96孔板中加入50 μL蒸馏水和50 μL质量分数0.025%三氯化铁溶液。VC为对照品,样品在波长700 nm处测定吸光度。
2 结果与分析
2.1 检测波长的选择
按照1.3节方法制备样品溶液和标准品溶液,在波长300~500 nm范围内进行波长扫描,样品溶液和对照品溶液在波长510 nm处均有最大吸收,由此确定检测波长为510 nm。
2.2 线性范围
按照1.3.1节所述方法用酶标仪测定不同质量浓度对照品溶液的吸光度。以对照品质量浓度C(mg/mL)为横坐标,吸光度(A)为纵坐标,绘制标准曲线。回归方程:A = 6.348C+0.009 8,r = 0.999 1。结果表明芦丁在0.01~0.05 mg/mL质量浓度范围内,吸光度与质量浓度间呈良好线性关系。
2.3 精密度
精密取质量浓度为0.1 mg/mL芦丁对照品溶液1.00 mL,连续测定5 次,记录吸光度,其相对标准偏差(relative standard deviation,RSD)为0.78%,表明精密度良好,结果见表1。
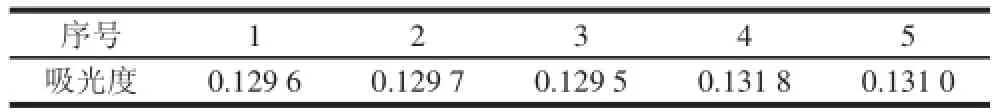
表 1 精密度实验结果Table 1 Precision of the spectrophotometric method for determination of total flavonoids ds
2.4 稳定性
精密称取干燥至恒质量的银合欢果皮粉末0.046 g,按1.3.2节方法制备样品溶液,室温条件下放置,分别于0、0.5、1、2、3 h测定吸光度,样品的吸光度RSD为0.47%,表明样品溶液在3 h内稳定。实验结果见表2。
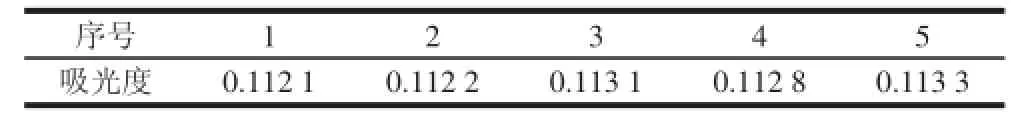
表 2 稳定性实验结果Table 2 Stability of the spectrophotometric method for determination of total flavonoids ds
2.5 重复性
精密称取5 份干燥至恒质量的银合欢果皮粉末,按1.3.2节方法制备样品溶液,测定其吸光度,样品的吸光度RSD为1.33%,表明该方法有良好的重复性。实验结果见表3。
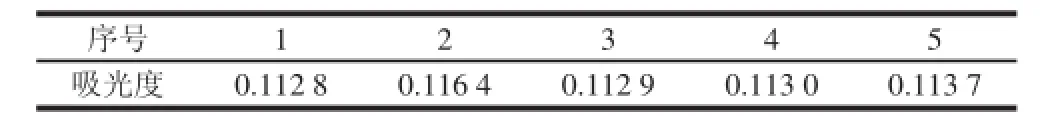
表 3 重复性实验结果Table 3 Repeatability of the spectrophotometric method for determination of total flavonoids ds
2.6 加样回收率
精密称取5 份已知含量(1.76 mg/g)的银合欢果皮粉末,每份加入芦丁对照品0.040、0.080、0.120、0.160、0.200 mg,按照1.3.2节方法测定其吸光度,计算回收率,芦丁的平均回收率为99.35%,RSD为1.37%。结果表明总黄酮回收率良好,方法准确性高,具有可行性,具体结果见表4。
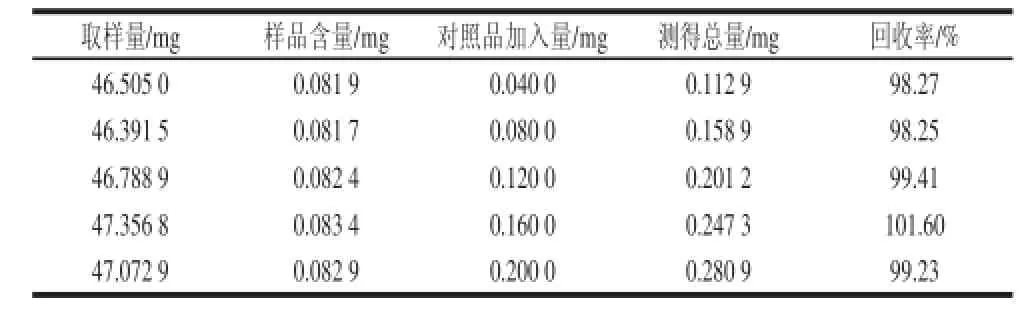
表 4 加样回收率实验结果Table 4 Repeatability of the spectrophotometric method forTable 4 Repeatability of the spectrophotometric method for determination of total flavonoids ds
2.7 银合欢果皮中总黄酮含量
按照1.3.2节方法制备5 份供试品溶液,按1.3.1节方法测定其吸光度,由回归方程计算含量。5 批银合欢果皮中总黄酮的平均含量为1.76 mg/g。
2.8 银合欢果皮的抗氧化能力
对银合欢果皮清除DPPH自由基的能力进行研究,由图1可知,银合欢果皮对DPPH自由基具有显著的清除作用,其清除能力随样品质量浓度增加而增强(半数抑制浓度(half inhibition concentration,IC50)为0.32 mg/mL),但银合欢果皮清除DPPH自由基的能力弱于阳性对照VC(IC50为0.01 mg/mL)。
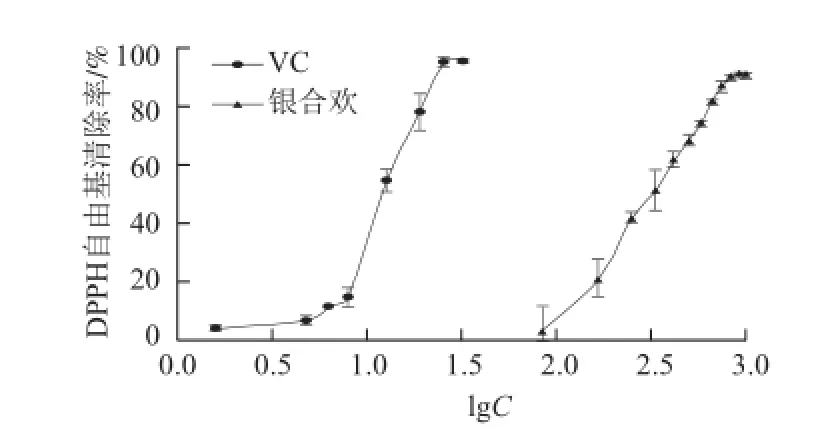
图 1 银合欢果皮对DPPH自由基的清除能力Fig.1 DPPH radical-scavenging capacity of L. leucocephala fruit peel
2.9 银合欢果皮的还原能力
抗氧化剂的抗氧化能力与其还原力有关,还原力越大,抗氧化能力越强。反应物的吸光度增加表明还原力增强。由图2可知,随着质量浓度的增加,样品的吸光度明显上升,表明还原能力逐渐增强,呈现较好的量效关系。IC50为70.12 μg/mL的银合欢果皮提取物的还原力与IC50为7.74 μg/mL的VC相当。
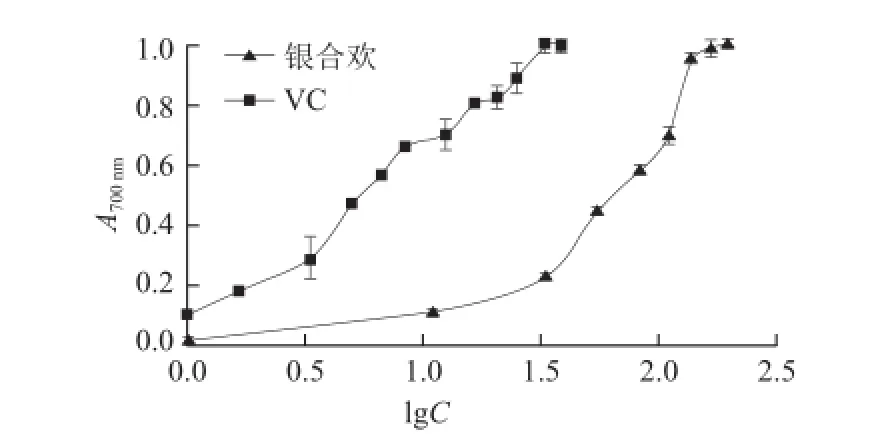
图 2 银合欢果皮还原能力Fig.2 Reducing power of L. leucocephala fruit peel
3 结 论
银合欢作为营养保健型的绿色食品,日益受到人们的关注,其研究和开发也在逐步深入。本实验运用NaNO2-Al(NO3)3显色法对银合欢果皮中总黄酮含量测定进行相关的探索,建立含量测定方法操作合理简单,方法精密度高,重复性及线性关系良好,回收率高,可为银合欢的质量控制提供研究基础。
目前关于银合欢果皮的药理活性鲜有报道,本研究探讨其体外抗氧化活性,银合欢果皮清除DPPH自由基的IC50为0.32 mg/mL,还原力的IC50为70.12 μg/mL,表现出较好的体外抗氧化活性。而关于其总黄酮含量与抗氧化活性间的相关性,还有待进一步的研究。
[1] 中国科学院中国植物志编辑委员会. 中国植物志: 第39卷[M]. 北京:科学出版社, 2006: 18.
[2] 赵英, 陈小斌, 蒋昌顺. 我国银合欢研究进展[J]. 热带农业科学, 2006, 26(4): 55-58.
[3] 王强, 王恩举, 迪丽菲嘎儿, 等. 银合欢叶成分槲皮素-3-O-鼠李糖苷FT-IR和FT-Raman光谱[J]. 光散射学报, 2000, 12(1): 27-29.
[4] HASSAM R A, TAWFIK W A, ABOU-SETTA L M. The flavonoid constitunts of Leucaena leucocephala. Growing in Egypt, and their biological activity[J]. African Journal of Traditional, Complementary, and Alternative Medicines, 2013, 11(1): 67-72.
[5] SALEM A Z M, SALEM M Z M, RONQUILLO M G, et al. Major chemical constituents of Leucocephala and Salix babylonica leaf extracts[J]. Journal of Tropical Agriculture, 2011, 49(1/2): 95-98.
[6] CHEN C Y, WANG Y D. Steroids from the whole plants of Leucaena leucocephala[J]. Ameciran Journal of Analytical Chmistry, 2010, 1: 31-33.
[7] MOHAMED E A, KHADIGA A A. Chemical composition and amino acids profile of Leucaena leucocephala seeds[J]. International Journal of Poultry Science, 2009, 8(10): 966-970.
[8] 候小涛, 邓家刚, 周江煜, 等. 银合欢叶的化学成分研究[J]. 华西药学杂志, 2012, 27(6): 610-612.
[9] 王恩举, 梁德华, 杨智藴. 银合欢叶黄酮类成分的研究[J]. 海南师范大学学报, 2008, 21(2): 171-172.
[10] CHEN C Y, WANG Y D. Polyprenol from the whole plants of Leucaena leucocephala[J]. Journal of Environmental Protection, 2010, 1: 70-72.
[11] CHEN C Y, WANG Y D. Secondary metabolites from Leucaena leucocephala[J]. Chemistry of Natural Compounds, 2011, 47(1): 145-146.
[12] 李学坚. 银合欢叶的化学成分及药理活性研究[D]. 南宁: 广西中医学院, 2005: 5-21.
[13] 李学坚, 林立波, 邓家刚, 等. 银合欢叶挥发油色谱-质谱-计算机联用分析[J]. 时珍国医国药, 2005, 16(2): 96-97.
[14] 张臻, 周媛, 邹坤. ICP-MS法测定银合欢种和种皮中27 种金属元素含量[J]. 三峡大学学报: 自然科学版[J]. 2012, 34(6): 106-109.
[15] 广西重要资源普查办公室. 广西中药资源名录[M]. 南宁: 广西民族出版社, 1993: 120.
[16] UMAH R K, BACANI A, NOORIZA A, et al. Leucaena leucocephala fruit aqueous extract stimulates adipogenesis, lipolysis, and glucose uptake in primary rat adipocytes[J]. The Scientific World Journal, 2014(2014): 1-8.
[17] ASSEM M S, LUIS S F, RONALD S R, et al. Effect of dietary inclusion of Leucaena leucocephala or Moringa oleifera leaf meal on performance of growing rabbits[J]. Trop Anim Health Prod, 2014, 46(7): 1-6.
[18] 李学坚, 邓家刚, 覃振林, 等. 银合欢种子总黄酮降血糖作用实验研究[J]. 中国中药杂志, 2005, 30(11): 842-843.
[19] 李学坚. 银合欢叶总黄酮降血糖作用的实验研究[J]. 中国现代应用药学杂志, 2006, 23(4): 277-279.
[20] 李学坚, 邓家刚, 覃振林. 银合欢叶提取物降血糖作用的实验研究[J].天然产物研究与开发, 2004, 16(1): 41-42.
[21] 李学坚. 银合欢叶总黄酮抑菌、利尿的实验研究[J]. 广西中医学院学报, 2005, 8(3): 13-14.
[22] 李学坚, 邓家刚, 覃振林. 银合欢叶总生物碱保肝降酶作用的实验研究[J]. 中国中医药科技, 2006, 13(3): 164-165.
[23] 冯定远, ATREJA P P. 银合欢叶粉中含羞草素在牛瘤胃内代谢降解的研究[J]. 动物营养学报, 1997, 9(3): 23-28.
[24] 冯定远, ATREJA P P. 银合欢叶粉中抗营养因子DHP在牛瘤胃中降解的研究[J]. 华南农业大学学报, 1997(18): 25-29.
[25] 张德权, 台建祥, 付勤. 生物类黄酮的研究及应用概况[J]. 食品与发酵工业, 1999, 25(6): 52-57.
[26] 李加兴, 陈选, 邓佳琴, 等. 黄秋葵黄酮的提取工艺和体外抗氧化活性研究[J]. 食品科学, 2014, 35(10): 121-125. doi: 10.7506/spkx1002-6630-201410022.
[27] 李姝蓓, 张东, 杨岚, 等. 荚果蕨贯众提取物中黄酮类成分的含量测定和抗氧化活性研究[J]. 中国药学杂志, 2013, 48(21): 1860-1863.
[28] 姜建辉, 赵俭波, 王贵云. 银合欢叶黄酮的提取工艺[J]. 食品研究与开发, 2014, 35(7): 40-43.
[29] 周镁, 黄秀平, 桂珊珊, 等. 海拔高度对黔产宽叶缬草根总黄酮含量的影响[J]. 中药材, 2014, 37(5): 747-749.
[30] 李利华. 芹菜不同部位总黄酮含量测定及其抗氧化活性[J]. 食品研究与开发, 2013, 34(7): 12-15.
[31] 韦献雅, 殷丽琴, 钟成, 等. DPPH法评价抗氧化活性研究进展[J]. 食品科学, 2014, 35(9): 317-322. doi: 10.7506/spkx1002-6630-201409062.
[32] LI Wu, LIANG Hong, ZHANG Mingwei, et al. Phenolic profi les and antioxidant activity of litchi (Litchi Chinensis Sonn.) fruit pericarp from different commercially available cultivars[J]. Molecules, 2012, 17(12): 14954-14967.
[33] KUMARL P S, SUDHA S. Evaluation of antioxidant activity and total phenolic content of padina boergesenii from Gulf of Mannar[J]. Drug Invention Today, 2012, 4(12): 635-639.
[34] TUNG Y, WU J, HUANG C, et al. Antioxidant activities and phytochemical characteristics of extracts from Acacia confusa bark[J]. Bioresource Technology, 2009, 100(1): 509-514.
Antioxidant Activities and Total Flavonoid Content in the Peel of Leucaena leucocephala Fruits
YANG Jingyi1, YU Lingling1,2,*, WU Mei1, LIU Jicheng1, ZHANG Yujie1, JIANG Kai1, WANG Bi1
(1. College of Medical Science, China Three Gorges University, Yichang 443002, China;2. Hubei Key Laboratory of Natural Products Research and Development, China Three Gorges University, Yichang 443002, China)
Purpose: To establish a method for the determination of total flavonoids and to evaluate the antioxidant activity of the ethanol extract of Leucaena leucocephala (Lam.) de Wait fruit peel. Methods: The content of total flavonoids was measured by NaNO2-Al(NO3)3assay. The antioxidant property was determined by 1,1-diphenyl-2-picrylhydrazyl (DPPH) free radical scavenging and reducing power assays. Results: The linear range of rutin was 0.01–0.05 mg/mL (r = 0.999 1). The average recovery rate was 99.35% with relative standard deviation (RSD) of 1.37%. The content of total flavonoids was 1.76 mg/g. In DPPH radical scavenging assay, the sample exhibited antioxidant activity in a dose-dependent manner with IC50of 0.32 mg/mL. The IC50for reducing power was 70.12 μg/mL. Conclusions: The developed method is rapid, accu rate, simple, reproducible and suitable for determination of total flavonoids in the fruit peel of L. leucocephala. Moreover, the fruit peel of L. leucocephala is rich in flavonoids and possesses high antioxidant activity.
Leucaena leucocephala (Lam.) de Wait peel; flavonoids; antioxidant activity
R284.1
A
1002-6630(2015)08-0187-04
10.7506/spkx1002-6630-201508034
2014-09-22
湖北省教育厅优秀青年项目(Q20131309);三峡大学人才启动基金项目(KJ2011B050)
杨静毅(1991—),女,本科生,主要从事天然产物质量控制研究。E-mail:429883444@qq.com
*通信作者:喻玲玲(1983—),女,讲师,博士,主要从事天然产物研究与利用。E-mail:yulingling@ctgu.edu.cn
