响应面法优化泡沫分离桑叶蛋白工艺
2015-12-29刘海彬陈元涛李轩领高中超
刘海彬,张 炜*,陈元涛,李轩领,陈 亮,高中超
响应面法优化泡沫分离桑叶蛋白工艺
刘海彬,张 炜*,陈元涛,李轩领,陈 亮,高中超
(青海师范大学化学系,青海 西宁 810008)
利用响应面法对泡沫分离桑叶蛋白的工艺条件进行优化,在单因素试验的基础上,根据Box-Behnken试验设计原理,选取稀释倍数、离子强度、温度和pH值4 个因素,依据回归分析法来确定各工艺条件的影响因素,以桑叶蛋白的回收率和富集比为响应值作响应面和等高线图,得出桑叶蛋白泡沫分离的最佳工艺条件为:稀释40 倍、pH 5.5、离子强度0.18 mol/kg、温度25 ℃。在该工艺条件下,桑叶蛋白的实际回收率为92.50%,富集比为7.63。验证实验结果表明,泡沫分离法能够作为桑叶蛋白粗分离的一种新方法。
泡沫分离;桑叶蛋白;响应面法;回收率;富集比
桑叶是桑科植物桑(Moms alba L.)的干燥叶,异名铁扇子,是国家卫生部公布的药食两用植物[1-2]。桑叶中含有丰富的氨基酸、维生素、无机盐、黄酮、生物碱等成分,其中蛋白含量为21%~27%[3],且氨基酸种类齐全,其中必需氨基酸含量占总氨基酸含量的34.7%左右,必需氨基酸与非必需氨基酸比值为0.531。氨基酸比值系数分为69.71[4],其营养价值优于多种植物蛋白与水果,基本接近动物蛋白的营养价值,是一种可食用的优质叶蛋白资源。
桑叶在我国分布十分广泛,传统上仅用于养蚕,由于桑蚕生产数量有限,而且有一定季节性,使其潜在价值没有得到充分发挥[5]。因此,对桑叶蛋白进行提取、分离及加工利用,对于缓解我国目前紧张的蛋白资源,提高桑叶的经济附加值和改善人们的膳食营养结构具有重要意义。
目前植物叶蛋白的常用提取方法主要有直接加热法、酸(碱)加热提法、盐析法、有机溶剂沉淀法、发酵法等[6-7]。这些方法只考虑了蛋白分离的单个因素,没有将各个因素组合起来进行优化,削弱了蛋白的分离效果,因此寻找一种有效、综合或复配的提取分离技术是迫切需要解决的问题。
泡沫分离技术是以气泡作分离介质来浓集表面活性物质的一种分离技术[8]。一些学者对其在低浓度表面活性物质,尤其是在蛋白、多糖等的分离纯化上的应用做了较多研究[9],为天然产物的提取分离提供了一种简单、高效的方法。同时泡沫分离法具有设备简单,易于放大,操作简单,耗能少,投入少,可选择连续或间歇式操作等优势,并且在生产过程中很少使用有机溶剂,可有效降低对环境的污染,利于工业化生产。
本研究以桑叶为原料,探究稀释倍数、温度、pH值和离子强度等因素对桑叶蛋白泡沫分离过程的影响,利用响应面分析法进行优化,以期筛选出桑叶蛋白提取的最佳工艺参数,并为今后开发新型叶蛋白的提取工艺研究和产业化提供理论依据。
1 材料与方法
1.1 材料与试剂
桑叶选取于青海省西宁市药材市场,自然晾干,粉碎过80 目筛,备用。
葡萄糖标准品 美国Sigma公司;考马斯亮蓝G-250、磷酸、乙醇均为国产分析纯;牛血清蛋白标准品(批号:20120202) 上海源叶生物科技有限公司。
1.2 仪器与设备
TU-1901双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司;LZB型玻璃转子流量计 南京顺来达测控设备有限公司;FB45/7空压机 上海捷豹压缩机制造有限公司;PB10 pH计 梅特勒-托利多(上海)仪器有限公司;BSA224S-CW分析天平 赛多利斯科学仪器(北京)有限公司;HK-2A超级恒温水浴 南京大学物理应用物理研究所;自制恒温泡沫分离装置如图1所示,恒温泡沫分离柱内径35 mm、外径 40 mm、柱高400 mm,外有夹套,通循环水,控制温度。
1.3 方法
1.3.1 桑叶蛋白的提取
取12.5 g桑叶粉末,在温度60 ℃条件下,以质量分数0.7%的氢氧化钠溶液为提取剂,料液比为1∶20,机械搅拌20 min,离心过滤重复2 次,合并滤液,储存备用[10]。测得桑叶蛋白的含量为16.8%。
1.3.2 蛋白含量的测定
采用考马斯亮蓝比色法[11-12]测定桑叶蛋白含量。
1.3.3 泡沫分离的原理
泡沫吸附分离技术是根据表面吸附的原理,通过向溶液鼓泡并形成泡沫层,将泡沫层与液相主体分离,由于表面活性物质聚集在泡沫层内,就可以达到浓缩表面活性物质或净化液相主体的目的。
1.3.4 桑叶蛋白泡沫分离的单因素试验
1.3.4.1 稀释倍数对桑叶蛋白泡沫分离的影响
在分离温度25 ℃、装液量300 mL、气速400 mL/min的条件下,选取不同稀释倍数,研究其对蛋白分离效果的影响。以回收率、富集比为评价指标来确定最佳稀释倍数。
1.3.4.2 pH值对桑叶蛋白泡沫分离的影响
在分离温度25 ℃、装液量300 mL、气速400 mL/min、稀释30 倍的条件下,选取不同pH值,研究其对蛋白分离效果的影响。以回收率、富集比为评价指标来确定最佳pH值。
1.3.4.3 离子强度对桑叶蛋白泡沫分离的影响
在分离温度25 ℃、装液量300 mL、气速400 mL/min、稀释30 倍、pH 5.0的条件下,选取离子强度为0~0.3 mol/kg,研究其对蛋白分离效果的影响。以回收率、富集比为评价指标来确定最佳离子强度。
1.3.4.4 温度对桑叶蛋白泡沫分离的影响
在装液量300 mL、气速400 mL/min、稀释30 倍、pH 5.0、离子强度0.15 mol/kg的条件下,用恒温水槽选取不同温度,通过循环水对泡沫分离器加热,使桑叶提取液达到需要的温度,研究其对蛋白分离效果的影响。以回收率、富集比为评价指标来确定最佳温度。
1.3.5 响应面试验设计
根据Box-Behnken试验设计原理,采用四因素三水平的响应面分析方法,对桑叶蛋白泡沫浮选工艺进行优化。在单因素试验的基础上,选择稀释倍数30、pH 5.0、离子强度0.15 mol/kg、温度30 ℃作为0水平,对各因素的试验水平分别以-1、0、1进行编码(表1),共设计29 个试验组,其中24 个析因点为单因素取值在各因素所构成的三维顶点;5 个零点为区域的中心点,中心试验重复5 次,用来估计试验误差。以X1、X2、X3、X4为自变量,以桑叶蛋白的富集比(E)和回收率(R)为响应值。
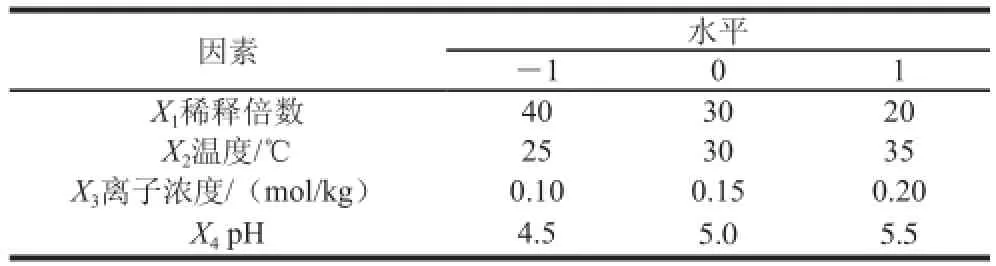
表 1 响应面法四因素三水平设计Table 1 Factors and their levels used in response surface design
评价指标的计算[13]如式(1)、(2)所示。

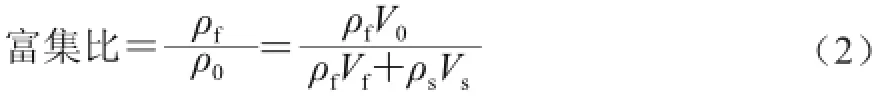
式中:ρf、ρS分别为泡沫层和残留液中蛋白的质量浓度/(mg/mL);V0、VS、Vf分别为原液、残留液和泡沫层的体积/mL。
2 结果与分析
2.1 桑叶蛋白泡沫分离的单因素试验结果
2.1.1 稀释倍数对蛋白泡沫分离的影响
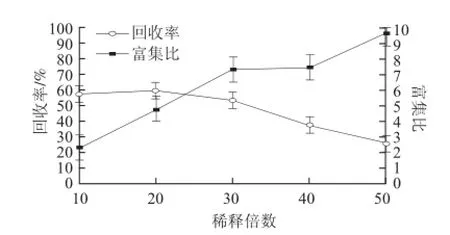
图 2 稀释倍数对蛋白泡沫分离的影响Fig.2 Effect of dilution fold on foam fractionation
由图2可以看出,随着蛋白提取液稀释倍数的增大,富集比增大而回收率减小。这是因为降低蛋白的初始质量浓度,溶液黏度减小,泡沫间隙液的流动阻力相应减小,泡沫排液速率相对加快,使得泡沫持液率降低,所以富集比升高,回收率降低[14-15]。因此选用稀释30倍作为下一步研究的条件。
2.1.2 pH值对蛋白泡沫分离的影响
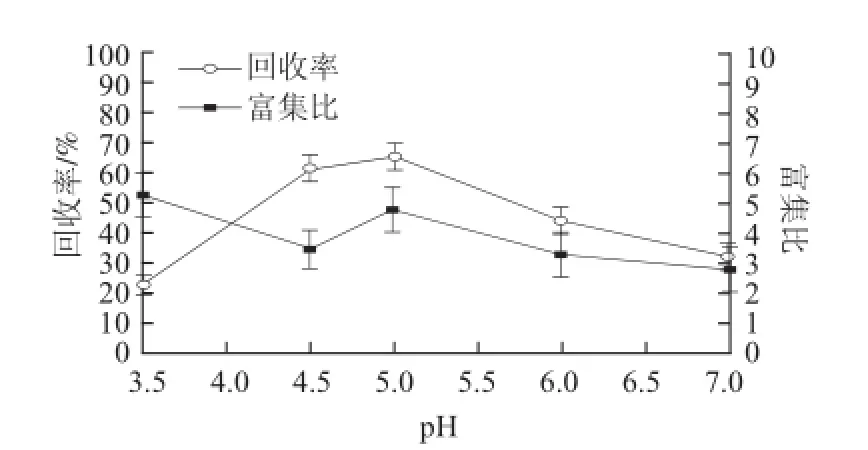
图 3 pH值对蛋白泡沫分离的影响Fig.3 Effect of pH on foam fractionation
溶液的pH值也是影响蛋白泡沫分离效果的重要因素。由图3可知,在等电点处,蛋白溶液表现良好的发泡能力,且形成的泡沫稳定性很好,这使得可供气-液两相传质的界面大大增加,也增加了蛋白的吸附量。当pH值偏离等电点时,蛋白分子又重新带电,分子间的排斥力和可溶性上升[16],导致富集比下降。因此,选用pH 5.0作为下一步研究的条件。
2.1.3 离子强度对蛋白泡沫分离的影响
由图4可以看出,随着离子强度的增加,回收率先升高后降低。增大离子强度,可以改善蛋白在气-液界面处的吸附,提高排液,增加泡沫的稳定性,加大泡沫产量,可以强化分离过程,提高回收率。但同时导致排水速率的减慢,增加了泡沫的含水量,富集比因此下降[17]。以离子强度0.15 mol/kg为下一步研究条件。
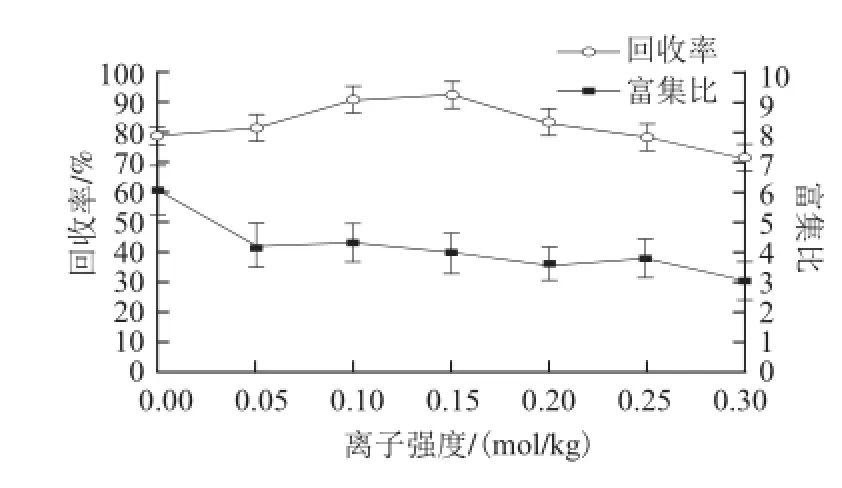
图 4 离子强度对蛋白泡沫分离的影响Fig.4 Effect of ionic strength on foam fractionation
2.1.4 温度对蛋白泡沫分离的影响
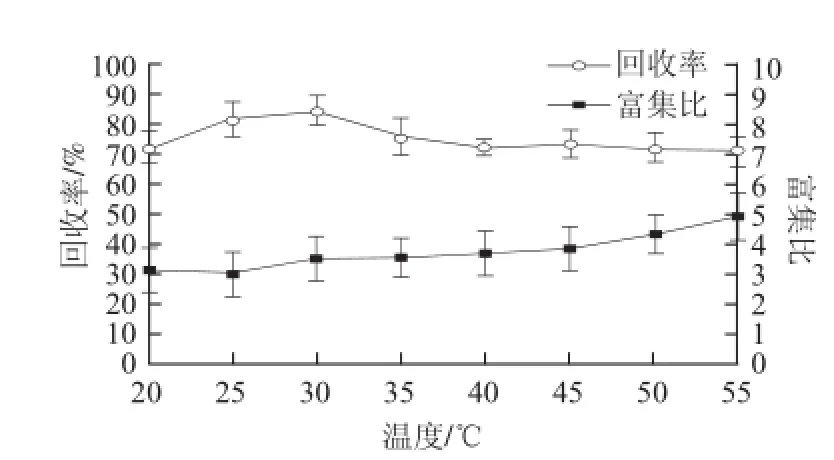
图 5 温度对蛋白泡沫分离的影响Fig.5 Effect of initial temperature on foam fractionation
由图5可以看出,随着温度的升高,回收率先升高后降低,富集比缓慢的升高。在低温时,随着温度的升高蛋白表面的张力逐渐减小,增强了泡沫的稳定性,加大泡沫量,使回收率逐渐增高。当温度过高时,泡沫的稳定性将下降,回收率也随之降低。但温度升高,泡沫含水率降低,富集比逐渐增大[18]。以温度30 ℃作为下一步研究条件。
2.2 响应面法设计桑叶蛋白的分离工艺优化结果
2.2.1 数学模型的建立及显著性检验
响应面试验设计与结果见表2。运用Design-Expert软件进行拟合,桑叶蛋白的回收率(R)和富集比(E)的响应值经回归拟合后,得到的方程为:R=88.41-
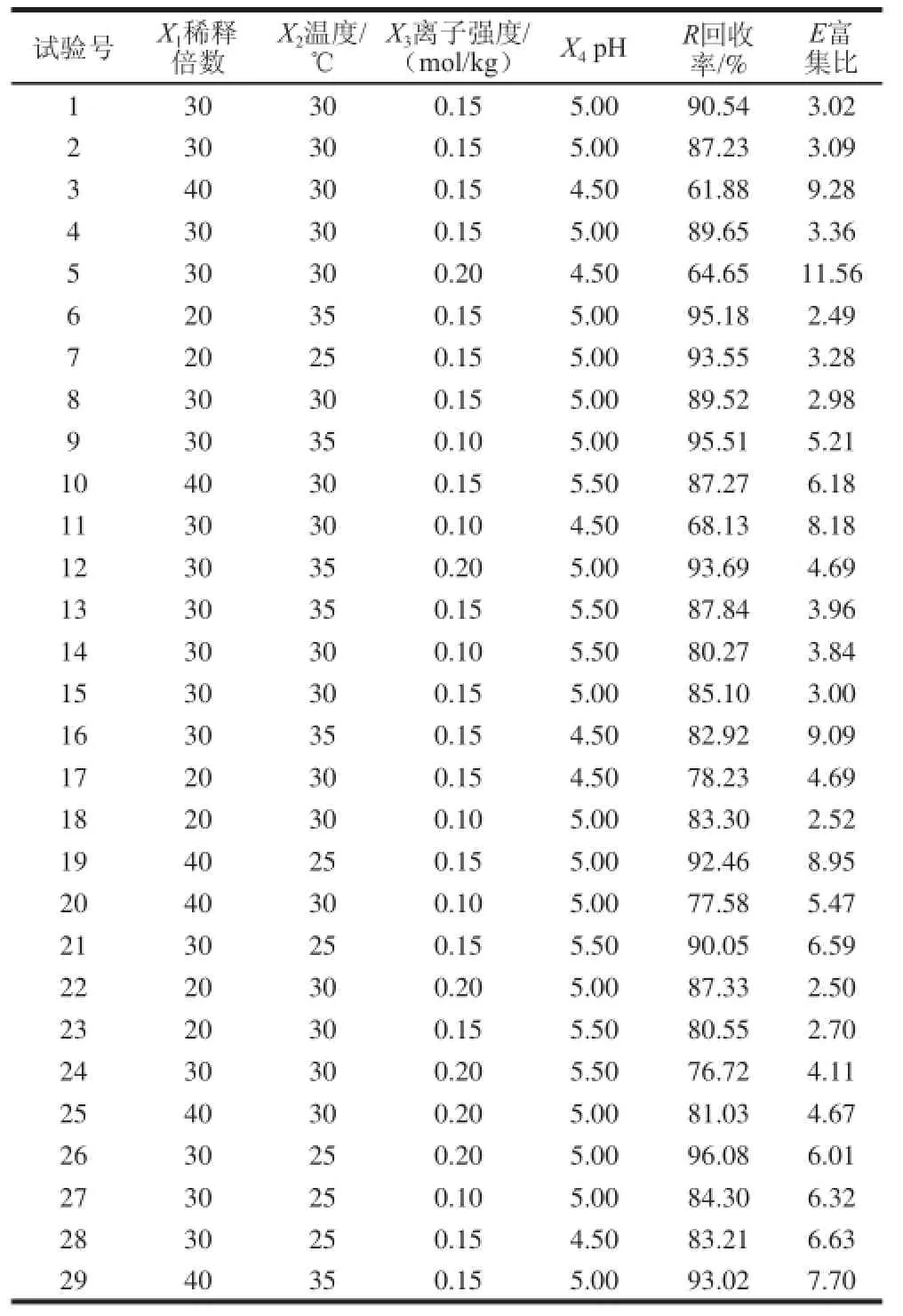
表 2 响应面试验设计及结果Table 2 Response surface design and experimental results
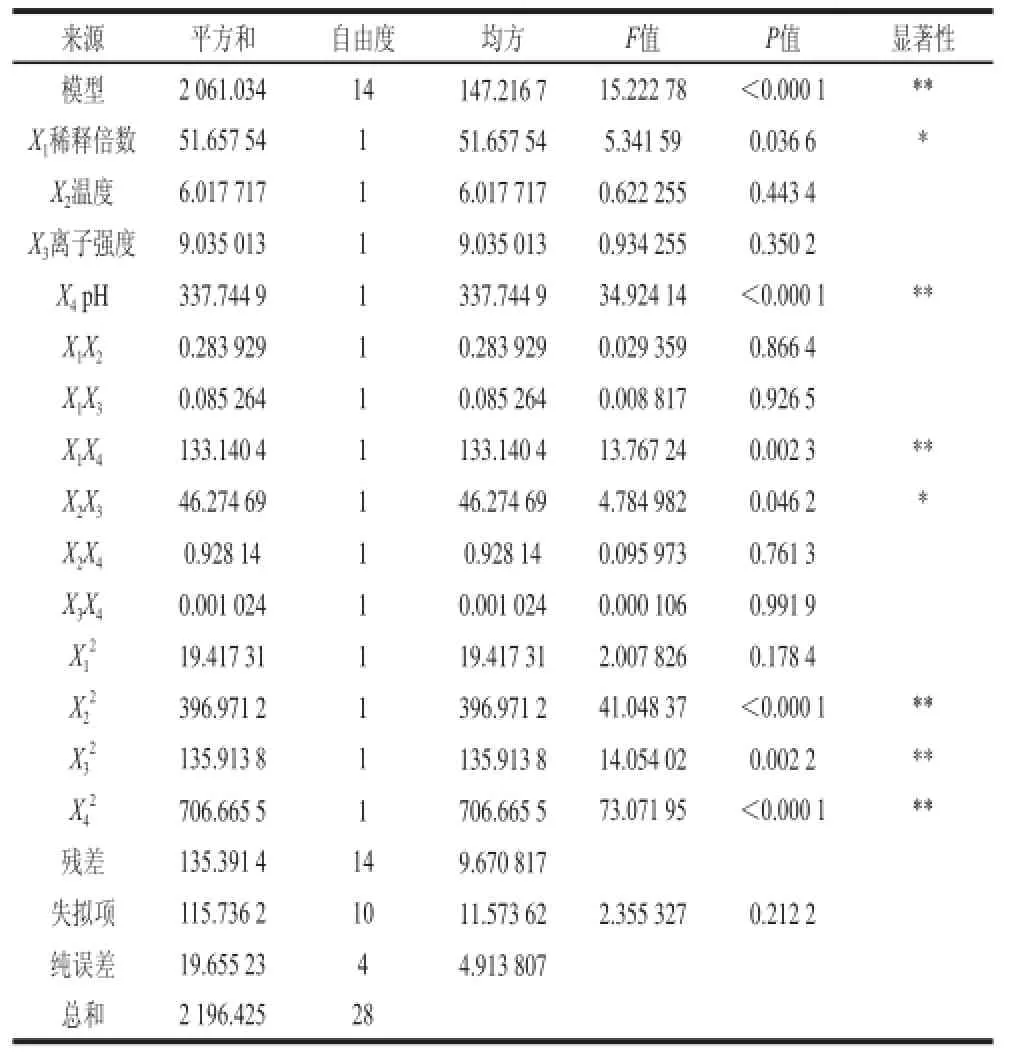
表 3 回收率的线性回归表Table 3 Regression analysis of protein recovery
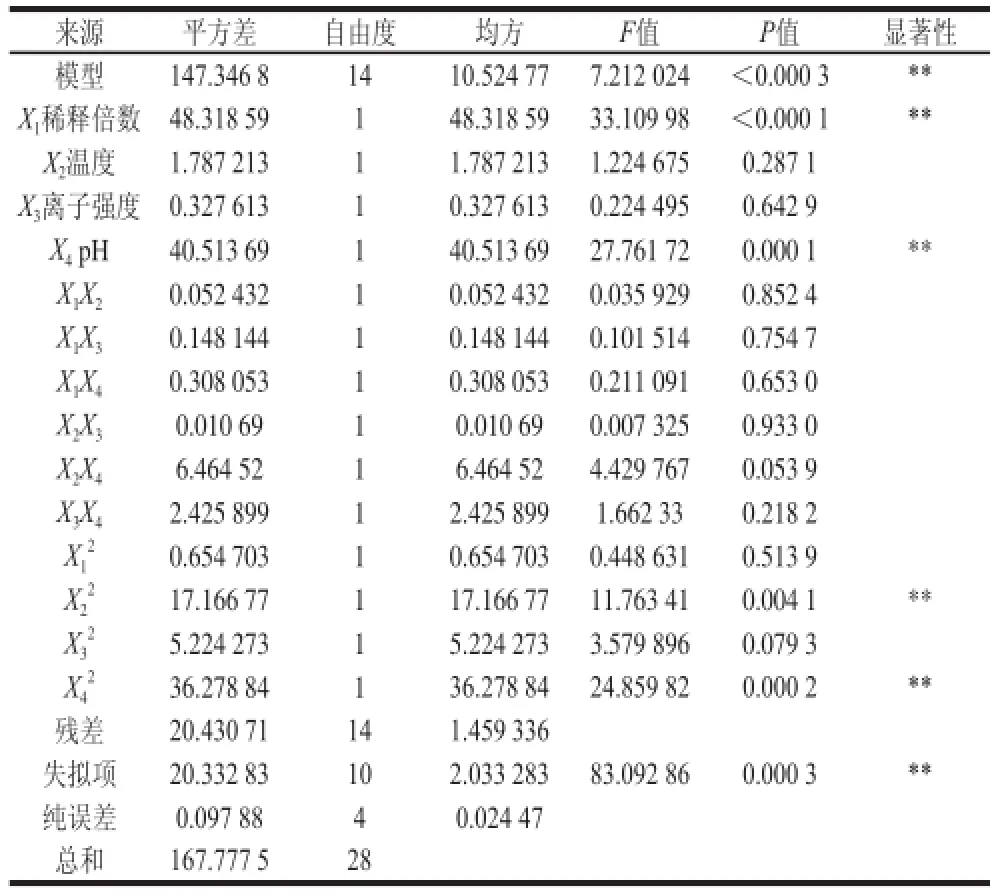
表 4 富集比的线性回归表Table 4 Regression analysis of enrichment ratio
对回归模型进行差异显著性检验及方差分析,如表3、4所示。对于回收率来说,其因变量和全体自变量之间的线性关系显著(R=0.938),该方程是高度显著的。说明响应值的变化有93.8%来源于所选变量,即稀释倍数、pH值、离子强度和温度[19]。因此该回归方程对试验拟合情况较好,可以较好地描述各因素与响应值之间的真实关系,若P<0.05方程是显著的,则表中X1、X4、X1X4、X2X3和X22、、项的影响是显著的,影响因素的顺序:pH值>稀释倍数>离子强度>温度;对于富集比来说,因变量和全体自变量之间的线性关系显著(R=0.878),该方程是显著性一般的,可能还与其他因素有关。若P<0.05方程是显著的,则表中X1、X4和X22、项的影响是显著的。影响因素的顺序:稀释倍数>pH值>温度>离子强度。其回归方程的各项方差分析结果表明:对于一次项来说稀释倍数和pH值是影响泡沫分离主要因素;对于二次项来说X2X3、X22、都由单因素中的不显著变成显著因素,因此各试验因素对响应值的影响不是简单的线性关系。所以,可以利用该回归方程确定最佳提取工艺条件。
2.2.2 响应面试验分析及优化
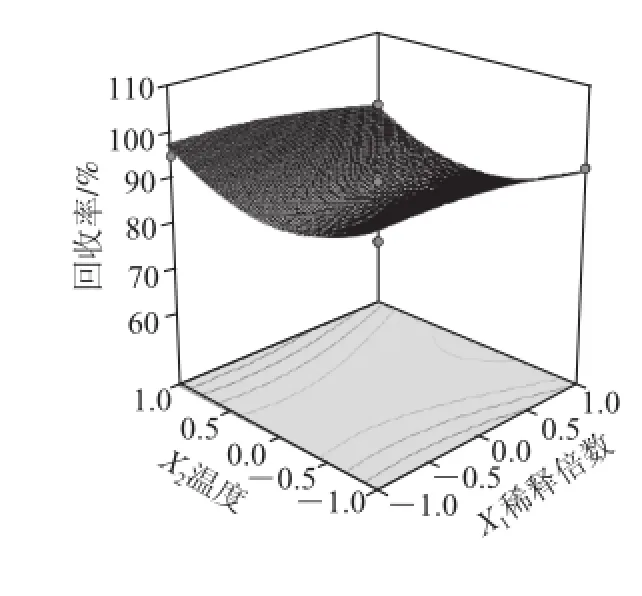
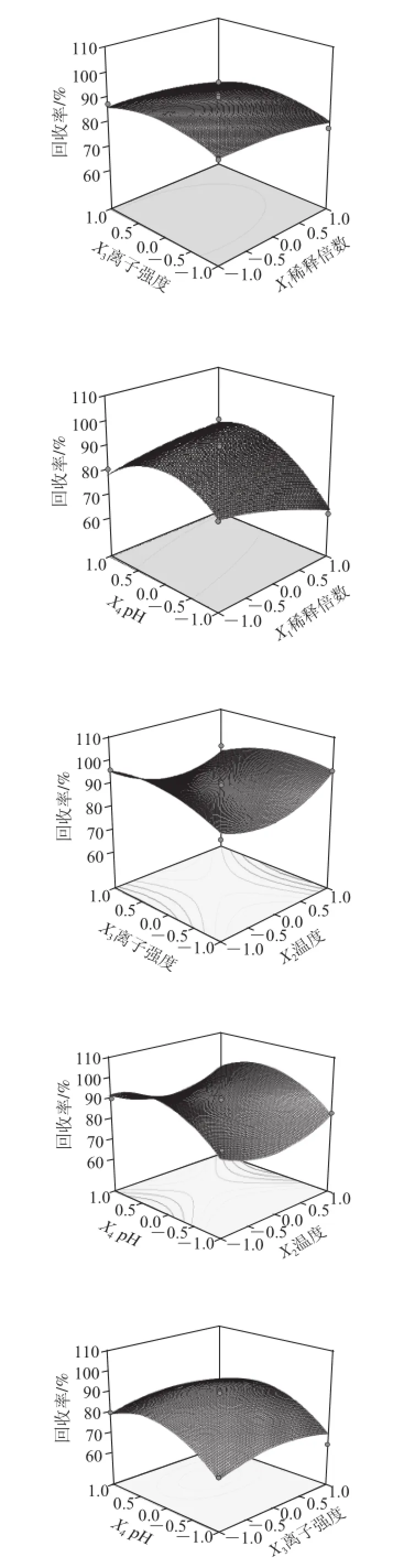
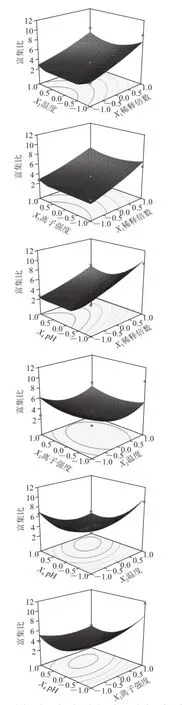
图 6 各两因素交互作用对泡沫分离富集比和回收率影响的响应面图Fig.6 Response surface graphs for the effects of experimental factors on foam separation
利用Design-Expert软件对回归方程进行统计分析,在保持其他因素不变的条件下,将回归模型进行降维处理分析,以考察因素间的交互作用对泡沫分离桑叶蛋白的影响。
根据回归分析结果,作出响应面和等高线图,如图6所示。响应值存在最大值,各参数间的等高线呈椭圆形,相互作用显著,而且能清晰地看到最高点。说明稀释倍数、pH值、温度、离子强度相互作用显著。利用Design-Expert软件为响应面分析例提供了最佳条件化优化模块,最佳优化工艺为溶液的稀释倍数39.99、温度25 ℃、离子强度0.18 mol/kg、pH 5.39,其回收率为93.86%,富集比为8.26。
2.2.3 验证实验
为了检验该法的可靠性,采用上述最优提取条件进行桑叶蛋白泡沫分离实验,同时考虑到实际操作的便利,将最优条件设为温度25 ℃、稀释倍数40、pH 5.5、离子强度0.18 mol/kg,实际测得回收率为92.50%,富集比为7.63。经冷冻干燥后,蛋白的纯度也由提取液固形物中的34.38%提高到泡沫层固形物中的65.51%,说明该方法具有实际价值。
3 结 论
应用响应面法分析桑叶蛋白的分离工艺,结果显示桑叶的最佳分离条件是:温度25 ℃、稀释倍数40、pH 5.5、离子强度0.18 mol/kg,实际测得回收率为92.50%,富集比为7.63。表明泡沫分离桑叶蛋白具有良好的分离效果,可以作为一种有效、低成本的粗分离技术[20-22],为桑叶蛋白的精深加工提供参考。
[1] 玄光善, 潘士佳, 南姬. 桑叶有效成分降糖作用研究[J]. 食品科学, 2011, 32(7): 323-326.
[2] 张传惠, 周忠泽. 霜桑叶的食用价值的研究[J]. 食品科学, 2001, 22(10): 64-65.
[3] 王芳, 刘华, 董梅红. 桑叶蛋白的功能特性研究[J]. 食品科技, 2010, 31(11): 81-86.
[4] 王芳, 乔璐, 张庆庆, 等. 桑叶叶蛋白氨基酸组成分析及营养价值评价[J]. 食品科学, 2015, 36(1): 225-228. doi: 10.7506/spkx1002-6630-201501043.
[5] 刘利林, 王帅, 尤宜安. 桑叶营养价值及部分活性物质的初步研究[J].塔里木大学学报, 2010, 22(3): 25-28.
[6] 刘青海, 张唐维, 李天才. 叶蛋白提取分离及应用研究进展[J]. 食品工业科技, 2011, 32(9): 468-471.
[7] 刘浪浪, 刘伦, 贺金金, 等. 叶蛋白研究热点及发展趋势[J]. 江西饲料, 2009(5): 24-26.
[8] 谭相伟, 吴兆亮, 贾永生, 等. 泡沫分离技术在蛋白质多元体系分离中的应用[J]. 化工进展, 2005, 24(5): 510-513.
[9] 董红星, 裴健, 刘剑. 泡沫分离法的现状与研究进展[J]. 化工时刊, 2005, 18(5): 20-22.
[10] 江洪波, 雷挺. 桑叶叶蛋白提取工艺的研究[J]. 农产品加工: 学刊, 2007(12): 19-21.
[11] 王孝平, 邢树礼. 考马斯亮蓝法测定蛋白含量的研究[J]. 天津化工, 2009, 23(3): 40-42.
[12] BRADFORD M M. A rapid and sensetitive method for the quantitation of microgram quantities utilizing the principle of protein dye binding[J]. Analytical Biochemistry, 1976, 72: 248-254.
[13] 孙瑞娉, 殷昊, 卢珂, 等. 两级泡沫分离废水中大豆蛋白的工艺[J].农业工程学报, 2010, 26(11): 374-378.
[14] CHAN N Y, HOSSAIN M M, BROOKS M S. A preliminary study of protein recovery from mussel blanching water by a foaming process[J]. Chemical Enginering and Procesing, 2007, 46: 501-504.
[15] HOSSAIN M, FENTON G. Concentration of proteins from single component solution using a semibatch foam process[J]. Separation Science and Technology, 1998, 33(16): 2623-2635.
[16] OGUNWOLUA S O, HENSHAWB F O, MOCKC H P, et al. Functional properties of protein concentrates and isolates produced from cashew nut[J]. Food Chemistry, 2009, 115(3): 852-858.
[17] 赵艳丽, 张芳, 吴兆亮. 不同pH下离子强度对泡沫分离乳清蛋白的影响[J]. 河北工业大学学报, 2012, 41(4): 40-45.
[18] LI Rui, WU Zhaoliang, WANG Yanji, et al. Pilot study of recovery of whey soy proteins from soy whey wastewater using batch foam fractionation[J]. Journal of Food Engineering, 2014, 142: 201-209.
[19] 吴晖, 赖富饶, 胡筱波. 响应面分析法优化油菜花粉多糖提取工艺的研究[J]. 食品与机械, 2007, 23(5): 66-69; 73.
[20] 赵艳丽, 吴兆亮, 佟斌. 两级泡沫分离回收多粘菌素E[J]. 食品研究与开发, 2009, 30(6): 63-66.
[21] 佟斌, 刘桂敏, 吴兆亮. 泡沫分离提取多粘菌素E的工艺研究[J]. 食品工业科技, 2007, 28(5): 153-156.
[22] 杨向平, 刘元东, 秦海良. 大豆蛋白废水中乳清蛋白的泡沫分离实验[J]. 化工进展, 2008, 27(1): 92-97.
Optimization of Foam Separation of Mulberry Leaf Protein by Response Surface Methodology
LIU Haibin, ZHANG Wei*, CHEN Yuantao, LI Xuanling, CHEN Liang, GAO Zhongchao
(Department of Chemistry, Qinghai Normal University, Xining 810008, China)
The foam fractionation of mulberry leaf protein was optimized by response surface methodology. The selection and optimization of Experiment factors affecting separation effi ciency and their levels were carried out using combination of one-factor-at-a-time method, Box-Behnken factorial design and regression analysis. Based on the response surface and contour plots established with protein recovery and enrichment ratio as the response values, the optimum conditions for the separation of mulberry leaf protein were found to be dilution factor of 40, pH 5.5, ionic strength of 0.18 mol/kg, and separation temperature of 25 ℃. Under these conditions, the experimental values of protein recovery and enrichment ratio were 92.50% and 7.63, respectively. In conclusion, foam fractionation can provide a new method for protein separation from mulberry leaves.
foam fractionation; mulberry leaf protein; response surface methodology; recovery; enrichment ratio
O629.73
A
1002-6630(2015)08-0097-06
10.7506/spkx1002-6630-201508017
2014-09-22
刘海彬(1986—),男,硕士研究生,研究方向为天然产物提取与分离。E-mail:1017971627@qq.com
*通信作者:张炜(1972—),女,教授,硕士,研究方向为天然产物提取与分离。E-mail:zhangwei@qhun.edu.cn
