18S rDNA介导的FKS1基因过表达对酵母自溶性能的影响
2015-12-29李佳王金晶李崎
李佳,王金晶,李崎
18S rDNA介导的基因过表达对酵母自溶性能的影响
李佳1,2,王金晶1,2,李崎1,2
1 江南大学工业生物技术教育部重点实验室,江苏 无锡 214122 2 江南大学酿酒科学与工程研究室,江苏 无锡 214122

李佳, 王金晶, 李崎. 18S rDNA介导的FKS1基因过表达对酵母自溶性能的影响. 生物工程学报, 2015, 31(9): 1344–1354.Li J, Wang JJ, Li Q. Overexpression of FKS1 by 18S rDNA targeted influence on yeast autolysis. Chin J Biotech, 2015, 31(9): 1344–1354.
酵母被誉为啤酒酿造的灵魂,然而随着啤酒高浓酿造技术的发展,酿造过程中渗透压增加、乙醇含量升高及营养平衡改变等会加快酵母的自溶,对啤酒的风味品质产生不利的影响。为提高酵母的抗自溶能力,本研究构建了以酿酒酵母18S rDNA序列为同源位点的过表达菌株。结果表明,过表达菌株细胞壁葡聚糖含量较原菌高62%;通过平板耐受性分析可知,过表达菌株在8%的乙醇浓度、0.4 mol/L NaCl的渗透压冲击以及24 h饥饿培养的条件下,其胁迫耐受性均高于原始菌株;模拟自溶实验结果显示过表达菌株自溶速度缓慢,抗自溶能力明显优于原始菌株。该结果有助于探究酵母自溶的机理,同时也对提高啤酒风味品质和稳定性有着重要的意义。
酿酒酵母,细胞壁,β-1,3-葡聚糖,抗环境胁迫,模拟自溶
酿酒酵母是与人类关系最为广泛和密切的一种微生物,不仅因为传统上它用于酿酒和制作面包、馒头;在现代分子和细胞生物学中也常被用作模式生物,是研究真核细胞遗传学和生理学的重要工具[1]。因此可谓是工业界最为重要的微生物之一。
在啤酒发酵过程中,随着发酵过程的深入进行,酵母所处环境的渗透压、乙醇浓度不断升高,营养成分不断减少[2],这种变化促使酵母衰老,胞内的生物化学过程受到破坏,各种酶和底物的作用失去协调性,致使酵母开始自 溶[3]。自溶过程会促使胞内物质释放到胞外,带给啤酒酵母味、加重的涩味、苦味等风味上的改变,同时使酒体的泡持性及风味稳定性变差,极大地影响了啤酒的品质[4]。
酵母细胞壁是抵抗外界环境刺激的一个非常重要的屏障[5-6],其坚固程度直接影响着酵母衰老死亡的速度。研究表明,葡聚糖作为酵母细胞壁的重要组成成分,对维持酵母细胞形态、增加细胞壁坚韧性、抵抗外界环境刺激等方面发挥着重要的作用[7]。在酿酒酵母的基因组中,基因直接调控细胞壁葡聚糖合成酶的表 达[8-10]。因此,可以通过基因的表达来调控细胞壁,进而影响酵母细胞的自溶。
在酵母基因的过表达过程中,使用最为广泛的载体分别是附加型载体 (YEP) 和整合型载体 (YIP)[11]。其中YEP型载体具有独立存活及拷贝数较高的优点,不足之处在于质粒容易丢失,即稳定性较差;相比之下,YIP型载体当整合入酵母基因组后则特异性高、稳定性强,但存在拷贝数低的问题[11]。所以,拷贝数高、稳定性强的基因过表达方式将会得到很好的应用。研究发现,在酿酒酵母的XII染色体中存在100−140个拷贝的rDNA[12-15],并且rDNA的序列有高度的保守性。因此,将此rDNA序列作为同源重组的整合位点可以使目的基因得到高效且稳定的过表达,本文即在此理论基础上构建了基因过表达质粒,将其整合到酿酒酵母中达到过表达基因的目的。
综上所述,本研究通过选取18S rDNA为同源重组整合位点,构建了过表达酿酒酵母基因的重组菌。结果表明,和野生菌相比,重组菌的细胞壁葡聚糖含量增多,从而使得其抗自溶能力有了很大的提高。对探究酵母自溶机理、提高啤酒风味品质及稳定性方面发挥了积极的作用。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒
本研究所用的菌株和质粒如表1所示。
1.1.2 培养基及试剂
LB培养基(g/L):胰蛋白胨10,酵母提取物5,氯化钠10。需要时使用前加入氨苄青霉素至100 μg/mL,固体培养基添加20 g琼脂,用于大肠杆菌培养。
YPD培养基(g/L):胰蛋白胨20,酵母提取物10,葡萄糖20。制备平板时添加20 g琼脂,用于酵母培养。筛选转化子时需添加G418至200 μg/mL。固体平板抗性实验时需添加无水乙醇至8%浓度,NaCl至0.4 mol/L浓度。
DNA聚合酶、DNA聚合酶、Prime STAR Max及克隆载体pMD19T-simple、T4 DNA连接酶、感受态细胞制作试剂盒、限制性内切酶HⅠ、Ⅰ、Ⅱ、Ⅰ、Ⅰ和Ⅰ均购自TaKaRa公司;酵母基因组提取试剂盒购自天根生化科技有限公司;质粒提取试剂盒、柱式胶回收试剂盒购自OMEGA Bio-Tek公司。其他试剂均为国药集团化学试剂有限公司产品。

表1 菌株和质粒
1.2 方法
1.2.1 基因的克隆及质粒的构建
以W303酵母基因组为模板,扩增启动子序列,得到Ⅰ--ⅡHⅠ片段;将得到的片段与T载体连接构建pTP质粒。再以W303酵母基因组为模板,扩增基因序列,得到Ⅱ-HⅠ片段;最后通过Ⅱ与HⅠ双酶切pTP质粒及片段,连接构建pTPF质粒。
以pUG6质粒为模板,扩增基因片段,得到ⅠHⅠⅠⅠ片段;将得到的该片段与T载体连接构建pTK1质粒。再以W303酵母基因组为模板,扩增18S rDNA下臂,即Ⅰ18S rDNAdownⅠ片段;通过Ⅰ与Ⅰ双酶切连接pTK1质粒及下臂片段,构建pTK2质粒。最后以W303酵母基因组为模板,扩增18S rDNA上臂,即Ⅰ18S rDNAupⅠHⅠ片段;通过Ⅰ与HⅠ双酶切pTK2质粒与上臂片段,构建pTK重组质粒。
pTPF及pTK重组质粒通过Ⅰ与HⅠ双酶切后连接,构建pTPFK质粒。再通过Ⅰ与Ⅰ双酶切获得目的同源整合线性片段:up-down。将所获片段按照醋酸锂转化法[12]转化,转化后先涂布到YPD平板上,24 h后影印[16]到含200 μg/mL G418的平板上,28 ℃培养2−4 d,检测转化子。片段扩增及转化子验证所需引物及条件如表2所示:

表2 实验所需引物及扩增条件
1.2.2 生长性能分析
将酿酒酵母野生对照菌株W303、重组菌W303-KT斜面菌种进行活化,接入装有10 mL YPD培养基的50 mL三角瓶中,180 r/min、28 ℃振荡培养18 h,然后以10%的接种量接入装有30 mL YPD培养基的100 mL三角瓶中,相同条件下培养。先每隔2 h取样,30 h后逐渐延长取样间隔时间,测定600值并作酵母生长曲线。
1.2.3 细胞形态分析
将酿酒酵母野生对照菌株W303、重组菌W303-KT斜面菌种进行活化,接入装有10 mL 麦汁培养基的试管中,180 r/min、28 ℃振荡培养18 h;然后1 500 r/min离心10 min收集菌体进行扫描电镜制样、镜检。
1.2.4 葡聚糖含量分析
样品处理:首先配制1.0 mol/L氢氧化钠溶液100 mL,取离心收集的酵母泥5 g加入其中,在90 ℃条件下反应3 h,后3 000 r/min离心 15 min,沉淀物水洗2次,无水乙醇洗涤定容[17]。
分光光度计检测:0.1 mL样品 + 1.9 mL蒸馏水 + 4.0 mL刚果红,20 ℃精确保温10 min后于550 nm下测吸光值。以2.0 mL蒸馏水 + 4.0 mL刚果红作空白。
β-葡聚糖含量 (mg/L) =××1/×20
式中,为试样吸光值;为标准曲线上吸光度为1时对应的β-葡聚糖μg数;为吸取稀释试样体积的毫升数;20为试样稀释倍数。
1.2.5 环境耐受性分析
于斜面试管中取一环菌接入5 mL YPD液体培养基中(饥饿培养则接入相同体积的无菌水中),28 ℃培养24 h。用无菌水调节菌液浓度使其=1.0,10倍稀释梯度,依次取2.5 μL点种在含有8%乙醇、0.4 mol/L NaCl的抗性平板上,以及将饥饿培养的按照同样方法点种在YPD平板上,培养2–3 d,观察菌落生长情况[18]。
1.2.6 模拟自溶分析
参考王敏等[19]的方法培养和收集酵母,2 g酵母泥加到200 mL的柠檬酸盐缓冲液(pH 4.0)(模拟自溶液) 中,于28 ℃、150 r/min放置,定时取样测定。
酵母细胞死亡率的测定及260和280的测定及比值计算方法参照许维娜等[20]方法。
2 结果与讨论
2.1 转化子的构建与筛选
2.1.1 重组质粒的构建
参照1.2.1质粒的构建方法,依次构建pTPF和pTK重组质粒(图1和图2);通过Ⅰ与Ⅰ双酶切连接上述两个质粒,构建pTPFK质粒,通过Ⅰ与Ⅰ、Ⅰ与HⅠ双酶切分别来验证转化子(图3和图4)。
2.1.2 转化子的筛选及验证
用醋酸锂法将所得的目的片段转化入野生对照菌W303,使重组片段两端的同源臂与目的基因18S rDNA发生同源重组,即用up--down来替换up-18S rDNA-down。然后通过平板影印法来筛选转化子。提取转化子的基因组,使用不同位置的引物进行PCR验证,引物验证结果如图5所示:A设计引物扩增18S rDNA-up和间的核苷酸序列,阳性结果为1 270 bp;B设计引物扩增和18S rDNA-down间核苷酸片段,阳性结果为975 bp。最终成功筛选出阳性转化子,并命名为W303-KT。

图1 pTPF质粒构建示意图
2.2 重组菌的基础性能分析
2.2.1 重组菌基因的表达水平和遗传稳定性
本实验使用实时荧光定量PCR (qRT-PCR) 来分析过表达菌株基因的mRNA表达水平,结果表明重组菌株基因的表达量约为原菌的10倍(图6);同时,为验证转化菌的遗传稳定性,将原菌和重组菌在无G418选择压力的条件下,连续转接液体YPD 培养10次并用第10代菌液划线。结果如图7所示:重组菌可以在含有200 μg/mL G418的YPD平板上生长,而原菌则不能,表明转化菌的遗传稳定性良好。以上结果表明基于18S rDNA的过表达拷贝数高且稳定性好。
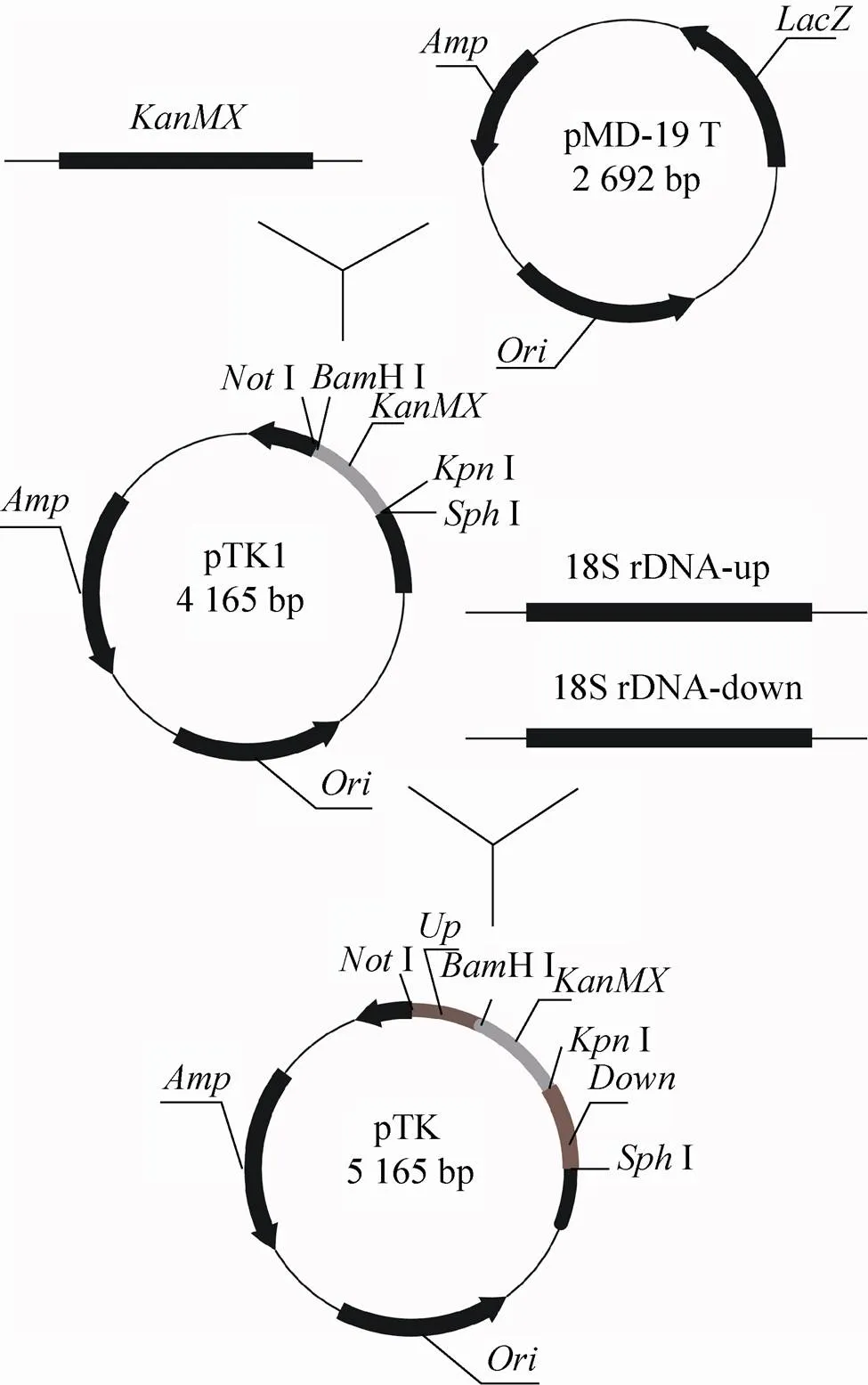
图2 pTK质粒构建示意图
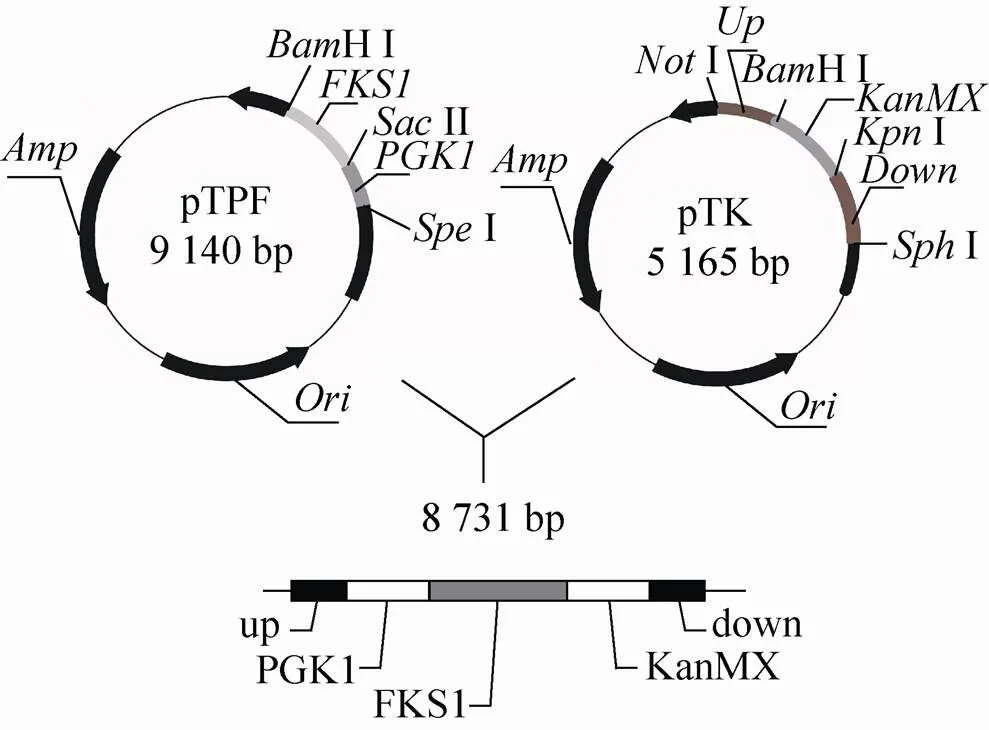
图3 pTPFK质粒构建示意图

图4 pTPFK质粒及酶切电泳图

图5 W303-KT转化子基因组验证结果
2.2.2 细胞形态和生长性能
为分析重组菌与原菌的性状异同点,本实验对它们进行了细胞形态观察,扫描电镜结果显示(图8):从外形上看,转化菌与原菌并无大的差别。然而,生长曲线测定结果则显示转化菌生长速度始终快于原菌(图9)。由此推测,基因的过表达加快了细胞壁葡聚糖的合成,从而促进了细胞的生长。
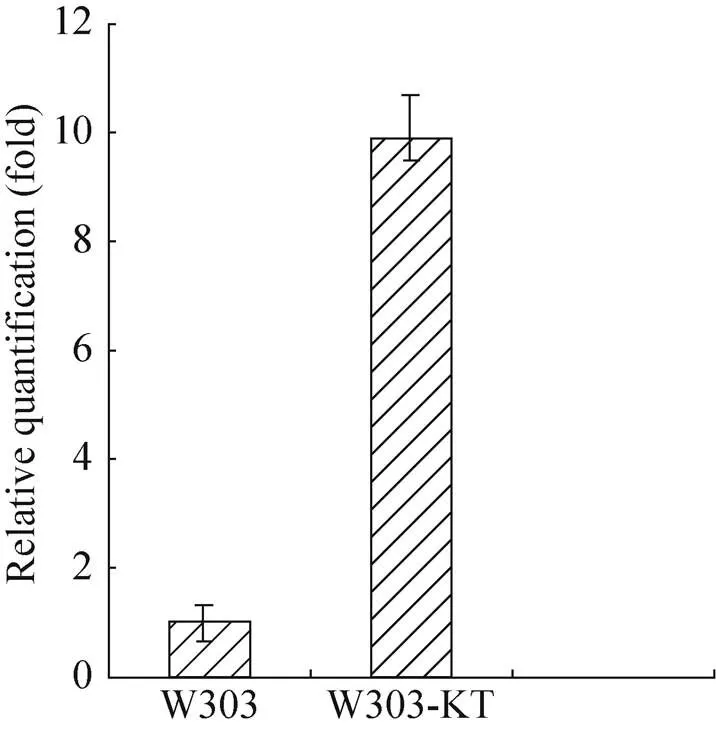
图6 原菌与重组菌的qRT-PCR分析

A B
2.3 重组菌自溶性能分析
为验证重组菌抗自溶能力的增强,本实验首先分析了菌株的葡聚糖含量变化情况,然后通过模拟自溶实验来评价菌株的自溶性能,最后通过环境胁迫性分析给予辅证。

图8 原菌与转化菌的扫描电镜 (SEM) 分析
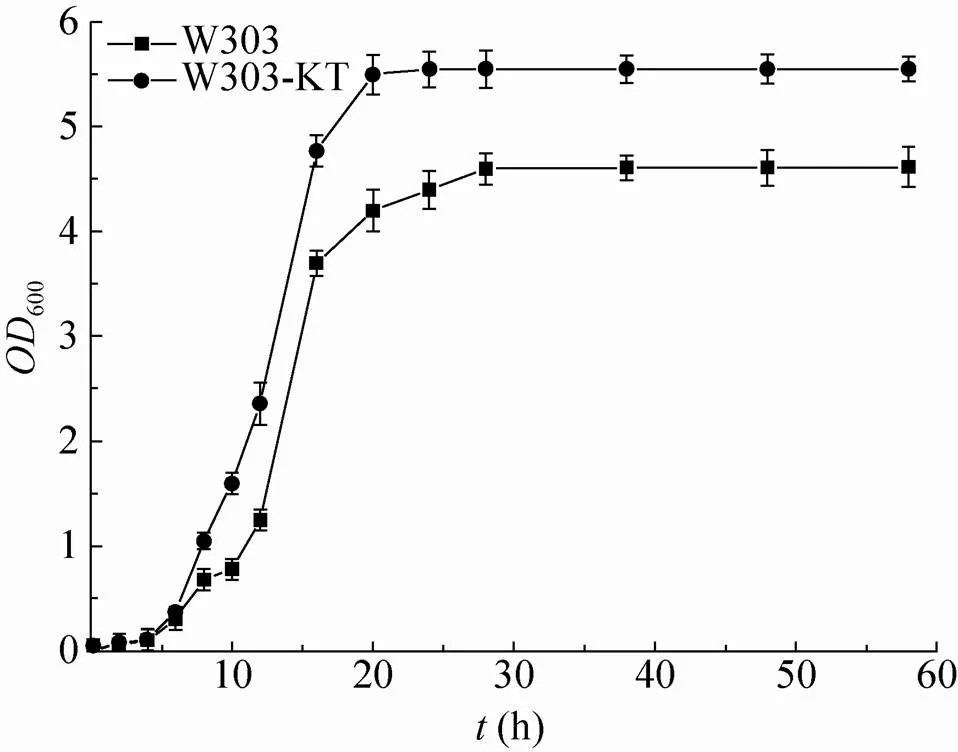
图9 不同菌株的生长曲线
2.3.1 葡聚糖含量分析
葡聚糖含量检测结果显示原菌为 (3.50 ± 0.02)mg/g,重组菌为 (5.68 ± 0.03) mg/g,较原菌增长62%。基因为调控β-1,3-葡聚糖合成酶的关键基因,由于基因的高效过表达,使得细胞壁内葡聚糖含量增多。同时,重组菌细胞壁葡聚糖含量的变化为后面的自溶性能分析提供了理论比较依据。
2.3.2 模拟自溶
本研究采用模拟分析,将不同菌株置于模拟自溶液中进行模拟自溶,以此来观察菌株的生长变化情况。首先,观察了酵母细胞在模拟自溶液中的死亡率变化情况,结果如表3所示:重组菌株的死亡率明显慢于原始菌株;同时,本实验还对模拟自溶液过滤后的滤液在260 nm和280 nm处的吸光度值进行测定,并计算260/280,结果如表4所示。自溶开始时,酵母释放出的蛋白类物质比例较大,260/280的值较小;随着自溶程度的增大,自溶液中的核酸类物质所占比例越来越大,260/A80的值也逐渐增大,向2.0靠近[20]。
基于本实验室先前的研究,我们对260/280与酵母的死亡率进行拟合与分析,发现随着酵母自溶程度的变化,(260/280)/死亡率呈现明显且一致的变化趋势,且酵母自溶程度越大该比值越小。该方法可适用于比较不同菌株的自溶性能,已得到良好的验证和应用[20-21]。在此理论基础上,W303-KT菌株的抗自溶能力明显优于原始菌株 (数据未显示)。

表3 酵母在自溶液中死亡率的变化
The results are presented as the average for three times.

表4 酵母在自溶液中A260/A280比值的变化
The results are presented as the average for three times.
2.3.3 环境胁迫性分析
基因是调控细胞壁完整性途径中的重要基因之一,该基因的过表达可提高菌株的抗环境胁迫能力,即抵抗外界刺激的能力,是菌株抗自溶能力增强的重要辅证。结果表明,在分别含有8%的乙醇、0.4 mol/L NaCl以及饥饿培养的条件下,W303-KT菌株的生长状况均优于原菌 (图10)。该结果证明重组菌株具有更强的抵抗环境刺激的能力,从侧面证明了菌株抗自溶能力的增强。

图10 不同胁迫条件下菌株生长状况
3 结论
酵母是啤酒酿造的灵魂,强壮的酵母可以酿造出品质优良、风味稳定性好、无杂异味的啤酒。而酵母自溶是影响啤酒风味品质的重要因素,自溶过程中会释放出对啤酒质量有较大负面影响的物质,使啤酒带有酵母味,加重苦味、涩味,使啤酒的泡持性及稳定性变差,如果有5%的酵母发生自溶,将对啤酒质量造成难以挽回的影响[22-23]。针对酵母自溶的研究,国内学者多从实际生产和工艺角度出发,方法简单快捷,但通常不是十分有效[24-25],并且不能从根本上理解和解决自溶问题;而国外学者采用的方法因设备或技术限制,在国内推广的空间不大。因此需要探索酵母自溶的机理,寻求简单灵敏的方法来从根本上解决酵母自溶的问题。
本研究从细胞壁的主要成分葡聚糖角度出发,运用分子生物学手段过表达葡聚糖合成酶基因,获得重组菌株W303-KT。研究表明,重组菌株细胞壁中葡聚糖积累量显著增加,不但增强了酵母菌株对环境胁迫的抵抗能力,更重要的是,通过模拟自溶实验证明,过表达菌株的抗自溶能力明显优于原始菌株,该发现对于进一步研究酵母自溶的机理以及细胞壁完整性途径(CWI) 的调控模式和调控因子功能奠定了基础,有助于从根本上理解酵母自溶并加以控制和利用,为最终工业生产风味品质更优、稳定性更好的啤酒提供了理论依据。
[1] Yu N. Sequence analysis of yeast genome[D]. Tianjin: Hebei University of Technology, 2009 (in Chinese).于娜. 酵母基因组序列分析[D]. 天津: 河北工业大学, 2009.
[2] Gibson BR, Lawrence SJ, Leclaire JP, et al. Yeast responses to stresses associated with industrial brewery handling. FEMS Microbiol Rev, 2007, 31(5): 535–569.
[3] Xu YJ, Jiang HB, Lu JF. The reasons and prevention of yeast autolysis. Brewing, 2010, 37(4): 52–54 (in Chinese).徐亚杰, 姜海波, 逯家富. 酵母自溶的原因及防控措施. 酿酒, 2010, 37(4): 52–54.
[4] Wang M, Li Q, Gu GX. The relationship between brewer yeast autolysis and cell wall. Chem Life, 2008, 28(4): 504–506 (in Chinese).王敏, 李崎, 顾国贤. 啤酒酵母自溶与细胞壁关系. 生命的化学, 2008, 28(4): 504–506.
[5] Levin DE. Cell wall integrity signaling in. Microbiol Mol Biol Rev, 2005, 69(2): 262–291.
[6] Firon A, Lesage G, Bussey H. Integrative studies put cell wall synthesis on the yeast functional map. Curr Opin Microbiol, 2004, 7(6): 617–623.
[7] Ohya Y, Nogami S. Biosynthetic enzymes for (1-3)-β-Glucans, (1-3;1-6)-β-Glucans from yeasts: biochemical properties and molecular biology//Chemistry, Biochemistry, and Biology of 1-3 Beta Glucans and Related Polysaccharides. Tokyo: Academic Press, 2009: 259–282.
[8] Katiyar SK, Alastruey-Izquierdo KR, Healey, et al. Fks1 and Fks2 are functionally redundant but differentially regulated in: implications for echinocandin resistance. Antimicrob Agents Ch, 2012, 56(12): 6304–6309.
[9] Johnson ME, Edlind ED. Topological and mutational analysis ofFks1. Eukaryot Cell, 2012, 11(7): 952–960.
[10] Garcia-Effron G, Lee S, Park S, et al. Effect ofFKS1 and FKS2 mutations on echinocandin sensitivity and kinetics of 1,3-beta-D-glucan synthase: implication for the existing susceptibility breakpoint. Antimicrob Agents Ch, 2009, 53(9): 3690–3699.
[11] Zhi XH, Wang LN, Zhu P, et al. Construction and application ofintegration vector based on rDNA sequence. Chin Med Biotechnol, 2011, 6(5): 330–335 (in Chinese).支晓慧, 王丽娜, 朱平, 等. 基于rDNA序列的酵母整合载体的构建及应用. 中国医药生物技术, 2011, 6(5): 330–335.
[12] Petes TD. Yeast ribosomal DNA genes are located on chromosome XII. Proc Nati Acad Sci USA, 1979, 76(1): 410–414.
[13] Wery J, Renniers AC. High copy number integration into the ribosomal DNA of the yeast. Gene, 1997, 184(1): 89–97.
[14] Liu XY, Shen Y, Guo T, et al. Construction of a ribosomal DNA multi-copy integration vector and application in the industrial. J Shandong Univ, 2005, 40(3): 105–109 (in Chinese).刘向勇, 沈煜, 郭亭, 等. rDNA介导的多拷贝整合表达载体的构建及其在酿酒酵母工业菌株中的应用. 山东大学学报, 2005, 40(3): 105–109.
[15] Zhang GM, Zeng YF, Chen YL, et al. Construction of rDNA-mediated stable expression vectors in. Mycosystema, 2011, 30(1): 39–45 (in Chinese).张桂敏, 曾毓芳, 陈雅兰, 等. rDNA介导的酿酒酵母稳定表达载体的构建. 菌物学报, 2011, 30(1): 39–45.
[16] Song HL, Guo XX, Yang YM, et al. Deletion o f ADH3 gene from. Ind Microbiol, 2006, 36(4): 28–32 (in Chinese).宋浩雷, 郭晓贤, 杨月梅, 等. 酿酒酵母ADH3基因的敲除. 工业微生物, 2006, 36(4): 28–32.
[17] Gong YD, Guo SY, Wei D. Study on the extraction of β-1,3-D-glucan from the cell wall of medical yeast. China Food Additives, 2006(2): 57–59 (in Chinese).龚炎杰, 郭祀远, 魏东. 从酵母细胞壁提取β-1,3-葡聚糖的研究. 中国食品添加剂, 2005: 57–59.
[18] Liu XY, Zhang XH, Zhang XJ. Cu, Zn-superoxide dismutase is required for cell wall structure and for tolerance to cell wall-perturbing agents in. FEBS Lett, 2010, 584(6): 1245–1250.
[19] Wang M, Zheng FY, Liu CF, et al. Research on evaluation index of autolytic ability in brewing yeast. Sci Technol Food Ind, 2009, 30(10): 75–75 (in Chinese).王敏, 郑飞云, 刘春凤, 等. 啤酒酵母自溶分析评价指标的标准. 食品工业科技, 2009, 30(10): 75–75.
[20] Xu WN, Wang JJ, Chen X, et al. Changes in autolysis solution of brewer's yeasts and the evaluation of autolysis. J Sci Biotechnol, 2012, 32(6): 574–580 (in Chinese).许维娜, 王金晶, 陈希, 等. 啤酒酵母自溶液中的物质变化及酵母自溶评价指标探索. 食品与生物技术学报, 2012, 32(6): 574–580.
[21] JM G. Analysis of yeast autolysis. Beer Sci Technol, 2009, 2(2): 56–57.
[22] Sun FB, Ren HY, Zhao CX. Ion influence on organic acid metabolized by beer yeast. J Food Sci Biotechnol, 2006, 25(3): 63–66 (in Chinese).孙付保, 任洪艳, 赵长新. 离子对啤酒酵母代谢产酸的影响. 食品与生物技术学报, 2006, 25(3): 63–66.
[23] Hua YC, Qiao WC, Zhang B. Discussion on the evaluation indexes of yeast autolysis. Beer Sci Technol, 2002, 6(3): 7–8 (in Chinese).华玉苍, 乔万昌, 张波, 等. 试论酵母自溶的判定指标. 啤酒科技, 2002, 6(3): 7–8.
[24] Wang ZJ. Determination of beer yeasts autolysis index. Shandong Food Fermen, 2011, 4(163): 427–429 (in Chinese).王志坚. 啤酒酵母自溶指标的判定, 山东食品发酵, 2011, 4(163): 427–429.
[25] Cavagna M, Dell'Anna R, Monti F, et al. Use of ATR-FTIR microspectroscopy to monitor autolysis ofcells in a base wine. J Agric Food Chem, 2010, 58(1): 39–45.
(本文责编 陈宏宇)
Overexpression ofto improve yeast autolysis-stress
Jia Li1,2, Jinjing Wang1,2, and Qi Li1,2
1,,,214122,,2,,214122,,
With the development of high gravity brewing, yeast cells are exposed to multiple brewing-associated stresses, such as increased osmotic pressure, enhanced alcohol concentration and nutritional imbalance. These will speed up yeast autolysis, which seriously influence beer flavor and quality. To increase yeast anti-autolytic ability,overexpression strain was constructed by 18S rDNA. The concentration of β-1,3-glucan of overexpression strain was 62% higher than that of wild type strain. Meantime,overexpression strain increased anti-stress ability at 8% ethanol, 0.4mol/L NaCl and starvation stress. Under simulated autolysis,showed good anti-autolytic ability by slower autolysis. These results confirms the potential ofoverexpression to tackle yeast autolysis in high-gravity brewing.
, cell wall, β-1,3-glucan, anti-stress, the simulation of autolysis
10.13345/j.cjb.140629
December 20, 2014; Accepted: January 22, 2015
National Natural Science Foundation of China (Nos. 31301539, 31271919).
Qi Li. Tel: +86-0510-86918176; E-mail: liqi@jiangnan.edu.cn
国家自然科学基金(Nos. 31301539, 31271919) 资助。
2015-02-27
http://www.cnki.net/kcms/detail/11.1998.Q.20150227.1114.002.html
