离子液体吸收CO2的研究进展
2015-12-29孙志敏李宝亮
孙志敏,李宝亮
(1.长春师范大学工程学院,吉林长春130032;2.天津钢管集团股份有限公司,天津300301)
1 提出问题
随着人们生活水平的日益提高,工业的发展也日渐强盛起来,环境问题成为人类面临的重大问题之一。近一个世纪以来,全球气温升高了约0.6℃,照这样下去,预计到2030年,全球平均气温会升高1.5~4.5℃[1]。另外,温室效应还会引起海平面的升高,两极海洋的冰块融化,这些都会对人类的生存环境产生巨大的影响。这些变化会严重威胁人类和野生动物的发展与生存。因此,CO2和其它有害气体的排放和捕捉问题成为了人们关注的焦点。近年来CO2的固定方法在工业上产生了一定的影响力,而利用离子液体吸收捕捉CO2已经成为研究者的探索热点。
离子液体,又叫室温离子液体,表层含义就是一般由离子构成的液体。实际上,有一定的温度要求,在常温(室温下)或相近温度下,完全由有机或无机的阴阳离子组成的液体物质,称为离子液体[2]。它是一种新型溶剂,在很多领域都得到广泛的应用。
离子液体作为溶剂在替代有机胺溶液吸收CO2方面具有广阔的应用前景,受到了学术界的广泛关注。使用离子液体吸收CO2是利用离子液作为溶剂或吸收剂来捕捉CO2,可通过调节改变离子液体的阴离子和阳离子,得到“功能化离子液体”,这类离子液体就具有特殊应用目的。例如,可以在离子液体的阴阳离子上引入碱性的官能团,那么该离子液体将具有很强的吸收酸性气体的能力,特别是从工业废气或者过程气中分离出 CO2气体[3]。
因此,设计并合成能够高效吸收CO2并具有高的解吸效率、黏度低、价格便宜的功能化离子液体是研究者面临的研究难点和重点。
2 离子液体吸收CO2
2.1 传统离子液体吸收CO2
传统离子液体吸收CO2主要是通过离子液体和CO2之间的物理作用,将CO2固定于离子液体的网状空隙中,利用离子液体特有的氢键网络结构及阴离子与CO2的特殊作用,此吸收机理属于物理吸收。常规离子液体包括吡啶类、咪唑类、吡咯类、氨基酸类和胍类等[4]。目前研究报道较多的是咪唑类离子液体,而对于吡啶类、吡咯类、氨基酸类和胍类的离子液体研究报道相对较少。压力、离子结构、温度、黏度等是影响常规离子液体吸收CO2性能的主要因素。大量的研究结果表明,在不同温度范围内,随着压力的增大,CO2在离子液体中的溶解度会也会增大[5-6]。当压力趋于平衡时,CO2的摩尔浓度也趋于平衡。Jennifer L等[7]报道离子液体中阴离子对吸收 CO2的影响。研究结果表明,采用相同的阳离子[bmim]+,阴离子分别为[Tf2N]-、[PF6]-、[BF4]-时,三种离子液体对 CO2的固定能力为[bmim][Tf2N]>[bmim][PF6]>[bmim][BF4],当压力增加时,CO2固定量的差别会更加明显,其中[bmim][PF6]和[bmim][BF4]的差别相对较小。[bmim][BF4]在压力为13bar,温度分别为10℃、25℃、50℃时,吸收达到平衡时间为90~180min。在温度为10℃、压力为13bar时,离子液体[bmim][BF4]对CO2的吸收可达0.3mol CO2/mo1 IL。当温度升高到50℃时,该离子液体对CO2的吸收能力小于0.15 mol CO2/molIL。离子液体的阳离子对CO2吸收性能影响较小。Blanchard L A 等[8]测定了温度为313.15K、323.15K 和333.15K 时不同压力下离子液体[C4mim]PF6对 CO2的溶解能力,如图1所示。结果表明,温度一定时,随着压力的增大,CO2在离子液体中的溶解度也随之增大;压力一定时,CO2的溶解度随温度升高而降低。在一定的温度和较高的压力下,传统离子液体具有良好的热稳定性。Raeissi和Peters证明了离子液体[bmim][Tf2N]在温度在40℃到177℃,压力高达140bar下具有热稳定性,即使在温度保持177℃长达10h以上,离子液体依然很稳定,且[bmim][Tf2N]可循环吸收CO2[9]。
Husson-Borg等[10]从热力学的角度证明了温度的影响效果。定量地计算了[bmim][BF4]吸收CO2反应的吉布斯自由能、吸收反应焓变和熵值。结果显示,温度从305K上升到345K时,反应吉布斯自由能、焓变和反应熵值随温度的升高而增加。通常,氟化作用可以增强离子液体吸收CO2的能力,且阴离子氟化的影响更为明显一些。RuthE.BaltuS等[11]利用石英晶体微重天平技术测定了不同离子液体对CO2的吸收性能,结果表明,CO2在压力小于等于1atm、温度为25℃时,且阳离子相同时,阴离子为[Tf2N]-时比[PF6]-时具有更好的CO2吸收性能。但是,由于降低了分子极性,增加氟代烷烃链的长度对于提高CO2吸收能力无显著影响。此外,氟取代基会增加离子液体的黏度,且对环境有一定的污染,因此,增加烷基取代基的长度和采用乙醇胺取代基都可提高离子液体对CO2的吸收性能[12]。
2.2 功能化离子液体吸收CO2
因为传统离子液体吸收CO2有着某些缺陷,因此研究者根据离子液体自身结构可调性和CO2气体具有酸性的特点,设计合成了一些有着特定目标和某种特殊性质的离子液体,即功能化离子液体。此类离子液体中,带有氨基功能化离子液体最多,其中包括咪唑类、乳酸盐类、磺酸盐等离子液体。
2.2.1 氨基咪唑类离子液体
Bates等[13]设计并合成出了带有-NH2官能团的氨基功能化离子液体,1-(3-丙胺基)-3-丁基咪唑四氟硼酸盐([apbin]BF4)。探索发现,在常温常压条件下,这类离子液体捕捉CO2的质量分数能够达到很高值,吸收时间越长,吸收所得结果会更明显。而没有-NH2官能团离子液体,如,在常温条件下,[C6min]PF6对CO2的吸收率几乎接近于零。FT-IR和13CNMR光谱探索发现CO2在[apbim]BF4的吸收效果是可逆的。CO2先和-NH2发生反应生成氨基甲酸酯铵盐,在一定温度下,可使CO2作为工业生产中的碳源解吸出来,而离子液体能够回收再利用。该研究证明了,氨基功能化离子液体很有可能取代醇胺类有机溶剂,应用于工业当中来固定分离 CO2,富集并转化为碳源。Yu等[14]应用量子化学和分子动力学理论,研究分析了[apbin]BF4捕捉CO2的实验现象。并研究了[apbin]BF4的氢键结构,得出CO2和[apbin]BF4能级差为6.07 eV,认为CO2在[apbin]BF4中发生的化学吸收是由较低的能级差造成的。
2.2.2 氨基酸离子液体
由于离子液体具有很低的蒸气压、良好的热稳定性、可再生利用等一些性质,所以,在吸收CO2上体现出多方面优越性。以天然的氨基酸为原料合成的氨基酸离子液体对CO2等酸性气体具有良好的吸收作用[15],还具有初始原料无毒性、生产成本低、生物可降解等特性,因此深受研究者们的关注[16]。张锁江课题组[17]根据Ohno等人的研究,研究出了四烷基季氨基酸离子液体,研究结果发现,该离子液体的黏度低于传统离子液体,且吸收原理与MEA溶液捕捉CO2的化学反应相似。该课题组还研究出了功能相似的四丁基膦氨基酸[P(C4)4]AA和双氨基功能化离子液体[aP4443][AA],研究结果表明,四丁基膦氨基酸离子液体吸收CO2能够达到8.6wt%,双氨基功能化离子液体捕捉CO2的效率高达16wt%。且它们对CO2的捕捉效率均大于功能化离子液体[NH2p-bim][BF4](7.4wt%)。由于氨基酸离子液体易吸水,F.Zhang等[18]研究发现四甲基铵甘氨酸离子液体[N1111][Gly]具有良好的对CO2的吸收能力,当该溶液的质量分数从100%降至30%的时候,CO2吸收饱和负荷从0.169 mol CO2/mol IL提高至0.601mol CO2/mol IL。稽艳[19]对比三种氨基酸离子液体对CO2的吸收性能,研究结果表明,氨基酸离子液体大于氨基酸盐对CO2的吸收速率和吸收容量,且对于再生时间,氨基酸离子液体远低于氨基酸盐溶液。但是,氨基酸离子液体的成本和黏度都比胺溶液要高,因此,这也成为限制其应用于工业的主要原因[20]。如果将氨基酸离子液体与胺溶液混合后用于吸收CO2,能够提高胺溶液的物理性质,还具有对CO2有着较大的吸收量,因此,这种脱碳工艺也将是成为国内外研究的重点[21]。
2.2.3 胍类离子液体
以Zhang等[22]研究的胍类离子液体1,1,3,3-四甲基胍乳酸盐(TMGL)为例,其反应方程式如下:
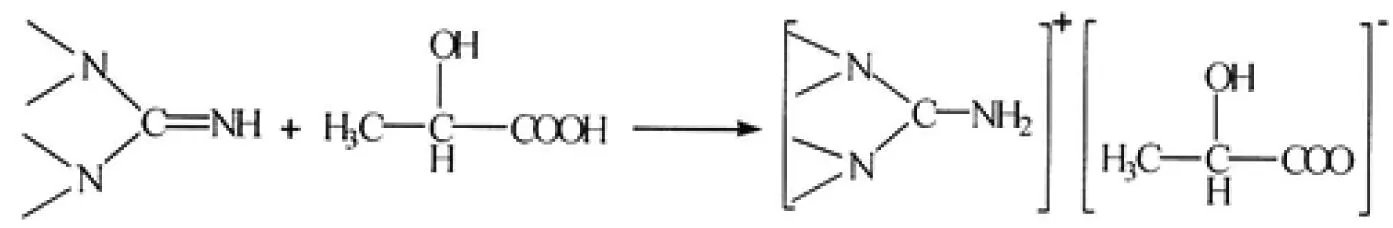
研究表明,胍类离子液体对CO2的溶解度要大于常规离子液体2~5倍。在常温常压条件下,CO2在胍类离子液体中平衡溶解度约为0.6%(w/w),带有-NH2官能团的咪唑类离子液体中具有很高的溶解能力,其平衡溶解度约为7.0%(w/w)。Yu等[14]运用量子化学知识,解析了CO2在带有-NH2官能团的两种不相同的离子液体溶解度差别很大的原因。经研究表明,-NH2的HOMO和CO2的LUMO之间的轨道作用制约着带有-NH2的离子液体捕集CO2的能力。同时研究还发现了,与-NH2相连的供电性亚甲基和强吸的电性碳正离子是使产生两种离子液体中-NH2上HOMO的轨道能大不同的关键因素,这是两种离子液体捕捉CO2性能差异的重要原因。上述研究说明了官能团、分子内的氢键和阴阳离子的配位能够很大方面的影响着离子液体对CO2的吸收,同时为探索功能化离子液体起到良好的铺垫作用。
2.2.4 其他功能化离子液体
大体而言,胺基功能化离子液体是由阴阳离子上的胺基官能团和CO2发生一系列的反应来捕捉CO2的。郭燕[23]研究了一种新型的无胺基的阴离子功能化离子液体。此类离子液体是利用强碱和弱酸的中和反应所制取的。该离子液体中,强碱作为一类较强的质子受体,在不用添加任何试剂情况下,就能够使弱酸去质子化。因此,在热力学上,利用强碱与弱酸制取这种可吸收CO2的质子型离子液体的方法是可行的。在这个体系中,离子液体是可以达到摩尔吸收CO2的,且CO2的质量吸收容量能够在17%以上。它们的吸收容量很大方面上是受阴离子的驱动影响。而且,CO2的解吸也能够在较低的温度下进行,这类离子液体在捕捉、分离CO2的循环过程中,吸收能力仅仅会受到相当小的影响,重复利用的性能好。
2.3 离子液体混合溶液吸收CO2
为了克服离子液体价格高、黏度大的缺点,人们尝试将离子液体与有机胺或其它有机物混合构成混合型吸收剂,但目前成功的混合溶液体系相对较少,并不是所有胺都溶于离子液体。方诚刚等[24]成功研究出了氨基酸离子液体四甲基铵甘氨酸-N-甲基二乙醇胺体系,该体系对CO2具有较高的吸收率,在恒体积的条件下,增加CO2的分压和提高体系中离子液体的浓度都能够增加混合体系对CO2的吸收量。王梅等[25]研究了咪唑类离子液体[bmim][BF4]和[bmim][Tf2N]与胺基功能化离子液体[NH2e-mim][BF4]进行混合,并研究了混合体系对CO2的吸收和解吸性能。结果表明,咪唑类离子液体混合后黏度降低,传质效果得到改善。而咪唑离子液体与胺基功能化离子液体混合后比单一离子液体对CO2的吸收量大,离子液体混合溶液在一定条件下解吸后可循环吸收CO2,且吸收率较高,多次吸收—解吸后混合吸收剂的质量不发生改变。
2.4 离子液体膜吸收CO2
离子液体膜吸收CO2,主要采用的是支撑液膜,将离子液体负载在惰性多孔膜上,由于离子液体液膜含浸在聚合物支撑体上,能够承受一定的压力,对CO2具有更高的扩散速度和渗透性。其中,离子液体聚合物液膜对CO2的吸收规律与溶液中的吸收规律具有一定的相似性,升高温度,吸收量降低,增大压力,吸收量增加[26]。聚合物离子液体膜吸收CO2具有一定的优越性,可连续操作,设备成本低,吸收达到平衡时间短,在几分钟内即可达到平衡吸收量的95%,真空解吸速度快,仅需15min即可在真空下解吸。但膜的稳定性、渗透性、选择性和寿命是影响离子液体膜吸收CO2的主要因素,因此,只有优化膜的性质才能满足工业大规模生产的需求,这也是今后研究的重点和难点。
3 结语
近年来,离子液体作为良好的“清洁”溶剂和新型的催化剂,逐渐地运用到工业生产等方面。虽然其发展与研究的时间并不长,但与以往的CO2吸收剂相比,体现出了更多、更大的优势,同时也被人们所认可,有可能代替以往的有机溶剂来捕捉CO2而应用到更多的领域当中。但是,当前我们所研究的离子液体还不够透彻,还有许多要改进与发展的地方。例如,目前所设计合成的离子液体黏度较大,使得流动性较差,降低了CO2的传质过程,限制了其工业化;根据离子液体具有可设计的特性,在其结构中引入具有特定性质的官能团,在适当的条件下,实现离子液体对CO2的吸收并转化成其它对大气没有污染的物质,减少生产消耗,离子液体的重复利用是研究的重点;基于CO2能够高效地溶于离子液体中,而离子液体却难溶于CO2的重要特性,加强离子液体和CO2两者不同体系的研究,开发离子液体捕捉CO2和催化同时进行的反应体系,建立高效环保节能的应用体系,达到吸收CO2的同时将其转化为其它可用资源,将其工业化并应用于相关行业中。
总而言之,随着人类科技的不断进步,对离子液体不断深入的研究与探索,这种对环境无污染的新型溶剂将会应用于更多的化工生产,有效解决尾气中含有大量污染气体的问题。同时由于离子液体基础研究和工业研究的不断深入,离子液体在固定CO2的同时并将其转化为其它可用资源也是指日可待的。
[1]张晓春.用于吸收CO2的功能化离子液体的分子设计研究[D].北京:北京化工大学,2009.
[2]Zhang S J,Chen Y H,Li F W,et al.Fixation and Conversion of CO2Using Ionic Liquids[J].Catal.Today,2006(115):61 -69.
[3]赵旭,邢华斌.离子液体在气体分离中的应用离子液体的制备性质及应用[J].化学进展,2011,23(11):2258-2268.
[4]魏文英.离子液体作为CO2吸附剂的研究进展[J].化学工程师,2010,174(3):41-44.
[5]Johan Jacquemin,Paseale Husson,Vladimir Majer,Margarida F,Costa Gomes.Influence of the Cation on the Solubility of CO2and H2in Ionic Liquids Based on the Bis(trifiuoromethylsulfonyl)imide Anion[J].Solution Chem,2007(36):967-979.
[6]M.F.Costa Gomes.Low -Pressure Solubility and Thermodynamies of Solvation of Carbon Dioxide,Ethane and Hydrogeninl-Hexyl-3-methylimidazolium Bis(trifluoromethylsulfonyl)amid between Temperatures of 283K and 343K[J].J.Chem.Eng.Data,2007(52):472 -475.
[7]Jennifer L.Anthony,Jessiaca L.Anderson,Edward J.Maiginn,Joan F.Brenifer L.Anion Effects on Gas Solubility in Ionic Liquids[J].Phys.Chem.B,2005(109):9366 -6374.
[8]Blanchard L A,Brennecke J F.Recovery of Organic Products from Ionic Liquids Using Supercritical Carbon Dioxide[J].Ind.Eng.Chem.Res.,2001(40):287 -292.
[9]S.Raeissi,C.J.Peters,Carbon dioxide solubility in the homologous 1-alkyl-3-methylimidazolium bis(trifluoromethylsulfo -nyl)imide family[J].Chem.Eng.Data,2009(54):382 -386.
[10]Husson -Borg P,Maier V,Costa Gomes M F.Solubilities of oxygen and carbon dioxide in buty 1 methylimidazolium tetraflu-oroborate as function of temperature and at pressures close to atmospheric pressure[J].Chem Eng Data,2003,48(3):480-485.
[11]Ruth E.Baltus.Benjamin H.Culbertson,Sheng Dai,Huimin Luo,David W.DePaoli.Low-Pressure Solubility of Carbon Dioxidein Room-Temperature Ionic Liquid Meas-ured with a Quartz Crystal Mierobalanee[J].Phys.Chem.B,2004(108):721-772.
[12]Mark J,Muldoon,Sudhirn.V.K.Aki,Jessiea L.Anderson,JaNeille K.Dixon,Joan F.Brenneckempro Ving Carbon Dioxide Solubilityin Ionic Liquids[J].Phys.Chem.B,2007(111):9001 -9009.
[13]Bates E D,M aytnn R D,N tai J et al.CO2capture by a task-pecific ionic liquid[J].Am Chen Soc.,2002(124):926-927.
[14]Yu G R,Zhang S,J Yao X Q,et al Design of task-pecific ionic iquids for capturing CO2:Amolecular on bital study[J].Ind Eng Chen Res,2006(45):2875 -2880.
[15]张建敏,张锁江.氨基酸类离了液体用于酸性气体吸收:中国[P].CN1709553,2005.12.21.
[16]吴阳,张甜甜,宋溪明.氨基酸离液体研究进展[J].渤海大学学报,2008,29(1):1-8.
[17]Y.Y Jiang,G N.Wang,Z.Zhou,et al.Tetraalkylammonium amino acids as functionalized ionic liquids of low viscosity[C].Chem.Commun,2008:505 -507.
[18]F.Zhang,C.G.Fang,Y.T.Wu,et al.Absorption of CO2in the aqueous solutions of functionalized ionic liquids and MDEA.Chem.Eng.,2010(160):691 -697.
[19]嵇艳.膜基CO2捕集剂及其性能研究[D].南京:南京信息工程大学,2001.
[20]K.Fukumoto,H.Ohno.Design and synthesis of drophobic and chiral anions from amino acids as precursor for functional ionic liquids.Chem.Commun,2006(29):3081 -3083.
[21]王冠楠,肖峰,吕学铭,等.离了液体吸收 CO2的研究进展[J].化工时刊,2010,24(3):61 -69.
[22]Zhang S Yuan X I,Chen Y H,et al Sulubilities of CO2in 1-buty -3-methy limidazo lium hexafluo rophosphate and 1,1,3,3-tetramethy lguan idium laclate at elevated pressures[J].Chen Eng Data,2005,50(5):1582 -1586.
[23]郭燕.功能化离子液体捕集CO2的研究[D].杭州:浙江大学,2013.
[24]方诚刚,张锋,马文静,等.氨基酸离子液体-MDEA混合水溶液对CO2的降膜吸收[J].化工学报,2011,62(3):723-729.
[25]王梅,张立麒.咪唑类离子液体混合物吸收CO2性能研究[J].燃料化学学报,2012,40(10):1264-1268.
[26]Shoji Hanioka.tatsuo Maruyama ,Tomothiro Sotani.CO2separation factilitated by task-specific ionic liquids using a supported liquid membrane[J].Member Sci,2008(314):1-4.
