TACE联合贝伐珠单抗治疗不可切除结直肠癌肝转移的临床研究
2015-12-28徐国辉,徐宗全,周峥等
TACE联合贝伐珠单抗治疗不可切除结直肠癌肝转移的临床研究
徐国辉徐宗全周峥周存才曾志平何均解长佶李林
作者单位:330029 江西省肿瘤医院
【摘要】目的评价经导管动脉内化疗栓塞(TACE)联合贝伐单抗治疗不可切除结直肠肝转移癌的临床疗效。方法将120例不可切除结直肠肝转移癌的患者随机分为TACE治疗组(40例)、贝伐单抗治疗组(40例)、TACE联合贝伐单抗治疗组(40例),观察这三组患者肿瘤大小、免疫功能、血清肿瘤标志物及患者生存情况等指标。结果TACE联合贝伐单抗治疗后,T淋巴细胞CD4+、CD8+细胞数CD4+、CD8+较治疗前显著升高(P<0.05),CD4+/CD8+的差异均无统计学意义;联合治疗中CEA、CA 199水平显著下降(P<0.05),肿瘤生长明显受抑制,坏死范围较另两组大;且TACE联合贝伐单抗组患者3年生存率显著高于TACE组、贝伐单抗组(P<0.05),TACE组与贝伐单抗组3年生存率比较差异无统计学意义。40例TACE联合贝伐单抗患者完全缓解0例、部分缓解16例、稳定20例、肿瘤进展4例,中位生存期为27.3个月,比二者单独治疗时控制肿瘤发展效果更佳。结论TACE联合贝伐单抗治疗不能手术切除的结直肠癌肝转移时,相比较于TACE或贝伐单抗单独治疗更能有效抑制肝转移瘤的生长,延长患者生存时间,具有一定的临床应用价值。
【关键词】化学栓塞;结直肠肿瘤;肝转移
基金项目:江西省卫生厅课题(编号:20141129)
通讯作者:李林
DOI:10.3969/j.issn.1001-5930.2015.10.020
中图分类号:R735.3+7
收稿日期(2015-06-15修回日期 2015-08-10)
Clinical Study of TACE Combined with Bevacizumab Chemotherapy in the Treatment of Unresectable Colorectal Carcinoma with Hepatic Metastases
XUGuohui,XUZongquan,ZHOUZeng,etal.JiangxiCancerHospital,Nanchang,330029
Abstract【】ObjectiveTo evaluate the clinical efficacy of transcatheter arterial chemoembolization (TACE)combined with bevacizumab in the treatment of unresectable colorectal carcinoma with hepatic metastases.Methods120 cases of unresectable colorectal carcinoma with hepatic metastases were randomly divided into TACE group (n=40),bevacizumab group (n=40),TACE and bevacizumab combination group (n=40).Tumor size,immune function,serum tumor markers and survival functions after treatment were observed in the 3 groups.ResultsIn the combination group,after the treatment with TACE and bevacizumab,CD4+ and CD8+ increased significantly (P<0.05),but CD4+/CD8+ had no significant difference.In the combined treatment group,CEA、CA 199 decreased significantly (P<0.05),the growth of tumor size were significantly suppressed,and necrosis area appeared larger than the other 2 groups.Moreover,the 3-year survival rate of the combination group was significantly higher than TACE group and bevacizumab group (P<0.05).There was 0 case of complete remission,16 cases of partial remission,20 cases of stability and 4 cases of tumor progression in 40 patients who undergone combined treatment.The median survival time was 27.3 months.The combination treatment could control the progress of tumor growth.ConclusionFor unresectable colorectal carcinoma with hepatic metastases,TACE combined with bevacizumab is more effective than conventional TACE or bevacizumad only,it should be recommended in clinical practice.
【Key words】Chemoembolization;Colorectal carcinoma;Hepatic metastases
(ThePracticalJournalofCancer,2015,30:1493~1496)
结直肠癌位居我国肿瘤死因第三位,50%~60%的病人会发生远处转移,肝脏为发生远处转移的最常见器官,15%~25%的结直肠癌患者在确诊时即伴有同时性肝转移,其中80%~90%患者肝转移灶为不可切除;而肝转移灶为初始可切除患者,仍有20%术后会发生肝转移[1-4]。手术是治疗结直肠癌肝转移的最佳手段,然而,临床上可进行肝转移灶切除的患者仅占10%~20%[5]。对于无法切除的肝癌病灶,经肝动脉化疗栓塞术(TACE)被公认为是有效的治疗方法之一,但常规的TACE术仅有20%~30%的肝转移癌组织达到完全坏死,除了门静脉参与供血导致其效果欠理想外,术后残余病灶边缘或残余病灶内肿瘤新生血管形成,也影响了栓塞的远期疗效。贝伐单抗是1种重组人源化、人鼠嵌合的抗VEGF的特异性单克隆抗体,是血管内皮生长因子(VEGF)受体抑制剂类药物,可抑制VEGF水平及组织中蛋白水解酶的生物活性,发挥多靶点抗血管形成作用。贝伐单抗与内源性VEGF竞争性结合VEGF受体,进一步减少新生血管的形成,发挥抗肿瘤的作用[6]。恶性肿瘤的发生、发展、转移与人体免疫功能下降密切相关,通过CD4和CD8 T细胞检测,可掌握患者疾病治疗过程中免疫动态变化,判断患者预后。因此,我们假设TACE与贝伐单抗联合应用时,后者可帮助化疗药物有效地进入肝脏肿瘤细胞,加强化疗药物杀伤肿瘤细胞的作用,缩小结直肠癌肝转移局部癌变范围。本研究拟联合应用TACE、贝伐单抗治疗结直肠癌肝转移,探索临床治疗结直肠癌肝转移新的方案。
1资料与方法
1.1资料收集
收集本院结直肠癌肝转移的患者120例,纳入标准如下:①所有患者均接受结直肠癌根治术治疗,经病理证实为结直肠癌;②术后复查时经影像学检查诊断为转移性肝癌;③肝功能Child-Pugh分级为A级或B级;④转移性肝癌未发生破裂及出血;⑤患者全身情况可,可耐受常规化疗及介入治疗。其中男性64例,女性56例;年龄36~74岁,平均58岁;结肠癌77例,直肠癌43例,均经手术后病理检查证实;肝转移癌单发42例,多发者78例,转移灶局限于半肝者47例。120例患者均按照WHO实体瘤疗效标准进行评价。所有患者身体功能状态(karnofsky's performance status,KPS)评分在70分以上,生存预期1年以上。
1.2TACE 联合贝伐单抗治疗方法
应用Seldinge技术,经皮股动脉穿刺导管,用4F或5F导管。根据原发肿瘤部位选择相应导管插入动脉,如原发肿瘤在右半结肠、升结肠盲肠、横结直肠癌时,导管插入动脉选择肠系膜上动脉,如原发肿瘤在左半结肠降结肠、乙状结直肠癌时,导管插入动脉选择肠系膜下动脉。在导管插入后,先行化疗药物灌注,化疗药物为氟尿嘧啶0.5 g、亚叶酸钙0.1 g、奥沙利铂50 mg;然后将导管退出,尽可能超选至肝癌供血动脉再进行化疗栓塞术,化疗药物为氟尿嘧啶0.5 g、亚叶酸钙0.1 g、奥沙利铂100 mg、阿霉素40 mg,栓塞剂为超液化碘油5~15 ml以及2 mm明胶海绵颗粒。根据患者肝功能损伤程度以及不良反应严重性,间隔时间4~6周,治疗2~3次。贝伐单抗组:剂量为5 mg/kg,每2周1次,连续使用24周;TACE联合贝伐单抗组:同时接受TACE与贝伐单抗治疗,方法与前述一致。
1.3检测方法及主要试剂
应用BDAccuri C6流式细胞仪进行外周血T淋巴细胞亚群[白细胞分化抗原(cluster of differentiation,CD)4+T细胞、CD8+T细胞、CD4+T细胞/CD8+T细胞]分析检测,严格按照试剂盒说明操作,小鼠抗人CD4、CD8单克隆抗体试剂盒均由博士德生物有限公司提供。采集空腹静脉血4 ml,采用Roche Elecsy2010全自动电化学发光仪和Roche公司提供的CEA、CA199配套试剂盒,严格按操作步骤检测。正常参考范围:CEA<5.3 μg/L,CA199<37 IU/L,联合检测时其中1项或者2项阳性为阳性,2项同为阴性为阴性。所有患者均行增强CT/MRI检查确定肿瘤体积变化、肿瘤坏死范围。
1.4疗效评价标准
介入治疗后进行疗效评估。按照WHO抗肿瘤药物客观疗效标准评价疗效,完全缓解:所有可见病灶消失至少维持4周以上;部分缓解:各病灶最大两条垂直径线之乘积的总和减少50%以上,维持4周以上,无病灶进展,无新病灶出现;稳定:肿瘤体积缩小<50%或增大<25%,无新病灶出现;进展:肿瘤体积增大≥25%或出现新病灶。且在治疗结束后对患者进行随访,观察所有研究对象的生存期,随访期根据研究过程中实际情况确定。
1.5统计学处理
应用SPSS 19.0统计软件,计量资料采用均数±标准差(±s)表示,计数资料采用百分率表示。多个样本均数间的比较采用方差分析、q检验(正态分布资料且方差相齐时使用)或完全随机设计多个样本比较的Krusskal-Wallis H检验、Nemenyi法检验(正态分布资料但方差不齐时使用,或偏态分布资料时使用),采用Kaplan-Meier法计算预期生存率并绘制生存曲线,生存分析采用Log rank检验,P<0.05为差异有统计学意义。
2结果
2.1组间临床资料的相关性比较
3组患者性别、年龄、术后复发时间、病灶大小、病灶数目、肝功能Child-Pugh评分等一般资料相比差异无统计学意义,见表1。
表1 三组间临床资料的相关性比较( ± s)
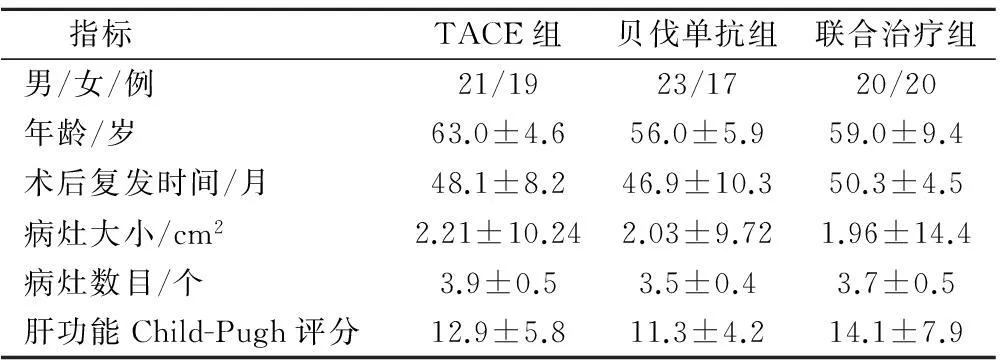
表1 三组间临床资料的相关性比较( ± s)
指标 TACE组贝伐单抗组联合治疗组男/女/例21/1923/1720/20年龄/岁63.0±4.656.0±5.959.0±9.4术后复发时间/月48.1±8.246.9±10.350.3±4.5病灶大小/cm22.21±10.242.03±9.721.96±14.4病灶数目/个3.9±0.53.5±0.43.7±0.5肝功能Child-Pugh评分12.9±5.811.3±4.214.1±7.9
2.2治疗前后外周血T淋巴细胞亚群水平的比较
治疗前,TACE组、贝伐单抗组、联合治疗组组间外周血CD4+、CD8+细胞数、CD4+/CD8+比值相比差异无统计学意义。治疗后,TACE组患者外周血CD4+、CD8+细胞数、CD4+/CD8+比值较治疗前有所升高,但CD4+ 细胞数差异有统计学意义(P<0.05);贝伐单抗治疗组各项指标同样有所升高,其差异无统计学意义;而当TACE和贝伐单抗联合治疗时,与治疗前相比CD4+、CD8+表达增高,二者差异并有统计学差异意义(P<0.05),见表2。
表2 治疗前后外周血T淋巴细胞亚群的比较( ± s,个)

表2 治疗前后外周血T淋巴细胞亚群的比较( ± s,个)
项目 CD4+CD8+CD4+/CD8+治疗前 TACE组35.3±4.232.3±6.51.2±0.7 贝伐单抗组34.3±6.532.7±6.21.3±0.3 联合治疗组36.7±7.431.8±3.21.3±0.8治疗后 TACE组44.7±5.9*33.9±5.71.3±0.4 贝伐单抗组34.8±9.134.5±2.71.3±1.0 联合治疗组46.2±4.4*39.2±6.3*1.4±0.6
注:*为与各组治疗前比较,P<0.05。
2.3血清中CEA和CA19-9水平比较
治疗前,TACE组、贝伐单抗组、联合治疗组组间CEA、CA19-9水平相比差异无统计学意义。治疗后TACE联合贝伐单抗治疗组CEA、CA19-9值比TACE和(或)贝伐单抗单独治疗组明显降低,均有统计学差异(P<0.05);且TACE治疗组CEA含量下降,具有显著差异(P<0.05),CA19-9水平虽有降低但总体偏差较大,无明显显著性,同时贝伐单抗组治疗前后无显著差异,见表3。CEA 和CA19-9指标对结直肠癌肝转移诊断敏感性及有效性见表4。
2.4结直肠癌肝转移肿瘤局部变化
三组1周后均有肝转移肿瘤灶变大现象,最大径增大0.4~1.3 cm,表现为肝脏区圆形或椭圆形肿块,边界清晰无钙化,个别表现有边缘薄层环状强化,周边多出现多区域低回声带,2周后低回声带逐渐缩减,3周后肿瘤灶缩小,大部分肿块边界比变模糊,回声增强,分布不均匀。然而,3周后贝伐单抗组的肿瘤灶大小只有12.5%(5/40)的变化不大,其对肝转移肿瘤的治疗作用没有明显的统计学意义。联合治疗组与TACE治疗组3周时肿瘤灶缩小率无显著差异,二者较贝伐单抗组具有统计学意义(P<0.05),显示TACE联合贝伐单抗治疗能更优化贝伐单抗组对不可切除的结直肠肝转移癌的治疗作用,见表5。
表3 治疗前后各组血清CEA 和CA 19-9含量( ± s)
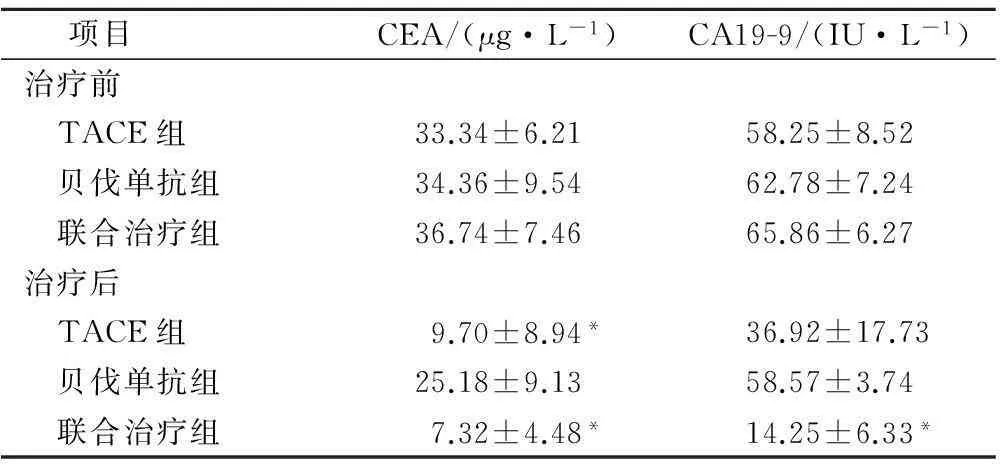
表3 治疗前后各组血清CEA 和CA 19-9含量( ± s)
项目 CEA/(μg·L-1)CA19-9/(IU·L-1)治疗前 TACE组33.34±6.2158.25±8.52 贝伐单抗组34.36±9.5462.78±7.24 联合治疗组36.74±7.4665.86±6.27治疗后 TACE组9.70±8.94*36.92±17.73 贝伐单抗组25.18±9.1358.57±3.74 联合治疗组7.32±4.48*14.25±6.33*
注:*为与各组治疗前比较,P<0.05。
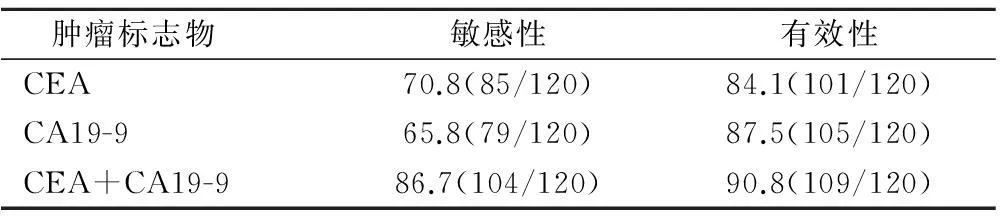
表4 治疗前CEA 和CA19-9检测对结直肠癌肝转移诊断
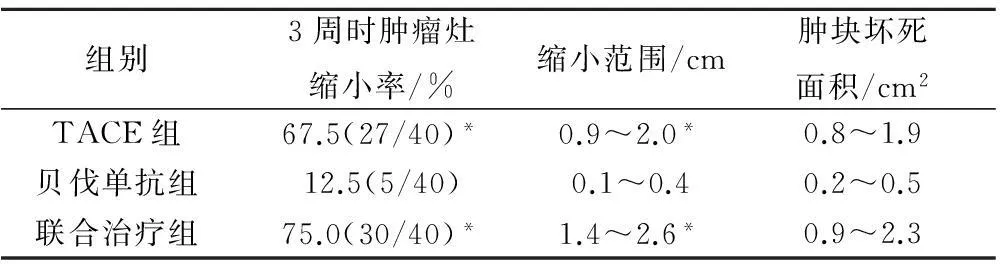
表5 三组治疗后结直肠癌肝转移肿瘤局部变化
注:*为与各组治疗前比较,P<0.05。
2.5近期疗效
联合治疗组近期疗效显著优于TACE组与贝伐单抗组,差异有统计学意义(P<0.05),见表6。
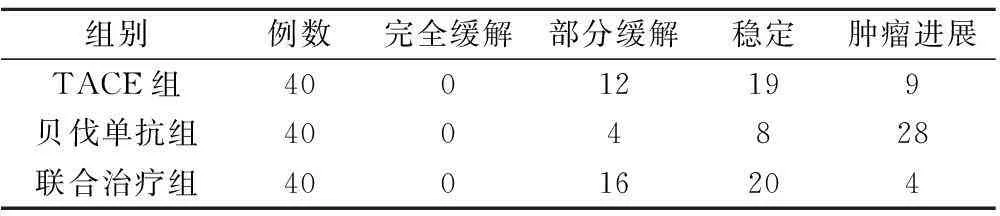
表6 三组近期疗效比较/例
2.6结直肠癌肝转移患者生存期
TACE组、贝伐单抗组及联合治疗组共120例结直肠癌术后肝转移患者,给予相应的治疗方案后随访3年。TACE联合贝伐单抗组患者3年生存率显著高于TACE组、贝伐单抗组(P<0.05),而TACE组较贝伐单抗组3年生存率提高,但其差异无统计学意义。TACE组、贝伐单抗组及联合治疗组的中位总生存期分别为20.7个月、15.3个月和27.3个月,见图1。
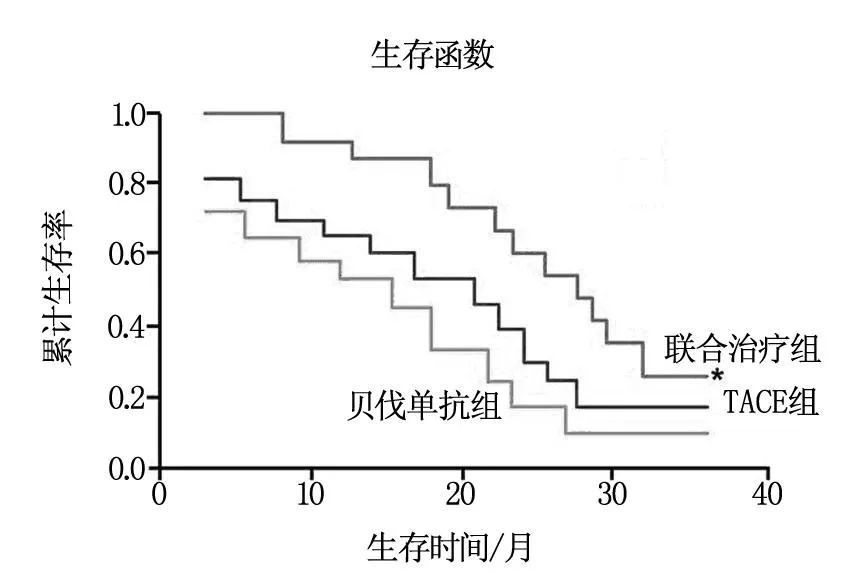
图1 各组患者3年生存期
3讨论
并发肝转移在结直肠癌患者中相当常见,是结直肠癌治疗失败的主要原因,经腹骶直肠切除术可能是唯一治疗局部晚期直肠癌患者的方法。然而,关于不可切除结直肠癌肝转移病人原发灶的处理问题,目前多存在争议。一些研究表明,初始切除结直肠癌原发灶可使病人在总体存活率以及无进展存活率方面获益,同时行二次治愈性手术也同样可使总生存期获益[7-8]。但是,也有研究认为初始手术切除会增加病人死亡的风险[9]。因此,目前针对于结直肠癌并发的肝转移仍旧缺乏前瞻性、高质量的统一的临床治疗方法。
本研究选择40例结直肠癌肝转移患者进行TACE联合贝伐单抗治疗,无肝转移灶完全消失病例,但有16例肝转移灶明显缩小,达到部分缓解,0.5年生存率100%,1年生存率为93.3%,该组病例中位生存期为27.3个月,相比TACE和贝伐单抗单独治疗取得了良好的近期疗效。TACE联合贝伐单抗治疗后,T淋巴细胞CD4+、CD8+细胞数及CD4+/CD8+均比治疗前有所升高,其中CD4+、CD8+与治疗前差异有统计学意义,表明TACE联合贝伐单抗治疗后,活化T细胞明显增多,细胞免疫功能增强,表明抗肿瘤治疗有利于提高患者的细胞免疫功能,增强机体的抗癌能力和自身免疫机能。同时,TACE联合贝伐单抗治疗后,患者中位生存期较其他研究治疗多3~8个月,显示出了良好的耐受性和对不能手术切除的结直肠癌肝转移患者的有效性,使部分化疗前评估为不能手术切除的患者获得了有效治疗的机会。
McCahill等[10]针对不可切除结直肠癌肝转移病人是否应初始切除原发灶问题进行了一项多中心的Ⅱ期临床对照试验。结果显示,未切除原发肿瘤的病人采取mFOLFOX6联合贝伐单抗治疗,其中位生存时间可达19.9个月。Bertolini等[11]应用贝伐单抗联合FOLFOX6方案治疗21例接受姑息手术治疗的结直肠癌肝转移患者,其中3例完全缓解,9例部分缓解,中位总生存期为22.5个月。同时,Nagasaki等[12]观察经腹骶直肠切除术后采取mFOLFOX6联合贝伐单抗治疗的患者发现,无残留癌细胞,证明治疗方法安全可行。贝伐单抗一方面能帮助化疗药物有效地进入肝脏肿瘤细胞,加强化疗药物杀伤肿瘤细胞的作用,缩小结直肠癌肝转移局部癌变范围;另一方面,贝伐单抗能抑制肝脏肿瘤中血管的形成,对于抑制肿瘤的生长具有显著地作用。这些研究显示贝伐单抗对直肠癌切除后能有效增加治疗作用,对临床治疗不可切除的结直肠癌肝转移治疗具有重要的临床参考意义。
本研究人群组的中位生存时间及长期生存的数据在进一步随访观察中,初步结果显示TACE联合贝伐单抗治疗优化了结直肠癌肝转移患者的化疗方案,提高了客观缓解率和疾病控制率,今后还需要进一步为仅有不可手术切除的肝转移患者设计前瞻性的临床试验来验证这一结论。此外,该方案联合分子靶向药物是否会更进一步提高客观缓解率,这也是临床上需要研究的课题。
参考文献
[1]Yoo PS,Lopez-Soler RI,Longo WE,et al.Liver resection for metastatic colorectal cancer in the age of neoadjuvant chemotherapy and bevacizumab〔J〕.Clin Colorectal Cancer,2006,6(3):202-207.
[2]Van Cutsem E,Nordlinger B,Adam R,et al.Towards a pan-European consensus on the treatment of patients with colorectal liver metastases〔J〕.Eur J Cancer,2006,42(14):2212-2221.
[3]Adam R,Wicherts DA,de Haas RJ,et al.Patients with initially unresectable colorectal liver metastases:is there a possibility of cure〔J〕.J Clin Oncol,2009,27(11):1829-1835.
[4]Folprecht G,Gruenberger T,Bechstein W,et al.Survival of patients with initially unresectable colorectal liver metastases treated with FOLFOX/cetuximab or FOLFIRI/cetuximab in a multidisciplinary concept (CELIM study)〔J〕.Ann Oncol,2014,25(5):1018-1025.
[5]Sugihara K,Uetake H.Therapeutic strategies for hepatic metastasis of colorectal cancer:overview〔J〕.J Hepatobiliary Pancreat Sci,2012,19(5):523-527.
[6]Brown DB.Hepatic artery dissection in a patient on bevacizumab resulting in pseudoaneurysm formation〔J〕.Semin Intervent Radiol,2011,28(2):142-146.
[7]Karoui M,Roudot-Thoraval F,Mesli F,et al.Primary colectomy in patients with stage IV colon cancer and unresectable distant metastases improves overall survival:results of a multicentric study〔J〕.Dis Colon Rectum,2011,54(8):930-938.
[8]Venderbosch S,de Wilt JH,Teerenstra S,et al.Prognostic value of resection of primary tumor in patients with stage IV colorectal cancer:retrospective analysis of two randomized studies and a review of the literature〔J〕.Ann Surg Oncol,2011,18(12):3252-3260.
[9]Boselli C,Renzi C,Gemini A,et al.Surgery in asymptomatic patients with colorectal cancer and unresectable liver metastases:the authors' experience〔J〕.Onco Targets Ther,2013,6:267-272.
[10]McCahill LE,Yothers G,Sharif S,et al.Primary mFOLFOX6 plus bevacizumab without resection of the primary tumor for patients presenting with surgically unresectable metastatic colon cancer and an intact asymptomatic colon cancer:definitive analysis of NSABP trial C-10〔J〕.J Clin Oncol,2012,30(26):3223-3228.
[11]Bertolini F,Malavasi N,Scarabelli L,et al.FOLFOX6 and bevacizumab in non-optimally resectable liver metastases from colorectal cancer〔J〕.Br J Cancer,2011,104(7):1079-1084.
[12]Nagasaki T,Akiyoshi T,Ueno M,et al.Laparoscopic abdominosacral resection for locally advanced primary rectal cancer after treatment with mFOLFOX6 plus bevacizumab,followed by preoperative chemoradiotherapy〔J〕.Asian J Endosc Surg,2014,7(1):52-55.
(编辑:吴小红)
