聚腺苷二磷酸核糖聚合酶(PARP)抑制剂AG014699提高BRCA2缺陷的胰腺癌细胞放射敏感性的体外实验研究
2015-12-28谢建国,钟睿,万爱萍等
聚腺苷二磷酸核糖聚合酶(PARP)抑制剂AG014699 提高BRCA2缺陷的胰腺癌细胞放射敏感性的体外实验研究
谢建国钟睿万爱萍汪华康恭礼何志坚钟晓鸣
作者单位:330029 江西省肿瘤医院
【摘要】目的探讨AG014699提高含BRCA2基因缺陷的胰腺癌细胞放射敏感性的作用机制。方法选择Capan-1和Panc-1 2种胰腺癌细胞株,分成单纯药物组、单纯放疗组、药物联合放疗组,MTT法检测药物IC50,通过细胞克隆形成率分析细胞存活状态,应用免疫荧光法观察H2Ax的形成。结果单药AG014699(≤10 μM)对Capan-1细胞有毒性作用,对Panc-1无效应;放疗联合药物组对Capan-1细胞克隆形成率影响最明显,与单药和单放疗组比较(P<0.05),而该差异在Panc-1细胞中不明显(P>0.05);DNA损伤表现为H2Ax形式,提示DNA双链断裂是细胞死亡的主要模式。结论AG014699 对含有BRCA2基因缺陷的胰腺癌细胞Capan-1有放疗增敏作用。
【关键词】胰腺肿瘤;放射增敏;PARP抑制剂;DNA修复
DOI:10.3969/j.issn.1001-5930.2015.10.005
中图分类号:R73-36
收稿日期(2015-02-23修回日期 2015-06-17)
Poly(ADP-ribose)Polymerase Inhibitor AG014699 Increase Sensitivity to Radiation in Pancreatic Cancer Cells with BRCA2 Mutation
XIEJianguo,ZHONGRui,WANAiping,etal.JiangxiCancerHospital,Nanchang,330029
Abstract【】ObjectiveTo investigate radiosensitization mechanism of AG014699 in BRCA2 deficient pancreatic cancer cells.MethodsPancreatic cancer cells lines were used,including Capan-1 with mutuated BRCA-2 and Panc-1 with BRCA1/2 wild type.Cell were treated AG014699 and /or radiotherapy (4~10 Gy) then the capability to proliferate was evaluated by colony formation,cell counting and MTT assays.Flow Cytometry were utilized to assess cell respone to AG014699 plus irradiation.ResultsAG014699 (≤ 10 μM)was cytotoxic to Capan-1 cell with mutuated BRCA-2 but not to Panc-1 cell without BRCA1/2 mutations.AG014699 indued DNA double-strand break in Capan-1 cell.Combination treatment with AG014699 plus radiotherapy was more effective than drug alone.ConclusionThe rationale of using a PARP inhibitor as radiosensitizer in pancreatic cancer with BRCA2 mutation has been demonstrated.
【Key words】Pancreatic cancer;Radiosensitivity;PARP inhibitor;DNA repair
(ThePracticalJournalofCancer,2015,30:1439~1442)
胰腺癌是1种早期临床症状不典型、进展快及预后较差的恶性消化肿瘤,由于早期症状不明显,80%以上胰腺癌诊断时已无法切除,其中50%~60%为局部晚期胰腺癌[1]。同步放化疗是局部晚期胰腺癌的主要治疗手段,尤其以健择为基础的同步放化疗可提高中位生存期[2],但平均中位生存期仅为9~10个月。因此,寻求新的治疗策略对胰腺癌的临床治疗具有重要意义。而癌细胞可以通过PARP酶及同源重组来修复基因毒性损伤而引起的单链及双链的断裂。本研究通过体外实验研究观察PARP抑制剂AG014699能否增加BRCA2缺陷的胰腺癌的放疗敏感性,并可能探讨其放疗增敏的分子机制。
1材料与方法
1.1细胞株
人胰腺癌细胞株CAPAN-1购自中国医学科学院肿瘤医院肿瘤细胞库。人胰腺癌细胞PANC-1购自武汉博士德生物工程有限公司。
1.2主要试剂与仪器
Rucaparib(AG-014699)(美国selleck);RPMI1640、DMEM高糖液体培养基(hyclone);胎牛血清(北京全式金生物技术有限公司);Histone H2AX Antibody(美国ANBO);荧光标记二抗(FITC)羊抗兔IgG、DAPI染色液(武汉博士德生物工程有限公司);姬姆萨染液(北京索莱宝科技有限公司);四甲基偶氮唑蓝(MTT)、DMSO(sigma)。
1.3方法
1.3.1细胞培养将购买的已复苏的人胰腺癌细胞Capan-1(含20%胎牛血清、100 U/ml青霉素及100 mg/L链霉素的1640培养液)置于5%CO2、37 ℃的培养箱中培养。待细胞增殖到80%~90%时可进行消化、离心、传代。取对数生长期细胞进行实验。
1.3.2MTT检测细胞增殖情况分别取对数期胰腺癌细胞Capan-1,以10 000个/孔细胞接种于96孔培养板中,每组设置5个复孔,过夜12 h后分别换为含有不同药物梯度的Rucaparib(AG-014699)(0 mmol/L、2.5 mmol/L、5.0 mmol/L、7.5 mmol/L、10.0 mmol/L、20.0 mmol/L、30.0 mmol/L),并设置空白对照组及阴性对照组。后置于5%CO2、37 ℃的培养箱中分别培养24 h、48 h及72 h,加入MTT(5 mg/ml)20 μl/孔,继续培养4 h,弃上清,加入DMSO100 μl/孔。后在水平摇床上摇动10 min,使结晶物充分溶解。在酶联免疫检测仪OD570 nm处测量各孔的吸光值。抑制率(%)=(1-实验组平均A值/对照组平均A值)×100%。
1.3.3细胞克隆形成率取对数生长期的胰腺癌细胞,用0.25%胰蛋白酶消化并吹打成单个细胞在培养液中备用。对照组、单纯药物组、单纯放疗组、放疗加药物组以每皿100、250、500、1 000、1 500、2 000个细胞的梯度密度分别接种于6cm含培养液的皿中,摇匀并使细胞分散均匀,含药组加入10 μmmol/L的Rucaparib(AG-014699),置于5%CO2、37 ℃的培养箱中培养。药物作用6 h后,上述细胞梯度密度分别照射0、1、2、4、6、8 Gy(采用Elekta 公司Precise 直线加速器,6-MeV 电子线照射,SSD 为100 cm,单次照射,加用0.5cm 硅胶组织补偿),继续培养12 天,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,PBS浸洗、甲醇固定、Giemsa染色、流水缓洗染色液、空气干燥。在显微镜(低倍镜)计数大于50个细胞的克隆数。最后计算克隆形成率。克隆形成率(%)= 克隆数/接种细胞数×100%。
1.3.4免疫荧光观察有丝分裂危像取对数生长期胰腺癌细胞,消化、离心并以40 000个/孔细胞接种到24孔板中,并加入10 μmmol/L的Rucaparib(AG-014699),药物作用6 h后给与放疗加药物组细胞2 Gy的照射剂量,继续培养24 h,后经PBS冲洗、4%多聚甲醛固定、PBS浸洗、0.5%Triton X-100通透20 min,PBS浸洗,正常山羊血清室温封闭30 min,滴加足量稀释好的一抗Histone H2AX Antibody并放入湿盒,4 ℃孵育过夜,次日早上加荧光二抗(FITC)羊抗兔IgG,湿盒中20 ℃~37 ℃孵育1 h,滴加DAPI避光孵育5 min,后在荧光显微镜下观察采集图像。
1.4统计学分析
所有数据均应用SPASS 19.0软件进行统计学分析,以(均数±标准差)表示计量资料,计数资料采用χ2检验,P<0.05为有统计学差异。
2结果
2.1MTT结果
在不同时间点24 h、48 h、72 h对2种胰腺癌细胞给予不同药物浓度的Rucaparib(AG-014699)药物,实验中发现CAPAN随着药物浓度的增加及作用时间的延长而细胞增殖抑制增强,细胞CAPAN-1在48 h细胞增殖抑制较明显,其IC50值为10 μmol/L,见图1。
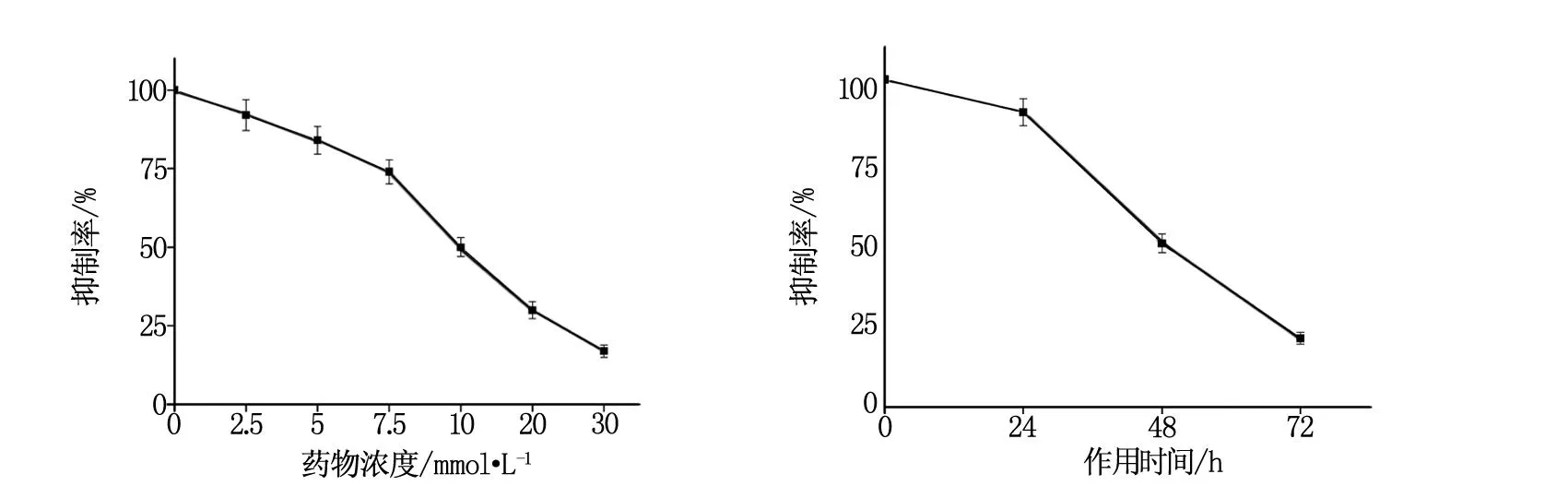
图1 不同药物浓度及作用时间对细胞增殖抑制影响
2.2细胞克隆分子实验结果
放疗联合药物组对胰腺癌细胞Capan-1细胞克隆形成率影响最明显,与单药和单放疗组比较(P<0.05),细胞CAPAN-1通过细胞克隆分子实验发现PARP抑制剂可增强放射治疗的敏感性。
2.3细胞免疫荧光结果
单纯放疗(2 Gy)和药物联合照射(2 Gy)24 h后,药物联合放疗组细胞有丝分裂危象较单纯放疗组增加(P<0.05)。
3讨论
胰腺癌是临床常见的1种消化道恶性肿瘤,预后也较差,由于胰腺癌位于腹膜后,位置较深,早期临床症状比较隐匿,临床诊断和治疗也较为棘手,大部分患者诊断时已为局部晚期而丧失手术机会,5年总生存率不足5%。放射治疗是胰腺癌综合治疗中的重要方法之一,可增加手术切除的可能,并改善患者预后。临床上胰腺癌患者对放射治疗的敏感性存在差异,与其自身生物学特点有关。胰腺癌是低血供肿瘤,乏氧环境生长,对放射治疗不敏感,而提高放疗剂量将引起相关并发症发生率的增加,少数患者可引起治疗中断[3]。临床上多采用多种药物联合放疗以提高其放疗敏感性。
放射治疗是通过电离辐射至DNA 双链断裂而引起致死性损伤事件,其作用靶点是DNA 链,有些细胞受照射后DNA 单链断裂,后通过多种DNA 修复途径复活,故凡能抑制DNA 损伤修复的药物,均有可能使单链断裂发展至双链断裂,从而提高放射治疗的杀伤效应,即放射增敏剂。1946年,遗传学家Dobzhansky 等[4]首次提出“合成致死”理论:两种非致死的遗传变异单独发生时对细胞无影响,但同时发生在一个细胞内可致细胞死亡。利用聚腺苷二磷酸核糖聚合酶(PARP)抑制剂治疗含BRCA1/BRCA2 突变体肿瘤的“合成致死”模式是目前国际上该领域的研究热点[5-6]。聚腺苷二磷酸核糖聚合酶(PARP)是存在于多数真核细胞中的一个多功能蛋白质翻译后修饰酶。PARP 家族由18种蛋白酶组成,分别参与DNA修复、基因转录、稳定遗传、细胞周期和细胞死亡等多种生物学功能[7]。BRCA1/BRCA2 基因编码的蛋白质参与细胞通路和DNA损伤修复等功能。BRCA1可调节细胞周期检测点和发现DNA 修复并募集修复酶;而BRCA2 直接将DNA 修复蛋白RAD51直接易位到DNA损伤区域进行修复[8-9]。流行病学调查发现胰腺癌,尤其是家族性胰腺癌,多数携带BRCA2 突变基因[10-12],位于乳腺癌和卵巢癌之后。PARP抑制剂是与DNA 损伤修复有关的一类小分子靶向药物,是否能提高放射治疗的敏感性呢?Khan 等[13]探索PARP抑制剂GPI-15427 联合放疗的效应,发现GPI-15427 可提高头颈部鳞状细胞癌JHU006 和JHU012 的放射敏感性,DNA双链断裂明显增多。Efimova 等[14]发现PARP 抑制剂ABT-888 联合放疗可延长放疗对BRCA1/BRCA2 缺陷的乳腺癌细胞的杀伤作用,并加速细胞衰老。Kaye 等[15]开展一项多中心、开放式的随机II 期临床研究,比较PARP 抑制剂AZD2281 和阿霉素脂质体对卵巢癌的疗效,97例复发或证实有BRCA1/2 突变的卵巢癌入组,结果显示口服AZD2281 200 mg/次和400 mg/次,每天2 次的患者与阿霉素组相比,无进展生存率(PFS)无统计学上差异,而400mg/次的AZD2281 组的药物毒性可耐受,提示AZD2281 是1种低毒高效型的药物。Jacob 等[16]比较PARP 抑制剂3-ABA 联合化疗药物健择与单独健择对胰腺癌细胞的杀伤效应,发现联合用药对细胞毒性更大,诱导细胞凋亡增多,体内实验显示肿瘤体积缩小,小鼠存活时间较对照组延长40 天以上。Gottipati 等[17]发现PARP 抑制剂对BRCA2 缺陷的胰腺癌细胞系CAPAN-1 有较强的抑制作用。Letizia 等[18]比较PARP抑制剂联合放疗较单纯放疗作用于胰腺癌细胞CAPAN-1,通过细胞克隆分子实验发现PARP抑制剂可提高放疗的敏感性,其联合放化疗较放化疗可增加胰腺癌CAPAN-1、MiapaCa-2、AsPC-1、Panc-1细胞增殖抑制效应。
本次研究结果显示:不同时间点24 h、48 h、72 h对两种胰腺癌细胞CAPAN-1给予不同药物梯度的Rucaparib(AG-014699)药物,实验中发现CAPAN随着药物浓度的增加及作用时间的延长而细胞增殖抑制增强,测得细胞CAPAN-1在48时细胞增殖抑制较明显,其IC50值在10 μmol/L值。胰腺癌细胞CAPAN-1通过细胞克隆分子实验发现PARP抑制剂可增加放射治疗的敏感性。单纯放疗(2 Gy)和药物联合照射(2 Gy)后24 h,药物加放疗组中细胞有丝分裂危象较单纯放疗增加,与上述Letizia P等学者研究相一致[18]。
综上所述,聚腺苷二磷酸核糖聚合酶(PARP)抑制剂AG014699可提高BRCA2缺陷的胰腺癌细胞放射敏感性,值得更多基础研究,进一步推广及应用到临床中。
参考文献
[1]Manuel H.Pancreatic Cancer〔J〕.N Engl J Med,2010,362(17):1605-1617.
[2]Chauffert B,Mornex F,Bonnetain F,et al.Phase III trial comparing intensive induction chemoradiotherapy (60 Gy,infusional 5-FU and intermittent cisplatin)followed by maintenance gemcitabine with gemcitabine alone for locally advanced unresectable pancreatic cancer.Definitive results of the 2000-01 FFCD/SFRO study〔J〕.Ann Oncol,2008,19(9):1592-1599.
[3]Adusumilli PS,Stiles BM,Chan MK,et al.Radiation therapy potentiates effective oncolytic viral therapy in the treatment of lung cancer〔J〕.Ann Thorac Surg,2005,80(2):409-416.
[4]Dobzhansky T.Genetics of natural populations;recombination and variability in populations of drosophila pseudoobscura〔J〕.Genetics,1946,31(3):269-290.
[5]Bryant HE,Schultz N,Thomas HD,et al.Specific killing of BRCA2-deficient tumours with inhibitors of poly(ADP-ribose)polymerase〔J〕.Nature,2005,434(7035):913-917.
[6]Farmer H,McCabe N,Lord CJ,et al.Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy〔J〕.Nature,2005,434(7035):917-921.
[7]Amé JC,Spenlehauer C,de Murcia G.The PARP superfamily〔J〕.Bioessays,2004,26(8):882-893.
[8]Venkitaraman AR.Cancer susceptibility and the functions of BRCA1 and BRCA2〔J〕.Cell,2002,108(2):171-182.
[9]De Koning L,Corpet A,Haber JE,et al.Histone chaperones:an escort network regulatinghistone traffic〔J〕.Nat Struct Mol Biol,2007,14(11):997-1007.
[10]Cho JH,Bang S,Park SW,et al.BRCA2 mutations as a universal risk factor for pancreatic cancer has a limited role in Korean ethnic group〔J〕.Pancreas,2008,36(4):337-340.
[11]Yamamoto H,Itoh F,Nakamura H,et al.Genetic and clinical features of human pancreatic ductal adenocarcinomas with widespread microsatellite instability〔J〕.Cancer Res,2001,61(7):3139-3144.
[12]Beger C,Ramadani M,Meyer S,et al.Down-regulation of BRCA1 in chronic pancreatitis and sporadic pancreatic adenocarcinoma〔J〕.Clin Cancer Res,2004,10(11):3780-3787.
[13]Khan K,Araki K,Wang D,et al.Head and neck cancer radiosensitization by the novel poly(ADP-ribose)polymerase inhibitor GPI-15427〔J〕.Head Neck,2010,32(3):381-391.
[14]Efimova EV,Mauceri HJ,Golden DW,et al.Poly(ADP-ribose)polymerase inhibitor induces accelerated senescence in irradiated breast cancer cells and tumors〔J〕.Cancer Res,2010,70(15):6277-6282.
[15]Kaye SB,Lubinski J,Matulonis U,et al.Phase II,open-label,randomized,multicenter study comparing the efficacy and safety of olaparib,a poly (ADP-ribose)polymerase inhibitor,and pegylated liposomal doxorubicin in patients with BRCA1 or BRCA2 mutations and recurrent ovarian cancer〔J〕.J Clin Oncol,2011,30(4):372-379.
[16]Jacob DA,Bahra M,Langrehr JM,et al.Neumann UP Combination therapy of poly (ADP-ribose)polymerase inhibitor 3-aminobenzamide and gemcitabine shows strong antitumor activity in pancreatic cancer cells〔J〕.J Gastroenterol Hepatol,2007,22(5):738-748.
[17]Gottipati P,Vischioni B,Schultz N,et al.Poly(ADP-ribose)polymerase is hyperactivated in homologous recombination-defective cells〔J〕.Cancer Res,2010,70(13):5389-5398.
[18]Porcelli L,Quatrale AE,Mantuano P,et al.Optimize radiochemotherapy in pancreatic cancer:PARP inhibitors a new therapeutic opportunity〔J〕.Mol Oncol,2013,7(3):308-322.
(编辑:吴小红)
