铜绿假单胞菌norB基因的克隆及表达
2015-12-28
(福建农林大学生命科学学院,福建福州350002)
随着经济的快速发展,活性氮污染日益突出,严重影响人们的日常生活。活性氮渗透范围较广,不仅包括人们所熟知的水体中的NO-3-N、NO-2-N 和NH+4-N,而且包括大气中的氮氧化物(NOx),如NO、N2O、N2O3等。我国排放的NOx主要来源于燃煤,以NO为主,约占95%以上。
目前,各国对活性氮污染的治理进行了深入研究,生物脱氮由于成本低及二次污染小而备受关注,已开发出诸多脱氮工艺,如同步硝化反硝化[1]、序批式反应器[2]、全程自养脱氮[3]、厌氧氨氧化[4]、高活性氨氮去除反应器[5]等,但处理的对象主要是水体中的活性氮,对大气中NOx的生物脱氮工艺研究相对薄弱。生物过滤系统[6-11]是针对NOx的生物脱氮工艺,目前还在实验室模拟阶段,尚未有工业化应用的实例,其原因主要有两点:(1)大气中的NOx以气体形式存在,要进行生物脱氮必先经过吸附、溶解等过程,但NOx的溶解性较差,尤其是NO 几乎不溶于水;(2)生物过滤系统中形成的生物膜成分复杂且受环境影响较大,因而随着外部环境的变化,生物膜的微生物种类及其活性也发生变化,导致NOx去除效率波动较大。
活性氮的去除主要是通过细菌的反硝化作用,即在相关还原酶的作用下,把NO-3最终还原成N2:NO-3→NO-2→NO→N2O→N2。NO 作为中间代谢产物,对细胞具有很大毒性,不会在细胞中积累,产生后会被迅速还原。而此过程由对NO 具有很高亲和力的一氧化氮还原酶(Nor)完成,它催化2分子NO 形成1分子N2O[12]。考虑到NO 的处理难度,为提高NO 的可溶性,作者在此将目的基因norB克隆至表达载体并构建基因工程菌,使之有效表达Nor催化亚单位NorB,提高对NO 的捕获能力,从而提高NOx的去除效率。
1 实验
1.1 材料
铜绿假单胞菌B136-33,华南理工大学亢春喜博士惠赠;克隆菌DH5α、表达菌BL21、质粒pET-28a,自行保存;PCR 及相关酶切试剂,TaKaRa公司;基因组DNA 提取试剂盒、质粒提取试剂盒、琼脂糖凝胶DNA 回收试剂盒,北京全式金生物技术有限公司;SDS-PAGE相关试剂,Omega公司。
1.2 方法
1.2.1 引物设计
利用软件Primer premier 5.0,根据GenBank 公布的铜绿假单胞菌B136-33norB基因序列及pET-28a上的多克隆位点设计引物。上游引物:5′-CG-GAATTCATGATGTCGCCCAATGGCTC-3′(下划线部分为EcoRⅠ酶切位点);下游引物:5′-CCCAAGCTTTCAGGCGGCCGCCTTGCCGC-3′(下划线部分为HindⅢ酶切位点)。上海生工生物工程有限公司负责引物合成。
1.2.2norB基因的扩增
以试剂盒提取的基因组DNA 为模板扩增norB片段。PCR 程序:94 ℃预变性5min;94 ℃变性45s,55 ℃退火45s,72 ℃延伸90s,30个循环;72 ℃延伸10min。1%琼脂糖凝胶电泳后,分析PCR 产物。
1.2.3 质粒pET-28a-norB及表达菌株BL21-pET-28anorB的构建
将质粒pET-28a及回收的norB基因片段进行双酶切(EcoRⅠ、HindⅢ),T4DNA 连接酶连接构建质粒pET-28a-norB,化学转化至克隆菌DH5α,以卡那霉素抗性平板筛选成功的转化子。然后将转化子接至含卡那霉素的LB 液体培养基中培养后,逐步经过菌液PCR、质粒PCR、双酶切及测序等鉴定程序,再把测序正确的转化子的质粒pET-28a-norB化学转化至表达菌BL21,以卡那霉素抗性平板筛选转化成功的BL21-pET-28a-norB,挑选单菌落,37 ℃培养12h后,菌种加入15%的甘油于-80 ℃保存。
1.2.4 目的蛋白分子量的鉴定
将BL21-pET-28a-norB在LB 液体培养基中以250r·min-1、37 ℃培养约3h,至A600约为1.0时加入IPTG 诱导norB的表达。IPTG 诱导浓度为0.5 mmol·L-1、1mmol·L-1,诱导时间1.5h,诱导温度37 ℃。对诱导后的菌液处理后,进行SDS-PAGE(电压100V,30min;电压120V,3h)电泳,考马斯亮蓝染色,脱色后分析目的蛋白质的分子量。
1.2.5 葡萄糖对norB基因表达的影响
为抑制本底表达,在LB液体培养基中加入1%的葡萄糖,按1.2.4方法进行SDS-PAGE电泳。
2 结果与讨论
2.1 norB 基因的扩增
norB基因的PCR 产物琼脂糖凝胶电泳结果见图1a。
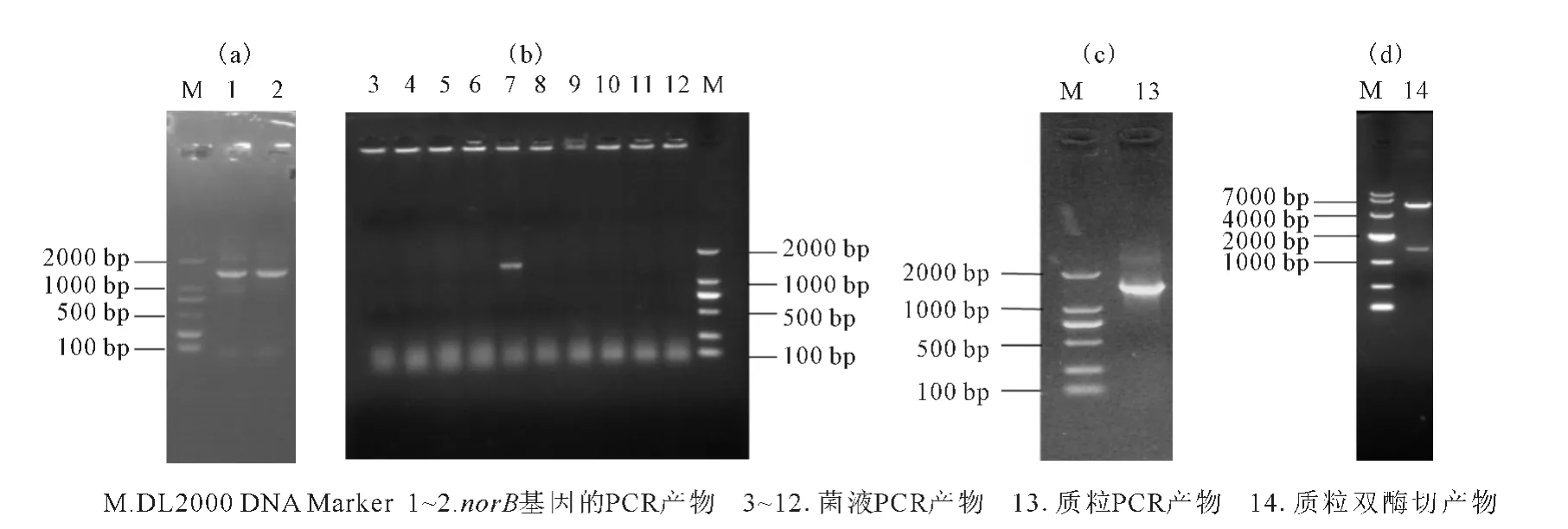
图1 PCR 产物琼脂糖凝胶电泳图谱Fig.1 Agarose gel electrophorogram of PCR products
由图1a可知,目的条带在琼脂糖凝胶电泳图谱中的位置与GenBank公布的norB基因大小(1 401bp)基本相符。
2.2 重组质粒pET-28a-norB 的构建及鉴定
从卡那霉素抗性平板上随机挑选出10株阳性克隆菌DH5α-pET-28a-norB,接至LB 液体培养基增菌后,依次进行菌液PCR(图1b)、质粒PCR(图1c),结果发现,只有菌株7 为阳性克隆菌DH5α-pET-28anorB(图1b)。对菌株7中的重组质粒进行双酶切后,再经琼脂糖凝胶电泳(图1d),结果与预期完全相符(共2 个片段,大片段约5 300bp,小片段约1 400 bp)。随后,对重组质粒测序,并通过BLAST 分析,结果见图2。
图2中灰色背景序列分别为酶切位点EcoRⅠ和HindⅢ,波浪线序列分别为起始密码子和终止密码子,2个密码子之间即为目的片段norB基因的序列,与GenBank公布序列一致,说明重组质粒pET-28anorB构建成功。
2.3 目的蛋白NorB分子量的鉴定
按norB基因的氨基酸序列推测,目的蛋白NorB的理论分子量约为52kDa,然而,众多研究结果表明,NorB在SDS-PAGE 中的表观分子量约为37~38 kDa,而由图3可知,目的蛋白(箭头所示)的迁移位置在40kDa附近,与NorB的表观分子量基本相符。
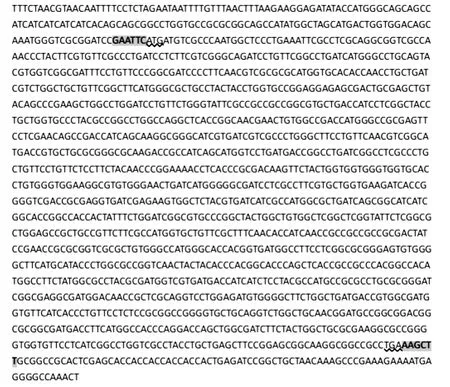
图2 重组质粒pET-28a-norB 测序结果Fig.2 Sequence of recombinant plasmid pET-28a-norB
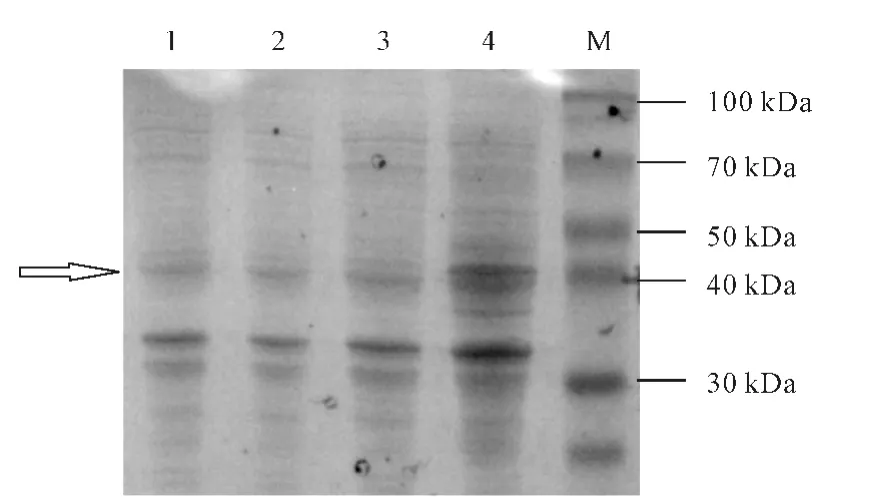
图3 NorB的SDS-PAGE电泳图谱Fig.3 SDS-PAGE Electrophorogram of NorB
2.4 葡萄糖对norB 表达的影响
由于未加入IPTG 的重组质粒亦表达了NorB(图3条带1),推测可能存在本底表达现象。为验证此现象,在LB液体培养基中加入1%的葡萄糖,再诱导表达,进行SDS-PAGE分析,结果见图4。
由图4可看出,葡萄糖的加入抑制了本底表达,即加入IPTG 后,在40kDa附近出现了目的蛋白。
2.5 讨论
(1)大气中NOx的治理是一个技术难题,其中一个重要原因就是NO 难溶于水。为提高去除效率,增大NO 可溶性就成为了一种必要手段,如Fe(Ⅱ)-EDTA 对NO 具有很好的吸收能力,但Fe(Ⅱ)-EDTA 易被氧化成Fe(Ⅲ)-EDTA,从而不能结合NO[13],致使NO 去除率下降。为再生Fe(Ⅱ)-EDTA,Li等[14]在系统中加入了大肠杆菌FR-2(铁还原细菌),并深入研究了Fe(Ⅱ)-EDTA 对Fe(Ⅲ)-EDTA 生物还原的影响。此外,从生物学角度,NO 的去除要依靠Nor的作用,Nor对NO 具有非常高的亲和力,能迅速“捕捉”NO,本实验通过PCR 扩增、基因克隆、表达载体构建等,有效地表达出了Nor催化亚单位NorB,为提高NO 的去除效率奠定了理论基础。
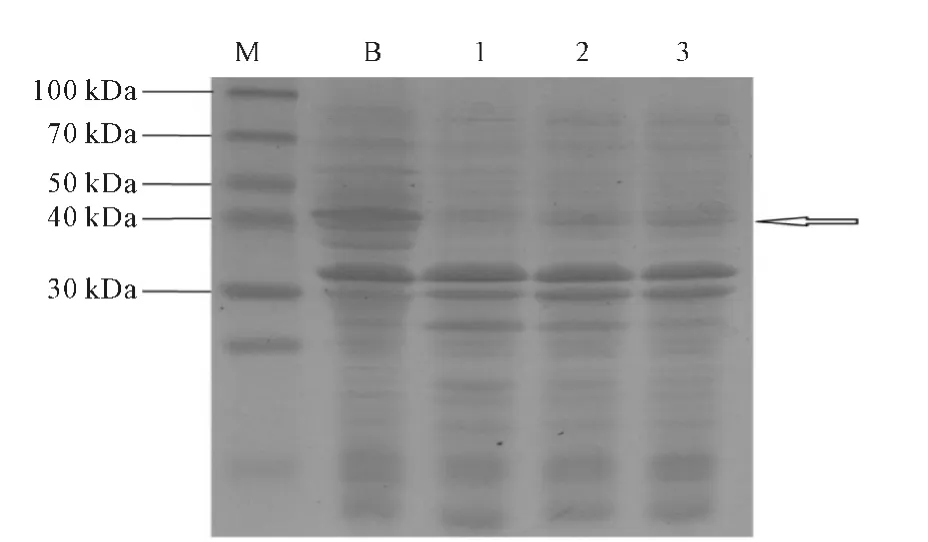
图4 加入1%葡萄糖后的NorB的SDS-PAGE电泳图谱Fig.4 SDS-PAGE Electrophorogram of NorB supplemented with 1%glucose
(2)细菌Nor为膜结合蛋白,含有2 个亚单位,NorC和NorB,分别由基因norC和norB编码。NorC分子量相对较小,为膜结合细胞色素c;NorB 分子量相对较大,为催化部位,由12 条跨膜α-螺旋构成[15],具有极强的疏水性,对表达极为不利。本实验也证实,与其它生物脱氮中的还原酶(如亚硝酸还原酶[16])的表达量相比,NorB 的表达量较低(图3、4)。然而,考虑到Nor对NO 的极高亲和力,即使NorB 的表达量不高,也仍然对NO 的去除具有积极的意义。
3 结论
为使norB基因得到有效表达,利用分子生物学技术将铜绿假单胞菌B136-33的norB基因克隆至表达载体pET-28a 上,并构建基因工程菌,高效表达NorB,提高对NO 的捕获能力,从而提高NOx的去除效率。
[1]VIRDIS B,RABAEY K,ROZENDAL R A,et al.Simultaneous nitrification,denitrification and carbon removal in microbial fuel cells[J].Water Research,2010,44(9):2970-2980.
[2]LIM J W,SENG C E,LIM P E,et al.Nitrogen removal in moving bed sequencing batch reactor using polyurethane foam cubes of various sizes as carrier materials[J].Bioresource Technology,2011,102(21):9876-9883.
[3]ZHANG Z,LI Y,CHEN S,et al.Simultaneous nitrogen and carbon removal from swine digester liquor by the Canon process and denitrification[J].Bioresource Technology,2012,114:84-89.
[4]SUNEETHI S,JOSEPH K.ANAMMOX Process start up and stabilization with an anaerobic seed in anaerobic membrane bioreactor(AnMBR)[J].Bioresource Technology,2011,102(19):8860-8867.
[5]CLAROS J,SERRALTA J,SECO A,et al.Real-time control strategy for nitrogen removalvianitrite in a SHARON reactor using pH and ORP sensors[J].Process Biochemistry,2012,47(10):1510-1515.
[6]JIANG R,HUANG S,CHOW A,et al.Nitric oxide removal from flue gas with a biotrickling filter usingPseudomonasputida[J].Journal of Hazardous Materials,2009,164(2-3):432-441.
[7]JIANG R,HUANG S B,YANG J,et al.Field applications of a bio-trickling filter for the removal of nitrogen oxides from flue gas[J].Biotechnology Letters,2009,31(7):967-973.
[8]YANG Y L,HUANG S B,LIANG W,et al.Microbial removal of NOxat high temperature by a novel aerobic strainChelatococcus daeguensisTAD1in a biotrickling filter[J].Journal of Hazardous Materials,2012,203-204:326-332.
[9]YANG Y L,HUANG S B,ZHANG Y Q,et al.Field applications for NOxremoval from flue gas in a biotrickling filter byChelatococcusdaeguensisTAD1[J].Aerosol and Air Quality Research,2013,13(6):1824-1831.
[10]蒋然,黄少斌,范利荣.在有氧条件下用生物过滤系统去除NOx[J].环境科学学报,2007,27(9):1469-1475.
[11]朱润晔,陈建孟,王家德.异养型生物过滤床硝化净化一氧化氮[J].环境工程学报,2007,1(9):94-99.
[12]YE R W,AVERILL B A,TIEDJE J M.Denitrification:Production and consumption of nitric oxide[J].Applied and Environmental Microbiology,1994,60(4):1053-1058.
[13]SADA E,KUMAZAWA H,MACHIDA H.Oxidation kinetics of Fe(Ⅱ)-EDTA and Fe(Ⅱ)-NTA chelates by dissolved oxygen[J].Industrial &Engineering Chemistry Research,1987,26(7):1468-1472.
[14]LI W,WU C Z,ZHANG S H,et al.Evaluation of microbial reduction of Fe(Ⅲ)-EDTA in a chemical absorption-biological reduction integrated NOxremoval system[J].Environmental Science &Technology,2007,41(2):639-644.
[15]ZUMFT W G.Cell biology and molecular basis of denitrification[J].Microbiology and Molecular Biology Reviews,1997,61(4):533-616.
[16]徐健,张德纯.Cd1-型亚硝酸盐还原酶脱氮工程菌的构建与表达[J].中国微生态学杂志,2008,20(5):463-465,468.
