血清瘦素及脂联素水平对子宫内膜癌的临床价值探讨
2015-12-28建斌
,,建斌,,
(1.南华大学附属第二医院妇产科,湖南 衡阳 421001;2.南华大学附属第二医院麻醉科)
·临床医学·
血清瘦素及脂联素水平对子宫内膜癌的临床价值探讨
周杰1,曾志英2*,周建斌1,张群锋1,刘珏1
(1.南华大学附属第二医院妇产科,湖南 衡阳 421001;2.南华大学附属第二医院麻醉科)
目的探讨血清中瘦素浓度及脂联素浓度与子宫内膜癌的关系以及联合检测两者对子宫内膜癌诊断的价值。方法利用ELISA(酶联免疫吸附法)测定41例正常健康妇女(对照组)、40例子宫内膜良性病变患者(良性组)及38例子宫内膜癌患者(恶性组)血清瘦素及脂联素的含量。结果恶性组在治疗前血清瘦素含量(8.40±2.88 ng/mL)显著高于良性组(4.97±1.90 ng/mL)、对照组(4.78±2.12 ng/mL)(P<0.01)。恶性组治疗前血清脂联素含量(2.50±1.76 μg/mL)显著低于良性组(5.12±2.20 μg/mL)、对照组(5.18±2.19 μg/mL)(P<0.01)。患者的血清瘦素与脂联素比值检测敏感度及特异度优于单一检测瘦素或脂联素时的敏感度及特异度。血清瘦素、脂联素浓度水平与子宫内膜癌患者的临床手术分期、病理分化程度有关(P<0.05)。血清中出现瘦素水平升高及血清脂联素水平降低是子宫内膜癌发病的独立危险因素。结论子宫内膜癌患者血清中出现瘦素水平升高的同时伴有脂联素水平的降低。血清中出现瘦素水平的升高及脂联素水平的降低为子宫内膜癌患病的独立危险因素。联合测定血清脂联素及瘦素可为子宫内膜癌的诊断提供相应的参考价值。
血清; 瘦素; 脂联素; 子宫内膜癌; 酶联免疫吸附法
过去,我国妇女子宫内膜癌的发病率一直很低,但近年来随着我国居民生活条件逐渐改善,子宫内膜癌的患病率也呈现上升趋势,严重危害着我国妇女的身体健康。但由于其病因及发病机制并不完全明确,早期发现及治疗该病对于改善子宫内膜癌患者的预后来说就至关重要,近期国外有研究报道子宫内膜癌Ⅰ期患者如得到早期有效的诊治,其5年生存率可高达95%[1],因此寻找子宫内膜癌早期诊断和治疗手段已成为近期一个热点。此前的研究证实,子宫内膜癌为代谢综合征中的一种表现,目前代谢综合征已包括肥胖、糖尿病、高血压、动脉粥样硬化、高血脂、乳腺癌及子宫内膜癌等多种疾病。瘦素及脂联素作为脂肪细胞因子的重要组成部分,与肥胖、动脉粥样硬化、糖尿病及高血压等多种临床常见疾病紧密联系,同时也被证实参与多种恶性肿瘤的发生发展过程[2-7]。本文通过观察子宫内膜癌患者血清瘦素及脂联素水平的变化,探讨它们与子宫内膜癌发生发展之间的相互关系。
1 资料与方法
1.1病例来源所有血清标本均来源于南华大学附属第二医院妇产科2012年6月~2014年10月住院并经病理学检查确诊的子宫内膜癌患者、子宫内膜良性病变患者以及正常健康妇女。本研究经过本院伦理委员会审批,并经患者同意。研究对象包括:(1)恶性组:子宫内膜癌38例(包括内膜样腺癌29例、浆液性癌及透明细胞癌等其他类型恶性子宫内膜癌9例),其中Ⅰ~Ⅱ期病例28例、Ⅲ~Ⅳ期病例10例;平均年龄为 48.5±15.6 岁。(2)良性组:子宫内膜良性病变40例(包括功能失调性子宫出血26例,子宫内膜息肉10例,子宫内膜炎4例);平均年龄 46.5±17.1 岁。(3) 对照组:正常健康妇女41例均来自2013年妇科普查对象,平均年龄 47.2±13.2 岁,在常规体检时都已排除高血压、乳腺癌及糖尿病等各种相关疾病。以上各待检测病例在年龄、生育状况、血压、体重、肥胖指数等各方面的差异均无统计学意义。
1.2标本采集恶性组及良性组患者在治疗前24~48 h抽取外周静脉血4 mL(空腹状态下)。对照组妇女则在体检时同样于空腹状态下抽取外周静脉血4 mL。所有血液标本采集后给予离心(3 000 r/min)5 min,于-80 ℃冰箱内冰冻保存,用于下一步测定血清中瘦素及脂联素含量。
1.3方法运用ELISA法检测所有待测血清中瘦素及脂联素的含量水平(采用复管检测所有检测标本)。瘦素ELISA试剂盒和脂联素 ELISA试剂盒均购自美国R&D公司。操作步骤严格按试剂盒说明书进行,实验操作时需配戴口罩和手套。以瘦素及脂联素标准抗原(标准品)的浓度值作为X轴,以两总标准品相应的OD450吸光值作为Y轴,建立出瘦素及脂联素的标准曲线,各个待检样品的浓度即可通过相应的OD450吸光值通过标准曲线转化获得。
1.4统计分析采用SPSS 16.0软件处理数据。血清瘦素及脂联素检测结果采用均数±标准差表示,组间比较采用t检验和方差分析,采用Logistic回归模型进行子宫内膜癌患病风险评估。绘制血清瘦素及脂联素的受试者工作特性曲线(ROC曲线),找出血清瘦素及脂联素检测的最佳阈值(敏感度和特异度之和最高值)。
2 结 果
2.1 3组患者治疗前血清瘦素及脂联素的含量见表1。在恶性组中,治疗前血清瘦素含量明显高于良性组和对照组,差异具有显著性(P<0.01)。而血清脂联素含量明显低于良性组和对照组,差异具有显著性(P<0.01)。
表1各组患者治疗前血清瘦素及脂联素含量比较
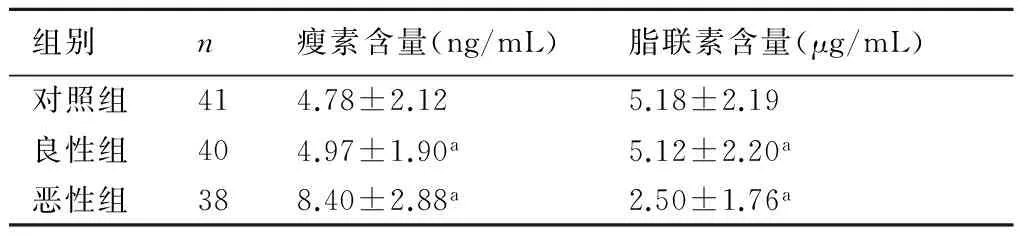
组别n瘦素含量(ng/mL)脂联素含量(μg/mL)对照组414.78±2.125.18±2.19良性组404.97±1.90a5.12±2.20a恶性组388.40±2.88a2.50±1.76a
与对照组比较,a:P<0.01
2.2血清瘦素及脂联素水平与子宫内膜癌患病风险的关系Logistic回归分析中显示,血清瘦素水平升高及脂联素水平降低则发生子宫内膜癌的风险对应增加(均P<0.01;瘦素OR=1.69,95% CI为1.259~2.27;脂联素OR=0.426,95% CI为0.307~0.590 9)。
2.3不同临床病理指标的子宫内膜癌患者治疗前血清瘦素及脂联素的含量在恶性组中,不同病理分化程度及不同临床分期子宫内膜癌患者之间的血清瘦素及脂联素的含量比较差异均有显著性(P<0.05),而不同组织学类型、有无宫颈受累、有无附件转移、不同腹腔细胞学情况及有无淋巴结转移的子宫内膜癌患者之间的血清瘦素及脂联素含量之间差异均无显著性(P>0.05)。见表2。
表2不同临床病理指标的子宫内膜癌患者治疗前血清瘦素及脂联素的含量
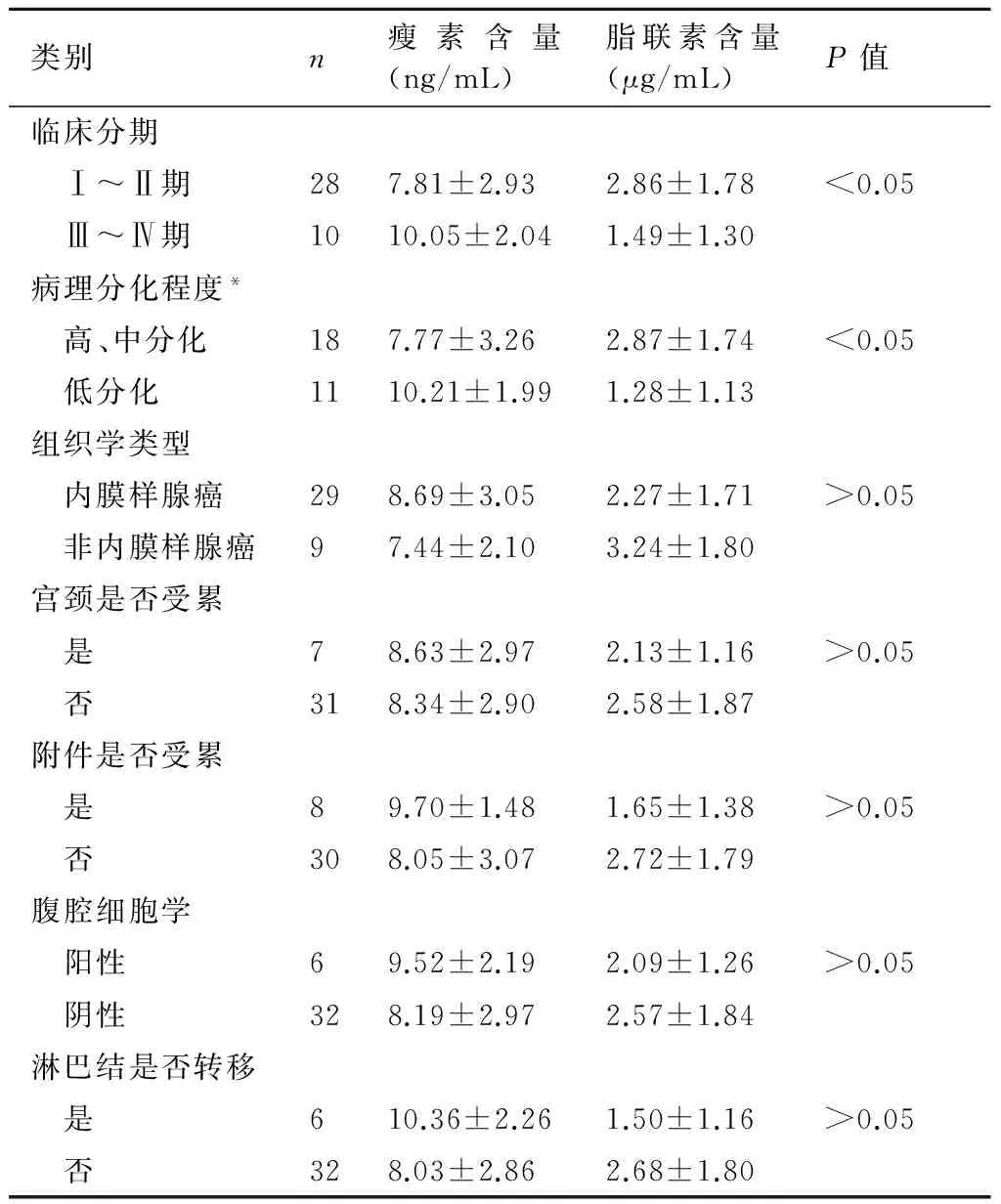
类别n瘦素含量(ng/mL)脂联素含量(μg/mL)P值临床分期 Ⅰ~Ⅱ期287.81±2.932.86±1.78<0.05 Ⅲ~Ⅳ期1010.05±2.041.49±1.30病理分化程度* 高、中分化187.77±3.262.87±1.74<0.05 低分化1110.21±1.991.28±1.13组织学类型 内膜样腺癌298.69±3.052.27±1.71>0.05 非内膜样腺癌97.44±2.103.24±1.80宫颈是否受累 是78.63±2.972.13±1.16>0.05 否318.34±2.902.58±1.87附件是否受累 是89.70±1.481.65±1.38>0.05 否308.05±3.072.72±1.79腹腔细胞学 阳性69.52±2.192.09±1.26>0.05 阴性328.19±2.972.57±1.84淋巴结是否转移 是610.36±2.261.50±1.16>0.05 否328.03±2.862.68±1.80
*:透明细胞癌及其他类型恶性子宫内膜癌9例病例无法区分病理分化程度
2.4 ROC曲线在受试者工作特性曲线当中,当敏感度与特异度总和最高时的对应检测值一般为最佳诊断阈值,从ROC曲线(图1~3)中可以看出,当血清瘦素取值为7.11 ng/mL时,敏感度为76.3%,特异度为87.7%,敏感度与特异度之和最高,故血清瘦素用来诊断子宫内膜癌最佳阈值为7.11 ng/mL。脂联素取值3.05 μg/mL时,敏感度为76.3%,特异度为80.2%,敏感度与特异度之和最高,故血清脂联素用来诊断子宫内膜癌的最佳阈值则为3.05 μg/mL。而用对应患者的血清瘦素与脂联素比值(L/A)所做出的ROC曲线中,当比值取最佳检测阈值2.34时,其检测敏感度为78.9%,而特异度达到了92.6%;明显高于单一检测瘦素或脂联素时的敏感度及特异度。
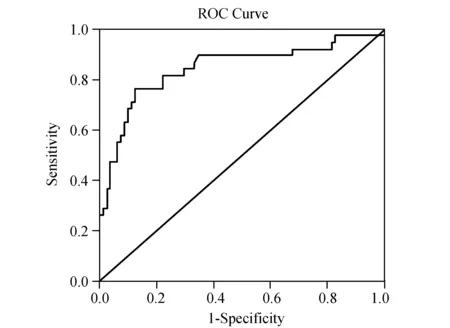
图1 血清瘦素浓度预测子宫内膜癌的ROC曲线
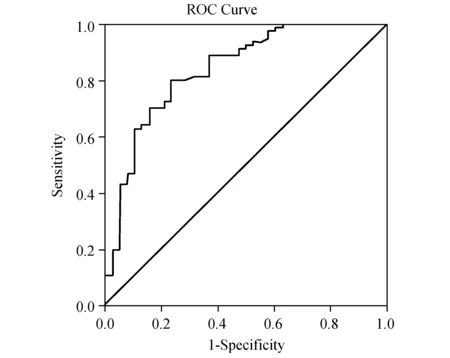
图2 血清脂联素浓度预测子宫内膜癌的ROC曲线

图3 血清瘦素/脂联素比值预测子宫内膜癌的ROC曲线
3 讨 论
子宫内膜癌在妇科恶性肿瘤中比较常见,众所周知,肥胖是子宫内膜癌发生中的一个危险因素。由脂肪细胞分泌的一系列具有生物活性的激素及因子统称为脂肪细胞因子,其中主要包括瘦素、脂联素、内脂素、肿瘤坏死因子α及抵抗素等。如果女性的子宫内膜组织过度地暴露于脂肪组织所产生的多种生物活性物质当中,可以促进子宫内膜癌的发生及发展。瘦素最初由Friedman等发现,它由位于人类染色体7q32当中的肥胖基因所编码,是一种分泌型蛋白质(由167个氨基酸组成)。最初的研究认为瘦素主要起到调控机体食物摄取和能量平衡的作用,与糖尿病、肥胖等疾病密切相关。近年来的研究则发现瘦素与恶性肿瘤也有着密切联系,它对多种不同的肿瘤细胞具有促有丝分裂及抗凋亡等相关作用[8]。脂联素是另一种主要由脂肪细胞产生的蛋白质(由244个氨基酸组成),它由Scherer等发现,脂联素基因全长约16 kb(位于3q27染色体),由apM1编码,人类脂联素包括N-端分泌信号肽、胶原样结构域、氨基端非螺旋功能区以及C-端球形结构域。正常人类血清中就有脂联素的大量表达(占血浆总蛋白的0.01%),它通过调节腺苷酸活化蛋白激酶(AMPK)等多种途径在限制癌细胞的增殖方面起着重要的作用[9]。
本研究发现,子宫内膜癌患者治疗前血清瘦素呈异常高表达,其浓度水平均显著高于对照组及良性组;子宫内膜癌患者治疗前血清脂联素呈异常低表达,浓度水平均显著低于对照组及良性组;而良性组与正常组之间的血清瘦素及脂联素含量比较则未发现差异;提示血清瘦素及脂联素含量的检测可能有助于子宫内膜癌的判断,这与Ashizawa、Ma等[10-11]的研究结果一致。本文根据各组血清瘦素及脂联素值绘制出ROC曲线,瘦素检测曲线下面积为0.843,脂联素检测曲线下面积为0.840,说明测定血清瘦素及脂联素含量对子宫内膜癌有相应的诊断价值。以最佳诊断阈值(敏感度与特异度之和最高:瘦素为7.11 ng/mL、脂联素为3.05 μg/mL)为界限,瘦素检测子宫内膜癌的敏感度及特异度分别达到了76.3%和87.7%,脂联素检测的敏感度及特异度分别达到了76.3%和87.7%,而用对应患者的血清瘦素与脂联素比值所做出的ROC曲线中,当比值取最佳检测阈值2.34时,其检测敏感度达到78.9%,特异度达到92.6%,明显高于单一检测血清瘦素或脂联素时的检测敏感度及特异度[12-13]。可见血清瘦素值7.11 ng/mL、脂联素值3.05 μg/mL可作为诊断子宫内膜癌的阈值,而两者联合检测所计算出来的L/A比值更加有利于子宫内膜癌的诊断,由此也得出临床上联合检测血清瘦素与脂联素含量对治疗前诊断子宫内膜癌有更高的应用价值。同时发现血清高瘦素水平及低脂联素水平是子宫内膜癌发生的独立危险因素,这与多项国外学者研究结果相同[14-17],进一步证实了血清高瘦素水平及低脂联素水平与子宫内膜癌的发病有相关性,血清高瘦素水平及低脂联素水平能通过多种途径增高罹患子宫内膜癌的可能性。通过同时检测不同临床病理指标子宫内膜癌患者治疗前的血清瘦素及脂联素含量,发现在恶性组中不同病理分化程度及不同临床分期患者的瘦素及脂联素的含量间差异均有显著性(P<0.05),而不同组织学类型、是否存在宫颈受累、是否存在附件转移、腹腔细胞学情况及是否存在淋巴结转移患者之间的瘦素和脂联素含量之间差异均无显著性(P>0.05),此结果与Rzepka-Gorska等[18]的研究结果类似。说明血清瘦素含量可能随着子宫内膜癌恶性程度增加而增加,瘦素促进子宫内膜癌细胞增殖,促进病程的不断进展,与子宫内膜癌的转移密切相关;而血清脂联素含量可能随着子宫内膜癌恶性程度增加而降低,脂联素抑制子宫内膜癌细胞增殖,抑制病程进展,对女性子宫内膜组织发挥了保护作用。
总之,本文发现子宫内膜癌患者中血清瘦素水平升高,同时血清脂联素水平出现降低。血清中出现瘦素水平升高、脂联素水平降低则是子宫内膜癌患病的独立危险因素。血清瘦素、脂联素水平测定及其生成的瘦素/脂联素比值可为子宫内膜癌诊断提供参考价值,从而为子宫内膜癌的防治提供了新的线索和策略。当然,本文的研究样本量仍较小,研究结果仍需要在长时间及大样本的进一步研究中得到相应的证实。
[1] Querleu D,Planchamp F,Narducci F,et al.Clinical practice guidelines for the management of patients with endometrial cancer in France:recommendations of the institut national du cancer and the société française d’oncologie gynécologique [J].Int J Gynecol Cancer,2011,21( 5):945-950.
[2] Daley-Brown D,Oprea-Ilies GM,Lee R,et al.Molecular cues on obesity signals,tumor markers and endometrial cancer [J].Horm Mol Biol Clin Investig,2015,21(1):89-106.
[3] Bansal P,Ghalaut VS,Sharma TK,et al.Status of leptin in MBCR-ABL p210 positive chronic myeloid leukemia patients before and after imatinib therapy:a conflicting scenario [J].Clin La,2014,60(11):1845-1852.
[4] Blank S,Deck C,Dreikhausen L,et al.Angiogenic and growth factors in gastric cancer [J].J Surg Res,2015,194(2):420-429.
[5] Lim HY,Im KS,Kim NH,et al.Obesity,expression of adipocytokines,and macrophage infiltration in canine mammary tumors [J].Vet J,2015,203(3):326-331.
[6] Nepal S,Park PH.Regulatory role of autophagy in globular adiponectin-induced apoptosis in cancer cells [J].Biomol Ther,2014,22(5):384-389.
[7] Minatoya M,Kutomi G,Shima H,et al.Relation of serum adiponectin levels and obesity with breast cancer:a Japanese case-control study [J].Asian Pac J Cancer Prev,2014,15(19):8325-8330.
[8] Dutta D,Ghosh S,Pandit K,et al.Leptin and cancer:Pathogenesis and modulation [J].Indian J Endocrinol Metab,2012,16(3):596-600.
[9] Kim AY,Lee YS,Kim KH,et al.Adiponectin represses colon cancer cell proliferation via AdipoR1- and -R2-mediated AMPK activation [J].Mol Endocrinol,2010,24(7):1441-1452.
[10] Ashizawa N,Yahata T,Quan J,et al.Serum leptin-adiponectin ratio and endometrial cancer risk in postmenopausal female subjects [J].Gynecol Oncol,2010,119(1):65-69.
[11] Ma Y,Liu Z,Zhang Y,et al.Serum leptin,adiponectin and endometrial cancer risk in Chinese women [J].J Gynecol Oncol,2013,24(4):336-341.
[12] Dallal CM,Brinton LA,Bauer DC,et al.Obesity-related hormones and endometrial cancer among postmenopausal women:a nested case-control study within the B~FIT cohort [J].Endocr Relat Cancer,2013,20(1):151-160.
[13] Nowosielski K,Pozowski J,Ulman-Wodarz I,et al.Adiponectin to leptin index as a marker of endometrial cancer in postmenopausal womenwith abnormal vaginal bleeding:an observational study [J].Neuro Endocrinol Lett,2012,3(2):217-223.
[14] Cust AE,Kaaks R,Friedenreich C,et al.Plasma adiponectin levels and endometrial cancer risk in pre-and postmenopausal women [J].J Clin Endocrinol Metab,2007,92(1):255-263.
[15] Friedenreich CM,Langley AR,Seidel TP,et al.Case-control study of markers of insulin resistance and endometrial cancer risk [J].Endocr Relat Cancer,2012,19(6):785-792.
[16] Ohbuchi Y,Suzuki Y,Hatakeyama I,et al.A lower serum level of middle-molecular-weight adiponectin is a risk factor for endometrial cancer [J].Int J Clin Oncol,2014,19(4):667-673.
[17] Luhn P,Dallal CM,Weiss JM,et al.Circulating adiponectin levels and endometrial cancer risk in the prostate,lung,colorectal,and ovarican cancer screening trial [J].Cancer Epidemiol Biomarker Prev,2013,22(7):1304-1312.
[18] Rzepka-Gorska R,Bedner A,Cyrnbaluk-Ploska A,et al.Serum adiponectin in relation to endometrial cancer and endometrial hyperplasia with atypia in obese women [J].Eur J Gynaecol Onco1,2008,29( 6):594-597.
InvestigationabouttheClinicalValueofSerumLeptinandAdiponectinLevelstoEndometrialCancer
ZHOU Jie,ZENG Zhiying,ZHOU Jianbin,et al
(TheSecondAffiliatedHospital,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo discuss the relationship between serum leptin and adiponectin with endometrial cancer,and to explore the clinical value of combined detection in diagnosis of endometrial cancer.MethodsSerum levels of leptin,adiponectin in 38 patients with endometrial cancer,40 patients with endometrial benign lesion and 41 healthy controls were measured by ELISA.ResultsThe serum level of leptin in patients with endometrial cancer(8.40±2.88 ng/mL) was significantly higher than that in patients with endometrial benign lesion (4.97±1.90ng/mL) and healthy group (4.78±2.12 ng/mL) (P<0.01).The serum level of adiponectin in patients with malignant ovarian tumors (2.50±1.76 μg/mL) was significantly lower than that in patients with endometrial benign lesion (5.12±2.20 μg/mL) and healthy group (5.18±2.19 μg/mL) (P<0.01).The sensitivity and specificity of the ratio of serum leptin and adiponectin were superior to single detection of leptin or adiponectin.The levels of serum leptin and adiponectin was in correlation with various FIGO stage and histopathologic grade (P<0.05).Increased serum leptin levels,decreased adiponectin levels were independent risk factors for endometrial cancer.ConclusionsIncreased serum leptin levels accompanied with decreased adiponectin levels occurs in Endometrial cancer patients.Increased serum leptin levels,decreased adiponectin levels were independent risk factors for endometrial cancer.Combined determination of serum adiponectin and leptin may have some value in the diagnosis of endometrial cancer.
serum;leptin;adiponectin;endometrial cancer;ELISA
10.15972/j.cnki.43-1509/r.2015.04.018
2015-04-16;
2015-05-05
*通讯作者,E-Mail:14535350@qq.com.
R737.33
A
(此文编辑:蒋湘莲)
