罗格列酮对脓毒症大鼠血糖及肺部炎症反应的影响
2015-12-28,,,
, , ,
(南华大学附属第一医院儿科,湖南 衡阳 421001)
·基础医学·
罗格列酮对脓毒症大鼠血糖及肺部炎症反应的影响
周灵芝*,张熠,康婷,高顺利
(南华大学附属第一医院儿科,湖南 衡阳 421001)
目的探索罗格列酮对脓毒症大鼠血糖及肺部炎症反应的影响。方法采用结肠结扎穿孔法建立脓毒症大鼠模型,36只SD大鼠随机分为3组,分别为脓毒症组、罗格列酮处理组和假手术组,每组12只。分别于造模后12 h,24 h行血浆血糖检测;HE染色及髓过氧化物酶(MPO)活性检测观察肺组织中性粒细胞聚集情况;荧光定量PCR检测肺组织炎症因子IL-6、TNF-α的表达变化。每时间点检测大鼠6只。结果与假手术组比较,脓毒症组组大鼠肺部炎症因子IL-6、TNF-α表达增高。肺组织微血管通透性增加,肺泡壁增厚,间质水肿,白细胞浸润,MPO活性明显增强(P<0.05);与脓毒症组比较,罗格列酮处理组肺间质水肿程度减轻,白细胞浸润减少,炎症因子的表达受到抑制(P<0.05)。三组大鼠各时间点血糖差别不明显(P>0.05)。结论罗格列酮能够降低脓毒症大鼠肺组织炎症因子IL-6、TNF-α的表达,减轻炎症反应。但对大鼠血糖无明显影响。
罗格列酮; 脓毒症; 肺; 炎症反应
脓毒症是由感染导致的全身炎症反应综合征(system in flammatory response syndrome,SIRS),是严重创伤、休克、外科大手术后常见的并发症。脓毒症时,由于炎症介质的“瀑布样释放”可导致多器官功能障碍综合征(multi organ dysfunction syndrome,MODS),其中肺脏是最易受累的器官。研究发现过氧化物酶体增殖物激活受体γ激动剂罗格列酮(Rosiglitazone ROSI)可通过抑制炎症介质的表达而减轻炎症反应,ROSI在脓毒症及缺血再灌注损伤发生过程中都发挥着抗炎作用。本文就ROSI对结肠结扎穿孔模型大鼠血糖及肺部炎症反应的干预作用进行研究。
1 材料与方法
1.1动物分组与处理SD大鼠36只,体重250~300 g,雌雄不拘,由南华大学实验动物部提供。实验前及实验过程中自由摄食、饮水。动物随机分为3组,脓毒症组、罗格列酮处理组(ROSI 0.3 mg/kg)和假手术组。每组12只。脓毒症组:行盲肠结扎穿孔术。假手术组:开腹,暴露盲肠,不行盲肠结扎穿孔术。罗格列酮处理组:手术同脓毒症组,术后立即尾静脉注射稀释后(0.3 mg/mL)的罗格列酮,以后每12 h一次。A,C组均按体重计算注射等量生理盐水。造模后12 h、24 h氯胺酮麻醉处死大鼠留取标本。各组大鼠均监测体温、呼吸频率、血压、心率及摄食状况。
1.2主要试剂与仪器罗格列酮购自美国Cayman公司;髓过氧化物酶(myeloperoxidase,MPO)比色活性检测试剂盒购自南京建成生物工程研究所;HE染色试剂盒购自武汉博士德生物工程有限公司;荧光定量PCR检测试剂盒购自北京天根公司;Trizol购自invitrogen公司;引物合成由上海生物工程有限公司完成(IL-6:上游引物5-AGCCCACCAGGAACGAAAGTC-3下游引物,5-TGGAAGTTGGGGTAGG AAGGA-3,片段大小559bp;TNF-α:上游引物5-TGCCTCAGCCTCTT CTCATT-3 下游引物5-GCTTGGTGGTTTGCTACGAC-3,片段大小209bp;GAPDH:上游引物5-GTCAGTGGTGGACCT GACCT-3 下游引物5-AGGGGTCT ACATGGCAACTG-3,片段大小420 bp)。
1.3检测指标及方法
1.3.1 血常规及血糖检测 大鼠颈动脉采血后立即采用上海ABX全自动血细胞分析仪检测血常规,日本东芝全自动生化仪检测全血葡萄糖浓度。
1.3.2 肺组织形态学观察 右肺中叶用10%甲醛固定,常规石蜡切片。进行苏木精—伊红(HE)染色,普通光镜下观察肺组织的肺泡充血、水肿及炎症细胞浸润情况。
1.3.3 MPO活性测定 准确称取肺组织重量100 mg/例,剪碎组织块,与配制好的匀浆介质按重量体积比1:19匀浆(10000r/min、匀浆液1 mL),制备成5%的组织匀浆。检测按照试剂盒说明书进行。
1.3.4 炎症因子检测 大鼠处死后,立即取新鲜左下肺新鲜标本以预冷的PBS冲洗干净后立即液氮研磨,Trizol法提取总RNA,按cDNA第一链合成试剂盒说明书逆转录,北京天根公司染色法荧光定量PCR试剂盒行PCR检测。
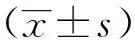
2 结 果
2.1脓毒症大鼠模型的建立参照Remick DG等关于盲肠结扎穿孔术脓毒症大鼠模型的手术方式及诊断标准,脓毒症组及罗格列酮处理组大鼠术后12 h均出现摄食减少、发热症状,肛温平均增加1.5 ℃;呼吸频率较术前增加1倍;心率较术前增加50%;白细胞增升高1倍以上,符合脓毒症大鼠诊断标准。假手术组大鼠术后12 h摄食基本正常,体温、心率、呼吸变化不明显。白细胞稍有上升,但较术前增加不到1倍。
2.2血糖的检测如表1所示,三组大鼠各时间点血糖水平无明显差异(P>0.05)。
表1各组大鼠血浆葡萄糖浓度检测(mmol/L)

组别0h12h24h脓毒症组4.45±0.895.38±1.086.12±1.12ROSI组4.36±0.714.31±0.915.78±0.95假手术5.46±0.955.53±1.124.50±0.89
2.3肺组织形态学改变如图1所示,假手术组小鼠肺组织小叶结构清晰,肺泡腔干净,肺泡间质少量炎性细胞浸润,肺泡壁无增厚,支气管黏膜上皮完整。脓毒症组肺组织充血明显,肺泡间质有大量炎性浸润,肺泡壁增宽,肺泡腔内可见炎性渗出,肺组织病理改变12~24 h逐渐加重。ROSI处理后肺组织充血程度、肺泡间质炎性浸润和渗出较脓毒症组明显改善,肺泡壁无明显水肿。
图1 各组大鼠肺部组织病理变化(HE,100×) A:脓毒症组;B:罗格列酮处理组;C:假手术组
2.4肺组织MPO活性的变化结果表明,与假手术组比较,脓毒症组术后12,24 h,小鼠肺部MPO活性均显著增强,ROSI干预后,MPO活性明显降低。结果见图2。
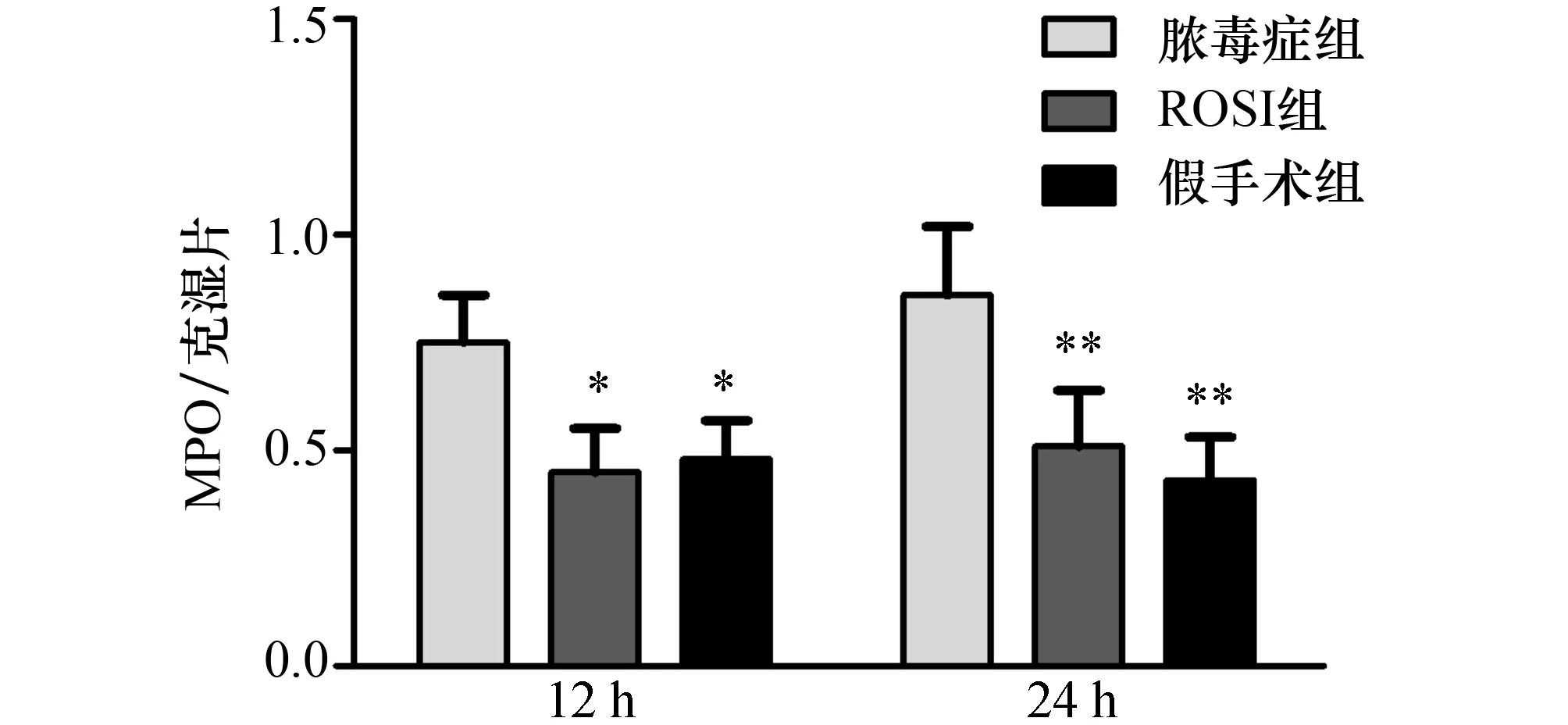
图2 ROSI对脓毒症大鼠肺组织MPO的干预作用 与脓毒症组比较,*:P<0.05,**:P<0.01
2.5炎症因子的变化建模后12 h,24 h各组大鼠肺部炎症因子水平如图3、4所示。脓毒症组IL-6、TNF-αmRNA水平在12 h、24 h逐渐增高。ROSI处理组在12 h、24 h IL-6、TNF-αmRNA水平有增高,但高峰水平低于同期脓毒症组(P<0.05)。假手术组炎症因子各时间点变化不明显且低于同期其他两组(P<0.05)。
3 讨 论
罗格列酮通过与过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptors gamma,PPARγ)结合,使PPARγ/RXRα发生空间构象改变,与辅抑制因子脱离并结合辅激活因子,进而与靶基因启动子上的PPAE结合,激活靶基因转录而激活细胞内信号通路发挥其作用。PPARγ活化可以调控NF-κB和AP-1信号转导通路,在转录水平抑制IL-6、TNF-α的表达而发挥抗炎作用。研究表明罗格列酮与吡格列酮可以抑制支气管哮喘、动脉硬化、炎症性肠病等器官的慢性炎症反应,减轻病变部位中性粒细胞及淋巴细胞的浸润与炎症因子的表达。二者能够减轻脓毒症大鼠的全身炎症反应,而对于脓毒症最易损伤的肺脏,罗格列酮对肺部炎症细胞浸润、炎症因子表达及其对大鼠血糖的影响目前尚无报道。
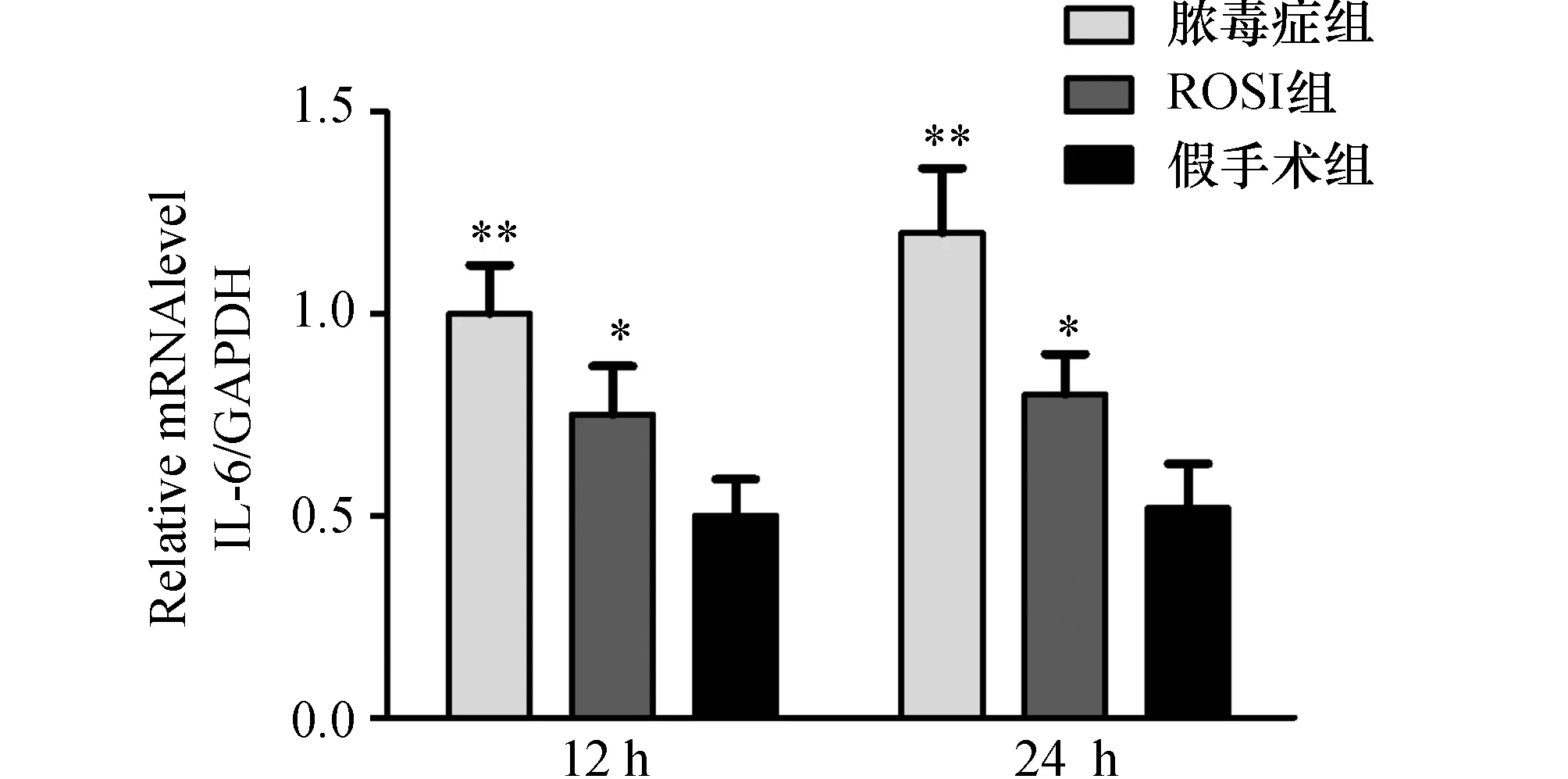
图3 ROSI对脓毒症大鼠肺组织IL-6 mRNA表达的影响与假手术组比较,**:P<0.01。与脓毒症组及假手术组比较,*:P<0.05

图4 ROSI对脓毒症大鼠肺组织TNF-α mRNA表达的影响 与假手术组比较,**:P<0.01;与脓毒症组组比较,*:P<0.05
本研究通过采用盲肠结扎穿孔术构建脓毒症大鼠模型,通过罗格列酮尾静脉注射的方法,研究发现,盲肠结扎穿孔后12小时大鼠出现明显全身炎症反应表现,达到脓毒症诊断标准,此时大鼠肺组织已经受累,表现为组织MPO活性明显增高,肺泡间质充血及炎性细胞浸润,肺泡壁增宽,肺泡腔内可见炎性渗出。而罗格列酮治疗能降低组织MPO活性,减轻肺组织充血程度,减少肺泡间质炎性浸润,减轻肺泡壁水肿。各组大鼠肺部炎症因子检测也表明,脓毒症组大鼠12~48小时肺部炎症因子TNF-α、IL-6水平逐渐增高。而予以罗格列酮治疗后,TNF-α、IL-6水平有明显减低。这一实验结果提示,罗格列酮在盲肠结扎穿孔导致的脓毒症大鼠肺损伤中具有明确的抑制炎症介质释放,减轻炎症反应的作用。
为了明确罗格列酮在减轻脓毒症炎症反应的同时对血糖的影响情况,本实验同时检测了各组大鼠的血糖,研究发现,三组大鼠各时间点血糖无明显差异,未因罗格列酮降糖作用而出现低血糖。我们分析其原因可能是脓毒症组大鼠炎症因子水平增加最高,全身炎症反应导致的应激最为强烈,此时大鼠摄食基本停止,机体血糖水平依靠应激性升高维持在正常。ROSI组大鼠炎症反应相对较轻,可以适当摄食,罗格列酮对血糖降低的影响通过大鼠摄食及炎症应激所导致的升高得到调控,因此血糖也维持在正常范围。假手术组大鼠基本无明显炎症反应,摄食正常,血糖稳定在正常水平。当然,其确切的血糖调控机制还有待进一步实验研究阐明。
综上所述,本研究表明,罗格列酮能够降低脓毒症大鼠肺组织炎症因子IL-6、TNF-αmRNA的表达,减轻炎症反应。但对大鼠血糖无明显影响且不会导致低血糖发生。本研究可能为罗格列酮的临床应用及脓毒症的药物治疗提供新的思路。
[1] Balk RA.Systemic inflammatory response syndrome (SIRS):where did it come from and is it still relevant today[J].Virulence,2014,5(1):20-26.
[2] Schorr CA,Zanotti S,Dellinger RP.Severe sepsis and septic shock:management and performance improvement[J].Virulence,2014,5(1):190-199.
[3] Fry DE.Sepsis,systemic inflammatory response,and multiple organ dysfunction:the mystery continues[J].Am Surg,2012,78(1):1-8.
[4] Celinski K,Dworzanski T,Korolczuk A,et al.Effects of peroxisome proliferator-activated receptors-gamma ligands on dextran sodium sulphate-induced colitis in rats[J].J Physiol Pharmacol,2011,62(3):347-356.
[5] Zhao Y,Huang Y,He J,et al.Rosiglitazone,a peroxisome proliferator-activated receptor-gamma agonist,attenuates airway inflammation by inhibiting the proliferation of effector T cells in a murine model of neutrophilic asthma[J].Immunol Lett,2014,157(1-2):9-15.
[6] Remick DG,Newcomb DE,Bolgos GL,et al.Comparison of the mortality and inflammatory response of two models of sepsis:lipopolysaccharide vs.cecal ligation and puncture[J].Shock,2000,13(2):110-116.
[7] Li Y,Hou M,Wang JG,et al.Changes of lymph metabolites in a rat model of sepsis induced by cecal ligation and puncture[J].J Trauma Acute Care Surg,2012,73(6):1545-1552.
[8] Gada E,Owens AW,Gore MO,et al.Discordant effects of rosiglitazone on novel inflammatory biomarkers[J].Am Heart J,2013,165(4):609-614.
[9] Belvisi MG,Hele DJ.Peroxisome proliferator-activated receptors as novel targets in lung disease[J].Chest,2008,134(1):152-157.
[10] Denning GM,Stoll LL.Peroxisome proliferator-activated receptors:potential therapeutic targets in lung disease[J].Pediatr Pulmonol,2006,41(1):23-34.
[11] Soskic SS,Dobutovic BD,Sudar EM,et al.Peroxisome proliferator-activated receptors and atherosclerosis[J].Angiology,2011,62(7):523-534.
[12] Celinski K,Dworzanski T,Fornal R,et al.Comparison of anti-inflammatory properties of peroxisome proliferator-activated receptor gamma agonists rosiglitazone and troglitazone in prophylactic treatment of experimental colitis[J].J Physiol Pharmacol,2013,64(5):587-595.
EffectofRosiglitazoneontheBloodGlucoseandPulmonaryInflammationinSepticRats
ZHOU Lingzhi,ZHANG Yi,KANG Ting,et al
(DepartmentofPediatrics,theFirstAffiliatedHospital,UniversityofSouthChina,Hengyang421001,Hunan,China)
ObjectiveTo explore the effect of rosiglitazone on the control of blood glucose and pulmonary inflammation in septic rats.MethodsThe model of septic rat was established by ligation and puncture on the colon.36 SD rats were randomly divided into three groups,they were sepsis group,sepsis with rosiglitazone intervention group (ROSI 0.3 mg/kg) and sham-operated group,12 rats in each group.Blood glucose was tested 12 and 24 hours after intervention.IL-6,TNF-α expression level in lung tissue were detected by quantitative PCR.Neutrophil aggregation status was observed by HE staining and myeloperoxidase (MPO) activity detection.6 rats were executed in each time.ResultsCompared with sham-operated group,TNF-α and IL-6 mRNA expression level in sepsis group were obviously increased.The permeability of lung microvascular,thickness of alveolar wall,edema of interstitial and activity of MPO were significantly enhanced in sepsis group (P<0.05);Compared with sepsis group,the inflammatory cytokines expression level and the degree of lung inflammation in rosiglitazone intervention group were significantly reduced (P<0.05).There were no differences in blood glucose level between three groups.(P>0.05).ConclusionRosiglitazone can inhibit the expression of TNF-α and IL-6 and reduce inflammation response in septic lung tissue without influence on blood glucose.It has certain effect on septic lung injure.
rosiglitazone; sepsis; lung; inflammation
10.15972/j.cnki.43-1509/r.2015.04.008
2014-06-22;
2015-03-013
*通讯作者,E-mail:lingzhi.zhou@163.com.
R631
A
(此文编辑:秦旭平)
