阿托伐他汀对血脂异常兔血清和脂肪组织脂联素的影响
2015-12-28,,,
, ,,
(1.南华大学第一临床学院心血管内科,湖南 衡阳 421001;2.湖南环境生物职业技术学院护理学院内科教研室)
·基础医学·
阿托伐他汀对血脂异常兔血清和脂肪组织脂联素的影响
刘健1,2,吴洁1,李群芳2,罗文2
(1.南华大学第一临床学院心血管内科,湖南 衡阳 421001;2.湖南环境生物职业技术学院护理学院内科教研室)
目的观察阿托伐他汀干预下血脂异常兔血清脂联素的水平以及脂肪组织过氧化物酶增殖体激活受体γ(PPARγ)和脂联素分泌量的变化,推测阿托伐他汀抗动脉粥样硬化的可能机制。方法将15只纯种新西兰大白兔随机分为3组进行血脂造模。造模结束后,留取兔主动脉标本并切片做HE染色,观察动脉粥样硬化斑块的变化;取腹股沟皮下脂肪组织称量,并进行脂肪组织孵育;应用逆转录聚合酶链反应技术测定脂肪细胞过氧化物酶增殖体激活受体mRNA和脂联素mRNA的表达;酶联免疫吸附试验测定血清及腹股沟脂肪细胞提取液中脂联素浓度。结果阿托伐他汀组兔主动脉粥样斑块面积明显低于高胆固醇组(P<0.05);高胆固醇组兔血清低密度脂蛋白胆固醇、血清总胆固醇浓度明显高于对照组(P<0.05);阿托伐他汀药物治疗后能明显降低兔血清低密度脂蛋白胆固醇以及总胆固醇浓度(P<0.05);高胆固醇组兔血清脂联素浓度和脂肪组织分泌的脂联素浓度较对照组低(P<0.05);阿托伐他汀药物治疗后能明显升高血清脂联素浓度并提高脂肪组织分泌脂联素的浓度(与高胆固醇组比较,P<0.05);血清脂联素浓度与脂肪组织分泌的脂联素浓度呈正相关(P<0.05);RT-PCR结果显示高胆固醇组脂肪组织过氧化物酶增殖体激活受体mRNA和脂联素mRNA表达低于对照组(P<0.05);阿托伐他汀组脂肪组织过氧化物酶增殖体激活受体mRNA和脂联素mRNA的表达高于高胆固醇组(P<0.05)。结论阿托伐他汀能上调血脂异常兔脂肪组织过氧化物酶增殖体激活受体γ和脂联素mRNA表达从而升高血清和脂肪组织脂联素的分泌水平,这可能是阿托伐他汀抗动脉粥样硬化作用的多效性机制之一。
血脂异常兔; 阿托伐他汀; 脂联素; 过氧化物酶增殖体激活受体γ
脂联素(adiponectin,APN)是由脂肪组织分泌的一种脂肪因子,脂联素在体内的生理作用主要是抑制动脉粥样硬化,增加胰岛素敏感性,调节糖脂代谢[1];此外,脂联素还有重要的抗炎、血管保护作用[2]。过氧化物酶增殖体激活受体γ(peroxisome proliferation activated receptor gamma,PPARγ)是一种核转录因子,是核受体超家族成员之一,1990年首次发现PPARγ在脂肪细胞的分化中起重要的调控作用,又称之为脂肪激活转录因子[3],PPARγ是体内糖与脂质代谢的关键调节因子,且与炎症、心血管疾病、糖尿病及肿瘤等多种疾病密切相关。阿托伐他汀是有明显的调脂和改善胰岛素抵抗的一种他汀类药物,是冠心病、脑血管疾病的一级治疗药物[4-5]。阿托伐他汀可升高血清APN水平,但是否通过增加脂肪组织合成PPARγ从而增加APN分泌这条途径尚不清楚。本研究通过观察阿托伐他汀干预下血脂异常兔腹股沟脂肪组织PPARγ表达变化以及对APNmRNA表达和APN分泌的影响,试阐明阿托伐他汀升高血清APN浓度的可能机制。
1 材料与方法
1.1材料15只3月龄的健康新西兰纯种雄性大白兔(南华大学实验动物中心提供);阿托伐他汀钙片(北京嘉林药业股份有限公司);胆固醇(上海耀景助剂有限公司);DMEM/HamsF12培养液(Gibco公司);10%胎牛血清(杭州四季青生物工程材料公司);兔子APN ELISA试剂盒(上海朗顿生物科技有限公司);TotalRNA提取试剂盒(TRIzol)(omega);PCR扩增试剂盒(上海生物工程技术有限公司)。
1.2血脂异常兔模型建立15只新西兰大白兔,平均体重2.0 kg,单笼喂养10天后,随机分3组,分别为正常对照组、高胆固醇组、高脂+阿托伐他汀组(简称阿托伐他汀组)。每日总食量约为125 g,单笼饲养,所给饮食如下,饮水不限。正常对照组,5只普通饮食8周作对照;高胆固醇组,5只高脂饮食(2%胆固醇和6%猪油)喂养8周;阿托伐他汀组,5只高脂饮食(2%胆固醇和6%猪油)喂养4周,再高脂饮食+他汀类药物(阿托伐他汀每天2.5 mg/kg)喂养4周,他汀类药物混入高脂饮食中并观察它们吃完。
1.3脂肪组织的培养3组兔喂养8周,10%水合氯醛5 mL肌肉注射麻醉。无菌条件下用无菌手术剪取兔双腹股沟皮下脂肪组织,一侧脂肪组织置于无菌去酶EP管内,-70 ℃冰箱冻存,备用逆转录聚合酶链反应(reverse transcriptase polymerase chain reaction,RT-PCR);另一侧脂肪组织用于培养,具体方法见后述。参照脂肪组织培养有关方法,在无菌条件下取兔腹股沟皮下脂肪组织1 g,剪成20块,每块50 mg,经冷PBS缓冲液清洗3次,剪碎置于EP管内。按50 mg脂肪组织加1 mL培养液比例置于培养板内,培养液为DMEM/F12,其中含有10%热灭活胎牛血清、青霉素(200 U/mL)、链霉素(50 μg/mL),然后放入5%CO2培养箱中孵育12 h,收集组织上清液,放入-70 ℃冰箱保存待测。
1.4血脂的测定分别在饲养前及饲养至第4周和第8周时,在严格无菌条件下经兔耳中央动脉取动脉血5 mL置于抗凝管中,静置30 min后在离心机上4 000 r/min离心15 min,用移液枪取血清1 000 μL待测。在日立7600-020全自动生化仪上测定兔TC、TG、LDLC、HDLC的浓度。
1.5脂肪组织逆转录聚合酶链反应使用TRIzol提取试剂盒抽提脂肪组织总RNA,采用紫外分光光度计测量其浓度。取纯化后的总RNA 5 μL进行RT反应。每一标本取RT产物4 μL进行PCR反应。兔APN基因序列(基因编号DQ334867)[7]上下游引物为5′-AAC CAC TAT GAC AGC ACC ACG-3′和 5′-AGA GAA GGA AGC CAG TGG AGA-3′,产物长度297 bp;兔脂肪组织中PPARγ引物基因序列(基因收录号AF013266)[6]上下游引物5′-TGC AGG AGC AGA GCA AAG AAG-3′和5′-GAG GCC AGC ATG GTG TAG ATG-3′,产物长度为187 bp;同时以GAPDH为反应内参,在Gnebank中查找到兔内参照GAPDH基因序列[7]上下游引物:5′-GCG CCT GGT CAC CAG GGC TGC TT-3′和5′-TGC CGA AGT GGT CGT GGA TGA CCT-3′,产物长度为465 bp,引物由上海生物工程技术有限公司合成,扩增片段为297 bp.反应参数为94 ℃预变性2 min,94 ℃变性30 s,58 ℃ 退火30 s,72 ℃延伸 10 min,共30循环,72 ℃终止延伸10 min,于-20 ℃保存。取PCR引物4 μL经1.0%琼脂糖凝胶电泳,溴化乙锭染色,照相并经光密度仪扫描分析,以内对照吸光度值进行标准校正,计算出APN的相对量。
1.6脂联素水平的检测采用酶联免疫吸附试验(双抗体夹心法)检测血清及脂肪细胞上清液中脂联素(APN)水平,其批内、批间的变异系数均<10%,每份样品均设复孔。

2 结 果
2.1三组兔主动脉血管斑块面积的变化第8周3组兔主动脉粥样斑块面积(肉眼所见):对照组0.01±0.02 mm2,高胆固醇组6.20±0.43 mm2,阿托伐他汀组4.90±0.28 mm2,与高胆固醇组相比,阿托伐他汀组斑块面积明显减小,两者相比有统计学意义(P<0.05)。各组兔主动脉HE染色结果显示:对照组动脉血管内皮完整;高胆固醇组血管内膜明显增厚,出现纤维帽斑块,内膜中大量巨噬细胞浸润,内有脂质沉积,形成泡沫细胞,并伴有中层平滑肌细胞增生;阿托伐他汀组内膜增厚和脂质沉积较高胆固醇组减轻(图1,表1)。

图1 三组兔主动脉血管HE染色图片(HE,ⅹ100)
表1三组兔脂质斑块面积的比较(mmol/L)
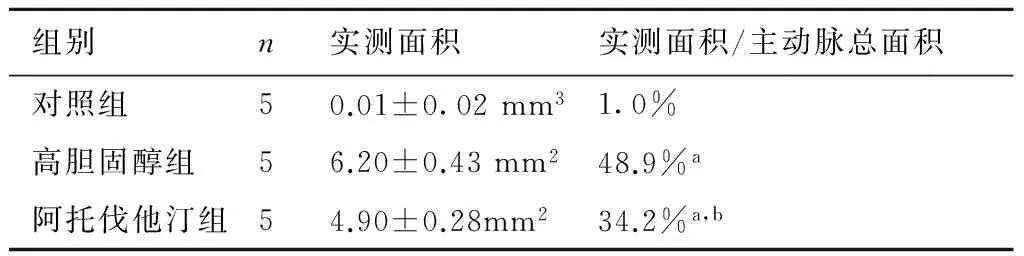
组别n实测面积实测面积/主动脉总面积对照组50.01±0.02mm31.0%高胆固醇组56.20±0.43mm248.9%a阿托伐他汀组54.90±0.28mm234.2%a,b
与对照组比较,a:P<0.05;与高胆固醇组比较,b:P<0.05
2.2三组兔血脂的变化三组兔0周时胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low denitylipoprotein cholesterol,LDLC)、高密度脂蛋白胆固醇(high denity lipoprotein cholesterol,HDLC)、甘油三酯(triglyceride,TG)浓度组间无统计学差异(P>0.05)。高脂饮食4周后,高胆固醇组和阿托伐他汀组TC、LDLC浓度均明显高于对照组(P<0.05);阿托伐他汀组治疗4周后TC和LDLC浓度较高胆固醇组明显减低,有统计学差异(P<0.05)(表2)。
表2三组兔血脂水平的比较(mmol/L)

血脂时间对照组(n=5)高胆固醇组(n=5)阿托伐他汀组(n=5)TC0周1.40±0.151.35±0.141.45±0.124周1.45±0.1427.39±2.83a28.60±2.48a8周1.51±0.1728.80±2.20a15.40±3.53abLDLC0周0.64±0.180.73±0.190.67±0.134周0.66±0.1218.74±2.75a19.45±2.01a8周0.63±0.1419.92±2.70a10.07±1.53abHDLC0周0.62±0.070.70±0.100.64±0.094周0.63±0.060.67±0.050.69±0.148周0.68±0.110.70±0.080.73±0.13TG0周1.23±0.131.16±0.141.14±0.154周1.34±0.181.35±0.121.41±0.198周1.41±0.111.48±0.171.32±0.16
与对照组比较,a:P<0.05;与高胆固醇组比较,b:P<0.05
2.3血清及脂肪组织APN浓度的变化高胆固醇组兔血清脂联素浓度和脂肪组织分泌的脂联素浓度较对照组低(P<0.05);阿托伐他汀药物治疗后能明显升高血清脂联素浓度并提高脂肪组织分泌脂联素的浓度(与高胆固醇组比较,P<0.05)(表3)。
2.4血清APN与脂肪组织APN的相关性分析
相关性分析显示血清APN水平与脂肪组织APN的分泌水平呈明显正相关(n=15,r=0.882,P<0.05)(图2)。
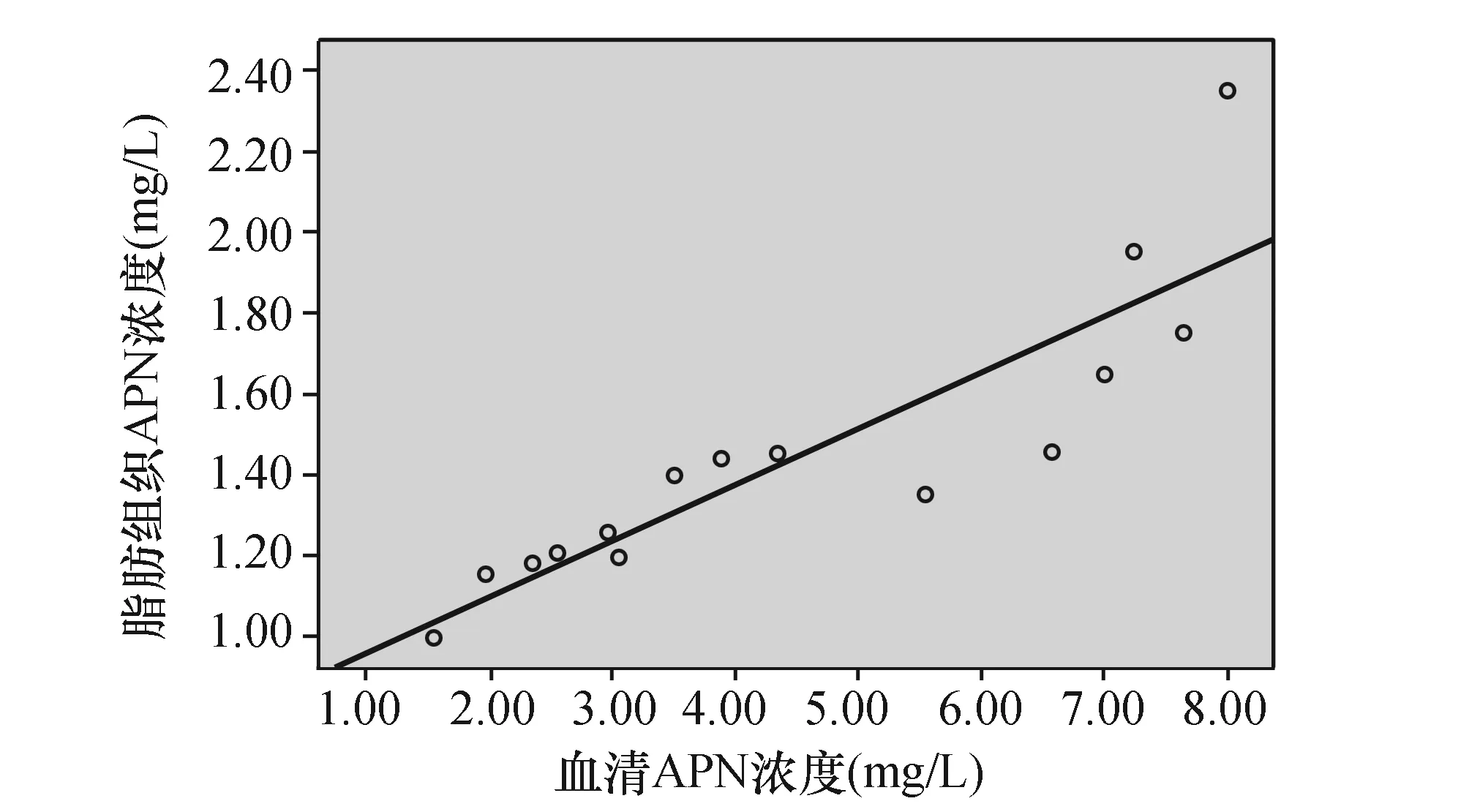
图2 第8周血清与脂肪组织APN浓度的相关性(呈正相关)
表3各组兔血清及脂肪组织APN水平的变化(mg/L)
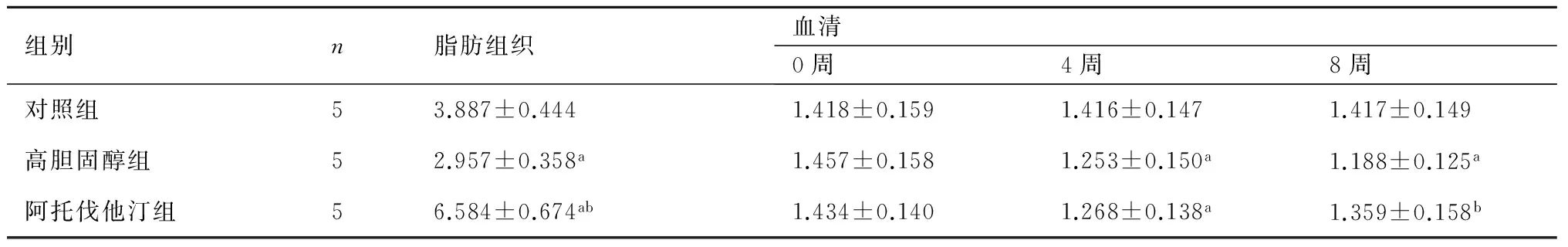
组别n脂肪组织血清0周4周8周对照组53.887±0.4441.418±0.1591.416±0.1471.417±0.149高胆固醇组52.957±0.358a1.457±0.1581.253±0.150a1.188±0.125a阿托伐他汀组56.584±0.674ab1.434±0.1401.268±0.138a1.359±0.158b
与对照组比较,a:P<0.05;与8周时高胆固醇组比较,b:P<0.05
2.5脂肪组织PPARγmRNA与APNmRNA表达的变化
2.5.1 脂肪组织PPARγmRNA的表达 三组兔脂肪组织PPARγmRNA均有表达,对照组为0.69±0.04,高胆固醇组为0.65±0.28,阿托伐他汀组为0.82±0.52,高胆固醇组PPARγmRNA的表达较对照组降低(P<0.05),而阿托伐他汀组脂肪组织细胞中PPARγmRNA的表达较高胆固醇组升高(P<0.05)(图3)。
2.5.2 脂肪组织APN mRNA表达 三组兔脂肪组织APNmRNA均有表达,对照组为0.82±0.05,高胆固醇组为0.79±0.03,阿托伐他汀组为0.95±0.04。高胆固醇组APNmRNA的表达较对照组降低(P<0.05),而阿托伐他汀组脂肪组织APNmRNA的表达较高胆固醇组升高(P<0.05)(图4)。
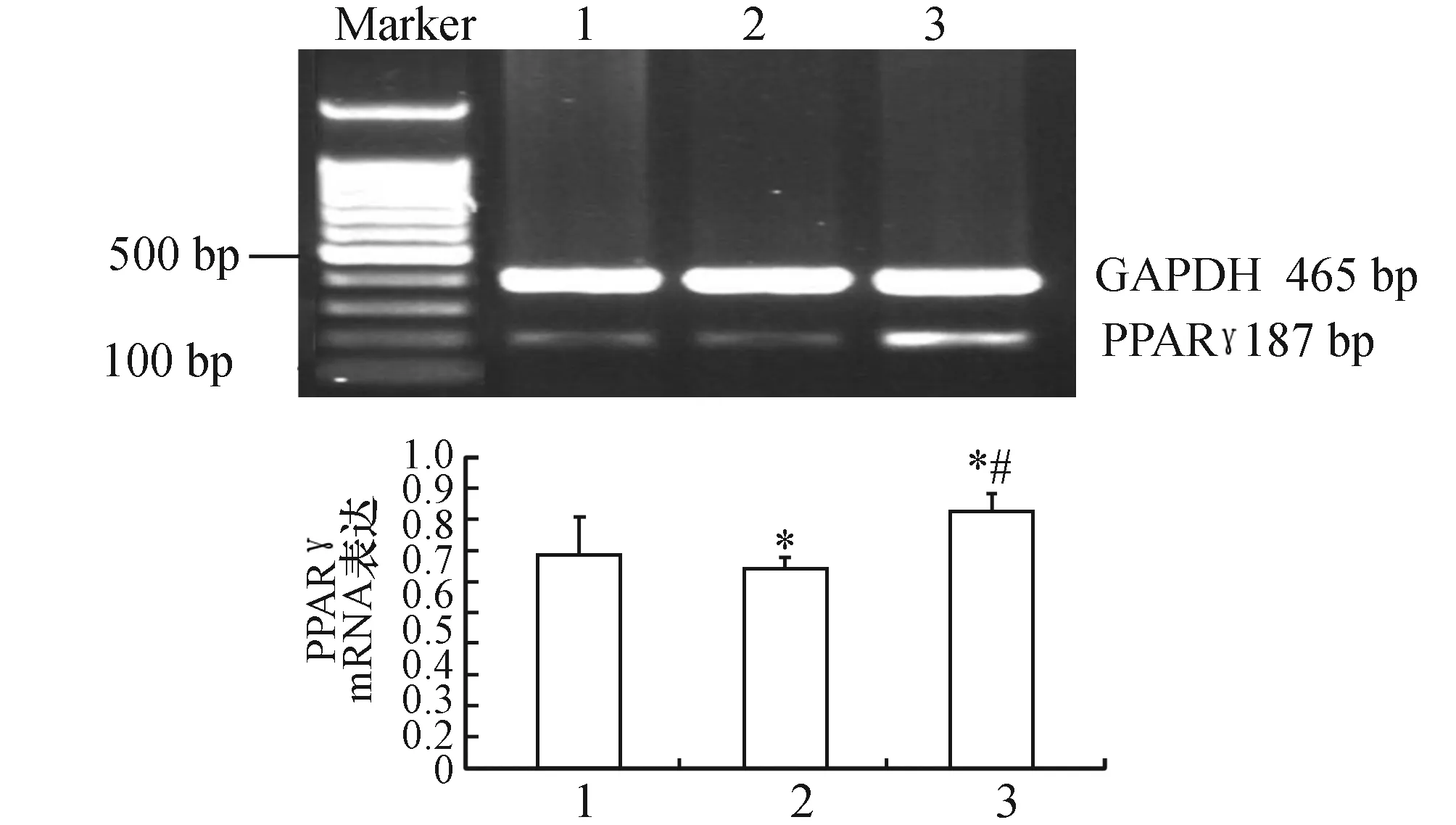
图3 脂肪组织PPARγmRNA的表达 1:对照组;2:高胆固醇组;3:阿托伐他汀组. 与对照组比较,*:P<0.05;与高胆固醇组比较,#:P<0.05
3 讨 论
众多的研究结果证明APN在人体的脂质代谢中发挥着重要影响,并在能量的平衡与控制方面起着重要的作用。本研究发现高胆固醇组脂肪组织PPARγmRNA以及APNmRNA的表达较对照组均明显降低,阿托伐他汀组脂肪组织PPARγmRNA以及APNmRNA的表达较高胆固醇组均明显升高;高胆固醇组血清APN水平和脂肪组织APN的分泌较高胆固醇组明显减少,而阿托伐他汀组血清APN水平和脂肪组织APN的分泌较高胆固醇组明显升高。
由于血清APN与脂肪组织APN浓度呈正相关,显示血清APN主要来源于脂肪组织APN的分泌,提示高胆固醇饮食有可能通过降低脂肪组织PPARγmRNA的表达并进一步调控脂肪组织APNmRNA的表达及分泌来降低血清APN水平;阿托伐他汀有可能通过升高脂肪组PPARγmRNA的表达并进一步调控脂肪组织APNmRNA的表达及分泌来升高血清APN水平。
总之,本研究发现阿托伐他汀除了通过抑制HMG-CoA还原酶的活性,发挥调脂抗动脉粥样硬化作用外,还能明显上调高脂血症兔皮下脂肪组织PPARγ和APNmRNA的表达,增加脂肪组织APN的分泌水平及血清APN浓度,这一作用可能是阿托伐他汀药物抗动脉粥样硬化的另一条重要作用机制。
[1] Van Kruijsdijk RC,van der wail E,Visseren FL.Obesity and cancer:the role of dysfunctional adipose tissue[J].Cancer Epidemiol Bio markers Prev,2009,18(10):2569-2578.
[2] 谢春燕,李强翔.脂联素在肥胖、胰岛素抵抗中作用的研究进展[J].中国老年学杂志,2011,6(31):2141-2142.
[3] 段叶辉,印遇龙,李丽立,等.n-3 PUFAs对脂质代谢和炎症-免疫的调节机制[J].生物技术通报,2012,8(3):34-40.
[4] 陈蓉,王埮,赵振强,等.急性脑梗死患者血清脂联素水平及阿托伐他汀干预的影响[J].中国现代医学杂志,2012,15(16):77-79.
[5] 何伟.阿托伐他汀的药理及临床应用效果分析[J].中国现代药物应用,2012,6(4):9-10.
[6] 杜克炜,吴洁,谷祥任,等.阿托伐他汀对血脂异常兔血清和脂肪组织分泌脂肪细胞型脂肪酸结合蛋白的影响[J].临床心血管病杂志,2009,5(25):371-373.
[7] 董劭壮,赵水平,吴智鸿,等.姜黄素对兔皮下脂肪细胞脂联素分泌的影响[J].医学临床研究,2007,24(8)1297-1299.
[8] 楚罗湘,姜德谦,刘照云.吡格列酮对高脂饮食兔主动脉LOX-1表达的影响[J].中国现代医学杂志,2008,18(10):1342-1345.
TheInfluencesofAtorvastatinonLevelsofAdiponectininSerumandAdiposeTissueofDyslipidemiaRabbits
LIU Jian,WU Jie,LI Qunfang,et al
(DepartmentofCardiology,theFirstClinicalCollegeofUniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo observe the changes of serum adiponectin(APN)level,peroxisome proliferation activated receptor gamma(PPARγ) and APN secretion in adipose tissues of dyslipidemia rabbits under atorvastatin intervention and to elaborate the possible anti-atherosclerosis mechanism of atorvastatin.MethodsFifteen pure New Zealand white rabbits were randomly divided into three groups to make lipid models.Then the Aortic specimens were obtained and sectioned to make HE staining and the atherosclerotic plaque changes were observed.The inguinal subcutaneous adipose tissues were obtained and weighed and incubation of adipose tissues was made.Reverse transcriptase polymerase chain reaction (RT-PCR) technology was applied to determine the expression of peroxisome proliferation activated receptor mRNA and adiponectin mRNA in fat cells.Enzyme linked immunosorbent assay was applied to determine the concentration of serum and the adiponectin in the extract from the inguinal fat cells.ResultsThe aortic atherosclerotic plaque area in the rabbits of the atorvastatin group was significantly lower than that in the rabbits of the high cholesterol group(P<0.05).The concentration of the low density lipoprotein cholesterol (LDL-C) and the total cholesterol (TC) in the serum of the rabbits of the high cholesterol group was significantly higher than that in the contrast group(P<0.05).Atorvastatin drug intervention for 4 weeks can significantly reduce the concentration of the low density lipoprotein cholesterol (LDL-C) and the total cholesterol (TC) in the serum of the rabbits (compared before and after the treatment,P<0.05).Serum APN concentration and the concentration of the APN secreted from adipose tissues in the rabbits of the high cholesterol group were lower than those in the contrast group (P<0.05).Atorvastatin drug intervention could significantly raise serum APN concentration and the concentration of the APN secreted from adipose tissues (compared with high cholesterol group,P<0.05).The serum APN concentration and the concentration of the APN secreted from adipose tissues were positively correlated(P<0.05).RT-PCR results showed that the expression of peroxisome proliferation activated receptor mRNA and adiponectin mRNA in fat cells of the rabbits in the high cholesterol group was lower than that in the contrast group(P<0.05) and the expression of peroxisome proliferation activated receptor mRNA and adiponectin mRNA in the atorvastatin group was higher than that in the high cholesterol group(P<0.05).ConclusionAtorvastatin increases the expression of peroxisome proliferation activated receptor gamma(PPARγ)and adiponectin mRNA in the adipose tissues of dyslipidemia rabbits,thus improving the secreting level of serum and adiponectin in fat cells,which may be one of the pleiotropic anti-atherosclerotic mechanisms of atorvastatin.
dyslipidemia rabbit; atorvastatin; adiponectin; peroxisome proliferation activated receptor gamma
10.15972/j.cnki.43-1509/r.2015.04.007
2014-09-11;
2015-04-15
衡阳市科技局基金项目(2013KS65).
R54
A
(此文编辑:朱雯霞)
