PF4通过NF-κB上调巨噬细胞MMP-9表达
2015-12-28,,2*,,
, ,2*,,
(1.南华大学心血管病研究所暨动脉硬化学湖南省重点实验室,湖南 衡阳 421001;2.宜昌市中心人民医院病理科)
·基础医学·
*并列第一作者,E-mail:hongapril@sina.com.
PF4通过NF-κB上调巨噬细胞MMP-9表达
赵战芝1,何钒1,2*,唐雅玲1,孙慧1
(1.南华大学心血管病研究所暨动脉硬化学湖南省重点实验室,湖南 衡阳 421001;2.宜昌市中心人民医院病理科)
目的观察血小板因子4(PF4)是否通过核因子κB (NF-κB)上调THP-1单核源性巨噬细胞基质金属蛋白酶9(MMP-9)表达。方法佛玻酯诱导THP-1细胞分化成巨噬细胞。巨噬细胞分别在NF-κB抑制剂(PDTC)缺乏或存在情况下与溶媒或PF4(100 μg/L)孵育一定时间,RT-PCR检测MMP-9 mRNA水平;同时,巨噬细胞与PF4(25~200 μg/L)单独或结合Toll样受体4(TLR4)阻断剂(抗体 HTA125,anti-TLR4)孵育,ELISA法检测NF-κB含量。结果PF4较对照组上调巨噬细胞MMP-9 mRNA水平。而NF-κB抑制剂抑制PF4诱导的巨噬细胞MMP-9表达上调。PF4呈浓度依赖性增加巨噬细胞的NF-κB含量,最大效应浓度为100 μg/L。TLR4阻断剂逆转PF4诱导的巨噬细胞NF-κB含量增加。结论PF4可能通过NF-κB上调巨噬细胞MMP-9的表达。TLR4可能是PF4-NF-κB通路中NF-κB的上游信号分子。
血小板因子4; 基质金属蛋白酶9; 巨噬细胞; 核因子κB; 动脉粥样硬化
动脉粥样硬化(atherosclerosis,As)是一种发生于大、中等动脉壁的慢性炎症性病变。随着As斑块的形成或破裂,可引起靶器官缺血性疾病甚至急性临床事件的发生。炎症在As中起重要作用[1]。业已证明,血小板是炎症和As的重要纽带。活化的血小板通过释放多种活性因子影响As发展[2]。其中,血小板因子4(platelet factor 4,PF4)的含量最丰富,且已证实可促进As形成[3],但机制尚未阐明。基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)做为炎性细胞因子在血管重构、斑块的不稳定性及其破裂中起着重要作用[4]。核因子κB (nuclear factor kappa B,NF-κB) 是‘Rel’家族中的转录因子,活化后介导的信号转导通路参与As的发生发展,包括斑块形成、斑块不稳定及斑块破裂等过程[5]。Toll样受体4(Toll-like receptor 4,TLR4)在天然免疫中可介导细胞跨膜信号传导。文献[6]报道,TLR4/NF-κB信号参与炎症反应。在高脂饲喂的动脉粥样硬化兔模型,TLR4/NF-κB信号通路被激活,血清炎症因子分泌增加。在脂多糖(lipopolysaccharide,LPS)刺激的单核细胞,TLR4/NF-κB的活化诱导白细胞介素-1β(interleukin-1β,IL-1β)、IL-6 和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)分泌[7]。在PF4处理的内皮细胞,E-选择素的表达有赖于NF-κB 的活化[8]。课题组前期研究发现PF4可上调巨噬细胞MMP-9表达,但机制尚未阐明[9]。因此,本研究探索TLR4和NF-κB是否参与PF4上调巨噬细胞MMP-9表达的信号转导,旨在探讨PF4对As斑块稳定性的影响及可能机制。
1 材料与方法
1.1 材料
重组人血小板因子4购自Peprotech公司,脂多糖购自上海捷瑞公司,胎牛血清购自杭州四季青生物研究所,RPMI1640培养基购自美国GIBCO公司,佛波脂(PMA)和NF-κB抑制剂吡咯烷二硫代氨基甲酸盐(pyrrolidine dithiocarbamate,PDTC)购自Sigma公司,TLR4抗体型阻断剂(单克隆抗体 HTA125,anti-TLR4)购自Biolegend公司,Trizol Reagent和引物分别从上海生物工程技术公司购买和合成,cDNA第一链合成试剂盒购自Fermentas公司,Taq PCR MasterMix以及DNA marker 购自北京天根公司,NF-κB ELISA试剂盒购自广州齐特科生物公司。THP-1单核细胞系购自上海细胞库。
1.2 细胞培养
THP-1单核细胞在含10%胎牛血清的RPMI1640培养基中,静置于37 ℃、5%CO2培养箱中培养。实验前,细胞用160 nmol/L PMA孵育24 h,使其诱导成为巨噬细胞。换无血清的RPMI1640培养基培养12 h,同步化后进行实验。为分析MMP-9表达,巨噬细胞在有或无NF-κB抑制剂PDTC(25 μg/mL)预处理30 min后,与溶媒(PBS)、PF4(100 μg/L)或LPS(阳性对照)孵育4 h;为检测NF-κB含量,巨噬细胞与PF4(0~200 μg/L)孵育12 h,或TLR4阻断剂HTA125 (25 μg/mL)预处理30 min后,再加入PF4继续孵育12 h。
1.3 RT-PCR反应
收集细胞,采用Trizol Reagent提取总RNA。每个样本取0.2 μg总RNA按cDNA第一链合成试剂盒说明书进行逆转录。用Taq PCR MasterMix试剂进行PCR循环:95 ℃温育5 min,95℃变性45 s,54 ℃退火45 s,72 ℃延伸1 min,共32个循环,72 ℃,继续延伸10 min,4 ℃冷却。反应结束后,取反应产物进行1.5%琼脂糖凝胶电泳,溴化乙锭染色,UVP型凝胶图像分析系统摄图。MMP-9和GAPDH产物大小依次为476 bp和240 bp。以各组目的基因与GAPDH基因灰度值比值代表目的基因mRNA的相对量。每组实验重复3次。
1.4 ELISA分析
按NF-κB ELISA试剂盒说明书进行。细胞处理好后,收集细胞培养上清液于4 ℃ 1 000 r/min离心8 min,吸取上清液。酶标板微孔中依次加入100 μL的标准品和样品。再于标准品和样品孔中加入50 μL的酶标记溶液;37 ℃孵育60 min;清洗后每孔加入底物A、B液,37 ℃避光反应15 min;加入终止液终止反应;于酶标仪450 nm波长下读取各孔的OD值,根据标准曲线计算NF-κB的含量,结果以μg/L表示。每组实验重复3次。
1.5 统计学分析
2 结 果
2.1 PF4上调THP-1源性巨噬细胞MMP-9 mRNA水平
如图1所示,静止的THP-1源性巨噬细胞有低丰度的MMP-9 mRNA表达,经PF4(100 μg/L)处理4 h后,巨噬细胞MMP-9 mRNA水平较对照组升高约1倍(P<0.001)。
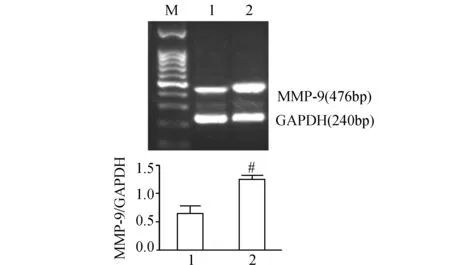
图1 PF4对巨噬细胞MMP-9 mRNA表达的影响(n=3) M:marker;1:对照组;2:PF4组. 与对照组比较,#:P<0.001
2.2 PF4升高THP-1源性巨噬细胞NF-κB的含量
为了探索PF4上调巨噬细胞MMP-9表达是否通过NF-κB信号环节,实验采用ELISA法检测PF4对THP-1源性巨噬细胞上清液中NF-κB含量的影响。结果显示,与PBS对照组比,不同浓度PF4(25~200 μg/L)处理巨噬细胞12 h后,NF-κB含量均升高,尤其以PF4 100 μg/L时最为显著,较对照组升高约78%(P<0.001,图2)。TLR4激活因子LPS也升高巨噬细胞NF-κB含量,但其程度略低于100 μg/L PF4组。
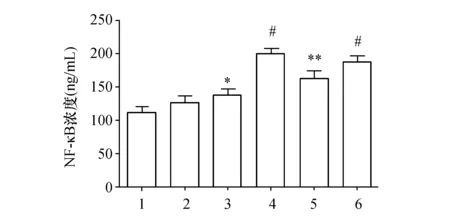
图2 不同浓度PF4对巨噬细胞NF-κB含量的影响(n=3)1:对照组;2:25 μg/L PF4组;3:50 μg/L PF4组;4:100 μg/L PF4组;5:200 μg/L PF4组;6:100 μg/L LPS组. 与对照组比较;*: P<0.05,**: P<0.01,#: P<0.001
2.3 NF-κB阻断剂逆转PF4诱导的THP-1源性巨噬细胞MMP-9 mRNA水平升高
为了证实NF-κB是PF4上调MMP-9 mRNA表达的信号环节,实验采用NF-κB抑制剂预处理细胞后,观察PF4对巨噬细胞MMP-9 mRNA水平的影响。结果显示,NF-κB抑制剂PDTC和PF4处理细胞后,其MMP-9 mRNA水平较PF4单独孵育组降低约19%(P<0.05,图3)。与上述结果一致的是,LPS/NF-κB抑制剂处理组也较LPS单独处理组明显下调MMP-9 的mRNA表达(P<0.05)。但NF-κB抑制剂单独孵育组对巨噬细胞MMP-9 mRNA表达无显著影响(P>0.05)。上述结果提示NF-κB可能是PF4上调MMP-9 mRNA表达的重要信号分子。
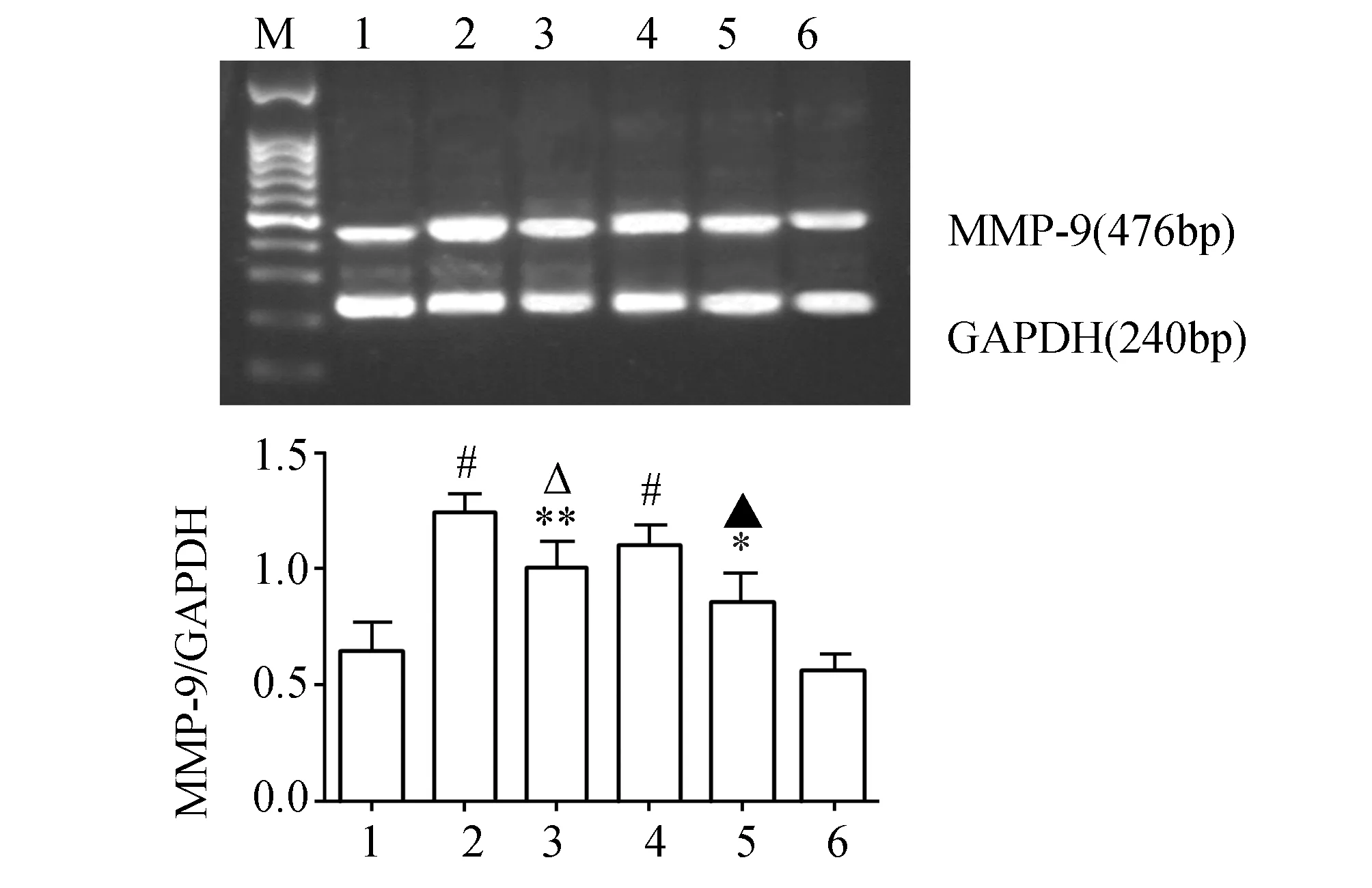
图3 25 μg/mL NF-κB抑制剂对100 μg/L PF4上调巨噬细胞MMP-9 mRNA表达的影响(n=3) M:marker;1:对照组;2:PF4组;3:PF4+NF-κ B组;4:100 μg/L LPS组;5: NF-κ B+LPS组;6:NF-κ B组. 与对照组比较,#:P<0.001,**:P<0.01,* :P<0.05;与PF4组比较,△:P<0.05;与LPS组比较,▲: P<0.05
2.4 TLR4阻断剂逆转PF4诱导的巨噬细胞NF-κB含量增加
为了进一步探索NF-κB与PF4、TLR4之间的内在关系,本实验观察了TLR4阻断剂对PF4上调巨噬细胞NF-κB含量的影响。如图4所示,经PF4与TLR4阻断剂处理后,巨噬细胞释放的NF-κB含量显著降低,较PF4单独孵育组降低约11%(P<0.05)。与此同时,LPS诱导的NF-κB含量增加也被TLR4阻断剂显著抑制(P<0.05)。以上结果提示,TLR4可能是PF4-NF-κB通路中NF-κB的上游信号分子。
3 讨 论
长期以来,血小板被认为在动脉粥样硬化的发生发展中发挥了至关重要的作用[2]。作为血小板活化的标记物及活化后释放的含量最丰富的活性因子之一,PF4已被证实不但存在于动脉粥样硬化早、晚期病变,而且促进动脉粥样硬化形成[10]。在 PF4-/-ApoE-/-小鼠,其主动脉根部和主动脉内膜面的动脉粥样硬化病变面积均较ApoE-/-小鼠显著减小[3]。在单核细胞,PF4可诱导细胞存活、表达细胞因子、产生氧自由基和粘附于受损的内皮[11];诱导外周血单核细胞募集到病变并分化为巨噬细胞[10];在巨噬细胞,PF4抑制CD163表达,诱导炎性巨噬细胞的形成[12];抑制LDL-R降解、促进巨噬摄取和酯化ox-LDL[13]。本实验表明,PF4上调巨噬细胞MMP-9 mRNA表达,其机制可能与NF-κB有关。结果显示:①PF4增加巨噬细胞的MMP-9mRNA水平;②NF-κB抑制剂削弱PF4诱导的MMP-9mRNA表达上调;③PF4增加巨噬细胞上清液NF-κB的含量;④TLR4阻断剂能显著逆转PF4诱导的巨噬细胞NF-κB含量增加。以上结果提示NF-κB是PF4上调巨噬细胞MMP-9表达的重要信号环节。
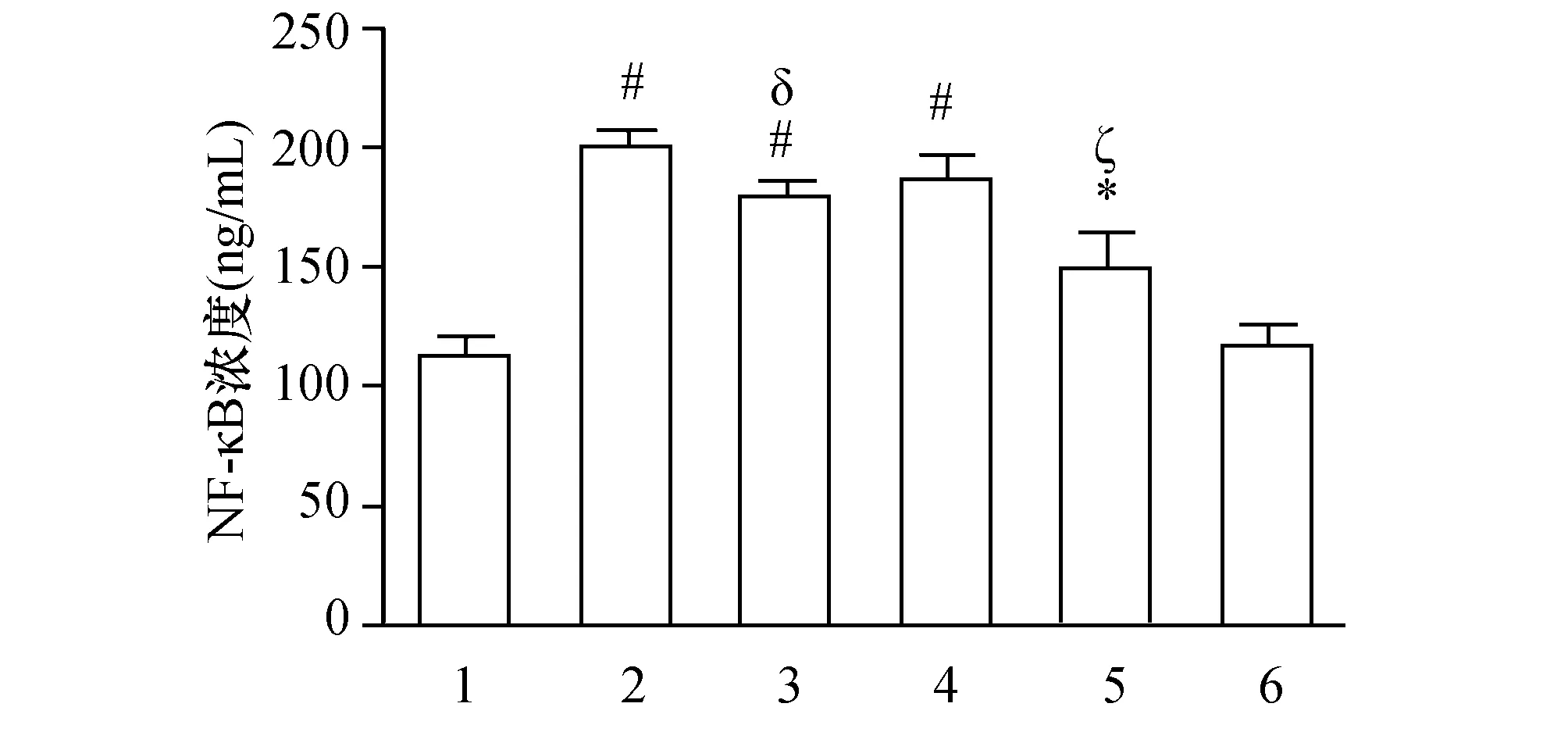
图4 TLR4阻断剂对PF4增加巨噬细胞NF-κB含量的影响(n=3) 1:对照组;2:PF4组;3:PF4+ TLR4阻断剂组;4:100 μg/L LPS组;5:TLR4阻断剂+LPS组;6:TLR4阻断剂组. 与对照组比较,#:P<0.001,*:P<0.05;与PF4组比较,:P<0.05;与LPS组比较,:ζ:P<0.05
细胞、细胞外基质和脂质在动脉内膜的积聚导致动脉粥样硬化斑块的发生发展。基质金属蛋白酶(MMPs)是一类可以降解和重组细胞外基质的酶类,参与动脉粥样硬化的病理生理过程。文献报道,动脉粥样硬化斑块破裂和随后的血栓栓塞与局部MMP-9的高表达和高活性相关;急性冠脉综合征患者的冠状动脉病变组织MMP-9表达和循环MMP-9水平均显著高于稳定心绞痛患者,且循环MMP-9水平与心血管风险显著相关;与此一致的还有,颈动脉疾病患者的循环MMP-9水平增高,他们的临床事件率也增高[14-15]。在血管重构期间,炎性细胞如巨噬细胞、肥大细胞和中性粒细胞是血管组织MMP-9的重要资源。多种炎性因子如TNF-α和IL-17等可诱导MMP- 9表达和活化[16]。课题组前期研究发现,25~200 μg/L的PF4均可诱导巨噬细胞MMP-9mRNA和蛋白表达上调,最大效应浓度为100 μg/L,且未出现细胞毒性作用[9]。本实验采用100 μg/L PF4处理巨噬细胞,可显著上调巨噬细胞MMP-9 mRNA水平,与前期结果一致。表明PF4可能通过促进MMP-9的表达,使斑块不稳定。但尚需进一步的在体实验以证实PF4是否上调动脉粥样硬化斑块MMP-9的表达。
NF-κB是一种具有多向转录功能的核转录因子,与许多免疫炎症相关基因表达密切相关。在As病变内,NF-κB主要存在于单核细胞、血管内皮细胞和血管平滑肌细胞。活化前,细胞质中的NF-κB与其抑制蛋白I κB以二聚体形式结合呈无活性状态。当细胞受到细胞因子、缺氧、病毒等一些因子的刺激时,IκB可磷酸化,后经泛素化-蛋白酶小体途径降解,使得NF-κB从IκB 复合物中释放出来,并由细胞质转入到细胞核,在此与NF-κB特异性结合位点结合,调控其靶基因转录[17]。业已证明,NF-κB对多种炎症细胞因子、粘附分子、趋化因子和生长因子等的表达起着至关重要的调控作用,参与As炎症过程中的多种信号转导通路[5]。本实验结果显示不仅PF4可升高巨噬细胞上清液中NF-κB的含量,而且NF-κB抑制剂可逆转PF4对MMP-9的诱导表达。表明NF-κB参与了PF4诱导巨噬细胞MMP-9表达的信号转导。有研究报道,细胞膜上的TLR4被LPS激活后,使NF-кB从细胞质转位至细胞核,从而诱导炎症反应[17]。本实验发现TLR4阻断剂能显著降低PF4诱升的巨噬细胞NF-κB含量,前期研究还发现TLR4阻断剂可逆转PF4上调巨噬细胞MMP-9表达[9]。结合上述实验结果表明,NF-κB是PF4- TLR4-通路的下游信号分子。
总之,现在的结果表明PF4通过增加巨噬细胞NF-κB的含量,从而促进MMP-9基因的转录。
[1] Libby P.Inflammation in atherosclerosis[J].Nature,2002,420(6917):868-874.
[2] Gleissner CA.Platelet-derived chemokines in atherogenesis:what’s new[J]?Curr Vasc Pharmacol,2012,10(5):563-569.
[3] Sachais BS,Turrentine T,Dawicki McKenna JM,et al.Elimination of platelet factor 4 (PF4) from platelets reduces atherosclerosis in C57Bl/6 and apoE-/- mice[J].Thromb Haemost,2007,98(5):1108-1113.
[4] Chen Q,Jin M,Yang F,et al.Matrix metalloproteinases:inflammatory regulators of cell behaviors in vascular formation and remodeling[J].Mediators Inflamm,2013,2013:928315.
[5] Pamukcu B,Lip GY,Shantsila E.The nuclear factor--kappa B pathway in atherosclerosis:a potential therapeutic target for atherothrombotic vascular disease[J].Thromb Res,2011,128(2):117-123.
[6] Hu ZP,Fang XL,Fang N,et al.Melatonin ameliorates vascular endothelial dysfunction,inflammation,andatherosclerosis by suppressing the TLR4/NF-κB system in high-fat-fed rabbits[J].J Pineal Res,2013,55(4):388-398.
[7] Yang S,Li R,Qu X,et al.Fosinoprilat alleviates lipopolysaccharide (LPS)-induced inflammation by inhibiting TLR4/NF-κB signaling in monocytes[J].Cell Immunol,2013,284(1-2):182-186.
[8] Yu G,Rux AH,Ma P,et al.Endothelial expression of E-selectin is induced by the platelet-specific chemokine platelet factor 4 through LRP in an NF-kappaB-dependent manner[J].Blood,2005,105(9):3545-3551.
[9] 赵战芝,何钒,唐雅玲,等.血小板因子4经Toll样受体4上调巨噬细胞基质金属蛋白酶9表达[J].中国动脉硬化杂志,2014,22(8):769-773.
[10] Aidoudi s,Bikfalvi A.Interaction of PF4 (CXCL4) with the vasculature:a role in atherosclerosis and angiogenesis[J].Thromb Haemost,2010,104(5):941-948.
[11] Kasper B,Winoto-Morbach S,Mittelst ddt J,et al.CXCL4-induced monocyte survival,cytokine expression,and oxygen radical formation is regulated by sphingosine kinase 1[J].Eur J Immunol,2010,40(4):1162-1173.
[12] Gleissner CA,Shaked I,Erbel C,et al.CXCL4 downregulates the atheroprotective hemoglobin receptor CD163 in human macrophages[J].Circ Res,2010,106(1):203-211.
[13] Gleissner CA,Ley K.CXCL4 in atherosclerosis:possible roles in monocyte arrest and macrophage foam cell formation[J].Thromb Haemost,2007,98(5):917-918.
[14] Fukuda D,Shimada K,Tanaka A,et al.Comparison of levels of serum matrix metalloproteinase-9 in patients with acute myocardial infarction versus unstable angina pectoris versus stable angina pectoris[J].Am J Cardiol,2006,97(2):175-180.
[15] Lim HS,Lip GY.Circulating matrix metalloproteinase-9 levels in atherosclerotic vascular disease:a possible measurement of systemic or specific disease pathophysiology[J]?J Intern Med,2008,263(6):620-622.
[16] Siasos G,Tousoulis D,Kioufis S,et al.Inflammatory mechanisms in atherosclerosis:the impact of matrix metalloproteinases[J].Curr Top Med Chem,2012,12(10):1132-1148.
[17] Hoesel B,Schmid JA.The complexity of NF-κB signaling in inflammation and cancer[J].Mol Cancer,2013,12:86.
PlateletFactor4Up-regulatestheExpressionofMatrixMetalloproteinase-9inMacrophagesviaNF-κB
ZHAO Zhanzhi,HE Fan,TANG Yalin,et al
(InstituteofCardiovascularDisease,KeyLaboratoryforAtherosclerologyofHunanProvince,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo investigate whether PF4 modulates the MMP-9 expression of macrophages via Nuclear factor kappa B(NF-κB).MethodsTHP-1 monocytes were differentiated into monocyte-derived macrophages by phorbol 12-myristate 13-acetate (PMA).Macrophages were incubated with PF4 (100 μg/L) in the absence or presence of NF-κB inhibitor pyrrolidine dithiocarbamate (PDTC),the MMP-9 expression of macrophages was determined by Reverse-transcription polymerase chain reaction (RT-PCR).Macrophages were incubated with PF4 (25-200 μg/L) or vehicle (PBS),NF-κB content in cultured supernatant of macrophages was measured by ELISA assay.To evaluate the intracellular signal transduction pathways,macrophages were pretreated for 30min with the TLR4 blocker(monoclonal antibody HTA125,anti-TLR4) before the addition of PF4,NF-κB content was measured.ResultsMacrophages that were untreated showed a relatively low MMP-9 mRNA level;treatment with PF4 increased MMP-9 expression.However,the high levels of MMP-9 expression induced by PF4 were significantly attenuated in the presence of NF-κB inhibitor.PF4 increased concentration of NF-κB in a dose dependent manner,with the strongest increase at 100ng/mL.The increased the concentration of NF-κB induced by PF4 was significantly reduced when treated with TLR4 blocker.ConclusionPF4 may up-regulate MMP-9 expression in macrophages via NF-κB.TLR4 may be upstream signaling molecules of NF-κB in PF4- NF-κB signaling pathway.
platelet factor 4; matrix metalloproteinase-9; macrophages; nuclear factor kappa B; atherosclerosis
10.15972/j.cnki.43-1509/r.2015.01.003
2014-05-12;
2014-09-22
国家自然科学基金(81100214),南华大学博士启动基金(2012XQD40).
R363
A
(此文编辑:朱雯霞)
