直乙交界处肠癌患者KRAS和BRAF基因突变138例分析
2015-12-27杨帆蔡业丰金浪平张筱骅瞿金妙
杨帆,蔡业丰,金浪平,张筱骅,瞿金妙
(1.温州医科大学 研究生院,浙江 温州 325035;2.温州医科大学附属第一医院 肿瘤外科,浙江温州 325015)
·论 著·
直乙交界处肠癌患者KRAS和BRAF基因突变138例分析
杨帆1,蔡业丰1,金浪平1,张筱骅2,瞿金妙2
(1.温州医科大学 研究生院,浙江 温州 325035;2.温州医科大学附属第一医院 肿瘤外科,浙江温州 325015)
目的:检测直乙交界处肠癌患者KRAS和BRAF基因的突变特征,分析KRAS和BRAF突变与患者临床病理特征的相关性及其临床意义。方法:收集138例直乙交界处肠癌患者的肿瘤组织,运用直接测序法检测组织标本中KRAS基因外显子2第12、第13位密码子,外显子3第61位密码子以及BRAF基因外显子15的突变状态,分析该2个基因突变与临床病理特征的相关性。结果:138例样本中,KRAS和BRAF的突变率为34.05%(47/138)和5.07%(7/138)。KRAS基因有9种突变类型,其中包括1种全新的突变类型。BRAF基因全为V600E突变。在直乙交界处肠癌患者中,KRAS基因在男性(P=0.041)、远处转移(P=0.002)、高临床分期(P=0.047)的患者中突变率更高,BRAF基因突变更常见于肿瘤多发(P=0.003)、低分化(P<0.001)的患者中,KRAS和BRAF与年龄、肿块大小、肿瘤病理形态、病理类型、浸润深度、淋巴结转移、脉管浸润、神经浸润等临床病理特征均无显著相关性。结论:直乙交界处肠癌有它的特殊性,KRAS基因在男性、远处转移、临床分期晚期的患者中突变率更高,BRAF基因在多发、低分化的患者中突变率更高。KRAS、BRAF基因在不同部位的结直肠癌中改变情况并不一致。
直乙交界;肠肿瘤;临床病理特征;KRAS基因;BRAF基因
结直肠癌是常见的消化道恶性肿瘤。根据全国肿瘤登记中心的数据,2009年中国结直肠癌发病率为29.44/10万,病死率为14.23/10万,结直肠癌新发病例占全部恶性肿瘤的10.30%,死亡病例则占7.88%[1]。目前研究认为结直肠癌是一类分子水平上高度异质性的疾病,患者之间的遗传背景、基因分型以及治疗的敏感性等方面存在较大的个体差异。KRAS和BRAF基因是现在结直肠癌中研究的热点,这些基因在结直肠癌发生、发展中发挥了重要的作用,并可以指导患者的个体化诊疗过程[2-4]。目前研究已经报道不同部位的结直肠癌中KRAS、BRAF突变率存在差异[5-6],然而还缺乏对于直乙交界处肠癌的KRAS和BRAF突变情况的研究。该处肿瘤国内报道较少,但临床上并不少见。因此我们回顾性地分析了138例直乙交界处肠癌患者中KRAS、BRAF基因突变发生率、突变特征及其与临床病理特征的关系,旨在探讨KRAS和BRAF基因在直乙交界处肠癌发生中的作用,研究其突变的临床意义。
1 资料和方法
1.1 一般资料 收集2000年1月至2013年12月期间于我院住院治疗的结直肠癌患者。纳入标准:①术后病理报告确诊为结直肠癌;②结直肠癌术中及术后病理明确肿瘤位于直乙交界处;③在我院经过完整规范化治疗的结直肠癌患者。排除标准:①存在其他部位肿瘤的多原发肿瘤;②其他组织来源的肿瘤,如黑色素瘤、淋巴瘤等;③随访资料不完整者。详细记录符合标准的患者性别、年龄、肿瘤原发部位、大小、病理类型、病理形态、分化程度、临床分期、Duke分期、癌结节、脉管浸润、神经浸润、远处转移等临床病理资料。所有标本均为甲醛固定,石蜡包埋组织。肿瘤分期采用AJCC标准,所有患者的临床病理资料见表1。

表1 直乙交界处肠癌患者临床病理特征分析(n=138)
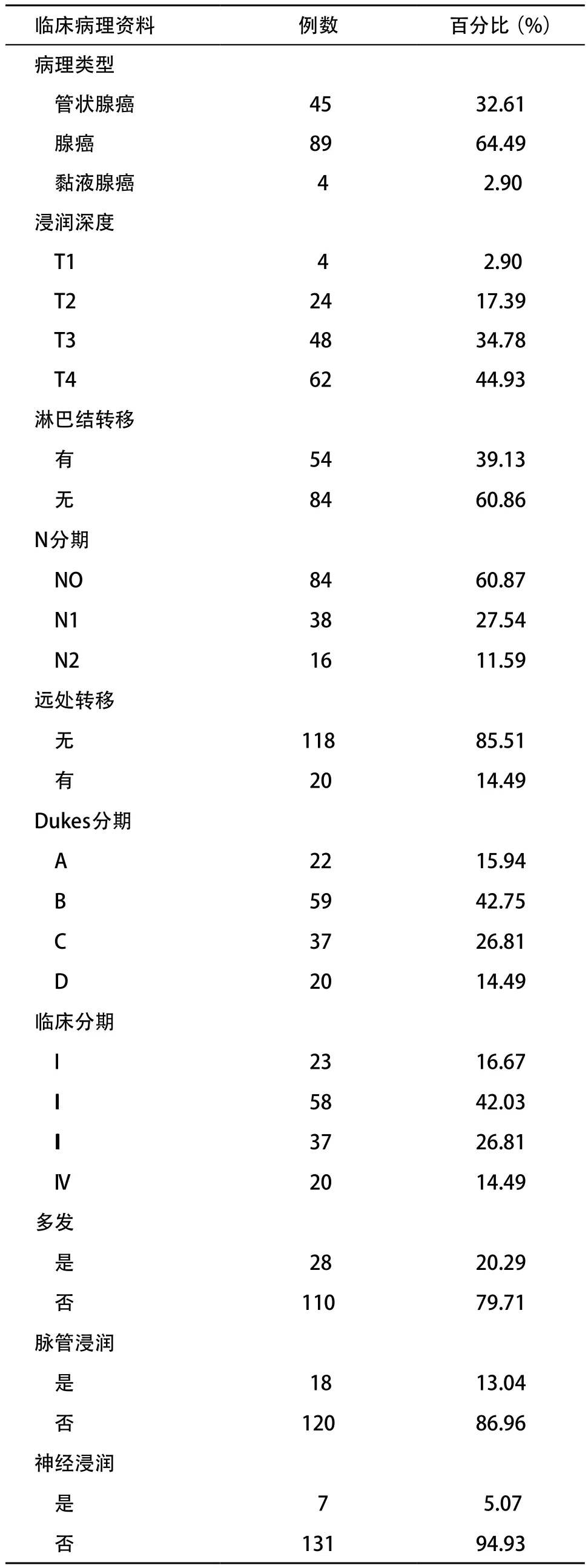
续表1
1.2 基因组DNA提取 按DNA提取试剂盒(QIAamp DNA Mini-Kit,QIAGEN)说明书提取石蜡标本基因组DNA。
1.3 PCR扩增 根据KRAS、BRAF基因组DNA序列设计PCR引物,引物序列见表2,引物由浙江迪诺基因科技有限公司合成。每个反应体系50 μL,其中包括10×PCR缓冲液5 μL,0.1 mol/L氯化镁1.5 μL,25 mmol/L dNTP mix 2.5 μL,上游引物(10 μmol/L)0.5 μL,下游引物(10 μmol/L)0.5 μL,10 μL rTaqDNA聚合酶,2 μL DNA模板,ddH2O 28 μL。PCR扩增条件:95 ℃预变性5 min,94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,共循环45次,最后72 ℃延伸4 min,每次反应均设置阳性及阴性对照,完成整个循环。将PCR扩增产物行琼脂糖凝胶电泳以鉴定PCR产物纯度。

表2 KRAS、BRAF基因PCR扩增与直接测序引物序列
1.4 DNA测序 送由浙江迪诺基因科技有限公司进行测序,所有病例均做KRAS基因第2、第3号外显子和BRAF基因第15号外显子突变检测。
1.5 统计学处理方法 采用SPSS 19.0统计软件进行统计学分析。对不同组别的突变率行x2值/t值检验。P<0.05为差异有统计学意义。
2 结果
2.1 KRAS基因突变特征 138例直乙交界处肠癌中有47例检出KRAS基因突变,其中KRAS基因12、13、61位密码子突变率分别为22.46%(31/138),9.42%(13/138),1.44%(2/138),以及1例(1/138)全新的突变(见表3)。12密码子共检测到5种突变类型:GGT>TGT(G12C),GGT>GTT(G12V),GGT>GAT(G12D),GGT>GCT(G12A),GGT>AGT(G12S)。13密码子检测到1种突变类型:GGC>GAC(G13D)。61密码子检测到2种突变类型:CAA>CTA(Q61L),CAA>CAC(Q61H)(见图1)。此外,我们发现了1例全新的突变,该突变导致第12密码子第2、第3三个碱基间发生6 bp插入突变,插入碱基为AGCTGG,这种全新的突变导致第12和第13密码子间插入2个氨基酸(见图2)。

表3 KRAS与BRAF基因突变类型
2.2 BRAF基因突变特征 138例直乙交界处肠癌中有7例BRAF基因突变,突变率为5.07%(7/138),均为V600E突变。未发现同时存在KRAS和BRAF基因突变的患者,KRAS突变和BRAFV600E突变相互排斥。
2.3 KRAS及BRAF基因突变与结直肠癌临床病理特征的关系 KRAS基因在男性(P=0.041)、远处转移(P=0.002)、高临床分期(P=0.047)的患者中突变率更高,与年龄、肿块大小、肿瘤病理形态、肿瘤分化情况、病理类型、浸润深度、淋巴结转移、多发、脉管浸润、神经浸润等临床病理特征均无显著相关性(P>0.05)。BRAF基因突变更常见于多发(P=0.003)、低分化(P<0.001)的患者中,而与性别、年龄、肿块大小、病理形态、病理类型等临床病理特征无相关性。见表4。
3 讨论

图1 KRAS、BRAF基因突变测序峰图

图2 全新的KRAS基因突变
结直肠癌的发生、发展是一个受多基因、多步骤调控的复杂过程。作为表皮生长因子受体(EGFR)信号转导通路下游的重要癌基因,KRAS基因在细胞的生长以及血管生成中发挥了重要调控作用[7-8]。2011年发布的美国《国家综合癌症网络结直肠癌临床实践指南(NCCN)》明确提出将KRAS基因状态作为是否对结直肠癌患者使用抗EGFR单抗治疗的标准。野生型KRAS基因需要在上游EGFR信号刺激下通过信号转导通路发挥调控作用,而突变型KRAS基因无需依赖其上游的EGFR信号刺激就可以通过自身磷酸化持续激活下游信号转导通路。因此抗EGFR药物对KRAS基因突变的结直肠癌患者无效[9-10]。目前报道的KRAS突变率、突变类型有一定差别。高静等[5]报道国内966例标本中,结肠癌患者发生KRAS突变的频率(为41%)高于直肠癌患者(为34.9%),并指出右半结肠癌患者发生KRAS突变与BRAF突变的频率明显高于左半结肠癌或直肠癌患者,同时他们发现KRAS基因在女性中的突变率较高。而朱晓丽等[6]分析了557例标本发现,左半结肠癌KRAS突变率为36.3%,要低于直肠癌的42.2%,并提示KRAS突变率与女性、肿瘤部位相关。而我们测得直乙交界处肠癌的KRAS突变率为34%,可见现在报道结直肠癌在不同部位的KRAS突变率并不一致。我们在直乙交界处发现一种全新的KRAS突变,该突变导致在第12和第13密码子间插入了2个氨基酸。目前国内鲜有此种新突变的临床研究报道,因此我们推测这种突变是在直乙交界处肠癌所特有的。同时我们发现KRAS基因突变在男性、远处转移、临床分期晚期的患者中突变率更高,而与年龄、肿块大小、肿瘤病理形态、肿瘤分化情况、病理类型、浸润深度、淋巴结转移、多发、脉管浸润、神经浸润等临床病理特征无相关性,而具体机制仍不明确,有待进一步研究。鉴于在远处转移和临床晚期的患者中KRAS突变率较高,在这些患者中开展KRAS基因筛选工作,可能具有更为重要的临床意义。
有研究报道部分KRAS基因野生型患者对抗EGFR单抗治疗无效,而BRAF基因突变是导致这一部分结直肠癌患者产生耐药反应的原因[11-13]。现在各家报道BRAF基因在结直肠癌患者中突变率较低,沈胤晨等[14]检测了676例结直肠癌患者中,直肠癌的BRAFV600E突变率为1.03%,乙状结肠癌的突变率为1.87%,而直乙交界处的突变率为0,并指出肿瘤分化程度越低,BRAF突变率越高。而曹祥龙等[15]报告BRAFV600E突变率为5.7%,更常见于老年(>65岁)、(脾区)近端结肠、无远处转移的患者。我们测得直乙交界处肠癌的BRAF突变率为5.07%,并且BRAF基因突变的患者多伴有多发病灶,且原发病灶呈低分化,而与性别、年龄、肿块大小、病理形态、分化情况、病理类型、浸润深度、临床分期等临床病理特征无相关性。随着肿瘤分化程度的降低,肿瘤远处转移的潜能上升,因此对于BRAF突变的患者,临床上应该更加关注其是否存在病灶转移和多发的情况。BRAF基因有望成为预测抗EGFR单抗治疗新的疗效指标。
表4 KRAF和BRAF基因突变与直乙交界处肠癌患者临床病理特征的相关性[n(%),]

表4 KRAF和BRAF基因突变与直乙交界处肠癌患者临床病理特征的相关性[n(%),]
临床病理资料例数KRAS基因BRAF基因野生型突变型x2/tP野生型突变型x2/tP性别 4.1650.04101男9356(60)37(40) 88(95)5(5)女4535(77)10(23)43(96)2(4)年龄(岁)13863.150±10.14065.702±10.518 1.3810.17063.67±10.2870.571±9.034 1.7380.084肿块大小(cm)1384.401±1.7034.353±1.260-0.1870.8524.397±1.5514.142±1.864-0.4190.676肿瘤病理形态 0.3090.643 0.6420.351溃疡型11474(65)40(35)109(96)5(4)隆起型2417(70) 7(30)22(92)2(8)肿瘤分化情况 1.0280.58533.143<0.001低分化5 4(80) 1(20)2(40) 3(60)中分化10671(67)35(33)102(96)4(4)高分化2716(59)11(41)27(100)0(0)病理类型 2.2190.373 3.3970.267管状腺癌4530(66)15(34)43(96)2(4)腺癌8957(64)32(36)85(96)4(4)黏液腺癌4 4(100)0(0)3(75) 1(25)浸润深度 0.4710.656 0.0001.000 T1-T22820(71) 8(29)27(96)1(4)T3-T411071(65)39(35)104(95)6(5)淋巴结转移 0.9220.362 0.0431.000有5433(61)21(39)51(94)3(6)无8458(69)26(31)80(95)4(5)N分期 2.1720.350 1.0730.616 NO8458(69)26(31)80(95)4(5)N13825(66)13(34)35(92)3(8)N216 8(50) 8(50)16(100)0(0)远处转移 9.9710.002 1.1790.593无11884(71)34(29)113(96)5(4)有20 7(35)13(65)18(90) 2(10)Dukes分期 2.8000.104 0.0001.000 A-B8158(72)23(28)77(95)4(5)C-D5733(58)24(42)54(97)3(3)临床分期 7.9000.047 1.4530.722 I 2318(78) 5(22)21(95)1(5)II 5839(67)19(33)56(95)3(5)III 3726(70)11(30)36(97)1(3)IV20 8(40)12(60)18(90) 2(10)多发 0.0431.000 8.8250.003是2818(64)10(36)23(82) 5(18)否11073(66)37(34)108(98)2(2)

续表4
直肠乙状结肠交界处位于第3骶椎前方,该处乙状结肠以近90°与直肠相连接,是整个结肠最狭窄的部位[16]。虽然此处的肠癌国内外报道较少,但临床上并不少见。国内几项大样本的研究报告直乙交界处结肠癌发生率占全部结直肠癌的2.2%~3.4%[17-18]。在回顾性收集2000年至2013年于我院行结直肠癌手术的3 280例患者中,我们发现了138例直乙交界处肠癌的患者,约占全部结直肠癌的4.2%,与之前报道基本一致。现在对于直乙交界处肠癌应该归属为结肠癌还是直肠癌,学界还存在争议[19]。直乙交界处肠癌发生于乙状结肠处的螺旋形黏膜上,从解剖上看属于结肠。但在腹膜折返处直乙交界处和直肠共用一套血管系统,因此也有学者认为该处肿瘤应该归属于直肠肿瘤。国内文献报道直乙交界处肠癌的X线检查极易漏诊、误诊。而内镜则把乙状结肠的螺旋形黏膜皱折作为分界线,其下方黏膜紧贴肠壁为直肠,其上方为乙状结肠。因其位置距肛门约15 cm以上,指诊多不能触及[20]。直乙交界处肠癌临床表现多无特异性,早期多表现为排便习惯与粪便性状改变为主。晚期可出现肠梗阻症状以及贫血、乏力、消瘦等全身症状。因此,该处的肿瘤早期诊断率较低。直乙交界处肠癌相对结、直肠肿瘤而言,发生肠梗阻的概率更高、手术切除率较低,因而直乙交界处肠癌具有它的特殊性。目前鲜有关于此处的肠癌与直肠癌、结肠癌预后及生存率有无差异的报道。
综上所述,本研究检测了138例直乙交界处肠癌患者中KRAS与BRAF基因突变状态,突变率分别为34.05%与5.07%,并发现KRAS基因突变与性别、远处转移、临床分期相关,而BRAF基因突变在多发、低分化的患者中更常见。同时我们发现了一种全新的KRAS基因突变类型。现在各家报道的KRAS、BRAF基因状态在不同部位的结直肠癌中改变情况并不一致。本研究针对直乙交界处的肠癌进行KRAS和BRAF基因的突变情况进行分析,而KRAS和BRAF基因在直乙交界处肠癌发生中的作用和机制有待于进一步研究。
[1] 王宁, 孙婷婷, 郑荣寿, 等. 中国2009年结直肠癌发病和死亡资料分析[J]. 中国肿瘤, 2013, 22(7): 515-520.
[2] Amado RG, Wolf M, Peeters M, et al. Wild-type KRAS is required for panitumumab effcacy in patients with metastatic colorectal cancer[J]. J Clin Oncol, 2007, 26(10): 1626-1634.
[3] 吴伟, 孙文勇. BRAF基因突变与结直肠癌的研究进展[J].实用医学杂志, 2011, 27(5): 903-905.
[4] Fang JY, Richardson BC. The MAPK signalling pathways and colorectal cancer[J]. Lancet Oncol, 2005, 6(5): 322-327.
[5] 高静, 孙志伟, 李艳艳, 等. 中国结直肠癌患者966例中KRAS和BRAF基因突变分析[J]. 中华病理学杂志, 2012, 41(9): 579-583.
[6] 朱晓丽, 蔡旭, 张玲, 等. 中国结直肠癌患者中KRAS与BRAF基因突变特征及其临床病理相关性[J]. 中华病理学杂志, 2012, 41(9): 584-589.
[7] 沈永奇, 冯献斌. 结直肠癌K-ras基因的研究进展[J]. 医学综述, 2011, 17(13): 1954-1957.
[8] Schmidt CR, Washington MK, Gi YJ, et al. Dysregulation of E-cadherin by oncogenic Ras in intestinal epithelial cells is blocked by inhibiting MAP kinase[J]. Am J Surg, 2003, 186 (5): 426-430.
[9] Cappuzzo F, Finocchiaro G, Rossi E, et al. EGFR FISH assay predicts for response to cetuximab in chemotherapy refractory colorectal cancer patients[J]. Ann Oncol, 2008, 19(4): 717-723.
[10] Normanno N, Tejpar S, Morgillo F, et al. Implications forKRAS status and EGFR-targeted therapies in metastatic CRC[J]. NatRev Clin Oncol, 2009, 6(9): 519-527.
[11] Benvenuti S, Sartore-Bianchi A, Di Nicolantonio F, et al. Oncogenic activation of the RAS/RAF signaling pathway impairs the response of metastatic colorectal cancers to antiepidermal growth factor receptor antibody therapies[J]. Cancer Res, 2007, 67(6): 2643-2648.
[12] DiNicolantonio F, Martini M, Molinari F, et al. Wild-Type BRAF Is Required for Response to Panitumumab or Cetuximab in Metastatic Colorectal Cancer[J]. J Clin Oncol, 2008, 26(35): 5705-12.
[13] Di Nicolantonio F, Martini M, Molinari F, et al. Wild-type BRAF is required for response to panitumumab or cetuximab in metastatic colorectal cancer[J]. J Clin Oncol, 2008, 26(35): 5705-5712.
[14] 沈胤晨, 王建飞, 杨红鹰. 结直肠癌患者BRAF基因突变检测及其临床意义[J]. 中华检验医学杂志, 2012, 35(11): 993-999.
[15] 曹祥龙, 汪欣. 结直肠癌KRAS和BRAF基因突变的实验研究与临床意义[J]. 中国医刊, 2013, 48(7): 23-26.
[16] Bagla N, Schofield JB. Rectosigmoid tumours: should we continue sitting on the fence?[J]. Colorectal Dis, 2007, 9(7): 606-608.
[17] 陶雅军, 段世政, 张明, 等. 649例大肠癌临床病理特征分析[J]. 实用肿瘤学杂志, 2006, 20(6): 489-490.
[18] 赖少清, 鞠凤环, 王贵齐, 等. 2004~2008年704例大肠癌临床流行特征[J]. 中国肿瘤, 2010, 19(2): 111-113.
[19] Mukai M, Kishima K, Yamazaki M, et al. Stage II/III cancer of the rectosigmoid junction: An independent tumor type? [J]. Oncol Rep, 2011, 26(3): 737-741.
[20] 尹德奎, 张红春, 马丽霞, 等. X线、内镜及超声联合应用在直乙肠交界处结肠癌诊断及分期中的价值[J]. 中国临床医学影像杂志, 2007, 18(4): 296-298.
(本文编辑:胡苗苗)
Clinicopathological characteristics of KRAS and BRAF mutation in 138 patients with rectosigmoid can-cer
YANG Fan1, CAI Yefeng1, JIN Langping1, ZHANG Xiaohua2, QU Jinmiao2. 1.Wenzhou Medical University, Wenzhou, 325035; 2.Department of Surgical Oncology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective: To identify the mutation rate and mutation feature of KRAS and BRAF gene in patients with rectosigmoid carcinoma, to analyse the association between KRAS/BRAF mutations and patients’clinicopathological characteristics, and discuss the clinical signifcance of KRAS/BRAF mutations. Methods: 138 patients with rectosigmoid carcinoma were collected. DNA sequencing was used to detect mutations in KRAS (codons12, 13 of exon2 and codons 61 of exon3) and BRAF (exon15). Statistically analyzing the relationships between gene mutations and clinicopathological characteristic. Results: In 138 cases, the mutation rate of KRAS and BRAF was 34.05% (47/138) and 5.07% (7/138). 9 mutation types were found in KRAS, including a new mutation type. BRAF mutation was all belong to V600E mutation. In patients with rectosigmoid carcinoma, KRAS mutation rate was higher in male (P=0.041), distant metastasis (P=0.002) and high clinical stages (P=0.047). BRAF mutation rate was higher in multiple (P=0.003) and poorly differentiate (P=0.001) carcinoma. No signifcant associations were observed between KRAS/BRAF mutations and age, tumor size, pathomorphism, pathological type, depth of invasion, lymph node metastasis, vessel infltration and nervous infltration (P>0.05). Conclusion: Rectosigmoid carcinoma is unique. KRAS mutation rate is higher in male, distant metastasis and high clinical stages carcinoma. BRAF mutation rate is higher in multiple and poorly differentiate carcinoma. KRAS and BRAF mutations are variant in different location of colorectal cancer.
rectosigmoid; intestinal neoplasms; clinicopathological characteristic; KRAS gene; BRAF gene
R735.3
A
10.3969/j.issn.2095-9400.2015.09.005
2014-12-22
温州市科技计划资助项目(Y20140132)。
杨帆(1991-),男,浙江温州人,硕士生。
瞿金妙,副主任医师,Email:Oncologist_qjm@sina. com。
