柚皮素对RSV A2株感染引起气道黏液高分泌的抑制作用
2015-12-27孟珊珊吕芳芳胡晓光张海邻李昌崇
孟珊珊,吕芳芳,胡晓光,张海邻,李昌崇
(1.温州医科大学附属第二医院育英儿童医院 儿童呼吸科,浙江 温州 325027;2.邹城市人民医院儿科,山东 济宁 273500)
·论 著·
柚皮素对RSV A2株感染引起气道黏液高分泌的抑制作用
孟珊珊1,2,吕芳芳1,胡晓光1,张海邻1,李昌崇1
(1.温州医科大学附属第二医院育英儿童医院 儿童呼吸科,浙江 温州 325027;2.邹城市人民医院儿科,山东 济宁 273500)
目的:探讨柚皮素(Nar)对呼吸道合胞病毒(RSV)感染引起的气道黏液高分泌的作用。方法:通过RSV A2株感染人肺腺癌上皮细胞构建气道黏液高分泌细胞模型,在RSV感染及Nar干预作用下,采用实时荧光定量PCR、ELISA和细胞免疫荧光技术检测各组细胞黏蛋白(MUC)5AC的表达情况。结果:RSV感染R1组[感染复数(MOI)=0.5]、R2组(MOI=1.0)、R3组(MOI=5.0)和对照组(C组)MUC5AC mRNA相对表达量分别为1.45±0.10、2.67±0.09、4.82±0.27和1,各组MUC5AC蛋白的表达量分别为(38.61±0.41)μg/L、(44.11± 0.96)μg/L、(51.01±0.48)μg/L和(34.38±0.95)μg/L,RSV感染组和C组相比差异均有统计学意义(P<0.05)。R2组和不同浓度Nar干预组N1组(Nar 30 μmol/L+RSV MOI=1.0)、N2组(Nar 100 μmol/L+RSV MOI=1.0)、N3组(Nar 30 μmol/L)、N4组(Nar 100 μmol/L)及DMSO组(D组)的MUC5AC mRNA水平依次为2.52±0.10、2.31±0.06、1.90±0.01、0.99±0.04、0.85±0.03、1.20±0.03,MUC5AC蛋白水平依次为(46.72±0.87)μg/L、(43.60±0.45)μg/L、(40.55±0.45)μg/L、(38.73±0.55)μg/L、(37.08±1.35)μg/L、(37.12±0.91)μg/L,C组MUC5AC蛋白水平为(37.62±1.18)μg/L,与C组相比,R2组MUC5AC mRNA和蛋白水平显著增加(P<0.05),N1、N2组与R2组相比,MUC5AC mRNA和蛋白水平显著降低,随Nar浓度增加,抑制效果更明显,呈剂量相关性(P<0.05),N3、N4组与C组相比,MUC5AC mRNA和蛋白表达水平下降,但差异无统计学意义(P>0.05),D组与C组差异无统计学意义(P>0.05)。荧光显微镜观察结果显示RSV感染后细胞质内MUC5AC蛋白表达增加,而Nar可下调其表达。结论:RSV A2株感染A549细胞会导致MUC5AC mRNA和蛋白表达增加,Nar通过抑制其表达,抑制RSV感染引起的气道黏液高分泌。
柚皮素;呼吸道合胞病毒;气道黏液高分泌;黏蛋白5AC
呼吸道合胞病毒(respiratory syncytial virus,RSV)是婴幼儿下呼吸道感染最常见的病毒病原,每年因RSV感染导致全球大约2%的确诊病例死亡[1]。RSV下呼吸道感染的主要病理改变是细支气管上皮的坏死脱落、黏液分泌增加、炎性细胞浸润、黏膜充血水肿、气道反应性增高等[2],其中黏液高分泌引起的气道阻塞起着十分重要的作用[3-4]。研究RSV感染引起气道黏液高分泌的机制并加以干预,对减轻RSV下呼吸道感染疾病严重度有十分重要的临床意义。
黏蛋白(mucin,MUC)是气道黏液中最具生理学意义的成分,其中MUC5AC和MUC5B构成了气道分泌蛋白的95%~98%[5]。多种刺激因素可导致MUC表达上调,例如臭氧、烟雾、细胞因子、中性粒细胞弹性蛋白酶、细菌产物、病毒等[5]。柚皮素(Naringenin,Nar)是一类天然黄酮类化合物,广泛存在于柚子、化橘红、桃叶等中。研究证实,Nar除具有抗肿瘤、抗动脉粥样硬化、抗氧化、抑制炎症反应的作用[6]外,还具有止咳化痰的功效,可减轻气道的黏液高分泌[7-8]。Nar是否对RSV感染引起的气道黏液高分泌有效鲜见报道。为此,笔者通过观察RSV A2株感染人肺腺癌上皮细胞(A549)气道黏液高分泌模型中MUC5AC基因转录及Nar干预后表达水平的变化,探讨Nar对RSV感染引起气道黏液高分泌的作用。
1 材料和方法
1.1 实验材料
1.1.1 细胞株与病毒株:人肺腺癌上皮细胞A549株和人喉癌上皮细胞Hep-2株购自中科院上海细胞生物研究所细胞库,RSV A2株购于美国模式培养物集存库(American Type Culture Collection,ATCC)。
1.1.2 药物:Nar(Sigma,美国)溶于二甲基亚砜(DMSO)溶液中,配成0.1 mmol/L母液,避光-20 ℃保存,实验时用培养液稀释成所需浓度。DMSO终浓度<0.1%。
1.1.3 主要试剂及仪器:DMEM培养液(Gibco,美国),1640培养液(Gibco,美国),胎牛血清(四季青,中国),Trizol(Invitrogen,美国),反转录-聚合酶链反应(RT-RCR)试剂盒(Thermo,美国),SYBR Green I Master(Roche,美国),LightCycler480实时荧光定量PCR仪(Roche,美国),引物设计合成(上海基康生物技术有限公司)。
1.2 实验方法
1.2.1 细胞培养:A549和Hep-2细胞培养于含5%胎牛血清的1640和DMEM培养基(加入100 U/mL青霉素和100 mg/mL链霉素)中,置于5% CO2、饱和湿度、37 ℃培养箱中,待细胞融合至80%~90%传代。取对数生长期细胞用0.25%胰蛋白酶消化后接种于培养皿,待细胞贴壁,融合至70%时换成细胞维持液(含2%的胎牛血清)继续培养24 h。
1.2.2 CCK-8法测定Nar对A549细胞的增殖毒性:将对数期A549细胞消化后以1×104/mL接种于96孔板中,每孔接种100 μL,待其生长至80%左右时,用PBS清洗2遍后,加入含30、50、80、100、200、400、800 μmol/L Nar的培养液100 μL,每个浓度设置8个复孔,同时设置正常细胞对照组,置培养箱内继续培养24 h,各孔中加入10 μL CCK-8溶液,于培养箱中孵育1 h后酶标仪检测450 nm波长处吸光度A值。
1.2.3 RSV培养及滴度测定:RSV接种于对数生长期的Hep-2细胞中,在DMEM维持液中培养,待病变>75%时收获病毒(约3~5 d),置-20 ℃≥2 h,37 ℃反复冻融4次,10 000 r/min离心10 min,取上清存-80 ℃冰箱中备用。病毒滴度通过在96孔板细胞中测病毒的半数感染量TCID 50/mL表示。根据实验加入不同的感染量,以感染复数(multiplication of infection,MOI)表示,MOI为病毒数和细胞数比例。
1.2.4 实验分组:RSV感染组包括R1组(MOI=0.5)、R2组(MOI=1.0)、R3组(MOI=5.0),各组加入不同感染量的RSV吸附2 h后,换为新的维持液培养;Nar干预组包括N1组(Nar 30 μmol/L+RSV)、N2组(Nar 100 μmol/L+RSV),在感染前加入Nar预处理1 h,RSV感染后加入含Nar培养液培养,RSV MOI=1.0;Nar组包括N3组(Nar 30 μmol/L)、N4组(Nar 100 μmol/L),加入含不同浓度的Nar培养液培养;DMSO组(D组)加入含0.1%的DMSO培养液培养细胞;对照组(C组)为细胞维持液培养。各组均培养24 h后检测相应指标,每组均重复3次。
1.2.5 琼脂糖凝胶电泳:收集RSV感染组和C组细胞,裂解提取mRNA,用RSV G蛋白基因的引物做RTPCR,通过琼脂糖凝胶电泳验证RSV是否成功感染A549细胞。G蛋白引物:上游为5’-TGGGACACTCTTAAT CAT-3’,下游为5’
-TGATTCCAAGCTGAGGAT-3’。
1.2.6 实时荧光定量PCR法检测MUC5AC mRNA的表达:以Trizol法提取各组细胞总RNA,并测定RNA浓度及纯度(A260/A280>1.8)。根据浓度取2 μg总RNA,按照反转录试剂盒操作说明将RNA反转录为cDNA,以10 μL反应体系进行PCR扩增。每个样本设3个复孔。反应程序:95 ℃预变性90 s,95 ℃退火5 s,58 ℃延伸30 s,共45个循环,获得各样本待测基因的Ct值,采用2-ΔΔCt法进行数据处理,其结果代表目的基因的相对含量,以C组作为矫正样本。MUC5AC上游引物:5’-GACACCAAATACGCCAACAA-3’,下游引物:5’-GGGTCGTCCATCTTCTGC-3’;GAPDH上游引物:5’-CACCATCTTCCAGGAGCGA-3’,下游引物:5’-GG CAGAGATGATGACCCTTTTG-3’。
1.2.7 ELISA法检测各组细胞上清液MUC5AC蛋白水平:取培养上清液,1 500 r/min离心5 min后-80 ℃冻存,根据ELISA试剂盒说明书进行操作,于酶标仪450 nm测定各孔MUC5AC蛋白浓度。
1.3 统计学处理方法 采用SPSS18.0软件进行统计处理。计量资料以表示,多组样本均数间比较采用单因素方差分析,方差齐性者两两比较采用LSD检验,方差不齐者采用Dunnett’s T3检验。P<0.05为差异有统计学意义。
2 结果
2.1 RSV感染气道上皮细胞 通过Reed-Muench公式计算RSV滴度为107.0TCID 50/mL,即7×106PFU/ mL。琼脂糖凝胶电泳结果显示,RSV感染组(R1、R2、R3组)采用RSV A株G蛋白引物在250 bp处扩增出一条清晰的条带,符合G蛋白大小(见图1)。表明RSV RNA已成功进入A549细胞中,即RSV成功感染A549细胞。
2.2 不同病毒感染量对气道上皮细胞MUC5AC mRNA及蛋白表达水平的影响 R1、R2、R3组和C组MUC5AC mRNA表达量分别为1.45±0.10、2.67±0.09、4.82± 0.27和1,蛋白表达量分别为(38.61±0.41)μg/L、(44.11±0.96)μg/L、(51.01±0.48)μg/L和(34.38± 0.95)μg/L,R1、R2、R3组MUC5AC mRNA及蛋白表达量呈剂量依赖性增加,与C组相比差异均有统计学意义(P<0.05),见图2A-B。
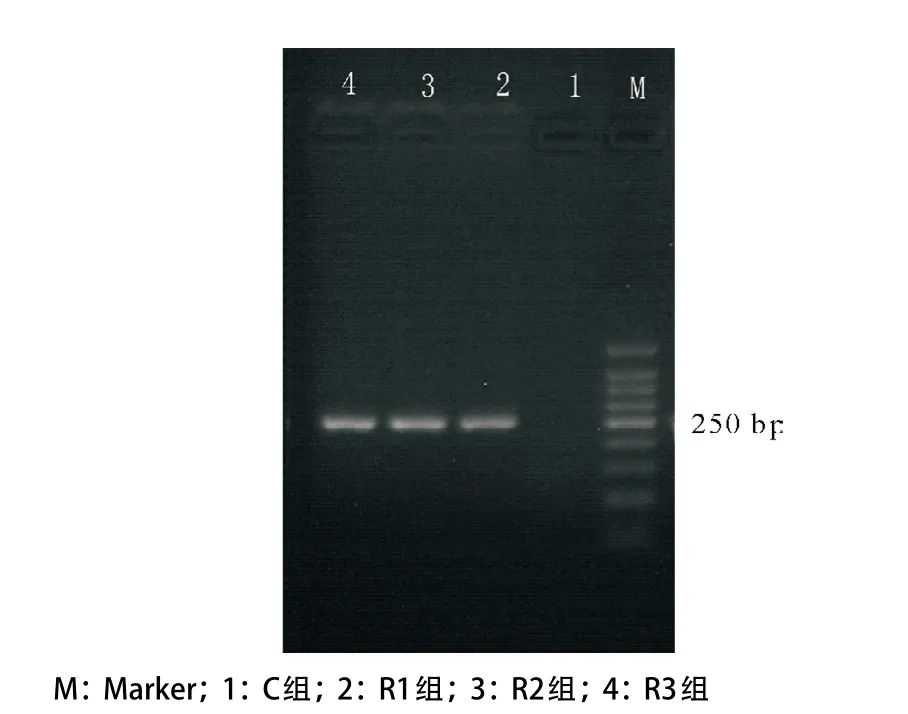
图1 PCR产物验证RSV成功感染A549细胞
2.3 Nar对A549细胞增殖-毒性影响 与对照组相比,Nar 400 μmol/L及800 μmol/L吸光度A值显著下降,差异有统计学意义(P<0.05),而Nar 200 μmol/L组细胞存活率显著下降,Nar 30~100 μmol/L组则对A549细胞的增殖活性无显著影响。因此,选用Nar 30 μmol/L为低浓度组,Nar 100 μmol/L为高浓度组(见表1)。
表1 不同浓度Nar对A549细胞增殖-毒性影响()

表1 不同浓度Nar对A549细胞增殖-毒性影响()
与对照组比:aP<0.05
组别吸光度A值细胞存活率(%)对照组1.58±0.06a100.00 Nar 30 μmol/L组1.57±0.07a98.28 Nar 50 μmol/L组1.54±0.09a93.10 Nar 80 μmol/L组1.52±0.06a89.66 Nar 100 μmol/L组1.47±0.07a81.03 Nar 200 μmol/L组1.25±0.05a43.10 Nar 400 μmol/L组1.12±0.13a20.69 Nar 800 μmol/L组1.03±0.14a5.17
2.4 Nar对RSV感染后气道上皮细胞MUC5AC mRNA及蛋白水平的影响 与C组相比,R2组MUC5AC mRNA和蛋白水平显著升高,差异具有统计学意义(P<0.05)。给予Nar 30 μmol/L及100 μmol/L干预后,RSV感染诱导的MUC5AC mRNA及蛋白表达水平降低,N1、N2组较R2组降低,差异有统计学意义(P<0.05),同时高浓度Nar干预效果较低浓度明显。N3、N4组细胞MUC5AC mRNA及蛋白水平低于C组,但差异无统计学意义(P>0.05),见图2C-D。
2.5 荧光显微镜下各组细胞内MUC5AC蛋白的表达水平 结果显示:正常细胞可见少量MUC5AC蛋白(红色)阳性染色,其主要在A549细胞胞浆内表达,在细胞核内也有少量表达(见图3C);未加一抗的阴性对照仅见DAPI染色的细胞核(蓝色),几乎见不到MUC5AC蛋白阳性染色(见图3D);RSV感染组可见细胞胞浆及胞核内大量MUC5AC蛋白阳性染色(见图3A);Nar干预组与RSV感染组相比,MUC5AC蛋白荧光染色水平降低(见图3B)。

图2 各组MU5AC mRNA及蛋白的表达水平
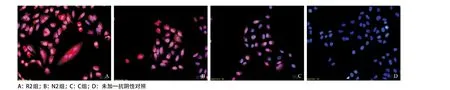
图3 荧光显微镜观察MUC5AC在气道上皮细胞中的表达情况(免疫荧光,×400)
3 讨论
MUC作为黏液的主要组成部分,包含一大家族高分子量的糖蛋白,位于消化道、生殖道、中耳及气管中。目前已确定的有20种MUC基因,其中MUC2、MUC5AC和MUC5B是和呼吸系统疾病有关的主要成分[9],而MUC5AC是炎症反应时气道黏蛋白增加的主要类型。已有研究证实RSV感染可导致MUC5AC表达上调。2003年Miller等[10]发现严重的炎症反应和黏液高度分泌是导致RSV感染后疾病重症的因素之一。鲍一笑等[11]报道气道上皮细胞在RSV感染时可出现黏蛋白表达增加,MUC5AC启动子活性增加。然而,RSV不同病毒株对气道炎症和黏液分泌的影响并不一致,这也是每年RSV感染性疾病严重度不同的原因之一[12]。Mata等[13]证实RSV long株感染肺上皮A549细胞可诱导MUC5AC表达上调。Martin等[14]证实RSV19株感染BALB/c小鼠也会导致IL-13水平升高和气道黏液的高分泌。
本研究采用实时荧光定量PCR及ELISA法检测RSV A2株感染A549细胞后MUC5AC的mRNA及蛋白表达情况,结果发现与C组相比,RSV感染组MUC5AC mRNA及蛋白表达水平明显增加(P<0.05),不同的病毒感染量MUC5AC增加水平不同,RSV感染MOI=5.0组的MUC5AC基因转录和蛋白表达水平高于MOI=0.5组和MOI=1.0组。本研究还通过细胞免疫荧光技术检测MUC5AC蛋白在A549细胞中的表达情况,结果发现RSV感染组细胞胞浆内大量MUC5AC蛋白阳性染色,核内也有少量表达,而在正常细胞可见少量MUC5AC蛋白阳性染色,证实感染RSV A2株能引起气道的黏液高分泌。
研究证实,Nar具有减轻气道黏液高分泌的作用,可下调多种病理模型的MUC5AC高表达[4,15-16]。本研究通过CCK-8细胞增殖毒性检测,选择Nar 30 μmol/L为低浓度组,100 μmol/L为高浓度组,分别进行干预,结果发现细胞内MUC5AC mRNA及蛋白表达水平均较RSV感染组(R2组)明显降低。与低浓度组相比,高浓度组抑制MUC5AC mRNA及蛋白表达的作用更为显著。本研究中DMSO组与C组相比差异无统计学意义,提示实验中终浓度的DMSO未对细胞造成损害。细胞免疫荧光结果同时发现与RSV感染组相比,Nar干预组MUC5AC蛋白荧光染色水平明显降低。以上结果表明,Nar可抑制MUC5AC mRNA和蛋白表达,并呈剂量依赖性。
综上所述,感染RSV可导致气道上皮细胞MUC5AC mRNA及蛋白表达水平增加,而Nar可下调MUC5AC mRNA及蛋白水平,具有抑制RSV感染引起的气道黏液高分泌的作用。
[1] Nair H, Nokes DJ, Gessner BD, et al. Global burden of acute lower respiratory infections due to respiratory syncytial virus in young children: a systematic review and meta-analysis[J]. Lancet, 2010, 375(9725): 1545-1555.
[2] 林立, 李昌崇. 呼吸道合胞病毒感染发病机制[J]. 中华儿科杂志, 2006, 44(9): 673-675.
[3] Stokes KL, Currier MG, Sakamoto K, et al. The respiratory syncytial virus fusion protein and neutrophils mediate the airway mucin response to pathogenic respiratory syncytial virus infection[J]. J Virol, 2013, 87(18): 10070-10082.
[4] Nadel JA. Mucous hypersecretion and relationship to cough [J]. Pulm Pharmacol Ther, 2013, 26(5): 510-513.
[5] Voynow JA, Rubin BK. Mucins, mucus, and sputum[J]. Chest, 2009, 135(2): 505-512.
[6] Nie YC, Wu H, Li PB, et al. Anti-inflammatory effects of naringin in chronic pulmonary neutrophilic infammation in cigarette smoke-exposed rats[J]. J Med Food, 2012, 15(10): 894-900.
[7] Lin BQ, Li PB, Wang YG, et al. The expectorant activity of naringenin[J]. Pulm Pharmacol Ther, 2008, 21(2): 259-263.
[8] Gao S, Li P, Yang H, et al. Antitussive effect of naringin on experimentally induced cough in Guinea pigs[J]. Planta Med, 2011, 77(1): 16-21.
[9] Rose MC, Voynow JA. Respiratory tract mucin genes and mucin glycoproteins in health and disease[J]. Physiol Rev, 2006, 86(1): 245-278.
[10] Miller AL, Strieter RM, Gruber AD, et al. CXCR2 regulates respiratory syncytial virus-induced airway hyperreactivity and mucus overproduction[J]. J Immunol, 2003, 170(6): 3348-3356.
[11] 鲍一笑, 董晓艳, 吕婕. 呼吸道合胞病毒诱导气道上皮粘液分泌及调节机制研究[J]. 临床儿科杂志, 2006, 24(1): 25-27.
[12] Lukacs NW, Moore ML, Rudd BD, et al. Differential immune responses and pulmonarypathophysiology are induced by two different strains of respiratory syncytial virus[J]. Am J Pathol, 2006, 169(3): 977-986.
[13] Mata M, Morcillo E, Gimeno C, et al. N-acetyl-L-cysteine (NAC) inhibit mucin synthesis and pro-infammatory mediators in alveolar type II epithelial cells infected with infuenza virus A and B and with respiratory syncytial virus (RSV)[J]. Biochem Pharmacol, 2011, 82(5): 548-555.
[14] Martin L, Chi MH, Luongo C, et al. A chimeric A2 strain of respiratory syncytial virus (RSV) with the fusion protein of RSV strain line 19 exhibits enhanced viral load, mucus, and airway dysfunction[J]. J Virol, 2009, 83(9): 4185-4194.
[15] Shi Y, Dai J, Liu H, et al. Naringenin inhibits allergen-induced airway infammation and airway responsiveness and inhibits NF-kappaB activity in a murine model of asthma[J]. Can J Physiol Pharmacol, 2009, 87(9): 729-735.
[16] Nie YC, Wu H, Li PB, et al. Naringin attenuates EGF-induced MUC5AC secretion in A549 cells by suppressing the cooperative activities of MAPKs-AP-1 and IKKs-IkappaB-NF-kappaB signaling pathways[J]. Eur J Pharmacol, 2012, 690 (1-3): 207-213.
(本文编辑:丁敏娇)
Inhibition of Naringenin on mucous hypersecretion of A549 cell induced by A2 strain of respiratory syncytialvirus
MENG Shanshan1,2, LV Fangfang1, HU Xiaoguang1, ZHANG Hailin1, LI Changchong1. 1.Department of Paediatric Respiratory Medicine, the Second Affiliated Hospital & Yuying Children’s Hospital of Wenzhou Medical University, Wenzhou, 325027; 2.Department of Paediatrics, Zoucheng People’s Hospital, Jining, 273500
Objective: To investigate the expression levels of MUC5AC protein and mRNAin mucous hypersecretion model induced by respiratory syncytial virus (RSV), and explore the effect of Naringenin (Nar) on mucous hypersecretion induced by RSV. Methods: Human lung adenocarcinoma epithelial cells (A549) were subcultured, infected with RSV and treated with Nar 30-100 μmol/L. After it was treated for 24 hrs, the expression of MUC5AC at mRNA and protein level in the groups were determined by real-time quantitative PCR and enzyme-linked immunosorbent assay (ELISA). The morphological changes of MUC5AC protein were observed with immunofuorescence technology. Results: The expressions of MUC5AC protein and mRNA in all RSV infected groups were signifcantly higher than that in group C in a dose-dependent manners (all P<0.05). Nar of 30 and 100 μmol/Lsignifcantly and dose-dependently decreased RSV-induced secretion of MUC5AC protein in cell supernatant and expression of MUC5AC mRNA (P<0.05), but still higher than that in group C (P<0.05). We also observed that RSV increased MUC5AC protein expression in the cytoplasm of A549 by immunofuorescence technology, and the protein expression decreased after pretreatment with Nar. Conclusion: Naringenin can inhib-ite the RSV-induced mucous hypersecretion of A549 cell.
Naringenin; RSV; mucous hypersecretion; MUC5AC
R725.6
A
10.3969/j.issn.2095-9400.2015.09.002
2015-03-18
卫计委国家临床重点专科开放基金资助项目(20130217)。
孟珊珊(1988-),女,山东泰安人,住院医师。
张海邻,主任医师,硕士生导师,Email:zhlwz97@hotmail.com。
