阿萨希毛孢子菌对人外周血单核源树突状细胞表型和功能的影响
2015-12-26王瑞丽敖俊红廖勇杨蓉娅杨冬倩吕雪莲陈珊珊安徽医科大学北京军区总医院临床学院北京100700北京军区总医院全军皮肤损伤修复研究所北京100700
王瑞丽敖俊红廖勇杨蓉娅杨冬倩吕雪莲陈珊珊(1.安徽医科大学北京军区总医院临床学院,北京100700;.北京军区总医院全军皮肤损伤修复研究所,北京100700)
阿萨希毛孢子菌对人外周血单核源树突状细胞表型和功能的影响
王瑞丽1,2敖俊红1,2廖勇2杨蓉娅2杨冬倩2吕雪莲2陈珊珊2
(1.安徽医科大学北京军区总医院临床学院,北京100700;2.北京军区总医院全军皮肤损伤修复研究所,北京100700)
【摘要】目的 通过体外研究热灭活阿萨希毛孢子菌(Trichosporon asahii,T.asahii)孢子对健康人外周血单核源树突状细胞(dendritic cells,DCs)的表型和功能的影响,探讨DCs在T.asahii感染中可能发挥的作用。方法 体外诱导培养正常人外周血DCs,与不同浓度的热灭活T.asahii孢子进行孵育,DCs与T.asahii浓度比分别为1∶1、1∶5和1∶10,RPMI⁃1640及脂多糖(lipopolysaccharide,LPS)刺激组分别作为空白对照及阳性对照,在显微镜下观察各组DCs形态的变化;瑞氏⁃姬姆萨染色观察实验组DCs对T.asahii的吞噬情况并计算吞噬率;流式细胞术检测各组DCs表面共刺激分子表达情况。结果 诱导孵育过程中DCs形态发生明显改变;24 h时实验组部分DCs内可观察到不止一个被吞噬的T.asahii孢子,吞噬率组间差异有统计学意义(P<0.05);与空白对照组相比,实验组DCs形态发生明显改变,且表面共刺激分子CD80、CD86、CD83表达水平明显升高(P<0.05),但升高水平低于LPS刺激组,差异有统计学意义(P<0.05)。结论 人外周血DCs吞噬热灭活的T.asahii孢子后,形态发生改变,表面分子表达水平升高,DCs进一步成熟。
【关键词】阿萨希毛孢子菌;树突状细胞;表面分子
The effects of T.asahii on monocyte⁃derived DCs phenotypic and functionWANG Rui⁃Li
1,2
,AO Jun⁃hong
1,2
,LIAO Yong
2
,YANG Rong⁃ya
2
,YANG Dong⁃qian
2
,LV Xue⁃lian
[Chin J Mycol,2015,10(5):266⁃271]
播散性毛孢子菌病是一种罕见的机会性深部真菌感染,常发生于免疫功能低下的人群,其病死率高达77%[1],目前认为阿萨希毛孢子菌(Tri⁃chosporon asahii,T.asahii)是其最主要的致病真菌。2001年杨蓉娅等[2]报道了国内首例播散性毛孢子菌病以来,该病的发病率呈明显上升趋势。既往研究发现T.asahii对目前大部分的抗真菌类药具有一定的耐药性,氟康唑、两性霉素B单独及联合用药治疗失败的案例已有报道[3]。因此,了解宿主感染T.asahii的免疫应答机制可能为进一步研发靶向治疗提供有力的理论基础。树突状细胞(dendritic cells,DCs)是目前已知的功能最强大的抗原提呈细胞,作为宿主固有免疫和适应性免疫的联系枢纽,DCs在病原微生物抗原的识别与呈递过程中发挥核心作用。以往研究发现DCs在白念珠菌[4]、红色毛癣菌[5]、烟曲霉[6]、新生隐球菌[7]、球孢子菌[8]的感染中可通过对病原真菌的吞噬、杀灭及激活适应性免疫应答等方式促进机体对病原真菌的清除,然而DCs在宿主抗T.asahii感染中是否发挥作用暂未见报道。本研究通过分离外周血单个核细胞(PBMC)诱导培养DCs,以热灭活T.asahii孢子进行体外干预,探讨人外周血单核细胞源DCs对T.asahii吞噬作用及其形态和表面分子变化,初步探究DCs在抗T.asahii感染中的免疫作用。
1 材料与方法
1.1 主要仪器及试剂
仪器 CKX41⁃A型倒置显微镜(日本Olym⁃Pus公司)、普通光学显微镜(德国Leica公司)、LRH⁃150⁃MS型真菌培养箱(广东省医疗器械厂)、ST16R高性能通用台式冷冻离心机(美国赛默飞世尔科技有限公司)、accuri C6流式细胞仪(美国BD公司)、恒温CO2培养箱(美国Thermo Multi⁃skan SPectrum)。
试剂 胎牛血清(FBS,美国Gibco公司)、RP⁃MI⁃1640液体培养基(美国Hyclone公司)、磷酸盐缓冲液(PBS,美国Hyclone公司)、0.25%胰蛋白酶(美国Hyclone公司)、链霉素⁃青霉素(美国Gibco公司)、L⁃谷氨酰胺(美国Sigma公司),人外周血淋巴细胞分离液(上海索莱宝生物科技有限公司)、瑞氏⁃姬姆萨染色液(南京建成科技有限公司)、台盼蓝(美国Sigma公司)、重组人粒细胞⁃集落细胞刺激因子(recombinant human granulocyte macrophage colony stimulating factor,rhGM⁃CSF,美国PeProtech公司)、重组人白介素⁃4(recombinant human interleukin⁃4,rhIL⁃4,美国PeProtech公司)、多聚赖氨酸(上海索莱宝生物科技有限公司)、脂多糖(lipopolysaccharide,LPS,北京宝瑞杰科技有限公司)、鼠抗人APC⁃CD11c单抗、鼠抗人FITC⁃ CD80单抗、鼠抗人PE⁃CD86单抗、鼠抗人PE/Cy7⁃CD83(美国BD公司)。
1.2 方法
T.asahii的分离培养与菌悬液的制备 T.asa⁃hii标准菌株(CBS2479)购自荷兰皇家学院真菌多样性中心(CBS),⁃80℃保存,使用前将⁃80℃保存T.asahii菌株转种于固体沙氏培养基,传代3次纯化培养后,挑取一接种环的T.asahii菌株接种于液体YPD培养基中,37℃、150 r/min摇床培养8 h,6 000 r/min离心5 min收集孢子,PBS重悬,血球记数板记数调整孢子悬液浓度为108CFU/mL,置于无菌三角烧瓶中121℃灭活15 min,4℃保存备用[9]。其他菌株继续培养,用于重复实验。
树突状细胞的分离及诱导 浓缩白细胞为北京军区总医院输血科惠赠,PBS 1∶1稀释混匀后,小心叠加至淋巴细胞分离液中,2 000 r/min离心20 min,吸取中间白膜层细胞,加入4~5倍体积的PBS吹打均匀,洗涤3遍,获得PBMC。将PBMC重悬于含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素、2 mmol/LL⁃谷氨酰胺的RPMI⁃1640完全培养液中,吹打均匀,调整浓度为1.0×106个/mL,均匀铺入6孔板,每孔2 mL,置37℃,5%CO2培养箱中贴壁2 h。取出6孔板,收集未黏附细胞冻存备用,贴壁细胞以含有rhGM⁃CSF 100 ng/mL、IL⁃4 500 IU/mL的完全RPMI⁃1640培养液继续培养,隔日半量换液并补足细胞因子[10]。
DCs鉴定及活性检测 细胞培养第5天,收集悬浮及半贴壁细胞,吸取制备的细胞悬液10 μL,用无血清培养基进行稀释,在100 μL的稀释细胞液中加入100 μL 0.4%的台盼蓝溶液混匀,5 min后用细胞计数板计算细胞数量并计算细胞存活率。染成蓝色的细胞为死细胞。细胞存活率计算公式为:细胞存活率=染色阴性细胞/细胞总数×100%。将制备的细胞悬液调成1×107个/mL,吸取100 μL,加入鼠抗人APC⁃CD11c单抗,4℃避光孵育30 min,通过流式细胞仪检测DCs表面因子CD11c的表达情况。
DCs吞噬功能检测 将1 cm×1 cm的无菌圆形载玻片置于24孔板中,每孔加入200 μL多聚赖氨酸,4℃包被过夜,吸弃多余的液体,用PBS漂洗2次,置于超净台中自然晾干,每孔加入1 mL浓度为1×105个/mL的DCs,贴壁2 h后加入热灭活的T.asahii悬液,DCs与T.asahii浓度比为1∶1、1∶5、1∶10,分别标记为1∗T.asahii、5∗T.asahii、10∗T.asahii,于37℃,5%CO2培养箱孵育。孵育过程中在倒置显微镜下观察各组DCs形态的变化。孵育24 h时,PBS漂洗3次,4%多聚甲醛固定后取出圆形盖玻片置于载玻片上,滴加瑞氏⁃姬姆萨染液,染色,自然干燥后在显微镜下观察多个视野中DCs 对T.asahii的吞噬现象,至少计数100个细胞,吞噬率=吞噬有T.asahii的DCs细胞个数/DCs总数×100%[11]。
DCs表面分子测定 收集诱导的DCs,调整计数为5×105个/mL,铺入6孔板中,每孔2 mL,分别加入不同浓度的T.asahii菌悬液,使DCs与T.asa⁃hii浓度比分别为1∶1、1∶5、1∶10,并标记为1∗T.asahii、5∗T.asahii、10∗T.asahi,完全培养基RP⁃MI⁃1640组作为空白对照,LPS刺激组(1 μg/mL)作为阳性对照,孵育24 h后收集各组DCs,按照试剂说明书,分别加入20 μL PE⁃CD86和APC⁃CD11c、FITC⁃80单抗及5 μL PE/cy7⁃CD83单抗,4℃避光孵育30 min,用PBS洗涤2次,流式细胞仪上机检测各组DCs表面表型变化。
统计学分析 采用SPSS 22.0软件进行分析数据,检测结果均以均数±标准差(ୱx±s)表示,采用单因素方差分析(ANOVA)进行各组均数间的两两比较,P<0.05认为差异有统计学意义。
2 结 果
2.1 培养过程中DCs形态变化及鉴定
人外周血单核细胞体外联合诱导后,在倒置显微镜下观察其形态的变化,第0天细胞大小均等,呈圆形,表面光滑,贴壁生长(见图1a),第3天可见细胞形态较前明显改变,体积略增大,部分细胞逐渐聚集成簇状细胞集落,集落边缘呈毛绒状(见图1b),第5天细胞逐渐从聚集变为分散状态,细胞体积较前明显变大,部分表面具有毛刺状突起,为典型的树突状细胞形态(见图1c)。培养第5天收集细胞,流式细胞术检测DCs表面CD11c的表达为(97.57±1.11)%(见图2),台盼蓝据染显示DCs活力>95%,表明DCs诱导成功,符合后续实验要求。
2.2 DCs对T.asahii吞噬功能
与空白对照组相比,不同浓度的T.asahii孢子刺激DCs后,其形态发生成熟样改变,细胞表面毛刺样结构增多,形状不规则,但变化无LPS组明显(见图3)。DCs与T.asahii共孵育30 min时即可发现DCs对T.asahii的吞噬现象,24 h时可见到部分DCs内吞噬不止一个T.asahii孢子(见图4)。DCs对不同浓度T.asahii孢子的吞噬率见表1,组间差异有统计学意义(P<0.05)。

表1 共孵育24 h时实验组DCs不同浓度T.asahii的吞噬率Tab.1 The phagocytic rates of DCs incubated with different concentra⁃tions of heat⁃inactived conidia after 24 hours of co⁃culture
2.3 T.aasahii对DCs表面分子的影响
收集培养至第5天的DCs,分别接受上述不同刺激因素处理后,以CD11c阳性的细胞圈门检测各组DCs表面共刺激分子表达情况。结果显示,CD11c+CD80+表达情况为空白对照组(59.97±1.209 7)%、1∗T.asahii组(63.37±1.150 3)%、5∗T.asahii组(68.1±2.260 5)%、10∗T.asahii组(73.47 ±1.457 2)%、LPS组(94.27±2.857 2)%;CD11c+CD86+表达情况为空白对照组(23.97±0.404 1)%、1∗T.asahii组(26.93±0.208 2)%、5∗T.asahii组(33.2±1.609 3)%、10∗T.asahii组(36.83±0.493 3)%、LPS组(99.73±0.115 5)%;CD11c+CD83+表达情况为空白对照组(6.3±0.529 2)%、1∗T.asahii组(11.97±0.737 1)%、5∗T.asahii组(15.73±0.611 0)%、10∗T.asahii组(26.13±2.957 0)%、LPS组(50.27±1.021 4)%;T.asahii刺激组与空白对照组相比CD80、CD86、CD83表达显著升高(P<0.05),但表达水平较LPS刺激组低,即使是10∗T.asahii组,共刺激分子CD80、CD86、CD83表达量也显著低于LPS组,各组间两两比较差异有统计学意义(P<0.05)。详细结果如图5所示。
3 讨 论
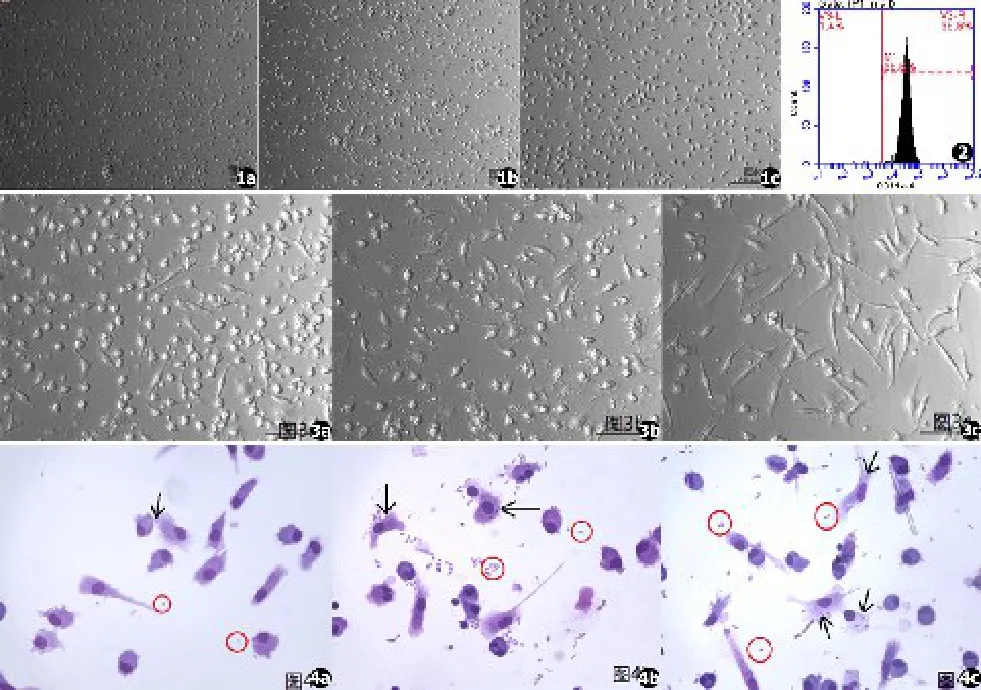
图1 不同培养时间DCs形态变化(倒置显微镜)。a.细胞体积较小,呈圆形,表面光滑,贴壁生长(培养第0天,×100);b.部分细胞聚集,形成集落(培养第3天,×100);c.细胞逐渐分散,表面出现毛刺状突起,为典型的树突状细胞形态(培养第5天,×200倍) 图2 DCs培养第5天表面CD11c表达情况(accuri C6流式细胞仪) 图3 DCs与T.asahii共孵育24 h时形态变化(倒置显微镜,×200)。a.空白对照组DCs形态变化;b.10∗T.asahii组DCs形态变化;c.LPS组DCs形态变化,10∗T.asahii组DCs与空白组相比形态向成熟状态转化,但不如LPS组明显 图4 24 h时DCs对T.asahii吞噬情况(普通光学显微镜,瑞氏⁃姬姆萨染色,×400)。a.1∗T.asahii组DCs对T.asahii的吞噬情况;b.5 ∗T.asahii组DCs对T.asahii的吞噬情况;c.10∗T.asahii组DCs对T.asahii的吞噬情况。镜下可均见到游离孢子(圆圈所示),DCs表面可见部分T.asahii孢子黏附,DCs细胞内部可见被吞噬的T.asahii孢子(箭头所示)Fig.1 Morphologic changes of human peripheral blood monocyte⁃derived dendrites cells at different times.On the first day of culture,the cells presen⁃ted typical precursor cell morphology,including small size,globular shape and a smooth surface:most of the cells were adherent(a×100).On 3days of culture,suspension cells increased obviously,which indicated an increase in volume and dendrites(b×100).On the fifth day of culture,the cells had differentiated into typical DC morphology with more dendrites and a larger size(c×200) Fig.2 The surface marker CD11c of monocyte⁃derived den⁃drites cells(accuri C6 Flow Cytometer)on the fifth day of culture Fig.3 Human peripheral blood monocyte⁃derived dendrites cells stimulated with heat⁃inactived conidia.DCs after 24 h of non⁃stimulated DCs(RPMI group)(a×200).DCs after 24 hours of co⁃culture with 10×conidia(b×200).DCs after 24 h of LPS⁃stimulated(c×200).The morphology of DCs in 10∗T.asahii group were significantly changed than non⁃stimulated DCs,but not as obvious as LPS group Fig.4 Monocyte⁃derived dendrites cells phagocytose heat⁃inactived conidia of T.asahii after 24 hours of co⁃culture(Optical microscope,Giemsa staining,×400).a.DCs infected with 1∗T.asahii,b.DCs infected with 5∗T.asahii,c.DCs infected with 10∗T.asahii.DCs were surrounded by many conidia,and some conidia were internalized by DCs
有效的细胞免疫应答在机体清除病原真菌感染过程中发挥重要的作用,DCs作为固有免疫和适应性免疫应答的桥梁,不仅可以摄取、加工、呈递特异性抗原,刺激初始T淋巴细胞(native T cells)增殖、诱导适应性T细胞免疫应答,决定免疫应答的方向,并在维持免疫耐受方面也具有重要作用[12]。正常情况下,人体内绝大多数DCs处于非成熟状态,表达能介导DCs摄取抗原的一些膜受体如Fc受体和甘露糖受体,因而具有极强的抗原摄取、加工和处理能力,但其表面缺乏或低表达MHCⅡ分子和共刺激分子,限制抗原提呈及激发免疫应答的能力。既往研究表明未成熟DCs体外接受申克孢子丝菌[13]、白念珠菌[6]、烟曲霉[8]、新型隐球菌[9]、红色毛癣菌[7]、巴西副球孢子菌[14]及非致病性真菌,如猴头菌[15],糠秕马拉色菌[16]和酿酒酵母[17]等微生物刺激后,可进行加工和处理,获得一系列的信号刺激后,分化为成熟DCs,主要表现为:①形态发生改变。②丢失介导吞噬的受体。③表面共刺激分子包括CD83、CD80、CD86及MHCⅡ分子表达水平升高。④分泌细胞因子,获得抗原提呈及促进T淋巴细胞增殖的能力[18⁃19]。然而T.asahii对DCs表型及功能的影响尚未见报道。
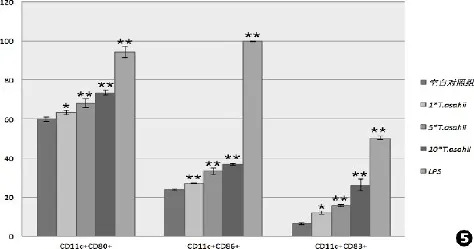
图5 各组DCs表面共刺激分子表达情况。T.asahii刺激组及LPS刺激组表面共刺激分子CD80、CD86、CD83表达水平与空白对照组相比显著升高,各组数据采用单因素方差分析,F值分别为FCD80=156.045、FCD83=410.560、FCD86=9948.203,P均<0.05,各组间差异有统计学意义。∗与空白对照组相比差异有统计学意义,P<0.05;∗∗与空白对照组相比差异有统计学意义,P<0.01Fig.5 Sur⁃face markers of human peripheral blood monocyte⁃derived dendrites cells.Both the LPS and inactive conidia groups(1×conidia,5×conidia and 10×conidia groups)promoted an increase in the percentage of cells surface markers CD80,CD86 or CD83 compared to non⁃stimulated DCs (RPMI group).Data areୱx±s,FCD80=156.045,FCD83=410.560,FCD86=9 948.203,∗P<0.05 vs.Control;∗∗P<0.01 vs.Control
本实验采用人外周血PBMC体外培养,rh⁃GM⁃CSF和rIL⁃4细胞因子联合诱导的方法获得具有典型形态的非成熟DCs,与热灭活的T.asa⁃hii孢子体外共培养,结果发现DCs接受T.asahii刺激后,30 min时可发现DCs对T.asahii的吞噬现象,24 h时部分DCs细胞内可见到不止一个的T.asahii孢子,说明DCs在T.asahii感染过程中发挥识别、黏附、吞噬功能,Newman等[20]通过研究DCs对白念珠菌的吞噬作用发现,共孵育10 min后即可发现吞噬现象,1 h后DCs对白念珠菌的吞噬率可高达60%,显著高于本实验的研究结果,因此我们推测T.asahii可能具有一定的抗吞噬能力。未成熟DCs对真菌孢子及菌丝均有一定的吞噬作用,识别、黏附、吞噬功能主要通过其表面丰富的模式识别受体(Pattern recognition receptors,PRRs)来实现,如DCs可通过甘露糖受体和β⁃葡聚糖受体介导对无荚膜隐球菌的吞噬过程[9],DC⁃SIGN受体和甘露糖受体参与了DCs对白念珠菌、红色毛癣菌的识别和吞噬[21],C⁃凝集素受体、Fc受体、TLR9受体则在DCs对孢子态和菌丝态的烟曲霉的识别吞噬中发挥重要作用[22⁃23]。但介导对T.asahii吞噬的受体目前尚不清楚。
DCs成熟活化后其形态、表型发生明显改变,主要表现在形状不规则、毛刺样结构增多、贴壁能力增强,共刺激分子CD80、CD86、CD83 及MHCⅡ分子表达升高,由于CD83在未成熟DCs几乎不表达,被认为是DCs成熟的主要标志。Wang等[23]通过对小鼠骨髓源DCs与热灭活的烟曲霉菌孢子体外共孵育发现,烟曲霉菌孢子可促进DCs表面共刺激分子CD80、CD86、CD83的表达及细胞因子IL⁃12、IFN⁃γ、TGF⁃β的分泌,启动机体适应性免疫应答。然而Huston等[24]体外研究发现格特隐球菌与DCs共孵育后,DCs表面共刺激分子MHCⅡ、CD80、CD86、CD83无明显升高,不能促进DCs成熟与活化,不能诱导T淋巴细胞增殖。本研究中我们发现空白对照组DCs表面分子CD80、CD86中低水平表达,而CD83几乎无表达,接受T.asashii刺激后表面共刺激分子CD80、CD86、CD83明显升高,差异有统计学意义,且与空白对照组相比DCs形态更加不规则,表面毛刺样结构明显增多,DCs进一步成熟,与白念珠菌、烟曲霉等研究结果相一致,与格特隐球菌结果相反,这可能是由于格特隐球菌荚膜及胞壁中含有大量的葡萄糖醛酸木糖甘露聚糖(Glucuronoxylomannan,GXM)导致,因为GXM具有拮抗DCs对格特隐球菌的吞噬及抑制单核细胞抗原提呈的功能[25]。
本实验从DCs形态、吞噬功能、表面分子3个方面证实了T.asahii对人外周血来源的DCs成熟与功能的改变,提示T.asahii感染人体后可通过诱导DCs成熟与活化,启动宿主有效免疫应答,促进宿主对阿萨希毛孢子菌的清除,然而DCs对T.asahii的识别受体及细胞内信号转导通路及机制还有待于进一步研究。
参考文献
[1] Girmenia C,Pagano L,Martino B,et al.Invasive infections caused by Trichosporon species and Geotrichum capitatum inpatients with hematological malignancies:a retrospective multi⁃center study from Italy and review of the literature[J].Clin Mi⁃crobiol,2005,43(4):1818⁃1828.
[2] 杨蓉娅,敖俊红,王文岭,等.阿萨希丝孢酵母引起播散性毛孢子菌病国内首例报告[J]中华皮肤科杂志,2001,34(5):329⁃332.
[3] Pfaller MA,Diekema DJ.Rare and emerging opportunistic fungal pathogens:concern for resistance beyond Candida albicans and Aspergillus fumigatus.[J].Clin Microbiol,2004,42(10):4419⁃4431.
[4] Romagnoli G,Nisini R,Chiani P,et al,The interaction of human dendritic cells with yeast and germ⁃tube forms of Candida albi⁃cans leads to efficient fungal processing,dendritic cell matura⁃tion,and acquisition of a Th1 response⁃promoting function[J].Leukoc Biol,2004,75(1):117⁃126.
[5] Santiago K,Bomfim GF,Criado PR,et al.Monocyte⁃derived den⁃dritic cells from patients with dermatophytosis restrict the growth of Trichophyton rubrum and induce CD4⁃T cell activa⁃tion[J].PLoS One,2014,9(11):e110879.
[6] Gafa V,Remoli ME,Giacomini E,et al.In vitro infection of hu⁃man dendritic cells by Aspergillus fumigatus conidia triggers the secretion of chemokines for neutrophil and Th1 lymphocyte re⁃cruitment[J].Microbes Infect,2007,9(8):971⁃980.
[7] Wozniak KL,Levitz SM.Cryptococcus neoformans enters the en⁃dolysosomal pathway of dendritic cells and is killed by lysosom⁃al components.[J].Infect Immun,2008,76(10):4764⁃4771.
[8] Kelly RM,Chen J,Yauch LE,et al.Opsonic requirements for dendritic cell⁃mediated responses to Cryptococcus neoformans [J].Infect Immun,2005,73(1):592⁃598.
[9] Syme RM,Spurrell JC,Amankwah EK,et al.Primary dendritic cells phagocytose Cryptococcus neoformans via mannose recep⁃tors and Fcγ receptorⅡfor presentation to T lymphocytes[J].Infect Immun,2002,70(11):5972⁃5981.
[10] Li DY,Gu C,Min J,et al,Maturation induction of human pe⁃ripheral blood mononuclear cell⁃derived dendritic cells[J].Exp Ther Med,2012,4(1):131⁃134.
[11] 丛林,夏志宽,杨蓉娅.补体对RAW264.7小鼠巨噬细胞吞噬阿萨希毛孢子菌的增强作用[J].实用皮肤病学杂志,2013,6(4):195⁃197.
[12] Ohnmacht C,Pullner A,King SB,et al.Constitutive ablation of dendritic cells breaks self⁃tolerance of CD4 T cells and results in spontaneous fatal autoimmunity[J].Exp Med,2009,206(3):549⁃559.
[13] Verdan FF,Faleiros JC,Ferreira LS,et al.Dendritic cell are able to differentially recognize Sporothrix schenckii antigens and Pro⁃mote Th1/Th17 response in vitro[J].Immunobiology,2012, 217:788⁃794.
[14] Loures FV,Pina A,Felonato M,et al.MyD88 signaling is re⁃quired for efficient innate and adaptive immune responses to Paracoccidioides brasiliensis infection[J].Infect Immun,2011,79(6):2470⁃2480.
[15] Kim SK,Son CG,Yun CH,et al.Hericium erinaceum induces maturation of dendritic cells derived from human peripheral blood monocytes[J].Phytother Res,2010,24(1):14⁃19.
[16] Buentke E,Heffler LC,Wallin RP,et al.The allergenic yeast Malassezia furfur induces maturation of human dendritic cells [J].Clin Exp Allergy,2001,31(10):1583⁃1593.
[17] Vittore Cereda,a Matteo Vergati,a Ngar⁃Yee Huen,et al.Matu⁃ration of human dendritic cells with Saccharomyces cerevisiae (yeast)reduces the number and function of regulatory T cells and enhances the ratio of antigen⁃specific effectors to regulatory T cells[J].Vaccine,2011,29(31):4992⁃4999.
[18] 曹雪涛.免疫学前沿进展[M].北京:人民卫生出版社,2009:68⁃69.
[19] Mellman I.Dendritic cells:master regulators of the immune re⁃sponse[J].Cancer Immunol Res,2013,1(3):145⁃149.
[20] Newman SL,Holly A.Candida albicans is phagocytosed,killed,and processed for antigen presentation by human dendritic cells [J].Infect Immun,2001,69(11):6813⁃6822.
[21] Bozza S,Gaziano R,Spreca A,et al.Dendritic cells transport conidia and hyphae of Aspergillus fumigatus from the airways to the draining lymph nodes and initiate disparate Th responses to the fungus[J].Immunol,2002,168(3):1362⁃1371.
[22] Susanne Herbst,Anand Shah,Maria Mazon Moya.et al.Phagocy⁃tosis⁃dependent activation of a TLR9⁃BTK⁃calcineurin⁃NFAT pathway co⁃ordinates innate immunity to Aspergillus fumigatus [J].EMBO Mol Med,2015,7(3):240⁃258.
[23] Wang Runchao,Wan Zhe and Li Ruoyu.Th and Treg response induced byAspergillus fumigatus pulsed dendritic cells in vitro [J].Chin Med J,2014,127(20):3616⁃3622.
[24] Huston SM1,Li SS,Stack D,et al.Cryptococcus gattii is killed by dendritic cells,but evades adaptive immunity by failing to in⁃duce dendritic cell maturation[J].Immunol,2013,191(1):249⁃261.
[25] Retini C,Vecchiarelli A,Monari C,et al.Encapsulation of Cryp⁃tococcus neoformans with glucuronoxylomannan inhibits the anti⁃gen⁃presenting capacity of monocytes[J].Infect Immun,1998,66(2):664⁃669.
[本文编辑] 卫凤莲
·论著·
2
,CHEN Shan⁃shan
2
(1.Clinical College of General Hospital of Beijing Military Command of PLA,Anhui Medical University,Beijing 100700,China;2.Insti⁃tute of Skin Damage and Repair,General Hospital of Beijing Military Command,Beijing 100700,China)
【Abstract】Objective To investigate the effects of Trichosporon asahii on the phenotypic and functional maturation of human pe⁃ripheral blood monocyte⁃derived dendritic cells(DCs).Methods The monocyte⁃derived DCs of health donors were obtained by cul⁃ture in vitro.In the experimental groups,DCs stimulated by different doses of heat⁃inactived T.asahii conidia(DCs∶T.asahii=1∶1,1∶5,1∶10),RPMI⁃1640 and lipopolysaccharide(LPS)stimulation groups were as the blank control and positive control,respec⁃tively.Shapes of the cells were observed under the inverted microscope,the rate of phagocytosis was calculated by Wright Giemsa stai⁃ning.DCs maturation was analysed by using flow cytometry.Results The morphology of DCs was significantly changed during incuba⁃tion.At 24 h,more than one T.asahii conidias were efficiently bound and internalized by DCs and the phagocytic rates were signifi⁃cantly different between the experimental groups(P<0.05).The expressions of CD80,CD86,CD83 in the experimental groups were much higher than the blank control group(P<0.05),but significantly lower than LPS group(P<0.05).Conclusion T.asahii can change the morphology of DCs and promote the expression of surface molecules,which enhance the maturation of the dendritic cells.
【Key words】T.asahii;dendritic cells;surface molecules
[收稿日期]2015⁃08⁃13
基金项目:国家自然科学基金(81201236),首都发展科研专项(首发2011⁃5021⁃04)
【文章编号】1673⁃3827(2015)10⁃0266⁃06
【文献标识码】A
【中图分类号】R 379.9
通讯作者:敖俊红,E⁃mail:aojunhong@sina.com
作者简介:王瑞丽,女(汉族),硕士研究生在读.E⁃mail:wangruilivv @126.com
