中国南北方地区临床孢子丝菌菌种鉴定
2015-12-26贺羽黄梦雅胡青碧周汛重庆医科大学附属第一医院皮肤科重庆40006重庆市中医院皮肤美容科重庆40002
贺羽黄梦雅胡青碧周汛,2(重庆医科大学附属第一医院皮肤科,重庆40006;2.重庆市中医院皮肤美容科,重庆40002)
中国南北方地区临床孢子丝菌菌种鉴定
贺羽1黄梦雅1胡青碧1周汛1,2
(重庆医科大学附属第一医院皮肤科,重庆400016;2.重庆市中医院皮肤美容科,重庆400021)
【摘要】目的 对分离自我国南、北方地区50株临床孢子丝菌进行菌种鉴定。方法 分离菌株分别进行25℃恒温培养和玻片小培养,肉眼和镜下观察形态特征;同时提取菌丝相基因组DNA,用PCR分别扩增部分微管蛋白(β⁃tubulin)基因和核糖体内部转录间隔区(Ribosomal Internal Transcribed Spacer,ITS),扩增产物进行测序,并采用最大似然法(maximum likeli⁃hood,ML)和邻接法(neighbor⁃joining,NJ)构建联合β⁃tubulin基因和ITS区域的系统发育树。结果 结合形态学及系统发育分析,50株菌均鉴定为球形孢子丝菌(Sporothrix globosa,S.globosa)。结论 球形孢子丝菌是目前我国南、北方地区孢子丝菌病的主要致病菌种,为进一步明确我国孢子丝菌病致病菌种的分布提供了依据。
【关键词】孢子丝菌;形态学;系统发育;球形孢子丝菌
Species identification of Sporothrix clinical isolates in Northern and Southern of ChinaHE Yu
1
,HUANG Meng⁃Ya
1
,HU Qing⁃bi
[Chin J Mycol,2015,10(5):279⁃282]
孢子丝菌是双相型真菌,普遍存在于自然界,可从土壤和腐烂植物中分离[1]。该菌包括巴西孢子丝菌、球形孢子丝菌、申克孢子丝菌等6个菌种[2]。孢子丝菌感染人或动物后可引起孢子丝菌病,主要表现为皮肤、皮下组织及其附近淋巴系统的慢性肉芽肿性病变[3],可经血液、淋巴系统扩散累及心、肺、脑等脏器,具有一定的致残率和致死率[4]。各个菌种在地理分布、毒力及对抗真菌药物敏感性等方面存在差异,可能是基因多态性所致[3,5],因此明确致病菌种类型在治疗及预后方面有重要的指导意义。
在我国孢子丝菌病是仅次于念珠菌病和曲霉病的深部真菌病,东北部是好发地区[6]。以往经形态学鉴定认为我国的致病菌种为申克孢子丝菌,随着生物信息技术的发展,越来越多的研究发现球形孢子丝菌是目前我国的主要致病菌种[7⁃8],但需要更多的临床样本证实。本实验对我国南、北方地区50株临床菌株进行形态学观察及系统发育分析,以期为明确我国孢子丝菌病致病菌种分布情况提供依据。
1 材料与方法
1.1 材料
实验菌株 50株孢子丝菌分离自孢子丝菌病患者皮损处。22株来自重庆医科大学附属第一医院,编号C01⁃C22。14株来自吉林大学第二医院,编号J14⁃J28。14株来自北京大学附属医院,编号B04481⁃B04494。
培养基及试剂 2%马铃薯葡萄糖琼脂培养基(Potato Dextrse Agar Medium,PDA),DNAMark⁃er1000,Premix TaqTM(TaKaRa,Japan),溴化十六烷基三甲胺等DNA提取相关试剂。
1.2 形态学观察
肉眼观察 将菌株分别接种在2%PDA培养基上,25℃恒温培养14 d,肉眼观察菌落形态结构。
镜下观察 所有菌株进行玻片小培养[9],7 d后显微镜下观察形态特征。
1.3 分子生物学鉴定
DNA提取 将菌株接种于2%PDA培养基上,25℃恒温培养7 d后提取菌丝相DNA[10]。用Nan⁃oDrop分光光度计评估DNA,光密度值在1.8~2.0提示纯度较高,并调整浓度为100~300 ng/μL以备PCR扩增。
PCR扩增ITS序列及β⁃tubulin基因 分别用引物BT2a/BT2b、ITS1/ITS4扩增β⁃tubulin基因和ITS序列[7],引物由北京华大基因公司合成。PCR反应条件参照Premix⁃TaqTM使用说明书。PCR产物经1.2%琼脂糖凝胶电泳后用凝胶成像系统记录结果。
PCR产物序列测定及系统发育分析 PCR产物交由北京华大基因公司进行双向测序。测序结果在BLAST(http://www.ncbi.nlm.nih.gov/blast)上进行比对,确认为孢子丝菌序列后,用Bioedit软件拼接两组序列。在NCBI中下载孢子丝菌6个菌种和同源物种Ophiostoma nigrocarpum(O.nigro⁃carpum)的β⁃tubulin基因及ITS序列作为参考序列并进行拼接。登陆http://www.ebi.ac.uk/Tools/msa/mafft进行多序列比对,将比对结果导入MEGA5软件,采用ML法和NJ法构建系统发育树,并用1 000次自引导法重复检测发育树分支置信度[11]。
2 结 果
2.1 形态学观察
肉眼观察 25℃恒温培养3~4 d后出现白色、乳白色菌落,后颜色逐渐加深为棕色或黑色,部分菌落保持白色;菌落呈椭圆形,表面有皱褶或毛刺,中央略高起,边缘可见膜状乳白色晕。14 d后可见3种颜色的菌落(见图1)。
显微镜下观察 7 d后镜下见细长菌丝两侧直角分出分生孢子柄,顶端有圆形或卵圆形分生孢子,呈花瓣状排列,部分孢子直接沿菌丝两侧生长(见图2)。
2.2 分子生物学鉴定
PCR扩增结果 ITS区域扩增产物约600 bp(见图3),β⁃tubulin基因扩增产物约400 bp(见图4),符合孢子丝菌该基因片段长度,所有菌株均测序成功。
成功构建系统发育树 所有菌株ITS序列及β⁃tubulin基因与球形孢子丝菌(CBS120340)有98%以上的相似性,进化距离最近,在ML树和NJ树中处于同一分支,故鉴定为球形孢子丝菌(见图5)。
3 讨 论
孢子丝菌于1989年由美国人Shenk首次在患者皮损处分离,故命名为申克孢子丝菌,以往认为申克孢子丝菌是国内外孢子丝菌病的唯一致病菌种[12],近年来发现该菌并非单一的菌种,而是6个菌种构成的复合体。巴西孢子丝菌仅见于巴西,申克孢子丝菌多见于美洲、非洲、亚洲,球形孢子丝菌在全世界广泛分布[13],其余3个菌种报道较少。孢子丝菌常通过接种于人或动物的皮肤伤口而致病,临床分为固定型、淋巴管型、皮肤外型、播散型[1],临床型别的差异主要与孢子丝菌毒力、接种量及宿主免疫功能等有关[14]。Arrillaga⁃Moncrief等[15]研究发现巴西孢子丝菌、申克孢子丝菌毒力最强,球形孢子丝菌次之,前者可经血液或淋巴扩散引起播散型孢子丝菌病[4],后者以皮肤固定型孢子丝菌病多见,目前两性霉素B联合伊曲康唑是播散型的一线治疗药物,而单用伊曲康唑是固定型的一线治疗药物[1]。毒力的大小与产色素能力、耐热性等密切相关[14],巴西孢子丝菌、申克孢子丝菌可产生大量色素使菌落黑化,且耐热力强,37℃体外培养时生长良好,而球形孢子丝菌色素生成相对较少,耐热力较差,37℃培养时生长明显受抑制[16⁃17]。Marimon等[18]对不同国家的5个菌种进行抗真菌药物敏感性试验发现所有菌株对特比萘芬最敏感,巴西孢子丝菌对抗真菌药物最敏感,墨西哥孢子丝菌最不敏感,而Ottonelli[19]研究发现巴西地区的不同菌种对抗真菌药物的敏感性没有明显差异,认为与Marimon的实验结果不同的原因在于菌株收集局限在巴西,而非来自不同国家。可见各个菌种在地理分布、毒力及抗真菌药物敏感性等方面存在差异,因此明确致病菌种类型在治疗及预后方面有重要的指导意义。

图1 25℃培养14 d后孢子丝菌菌落形态:a.黑色菌落,b.乳白色菌落,c.棕色菌落 图2 孢子丝菌镜下形态(一比例尺=10 μm):a.大量圆形分生孢子;b.大量卵圆形分生孢子;c.菌丝密集分布,少量孢子着生于菌丝两侧 图3 β⁃tubulin扩增产物电泳图(a:1.Marker 1 000 bp,2⁃26.C01⁃C22、J15、J16、J17:β⁃tubulin基因;b:1.Marker 1 000 bp,2⁃26.J17⁃J28、B04481⁃B04489:β⁃tubulin基因) 图4 ITS扩增产物电泳图(a:1.Marker 1 000 bp,2⁃26.C01⁃C22、J15、J16、J17:ITS基因;b:1.Marker 1 000 bp;2⁃26.J17⁃J28、B04481⁃B04489:ITS基因)Fig.1 General conformation of Sporothrix cultured on 2%PDA at 25℃in 14 days:a.Black colony,b.White colony,c.Brown colony Fig.2 Micros⁃copy of Sporothrix(a scale bars=10 μm):a.Abundant of round spores,b.Abundant of oval⁃shaped spores,c.Amount of hyphae with less spores Fig.3 PCR products of β⁃tubulin(a:1.Marker1 000 bp;2⁃26.C01⁃C22,J15,J16,J17:β⁃tubulin genes.b:1.Marker1 000 bp;2⁃26.J17⁃J28,B04481⁃B04489:β⁃tubulin genes) Fig.4 PCR products of ITS(a:1.Marker 1 000 bp;2⁃26.C01⁃C22,J15,J16,J17:ITS genes.b:1.Marker 1 000 bp;2⁃26.J17⁃J28,B04481⁃B04489:ITS genes)
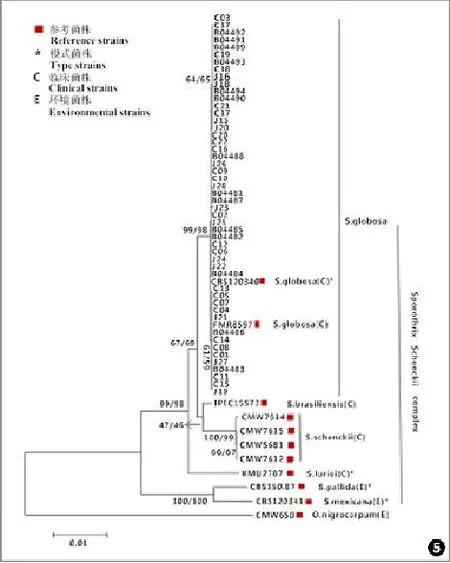
图5 联合β⁃tubulin基因和ITS序列的系统进化树(O.nigrocarpum是树根,邻近树枝的数值代表的是1 000次自引导法重复检测下(ML/NJ)树的自检举支持率)Fig.5 Phylogenetic relationships of β⁃tubulin genes and ITS sequences (Thephylogenetic tree is rooted with O.nigrocarpum.The number closed to branches represent indices of support(ML/NJ)based on 1 000 boot⁃strap replications)
孢子丝菌复合体各隐含种形态相近[1,17],观察形态结构不能准确鉴定菌种类型。有研究者采用Marimon区分各菌种的表型试包括碳源同化、37℃生长情况及28℃接种于PDA培养基上菌落直径和系统发育分析对孢子丝菌进行鉴定发现10.1%的菌株通过表型特征不能准确鉴定菌种类型[20],Ot⁃tonelli的试验中表型同基因型鉴定结果的差异高达37.7%[19],而谭静文等[21]对我国临床菌株进行表型和基因型鉴定发现两种方法的结果一致,可见对于表型实验鉴定菌种类型的准确性并未达成共识。Oliveira等[22]首次将基质辅助激光解吸电离飞行时间质谱术用于孢子丝菌菌种分类,认为通过蛋白质谱分析能准确、快速鉴定6个菌种,但目前该技术应用甚少,仍需大量实验进行验证。分子生物学方法可从基因水平上检测孢子丝菌,PCR、巢式PCR、肽指纹图谱分析等技术已被用于鉴定孢子丝菌,并且在菌种分类上具有显著优势,Marimon等[2]利用CAL基因将其分为6个菌种,Camacho等[23]利用CAL基因及ITS序列鉴定发现委内瑞拉地区存在申克孢子丝菌和球形孢子丝菌两个种。
本研究对临床菌株进行形态学观察,发现50株菌株均符合孢子丝菌的形态学特点,但据此不能准确鉴定菌种类型。通过联合β⁃tubulin基因和ITS区域构建系统发育树分析,所有菌株均鉴定为球形孢子丝菌,与之前的研究结果一致[7⁃8,21],进一步证实了我国南、北方地区分布的孢子丝菌以球形孢子丝菌为主,为明确我国孢子丝菌菌种分布提供了依据。PCR及其相关技术是目前鉴定孢子丝菌的主要分子生物学技术,但因技术要求较高,目前未广泛用于临床诊断,仅限于实验室研究,因此我们将进一步探索设计针对各菌种间多位点差异序列的种特异性引物,应用环介导等温扩增技术(Loop⁃mediated isothermal Amplication,LAMP)等更为简单、快速的新兴技术实现对孢子丝菌病致病菌种的鉴定。
参考文献
[1] Mahajan VK.Sporotrichosis:an overview and therapeutic options [J].Dermatol Res Pract,2014,2014:272376.
[2] Marimon R,Gene J,Cano J,et al.Molecular phylogeny of Sporo⁃thrix schenckii[J].J Clin Microbiol,2006,44(9):3251⁃3256.
[3] Tellez MD,Batista⁃Duharte A,Portuondo D,et al.Sporothrix schenckii complex biology:environment and fungal pathogenicity [J].Microbiology,2014,160(Pt 11):2352⁃2365.
[4] Moreira JA,Freitas DF,Lamas CC.The impact of sporotrichosis in HIV⁃infected patients:a systematic review[J].Infection,2015,43(3):267⁃276.
[5] Fernandes GF,Dos SP,Rodrigues AM,et al.Characterization of virulence profile,protein secretion and immunogenicity of differ⁃ ent Sporothrix schenckii sensu stricto isolates compared with S.globosa and S.brasiliensis species[J].Virulence,2013,4(3):241⁃249.
[6] Song Y,Li SS,Zhong SX,et al.Report of 457 sporotrichosis cases from Jilin province,northeast China,a serious endemic region [J].J Eur Acad Dermatol Venereol,2013,27(3):313⁃318.
[7] Liu TT,Zhang K,Zhou X.Molecular identification of Sporothrix clinical isolates in China[J].J Zhejiang Univ Sci B,2014,15 (1):100⁃108.
[8] Yu X,Wan Z,Zhang Z,et al.Phenotypic and molecular identifi⁃cation of Sporothrix isolates of clinical origin in Northeast China [J].Mycopathologia,2013,176(1⁃2):67⁃74.
[9] 黄怀球,袁立燕,张静,等.申克孢子丝菌的扫描电镜观察[J].热带医学杂志,2012,(12):1442⁃1443.
[10] Allen GC,Flores⁃Vergara MA,Krasynanski S,et al.A modified protocol for rapid DNA isolation from plant tissues using cetyltri⁃methylammonium bromide[J].Nat Protoc,2006,1(5):2320⁃2325.
[11] Zharkikh A,Li WH.Estimation of confidence in phylogeny:the complete⁃and⁃partial bootstrap technique[J].Mol Phylogenet Evol,1995,4(1):44⁃63.
[12] Lopes⁃Bezerra LM,Schubach A,Costa RO.Sporothrix schenckii and sporotrichosis[J].An Acad Bras Cienc,2006,78(2):293⁃308.
[13] Madrid H,Cano J,Gene J,et al.Sporothrix globosa,a pathogenic fungus with widespread geographical distribution[J].Rev Ibe⁃roam Micol,2009,26(3):218⁃222.
[14] Carlos IZ,Sassa MF,Da GSD,et al.Current research on the im⁃mune response to experimental sporotrichosis[J].Mycopatholo⁃gia,2009,168(1):1⁃10.
[15] Arrillaga⁃Moncrieff I,Capilla J,Mayayo E,et al.Different viru⁃lence levels of the species of Sporothrix in a murine model[J].Clin Microbiol Infect,2009,15(7):651⁃655.
[16] Almeida⁃Paes R,de Oliveira LC,Oliveira MM,et al.Phenotypic characteristics associated with virulence of clinical isolates from the Sporothrix complex[J].Biomed Res Int,2015,2015:212308.
[17] Marimon R,Cano J,Gene J,et al.Sporothrix brasiliensis,S.globo⁃sa,and S.mexicana,three new Sporothrix species of clinical in⁃terest[J].J Clin Microbiol,2007,45(10):3198⁃3206.
[18] Marimon R,Serena C,Gene J,et al.In vitro antifungal suscepti⁃bilities of five species of Sporothrix[J].Antimicrob Agents Che⁃mother,2008,52(2):732⁃734.
[19] Ottonelli SC,Magagnin CM,Castrillon MR,et al.Antifungal sus⁃ceptibilities and identification of species of the Sporothrix schenckii complex isolated in Brazil[J].Med Mycol,2014,52 (1):56⁃64.
[20] Oliveira MM,Almeida⁃Paes R,Muniz MM,et al.Phenotypic and molecular identification of Sporothrix isolates from an epidemic area of sporotrichosis in Brazil[J].Mycopathologia,2011,172 (4):257⁃267.
[21] 谭静文,刘伟,万喆,等.来自中国北方部分地区33株孢子丝菌菌株的表型和基因型鉴定[J].菌物学报,2013(02):162⁃168.
[22] Oliveira MM,Santos C,Sampaio P,et al.Development and opti⁃mization of a new MALDI⁃TOF protocol for identification of the Sporothrix species complex[J].Res Microbiol,2015,166(2):102⁃110.
[23] Camacho E,Leon⁃Navarro I,Rodriguez⁃Brito S,et al.Molecular epidemiology of human sporotrichosis in Venezuela reveals high frequency of Sporothrix globosa[J].BMC Infect Dis,2015,15:94.
[本文编辑] 施 慧
·论著·
1
,ZHOU Xun
1,2
(Department of Dermatology,The First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China;2.Department of Dermatology and Cosmetology,Chongqing Hospital of Traditional Chinese Medicine,Chongqing 400021,China)
【Abstract】Objective To identify 50 Sporothrix clinical isolates in Northern and Southern of China.Methods All isolates from patients were subcultured at 25℃and morphological characteristic was analysed by microscope and visual inspection.The total ge⁃nomic DNA was extracted to amplify the partial β⁃tubulin gene and the internal transcribed(ITS)region by polymerase chain reac⁃tion(PCR).The phylogenetic tree was constructed by DNA sequences analyses based on datasets of ITS and a combined ITS and partial β⁃tubulin region using maxium likehood(ML)and neighbor⁃joining(NJ)methods with MEGA5 software.The Reference se⁃quences used for phylogenetic analyses were retrieved from GenBank.Result The macroscopic morphologies and microscopic fea⁃tures of all isolates were comformed to Sporothrix spp.The phylogenetic tree showed that all of the isolates were clustered in a distinct clade with a type of Sporothrix globosa.Conclusion S.globosa may be the major Sporothrix existing in northern and southern of Chi⁃na,which can provide basis for the epidemiological investigation of Sporothrix.
【Key words】Sporothrix;morphology;phylogeny;Sporothrix globosa
[收稿日期]2015⁃06⁃23
基金项目:国家自然科学基金(31270062)
【文章编号】1673⁃3827(2015)10⁃0279⁃04
【文献标识码】A
【中图分类号】R 519.8
通讯作者:周汛,E⁃mail:zhouxun123@sina.com
作者简介:贺羽,女(汉族),硕士研究生在读.E⁃mail:15123825300 @163.com
