急性侵袭性真菌性鼻⁃鼻窦炎大鼠模型的建立
2015-12-26阎玉彦赵作涛刘红刚首都医科大学附属北京同仁医院病理科头颈部分子病理诊断北京市重点实验室北京0070河北省儿童医院耳鼻咽喉头颈外科石家庄0500北京大学第一医院皮肤病与性病科北京0004
阎玉彦赵作涛刘红刚(.首都医科大学附属北京同仁医院病理科,头颈部分子病理诊断北京市重点实验室,北京0070;2.河北省儿童医院耳鼻咽喉头颈外科,石家庄0500;.北京大学第一医院皮肤病与性病科,北京0004)
急性侵袭性真菌性鼻⁃鼻窦炎大鼠模型的建立
阎玉彦1,2赵作涛3刘红刚1
(1.首都医科大学附属北京同仁医院病理科,头颈部分子病理诊断北京市重点实验室,北京100730;2.河北省儿童医院耳鼻咽喉头颈外科,石家庄050031;3.北京大学第一医院皮肤病与性病科,北京100034)
【摘要】目的 建立稳定且易操作的急性侵袭性真菌性鼻⁃鼻窦炎大鼠模型,以促进对急性侵袭性真菌性鼻⁃鼻窦炎的实验研究,指导临床。方法 将SD大鼠随机分为4组。A组,免疫抑制+右侧鼻腔填塞Merocel海绵条+右侧鼻腔滴入烟曲霉孢子悬液;B组,右侧鼻腔填塞Merocel海绵条+右侧鼻腔滴入烟曲霉孢子悬液;C组,免疫抑制+右侧鼻腔滴入烟曲霉孢子悬液;D组:对照组。A、B、C组大鼠连续3 d鼻内滴入烟曲霉孢子悬液,4组大鼠均于第1次滴菌后第4天处死。取内眦静脉血监测大鼠免疫抑制情况,对鼻部组织行真菌培养和组织病理学观察。结果 免疫抑制组大鼠血中性粒细胞明显降低,接种烟曲霉当天中性粒细胞计数<0.1×109/L,其余两组变化不明显。病理结果显示A组90%(9/10)大鼠鼻腔鼻窦组织被烟曲霉侵袭,10%(1/10)肺部可见侵袭;B、C、D组大鼠无鼻部烟曲霉感染,但C组中20%(2/10)大鼠肺部可见烟曲霉侵袭。真菌培养结果显示A组71%(5/7)大鼠鼻部组织烟曲霉培养阳性,其他组均为阴性。结论 单纯对大鼠进行免疫抑制或单纯造成大鼠鼻腔堵塞均不易造成大鼠鼻腔被真菌侵袭;免疫抑制基础上,对大鼠鼻腔填塞Merocel海绵条后再滴入烟曲霉可以成功建立急性侵袭性真菌性鼻⁃鼻窦炎模型,其成模率高,模型稳定,操作简易,有利于对此疾病在免疫、病理、药物等方面的深入研究。
【关键词】侵袭性鼻窦炎;烟曲霉;大鼠模型
Establishment of a rat model of acute invasive fungal rhinosinusitisYAN Yu⁃yan
1,2
,ZHAO Zuo⁃tao
[Chin J Mycol,2015,10(5):261⁃265]
急性侵袭性真菌性鼻⁃鼻窦炎(acute invasive fungal rhinosinusitis,AIFR)是由真菌引起的一种鼻窦急性炎症,烟曲霉是其主要致病菌,其特点是,真菌侵袭鼻窦黏膜、骨质,甚至眼、颅内等周围器官组织,多发生于免疫功能严重受损的患者,治疗不及时常导致死亡,病死率可高达50%~80%[1⁃3]。近几年,随着免疫抑制剂、广谱抗生素、皮质类固醇激素、抗肿瘤药物的广泛应用,以及艾滋病、糖尿病和器官移植患者的增多,AIFR的发病率逐年升高。建立AIFR的动物模型对于研究该疾病的发病机制、病理生理学、免疫学及其治疗新手段及新药物具有重要价值。
目前,关于鼻窦炎的动物模型局限于细菌性,尚无成熟稳定的AIFR的动物模型造模方法。至今仅发现2篇关于侵袭性真菌性鼻窦炎造模方法的报道。Rodriguez[4]在2007年用抗Gr⁃1抗体建立免疫抑制小鼠后,成功建立侵袭性真菌性鼻窦炎模型,但用临床常用免疫抑制药物环磷酰胺对小鼠进行免疫抑制后造模失败。2013年,Zhang等[5]在鼻腔填塞Merocel绵基础上用环磷酰胺免疫抑制大鼠,再连续7 d鼻内滴入烟曲霉混悬液,成功建立侵袭性真菌性鼻窦炎模型,整个造模过程历时18 d。
本研究旨在建立一种更能模拟临床AIFR发生发展过程、且造模稳定、操作更简易的AIFR动物模型的造模方法,使其更有利于对此疾病的发生、发展及治疗、预防进行深入研究,指导临床。
1 材料与方法
1.1 材料
实验动物 清洁级SD大鼠40只,雌性,6~8周龄,由北京304医院动物房提供,许可证号:SYXK(JUN)2012⁃0014。
实验菌株 烟曲霉由北京大学第一医院真菌室提供,编号为9732。
器械与材料 Merocel海绵(美国,Medtron⁃ic)、环磷酰胺(美国,Sigma)、醋酸可的松(美国,Sigma)、戊巴比妥钠(美国,Sigma)、眼科镊、手术镊和眼科手术剪。所有金属手术器械以碘伏消毒。
1.2 方法
烟曲霉孢子悬液制备 将烟曲霉菌株种植在PDA斜面培养基上,37℃培养箱内培养5 d,取孢子,将孢子离心、过滤、纯化,血细胞计数板计数,制备5×107孢子/mL的孢子悬液。
动物分组 40只清洁级雌性SD大鼠随机分为A、B、C、D 4组。A组,免疫抑制+右侧鼻腔填塞Merocel海绵条+右侧鼻腔滴入烟曲霉孢子悬液;B组,右侧鼻腔填塞Merocel海绵条+右侧鼻腔滴入烟曲霉孢子悬液;C组,免疫抑制+右侧鼻腔滴入烟曲霉孢子悬液;D组:对照组,不干预(见表1)。
环磷酰胺及醋酸可的松诱导大鼠免疫抑制免疫抑制:A、C组大鼠接种曲霉菌前5 d(D⁃5)、前1 d(D⁃1)、后2 d(D+2)腹腔注射环磷酰胺,剂量分别为75 mg/kg、60 mg/kg、50 mg/kg,同时皮下注射醋酸可的松80 mg/kg(见表2)。

表1 实验分组及干预Tab.1 Groups and interventions

表2 大鼠免疫抑制方法及剂量Tab.2 Rat immunosuppressant methods and doses(mg/kg)
免疫抑制大鼠血常规的监测 动态监测免疫抑制大鼠血常规作为免疫抑制观察指标。分别于接种烟曲霉孢子悬液前5 d(D⁃5)、第1次接种烟曲霉当天(D0)、第1次接种烟曲霉后4 d(D+4)用毛细玻璃管取100 μL大鼠内眦静脉血,EDTA抗凝,血标本立即行血常规检测。
大鼠鼻腔填塞及滴入烟曲霉孢子悬液的方法用3%戊巴比妥钠将A、B、C组大鼠浅麻醉,左手固定大鼠,使其鼻孔朝上,右手持眼科镊将修剪好的Merocel海绵条(10 mm×0.5 mm×0.5 mm)填塞入A组和B组大鼠右侧鼻腔上颌窦口处,塞入深度距大鼠前鼻孔约1.5 cm。用1 mL注射剂将100 μL烟曲霉孢子悬液缓慢滴入A、B和C组大鼠右侧鼻腔,D组大鼠不干预。操作过程见图1、2。
曲霉菌培养 每组随机选取7只SD大鼠分别于第1次接种烟曲霉孢子悬液后第4天取鼻腔部分组织,无菌生理盐水冲洗,剪碎,接种到PDA培养基上,37℃培养箱内培养5 d。
病理学检查 4组分别于第1次接种烟曲霉孢子悬液后第4天时处死,取头部、肺部等周围组织,及心、肝、脾、肾等脏器,10%中性福尔马林固定24 h,EDTA脱钙,石蜡包埋,切片,行HE染色、PAS染色、六胺银染色及免疫组化染色EnVision法检测MUC5B确定曲霉菌,进行病理学检查,观察各组烟曲霉感染情况。
统计学处理 本实验采用SPSS 17.0(SPSS,Inc.,美国,英语)统计软件来进行统计。用重复方差分析法对大鼠体重变化进行统计;用卡方检验对组间成模率及各组鼻、肺烟曲霉侵袭率进行统计。P<0.05有统计学意义。
2 结 果
实验期间,所有棉条都在原位,没有脱出。
2.1 免疫抑制后血常规变化
用环磷酰胺及醋酸可的松对大鼠进行免疫抑制后,大鼠中性粒细胞明显降低,接种烟曲霉当天中性粒细胞计数<0.1×109/L,明显低于对照组(3.7±1.84)×109/L。
2.2 大鼠的大体表现
免疫抑制后大鼠精神、饮食欠佳,喜聚群,活动减少,毛色稍暗,无光泽。接种烟曲霉后精神更差,毛色暗淡,有频繁挠鼻、打喷嚏等现象。免疫抑制和鼻内接种烟曲霉使大鼠体重呈下降趋势(P<0.05)。实验中大鼠体重变化情况见表3和图3。
2.3 4组鼻部组织真菌培养结果
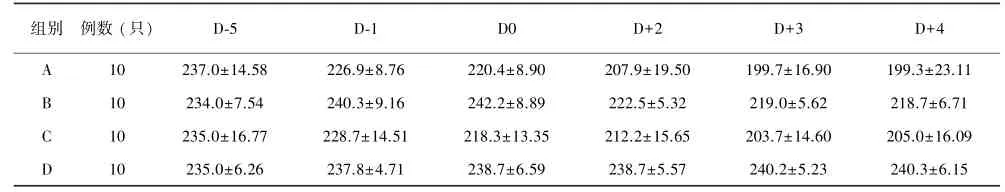
表3 各组大鼠体重变化(g)Tab.3 Changes of rat weight by group(g)
A组:71%(5/7)真菌培养阳性(见图4);B组、C组和D组真菌培养阴性。
2.4 3组大鼠鼻腔、鼻窦病理改变
A组90%(9/10)大鼠可见烟曲霉孢子在鼻黏膜下形成菌丝,侵袭鼻腔及鼻窦黏膜,破坏鼻窦骨质,并侵入血管(见图5)。
B组、C组、D组大鼠均未见鼻腔烟曲霉侵袭。B、C组可见鼻腔黏膜轻度上皮增生、紊乱(见图6)。D组未见异常表现。
2.5肺组织、脑组织及心、肝、脾、肾烟曲霉侵袭情况
A组:10%(1/10)大鼠肺部支气管及肺泡被烟曲霉侵袭(见图7),远低于AIFR成模率(P<0.05),感染部位支气管及肺泡上皮可见增生,分泌物增多;C组:20%(2/10)大鼠肺部支气管及肺泡可见烟曲霉侵袭;B组和D组大鼠肺部未见烟曲霉侵袭。
各组大鼠脑部组织及心、肝、脾、肾等脏器未见烟曲霉侵袭。
3 讨 论
理想的AIFR动物模型应满足以下条件:①与人类AIFR的病因及病理生理改变相符合,建模过程没有直接损害窦腔。②病理学上可见真菌菌丝侵犯鼻腔、鼻窦黏膜、骨质,或向周围组织器官侵犯。③造模方法稳定,成功率高。④操作简易,可重复性强。遵循以上造模原则,我们成功建立了AIFR大鼠模型。
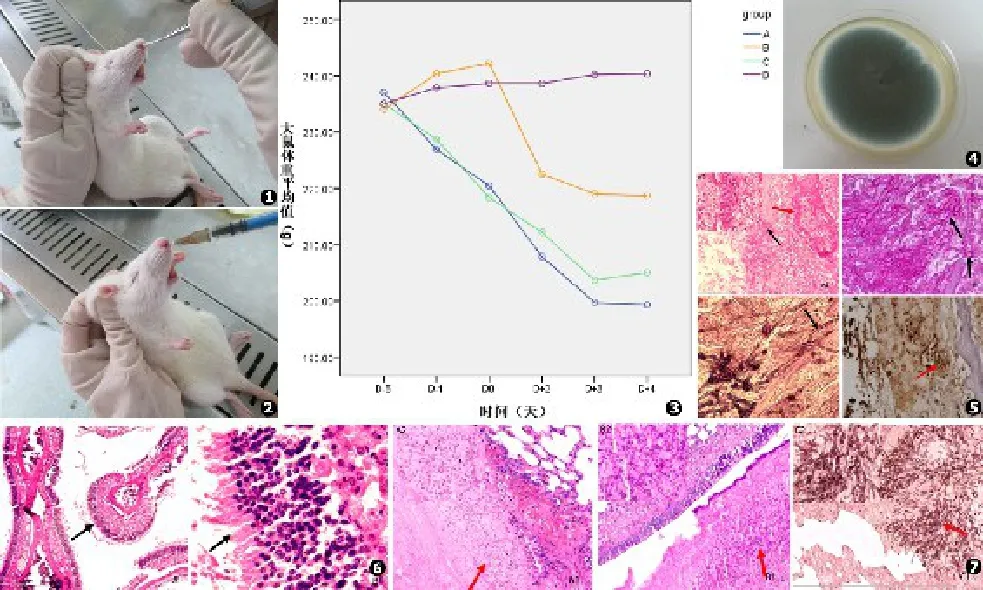
图1 将长约1 cm的Merocel绵填入SD大鼠右侧鼻腔约1.5 cm深度处,动作要轻柔 图2 SD大鼠鼻腔朝上,将100 μL浓度为5×107孢子/mL的烟曲霉孢子悬液缓慢滴入大鼠右侧鼻腔 图3 各组大鼠体重变化。图中可见与对照组(D组)比较,给予免疫抑制后大鼠体重明显下降,填塞Merocel绵及鼻内滴菌后体重进一步下降 图4 A组大鼠鼻腔组织培养结果,可见烟曲霉呈墨绿色、短绒毛状 图5 曲霉菌菌丝侵袭大鼠鼻腔、鼻窦黏膜、血管及骨质。可见烟曲霉菌丝分节、呈锐角分支,黑色箭头指示烟曲霉菌丝侵袭黏膜及骨质;红色箭头指示烟曲霉菌丝侵袭血管(A1.HE染色×20,A2.HE染色×40,B.PAS染色×40,C.六胺银染色×40,D.MUC5B染色×40) 图6 B组和C组大鼠筛窦及鼻甲黏膜上皮轻度增生,部分紊乱(A.HE染色×5,B.HE染色×40) 图7 烟曲霉菌丝侵袭大鼠肺部支气管及肺泡黏膜,感染部位可见黏膜上皮增生,分泌物增多(A1.HE染色×10,A2.HE染色×40,B1.PAS染色×10,B2.PAS染色×40,C1.六胺银染色×10,C2.六胺银染色×40)Fig.1 1 cm length Merocel sponges were gently inserted 1.5 cm deep into the rats’right nasal cavities Fig.2 With the rats’nostrils pointed up⁃ward,100 μL 5×107spores/mL suspensions of A.fumigatus spores were dropped at a slow speed into the right nasal cavities Fig.3 Changes of rat weight by group(g).Compared with the control group(group D),the rats weight showed a trend downward after immunosuppression,inserting Merocel sponges,or inoculation of A.fumigatus Fig.4 Culture result of rat nasal tissue in group A.A.fumigatus was dark green,short hairy Fig.5 A.fumiga⁃tus hyphae invasion in rats nasal⁃sinus mucosa,vascular and bone.The hyphae are antler⁃like.The black arrow indicates the A.fumigatus hyphae invasion in mucosa and bone;The red arrow indicates A.fumigatus hyphae invasion in vessels(A1.Hematoxylin and eosin staining,×20;A2.Hematoxylin and eo⁃sin staining,×40;B.Periodic acid⁃Schiff staining,×40;C.Methenamine silver staining,×40;D.MUC5B staining,×40) Fig.6 Epithelium hyperplasia and partly disorder of ethmoid sinus and turbinate mucosa of rats in group B and C(A.Hematoxylin and eosin staining,×5;B.Hematoxylin and eosin staining,×40) Fig.7 A.fumigatus hyphae invasion in the bronchial and alveolar mucosa of rats.Epithelial hyperplasia and increased secretions could be seen at the infection site(A1.Hematoxylin and eosin staining,×10;A2.Hematoxylin and eosin staining,×40;B1.Periodic acid⁃Schiff staining,×10;B2.Periodic acid⁃Schiff staining,×40;C1.Methenamine silver staining,×10;C2.Methenamine silver staining,×40)
本研究同时比较了免疫抑制和鼻腔填塞Mero⁃ cel绵对AIFR大鼠模型建立的影响。病理结果显示,A组90%(9/10)大鼠鼻腔鼻窦被烟曲霉侵袭,而其他3组大鼠鼻腔、鼻窦均未发现烟曲霉侵袭。其中A组有1例大鼠肺部被烟曲霉侵袭,C组大鼠有2例肺部烟曲霉侵袭。本实验表明,免疫抑制和鼻内填塞Merocel绵都是AIFR大鼠模型成功建立的关键,单纯免疫抑制(B组)和鼻内滴入真菌(C组)均不易造成烟曲霉鼻腔感染,鼻腔不填塞Mer⁃ocel绵易导致真菌进入肺部。
兔和鼠是鼻窦炎造模的主要实验对象[6⁃8],鉴于兔体格较大,较难控制,而小鼠鼻腔太小,前期实验证明很难将Merocel绵塞入小鼠鼻腔,因此,本实验选取体格相对较小而鼻腔足够满足实验操作的SD大鼠作为研究对象。
在临床上,AIFR多见于免疫功能低下或缺陷的患者,为了使模型更好的模拟临床此疾病的发生、发展过程,本实验首先对SD大鼠进行了免疫抑制。我们选用联合应用免疫抑制剂环磷酰胺和醋酸可的松的方法对大鼠进行免疫抑制。环磷酰胺是一种临床常用免疫抑制剂[9⁃10],经济且易获得,可使白细胞减少。多次前期实验表明,大剂量应用环磷酰胺容易引起血尿等并发症,造成大鼠死亡。醋酸可的松是一种具有免疫抑制功能的激素类药物,联合应用醋酸可的松可在降低环磷酰胺用量基础上成功建立免疫抑制大鼠。文献报道,在中性粒细胞<0.1×109/L的状态下接种真菌可成功建立侵袭性肺曲霉病[11⁃12]。本研究对大鼠血常规监测结果表明,第1次接种烟曲霉当天大鼠血中中性粒细胞<0.1×109/L。
临床上,鼻腔堵塞、鼻窦引流不畅是鼻窦炎的主要致病因素,因此,既不损伤大鼠鼻腔、鼻窦正常解剖结构,又能造成其鼻腔、鼻窦引流不畅是成功建立AIFR的关键。本研究选用鼻腔填塞Merocel绵的方法模拟大鼠鼻腔堵塞的状态。Merocel绵是一种生物合成材料,其组织相容性好,对黏膜损伤小,且易被塞入大鼠鼻腔而不易脱落,是临床鼻部手术常用鼻填塞物。2006年,叶菁等[13]实验证实,运用Merocel止血棉作为肺炎链球菌的载体可建立稳定的大鼠急性细菌性鼻⁃鼻窦炎模型。2011年,Mingzhu Jin等[14]将吸附葡萄球菌悬液的Merocel海绵塞入小鼠鼻腔,成功建立急性细菌性鼻窦炎小鼠模型,而单纯滴入葡萄球菌悬液的小鼠鼻腔无细菌感染,表明鼻腔填塞Merocel绵可在不改变鼻腔、鼻窦解剖结构前提下有效模拟临床鼻腔堵塞的状态,是鼻窦炎造模成功的关键。
鼻腔灌洗液常被用来做细菌培养,阳性率在慢性鼻⁃鼻窦炎患者中可达50%~96%[15],但组织灌洗液阳性并不能代表是否有真菌侵袭。本文取部分鼻部组织,反复盐水冲洗,剪碎后进行培养,使结果更能发映组织是否有真菌侵袭,且操作简易。可能由于受取材部位的影响,A组真菌培养阳性率低于病理结果。
目前对鼻窦炎动物模型的研究多限于对细菌性鼻⁃鼻窦炎动物模型的研究[6,16]。有关真菌性鼻⁃鼻窦炎动物模型的文献报道较少。2005年,Dufour等[17]在堵塞新西兰大白兔上颌窦窦口基础上接种烟曲霉,成功建立非侵袭性真菌性鼻⁃鼻窦炎动物模型。迄今为止,有关AIFR动物模型的文献报道仅有两篇。2007年,Rodriguez[4]在用抗Gr⁃1抗体免疫抑制小鼠基础上,通过滴入方式成功建立侵袭性真菌性鼻窦炎模型,但本研究通过多次前期实验发现,单纯鼻内滴入真菌易导致小鼠肺部感染,而真菌性鼻窦炎成模率低且不稳定。2013年,Zhang等[5]报道了一种新的AIFR的造模方法,即先用Merocel绵造成鼻腔堵塞,再用环磷酰胺免疫抑制大鼠,最后连续7 d鼻腔滴入烟曲霉混悬液,成功建立侵袭性真菌性鼻窦炎模型,整个造模过程历时较长(18 d)。本实验在免疫抑制基础上,鼻腔填塞Merocel绵后连续3 d鼻内滴入烟曲霉孢子悬液,成功建立AIFR大鼠模型,提供了一种新的AIFR模型的造模方法。此造模方法成功率高(90%),可重复性强,所用试剂易获得,较前2种造模方法能更好的模拟临床AIFR的发生、发展过程,操作更简易,整个造模过程仅用9 d,历时更短,为深入研究AIFR的发生、发展、治疗及预后提供了很好的新平台。
参考文献
[1] Donovan ST,Thompson JW,Sandlund JT,et al.Imaging of acute invasive fungal rhinosinusitis in a patient with gorlin syndrome and acute lymphocytic leukemia[J].Case reports in otolaryngolo⁃gy,2013,2013(ID:272314):1⁃4.
[2] Seo J,Kim HJ,Chung SK,et al.Cervicofacial tissue infarction in patients with acute invasive fungal sinusitis:prevalence and char⁃acteristic MR imaging findings[J].Neuroradiology,2013,55 (4):467⁃473.
[3] Turner JH,Soudry E,Nayak JV,et al.Survival outcomes in acute invasive fungal sinusitis:a systematic review and quantitative synthesis of published evidence[J].Laryngoscope,2013,123 (5):1112⁃1118.
[4] Rodriguez TE,Falkowski NR,Harkema JR,et al.Role of neutro⁃phils in preventing and resolving acute fungal sinusitis[J].Infect and immun,2007,75(12):5663⁃5668.
[5] Zhang F,An Y,Li Z,et al.A novel model of invasive fungal rhi⁃nosinusitis in rats[J].Am J Rhinol Allergy,2013,27(5):361⁃366.
[6] Jin M,Gu Z,Bian Z,et al.Developing a mouse model of acute bacterial rhinosinusitis[J].Eur Arch Otorhinolaryngol,2011,268 (6):857⁃861.
[7] Liang KL,Jiang RS,Wang J,et al.Developing a rabbit model of rhinogenic chronic rhinosinusitis[J].Laryngoscope,2008,118 (6):1076⁃1081.
[8] Ahn SK,Jeon SY,Khalmuratov R,et al.Rat model of staphylo⁃coccal enterotoxin B⁃induced rhinosinusitis[J].Clin Exp Otorhi⁃nolaryngol,2008,1(1):24⁃28.
[9] Sistigu A,Viaud S,Chaput N,et al.Immunomodulatory effects of cyclophosphamide and implementations for vaccine design[J].Semin Immunopathol,2011,33(4):369⁃383.
(下转第278页)
[10] Guerriero JL,Ditsworth D,Catanzaro JM,et al.DNA alkylating therapy induces tumor regression through an HMGB1⁃mediated activation of innate immunity[J].J Immunol,2011,186(6):3517⁃3526.
[11] van de Sande WW,van Vianen W,ten Kate MT,et al.Caspofun⁃gin prolongs survival of transiently neutropenic rats with ad⁃vanced⁃stage invasive pulmonary aspergillosis[J].Antimicrob A⁃gents Cchemother,2008,52(4):1345⁃1350.
[12] van Vianen W,de Marie S,ten Kate MT,et al.Caspofungin:anti⁃fungal activity in vitro,pharmacokinetics,and effects on fungal load and animal survival in neutropenic rats with invasive pulmo⁃nary aspergillosis[J].Antimicrob Agents Chemothe,2006,57 (4):732⁃740.
[13] 叶菁,余洪猛,李华伟,等.运用Merocel止血棉与肺炎链球菌建立大鼠急性鼻腔鼻窦炎模型[J].中国眼耳鼻喉科杂志,2006,6(4):214⁃216.
[14] Jin M,Gu Z,Bian Z,et al.Developing a mouse model of acute bacterial rhinosinusitis[J].Eur Arch Otorhinolaryngol,2011,268 (6):857⁃861.
[15] Polzehl D,Weschta M,Podbielski A,et al.Fungus culture and PCR in nasal lavage samples of patients with chronic rhinosinus⁃itis[J].J Med Microbiol,2005,54(Pt 1):31⁃37.
[16] Wang Y,Chen S,Chen J,et al.Bacterial biofilm formation after nasal packing in nasal mucosa⁃wounded mice[J].Am J Rhinol Allergy,2013,27(4):e91⁃95.
[17] Dufour X,Kauffmann⁃Lacroix C,Goujon JM,et al.Experimental model of fungal sinusitis:a pilot study in rabbits[J].Ann Otol Rhinol Laryngol,2005,114(2):167⁃172.
[本文编辑] 王 飞
·论著··论著·
3
,LIU Hong⁃gang
1
(1.Department of Pathology,Affiliated Beijing Tongren Hospital,Capital Medical University,Beijing Key Laboratory of Molecular Path⁃ological Diagnosis of Head and Neck,Beijing 100730;2.Department of Otolaryngology,Head&Neck Surgery,Children’s Hospital of Hebei Province,Shijiazhuang 050031;3.Department of Dermatology,First Hospital,Peking University,Beijing 100034)
【Abstract】Objective To develop a rat model of acute invasive fungal rhinosinusitis(AIFR)which is stable and easy to operate in order to promote the basic and clinical researches of AIFR.Methods Sprague⁃Dawley(SD)rats were divided randomly into four groups.Immunosuppression,right nasal packing Merocel sponge and nasal inoculation with Aspergillus fumigatus spores were all in⁃volved in group A.Only right nasal packing Merocel sponge and nasal inoculation with A.fumigatus spores were involved in group B.Only immunosuppression and nasal inoculation with A.fumigatus spores were involved in group C.No treatment was involved in group D.A.fumigatus was dropped into rat nasal for three consecutive days in group A,B and C.All rats were killed four days after the first fungi intranasal instillation.Hematology,fungal culture and histopathology investigations were performed.Results The neutrophil quantities reduced after immunosupression,and less than 0.1×109/L on the first administration day of A.fumigatus spores.An AIFR rat model was established successfully only in group A with an incidence rate of 90%(9/10).A.fumigatus invasion was also observed in 10%(1/10)of the lungs in group A and 20%(2/10)in group C.Positive rates of fungal culture of nasal tissue was about 71% (5/7)in group A,while the remaining groups was zero.Conclusion Immunosupression,nasal obstruction,and fungal inoculation were the three essential conditions for successfully developping a stable AIFR rat model.This model is stable,easy to operate,and closely mimics the pathophysiology of anthropic AIFR.It can be used in a further study in immunity,pathology,drug of AIFR.
【Key words】invasive rhinosinusitis;Aspergillus fumigatus;rat model
[收稿日期]2015⁃01⁃09
基金项目:国家自然科学基金(81070769)
【文章编号】1673⁃3827(2015)10⁃0261⁃05
【文献标识码】A
【中图分类号】R 379.6
通讯作者:刘红刚,E⁃mail:liuhg1125@163.com
作者简介:阎玉彦,女(汉族),博士,主治医师.E⁃mail:yanyuyan20061979@126.com
