秋枫和木棉对大气臭氧浓度升高的生理响应
2015-12-26郭雄飞黎华寿杨宝仪陈红跃王志云
郭雄飞,黎华寿,杨宝仪,陈红跃,王志云
(1.华南农业大学资源环境学院,广东 广州 510642;2.华南农业大学林学与风景园林学院,广东 广州 510642;
3. 佛山市林业科学研究所,广东 佛山 528222)
秋枫和木棉对大气臭氧浓度升高的生理响应
郭雄飞1,黎华寿1,杨宝仪2,陈红跃2,王志云3
(1.华南农业大学资源环境学院,广东 广州 510642;2.华南农业大学林学与风景园林学院,广东 广州 510642;
3. 佛山市林业科学研究所,广东 佛山 528222)
以秋枫Bischof i a javanica Bl.和木棉Bombax malabaricum DC.苗木为试验材料,采用自行设计的开顶式熏气室装置,研究在4种体积分数的臭氧(O3)[E200,Φ(O3)=200×10-9;E100,Φ(O3)=100×10-9;E50,Φ(O3)=50×10-9;环境大气NF,Φ(O3)=10×10-9~20×10-9]下2种植物叶片可溶性糖含量、可溶性蛋白质含量、保护酶活性和膜脂过氧化程度的变化情况,旨在探究在地表臭氧浓度升高的条件下2种植物的生理生化指标的变化情况及其响应机理。结果显示:随臭氧浓度的增加,2种植物膜透性和丙二醛含量均逐渐上升,且与臭氧浓度呈显著正相关关系,说明2种植物膜脂过氧化程度加剧;秋枫可溶性蛋白含量均逐渐下降,木棉先降低后大幅上升;二者可溶性糖含量均是先上升后小幅度下降;POD活性均是先降低后升高;秋枫CAT活性呈先升高再降低的趋势,木棉则是逐渐降低。对2种植物各生理指标进行主成分分析表明,2种植物耐臭氧能力顺序为秋枫>木棉。
园林植物;秋枫;木棉;苗木;大气臭氧浓度;生理响应
O3具有超强氧化性,是二次污染物[1],对动植物均能造成一定程度的危害。随着含氮化肥和化工燃料的大量使用,地表臭氧的浓度日益增加[2],尤其在人口密集的华南地区,由于经济的快速发展,汽车的使用量日益加大,加上工业企业数量多,电、油等能源消耗量大。O3已经达到较高的水平,大气O3浓度升高对植物的影响逐渐引起了人们的密切关注。
国内外的研究表明,O3能阻碍植物的生长发育,改变碳代谢库[3]。目前,在探讨O3污染对植物造成伤害的外部症状及生理生化的影响方面已经做了一些研究工作,如臭氧对叶绿体荧光特性及光合特性的影响[4-5],O3熏气引起的脂质过氧化的影响[6],O3对植物伤害的外部症状[7-8],O3对植物部分生理指标及新陈代谢的影响[9-12],对植物生物量、光合产物及农产品产量的影响[13-15]等。总体来看,过去关于O3对植物影响方面的研究大多局限于少数农作物,对树种影响方面的研究则少见报道,并且研究所涉及的指标也相对较少。
秋枫Bischof i a javanica Bl.和木棉Bombax malabaricum DC.是中国南方地区常用的园林绿化树种,研究其抗臭氧污染的能力对合理筛选和应用园林绿化树种具有重要意义,本实验采用人工熏气法,以木棉和秋枫为材料,对它们进行不同浓度的臭氧熏气处理,测定处理前后植物可溶性糖、可溶性蛋白、丙二醛、过氧化物酶、过氧化氢酶和膜透性六个生理指标,分析不同浓度O3胁迫下植物体生理代谢活动的变化情况及抗性机理。为绿化造林筛选抗性强的树种以及研究植物对O3逆境的适应机理等方面提供理论依据和参考价值。
1 材料和方法
1.1 试验设计
试验场地位于广州市华南农业大学(23°09′N,113°21′E) 校 园 内。 该 地 年 均 气 温 为 21.4 ~21.9℃,年降水量1 623.6~1 899.8 mm,年平均日照时数1 820~1 920 h。试验材料为秋枫(平均株高30 cm,冠幅20 cm×20 cm)和木棉(平均株高50 cm,冠幅15 cm×15 cm),均为2年生袋苗。
实验设备采用自制的模拟自然动态的、开顶式熏气室,体积约1.5 m3。O3由广东省中山市聪明人环保科技有限公司生产的YIDAB-8D型号臭氧发生器产生,采用美国ECO公司生产的A-21ZX便携式臭氧分析仪(灵敏度0.01×10-6,量程为0~10×10-6)对熏气室中O3浓度进行实时测量。
本试验参照前人研究成果设置臭氧浓度和熏气时间[16],并根据本次的试验材料和研究目的进行相应的调整,此外,在正式试验开始前进行了预备试验,综合考虑制定如下试验设计方案:
试验设4个处理:高浓度O3处理-E200(臭氧体积分数为200×10-9)、中浓度O3处理-E100(臭氧体积分数为100×10-9)、低浓度O3处理-E50(臭氧体积分数为50×10-9)和自然大气处理-NF(臭氧体积分数为10×10-9~20×10-9)。每个处理设置3次重复,每次重复的熏气时间为3 d,选取10株苗木作为实验对象。
试验时分别将秋枫和木棉的苗木各10盆放入熏气室中,关闭气室门,留出空隙以补充自然空气,控制好臭氧发生器产生的O3的浓度和气室空隙的大小,利用室内风扇搅动空气使气体处于流动状态,使熏气室内的O3浓度保持稳定。从2010年4月16日起正式熏气,每天熏气时间为9:30~16:30,每小时测定一次O3浓度看其是否保持稳定。4月19日停止供气,试验过程中水肥条件、温度和病虫害等因素可能有一定影响,但不成为主要限制因子。
1.2 测定指标
4月19日对4个处理的秋枫和木棉取样,选取每株实验苗自下而上的第2、3片叶片数片,用蒸馏水洗净,滤纸吸干,去除叶片中脉测定各项生理指标。
膜透性以相对电导率表示,相对电导率测定采用DDS-11A型电导仪,电导率为试验苗叶片初始电导率与煮沸后电导率的比值[2];丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)法[17,18];可溶性糖含量采用蒽酮比色法测定[19-20];可溶性蛋白质含量采用考马斯亮蓝染色法测定[21],以牛血清蛋白为标准蛋白[5,22-23];过氧化氢酶(CAT)活性采用紫外分光光度计法[24]测定,以每分钟每毫克蛋白氧化的H2O2毫摩尔数表示酶活性;过氧化物酶(POD)活性采用愈创木酚法[6]测定,以mg·min-1为单位[25]。
1.3 数据处理方法
应用Microsoft Excel 2003与R语言等软件分析程序对试验数据进行统计分析。
2 结果与分析
2.1 O3对膜脂过氧化程度的影响
由图1可知,木棉和秋枫叶片的MDA含量均随臭氧浓度增加而上升,两种植物的MDA含量与臭氧浓度呈显著正相关关系(秋枫R2=0.889、木棉R2=0.7996),同种植物不同浓度处理之间差异极其显著(p<0.05)。这表明臭氧浓度升高,加剧了木棉和秋枫叶片的膜脂过氧化作用,加速了叶片的衰老进程。

图1 O3对秋枫和木棉丙二醛含量的影响Fig.1 Effects of ozone on MDA content of two tree species
由图2可知,木棉和秋枫叶片的膜相对透性均随臭氧浓度增加而上升,且两种植物的膜相对透性均与臭氧浓度呈显著正相关关系(秋枫R2=0.995、木棉R2=0.7943),同种植物不同浓度处理之间差异显著(p<0.05)。这说明在高浓度臭氧暴露下,木棉和秋枫叶片的膜系统受到伤害。

图2 O3对秋枫和木棉膜透性的影响Fig.2 Effects of ozone one membrane permeability of two species
2.2 O3对可溶性蛋白和可溶性糖含量的影响
图3表明,臭氧胁迫下,秋枫叶片可溶性蛋白含量随臭氧浓度的升高而逐渐降低,在E50、E100、E200处理时,分别较对照(NF)降低14.07%、74.40%和96.93%;木棉叶片可溶性蛋白含量在E50、E100处理时分别降低19.00%和1.00%,而在E200处理时上升至7.46 mg·g-1,较对照上升幅度达120.00%。
如图4所示,随臭氧浓度的增加,木棉和秋枫叶片的可溶性糖含量变化一致。均是随臭氧浓度的增加而上升,E50处理时达到最高值,分别为18.92 mg·g-1、21.62 mg·g-1,分别较对照升高 18.16%和12.14%。而后在E100、E200处理时有小幅下降。
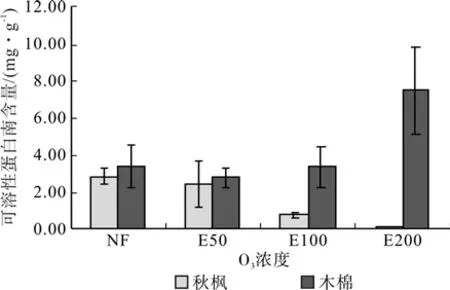
图3 O3对秋枫和木棉可溶性蛋白含量的影响Fig.3 Effects of ozone on soluble protein contents of two species
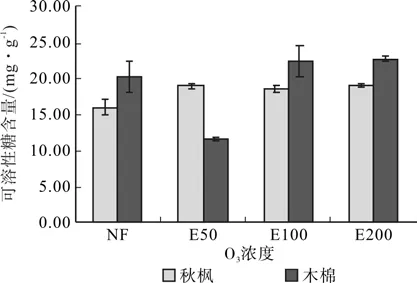
图4 O3对秋枫和木棉可溶性糖含量的影响Fig.4 Effects of ozone on the soluble sugar contents of two species
2.3 O3对保护酶活性的影响
由图5可知,秋枫和木棉叶片POD活性随臭氧浓度的增加先降低后升高,秋枫在E100处理时达到最低点,POD活性为0.24 mg·min-1,在E200处理时则突然升高,POD活性为1.53 mg·min-1;木棉叶片POD活性则在E50处理时达到最低值,为7.18 mg·min-1,在E100和E200处理时分别较对照提高了109.24%和208.57%。

图5 O3对秋枫和木棉过氧化物酶活性的影响Fig.5 Effects of ozone on POD activity of two species
图6表明,秋枫叶片的过氧化氢酶活性呈先升高后降低的趋势,在E100浓度处理时达到最高值,较对照升高161.86%;木棉叶片CAT活性随臭氧浓度增加而降低。较对照分别降低16.67%(E50)、12.50%(E100)和68.33%(E200)。

图6 O3对秋枫和木棉过氧化氢酶活性的影响Fig.6 Effects of ozone on CAT activity of two species
2.4 2种植物适应O3胁迫能力的综合评价
采用主成分分析对2种苗木的耐臭氧胁迫能力做综合评价。选E50、E100两个浓度进行处理,其综合得分排序均为秋枫>木棉,表明秋枫耐臭氧胁迫的能力比木棉强。
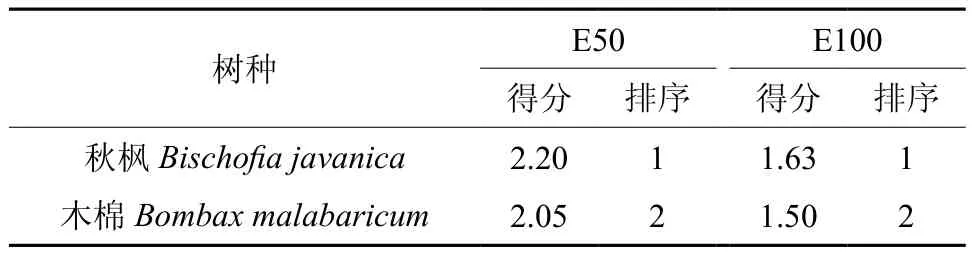
表1 两种植物适应O3胁迫能力的综合评价Table 1 Overall evaluation of two species’ ability adapted to O3 stress
3 结论和讨论
MDA是叶细胞代谢过程中产生的过氧化产物,其含量的高低是判定叶片衰老程度的重要指标[26],它反映了膜脂过氧化的程度,植物衰老进程的改变也能反映了植物受害程度,这在酸雨、二氧化硫及重金属污染等研究中已得到证明[27]。细胞膜是植物受臭氧胁迫时的原初反应基地[28],如果植物在胁迫下还能保持其细胞膜结构和性质的稳定性,则其内部发生的变化也是微弱的,并且危害通常也是可逆的。相反,如果膜的性质和结构遭到严重破坏,植物的局部和整体都可能受害,最后死亡[28]。因此,臭氧含量超过一定浓度时,植物可能受到伤害。在本研究中,随着臭氧浓度的增加,秋枫和木棉两种植物叶片MDA 的含量均显著增加(p<0.05),膜的相对透性也均显著上升(p<0.05)。说明两种植物对臭氧胁迫均比较敏感,并且两种植物体内MDA和膜透性的增加具有同步性,这是因为在臭氧胁迫下,秋枫和木棉体内产生大量活性氧,而活性氧能使膜脂发生过氧化作用或脂膜脱脂作用(形成MDA),从而引起膜透性的增加[28]。
植物体内可溶性蛋白是可转运氮的贮存物,是植物进行各项生理生化过程的基础[2]。因此,植物体内可溶性蛋白含量的高低能反映出植物体生理生化活动的状态[29]。有研究表明,臭氧胁迫下大部分植物可溶性蛋白含量出现下降,而在部分重金属污染的胁迫下植物体可溶性蛋白含量则表现出先升高再降低[27]。本实验研究中,随臭氧浓度的增加,秋枫可溶性蛋白的含量逐渐降低,木棉则表现为先降低而后大幅度回升。从这一指标来看,木棉对臭氧胁迫保护性的适应性性更强。
可溶性糖是植物体碳素营养状况和环境胁迫的指标[6],并且具有抗氧化作用,能减少植物细胞膜脂过氧化程度,对膜透性的变化起到一定的缓和作用,从而对植物产生一定的防护作用。在臭氧胁迫下,可溶性糖作为渗透调节物质来适应胁迫,通常情况下,随O3浓度的升高,植物体可溶性糖含量降低。本实验中,秋枫呈上升后略为下降的趋势,但总体上变化不明显;而木棉则是呈先下降后升高的趋势,表明木棉对O3浓度的敏感性较强。
大量研究表明,逆境会影响植物的酶促系统。其中,POD、CAT等酶组成植物体内抗氧化酶系统的重要保护酶,CAT 、POD 催化H2O2形成H2O,能够在逆境胁迫中有效地清除植物体内的活性氧,平衡活性氧的代谢,保护膜结构[30]。本实验中,秋枫和木棉POD活性均是随臭氧浓度的增加而呈现先降低后升高的趋势,而CAT则是随臭氧浓度的增加而呈现先升高后降低的趋势。说明两树种对O3的胁迫反映特点基本一致。
臭氧胁迫下,植物体生理生化活动的代谢特点和机制可能是:植物遭到臭氧胁迫时产生了大量活性氧和羟自由基,当植物体内活性氧的浓度积累到一定浓度时,CAT、POD、SOD等抗氧化酶被诱导加速生成,SOD清除和 OH·形成H2O2,CAT、POD催化H2O2形成H2O[31]。这些酶活性的增加,机体内膜保护系统被诱导而加强生理活动,是对O3污染的胁迫响应,更有利于活性氧的清除。另一方面,POD具有IAA氧化酶的活性[31],在臭氧胁迫下POD活性的增加和CAT活性的降低都不利于植物对活性氧的清除,加速了、H2O2向毒性更强的·OH 转化,导致植物体内活性氧的积累,从而加速了膜脂过氧化作用,膜透性增加,损害了膜保护系统,导致细胞器官的破坏,代谢紊乱,从而加速了植物的衰老进程[32]。
综上所述,在不同浓度的O3胁迫下,秋枫和木棉均受到了不同程度的伤害,其受伤害后的反应特征基本一致,但其中可溶性蛋白含量上,两者则完全相反,且由主成分分析表明,秋枫的抗性相对比较强。
[1] 林伟立,胡建信,唐孝炎.臭氧层耗损对对流层大气质量的影响和在中国的响应[J].环境科学研究, 2002, 15(3):61-64.
[2] 张巍巍,郑飞翔,王效科,等. 大气臭氧浓度升高对水稻叶片膜脂过氧化及保护酶活性的影响[J]. 应用生态学报, 2008,19(11): 2485-2489.
[3] 郑有飞,张金恩,吴荣军,等. 地表臭氧胁迫对北方冬小麦光合及生理特征的影响[J].农业环境科学学报,2010,(8):1429-1436.
[4] 郑启伟,王效科,冯兆忠,等.臭氧对原位条件下冬小麦叶片光合色素、脂质过氧化的影响[J].西北植物学报,2005,(11): 102-106.
[5] 庄明浩,李迎春,郭子武,等. 臭氧浓度升高对毛竹叶片光合色素和抗性生理的影响[J].生态科学,2011, 30(6): 607-612.
[6] 路光超,黄玉源,陈红跃,等.地表臭氧增加对黄花夹竹桃和芒果叶片膜脂过氧化程度和保护酶活性的影响[J].生态环境学报,2012, 21(7): 1235-1240.
[7] GEROSA G, MARZUOLI R, ROSSINI M, et al. A fluxbased assessment of the effects of ozone on foliar injury,photosynthesis, and yield of bean (Phaseolus vulgaris L. cv.Borlotto Nano Lingua di Fuoco) in open-top chambers[J].Environ Pollut, 2009, 157(5): 1727-1736.
[8] 武志林. 臭氧对蚕豆外部形态的影响及叶绿素a的表征作用[J]. 重庆环境科学,1993, (1): 24-26.
[9] 高吉喜,张林波,舒俭民,等.臭氧对植物新陈代谢的影响[J].农村生态环境,1996, (4): 42-46.
[10] 张巍巍,赵天宏,王美玉.对流层臭氧浓度升高对植物的影响[J].安徽农业科学, 2006, (8): 1520-1522.
[11] 曹际玲,朱建国,曾 青,等. 对流层臭氧浓度升高对植物光合特性影响的研究进展[J].生物学杂志, 2012, (1): 66-70.
[12] CALATAYUD A, ALVARADO J W, BARRENO E. Differences in ozone sensitivity in three varieties of cabbage (Brassica oleracea L.) in the rural Mediterranean area[J]. Journal of Plant Physiology, 2002, 159(8): 863-868.
[13] LI C H, Li Y, WUYUN T N, et al. Effects of high concentration ozone on soybean growth and grain yield[J]. Chinese Journal of Applied Ecology, 2010, 21(9): 2347-2352.
[14] 周康群,冯 岩. 臭氧对广州主要栽培蔬菜生长的影响[J].华中农业大学学报, 2001(04): 344-347.
[15] GUIDI L, NALI C, LORENZINI G, et al. Effect of chronic ozone fumigation on the photosynthetic process of poplar clones showing different sensitivity[J]. Environ Pollut, 2001, 113(3):245-254.
[16] 郑飞翔,王效科,张巍巍,等. 臭氧胁迫对水稻光合作用与产量的影响[J]. 农业环境科学学报, 2009, (11): 2217-2223.
[17] 路文静,李奕松. 植物生理学实验教程[M]. 北京: 中国林业出版社, 2012.
[18] 郭 凌,卜玉山,张 曼,等. 煤基腐殖酸对外源砷胁迫下玉米生长及生理性状的影响[J]. 环境工程学报, 2014,(2):758-766.
[19] 阮亚男,何兴元,陈 玮,等. 臭氧浓度升高对植物抗氧化系统的影响[J]. 生态学杂志, 2008, (5): 829-834.
[20] 安黎哲,王勋陵,李 岚. 臭氧熏气下春小麦叶片脂质过氧化作用的研究[J]. 植物生态学报, 1994, (2): 171-176.
[21] BRNDFORD M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye[J]. Anal. Biochem. 1976, 72: 248-253.
[22] 张巍巍,郑飞翔,王效科,等. 臭氧对水稻根系活力、可溶性蛋白含量与抗氧化系统的影响[J]. 植物生态学报,2009,(3):425-432.
[23] 郑有飞,胡程达,吴荣军,等. 臭氧胁迫对冬小麦光合作用、膜脂过氧化和抗氧化系统的影响[J]. 环境科学, 2010, (7):1643-1651.
[24] 杨兰芳,庞 静,彭小兰,等. 紫外分光光度法测定植物过氧化氢酶活性[J]. 现代农业科技, 2009,(20): 364-366.
[25] 金明红,冯宗炜,张福珠. 臭氧对水稻叶片膜脂过氧化和抗氧化系统的影响[J]. 环境科学, 2000,(3): 1-5.
[26] 杨剑平,杨秋瑾. MDA作为叶片衰老指标的范围[J].北京农学院学报, 2000, 15(3): 67-69.
[27] 黄玉源,黄益宗,李秋霞,等.臭氧对南方3种木本植物的急性伤害症状及其生理指标变化[J].生态环境,2006,(4):674-681.
[28] 金明红,冯宗炜. 臭氧对冬小麦叶片膜保护系统的影响[J].生态学报, 2000,(3): 444-447.
[29] 庄明浩,李迎春,李 应,等. 3种地被类观赏竹对大气臭氧浓度倍增的生理响应[J]. 西北植物学报,2011,31(10):2014-2020.
[30] 庄明浩,李迎春,李应,等. 毛竹对大气臭氧浓度倍增的生理响应[J]. 植物分类与资源学报, 2012,(1): 69-75.
[31] 吴芳芳,郑有飞,吴荣军,等. 近地层臭氧对小麦抗氧化酶活性变化动态的影响[J].生态学报, 2011,31(14): 4019-4026.
[32] PUCKETTE M C, WENG H, MAHALINGAM R. Physiological and biochemical responses to acute ozone-induced oxidative stress in Medicago truncatula [J]. Plant Physiology and Biochemistry, 2007, 45(1): 70-79.
Physiological responses of Bischof i a javanica and Bombax malabaricum to elevated atmospheric ozone concentration
GUO Xiong-fei1, LI Hua-shou1, YANG Bao-yi2, CHEN Hong-yue2, WANG Zhi-yun3
(1. College of Natural Resources and Environmental Sciences, South China Agricultural University, Guangzhou 510642, Guangdong, China;2. College of Forestry and Landscape Architecture, South China Agricultural University, Guangzhou 510642, Guangdong, China;3. Foshan Institute of ForestryScience, Foshan 528222, Guangdong, China)
By taking seedlings of Bischofia javanica Bl. and Bombax malabaricum DC. as the test materials, and employing selfdesigned open-top fumigation chamber devices, the variation degrees of contents of soluble sugar, soluble protein, contents of malonaldehyde (MDA), membrane permeability, activities of catalase (CAT) and peroxidase (POD) of the two plants were studied with four ozone volume fractions [E200 (Φ(O3)=200×10-9), E100 (Φ(O3) =100×10-9),E50 (Φ(O3)=50×10-9)and non-filtered air,Φ(O3)=10×10-9~ 20×10-9]. The study was aimed at exploring the physiological and biochemistry activities changing mechanisms and response patterns of the two plants under the raising of the ground surface ozone concentration. The results were as follows: with the ozone concentration increasing, the levels of malonaldehyde (MDA) content and membrane permeability in B. javanica and B.malabaricum leaves increased gradually and were signif i cantly positive correlated with the concentration of O3,which indicated that the levels of membrane lipid peroxidation were aggravated in the two plants; The contents of soluble protein in B. javanica declined gradually, while the contents of soluble protein in B. malabaricum declined fi rst and then increased with high amplitude; The contents of soluble sugar in B. javanica and B. malabaricum both increased fi rst and then declined with low amplitude; Activities of peroxidase(POD) in the two plants declined fi rst and then increased, activities of catalase (CAT) in B. javanica increased fi rst and then declined,while activities of catalase (CAT) in B. malabaricum declined gradually; The physiological parameters of the two plants were evaluated with principal component analysis, the results indicated that the order of the tolerance to ozone of the two plants was B. javanica, B.malabaricum.
ornamental plant; Bischofia javanica Bl.; Bombax malabaricum DC.; seedings; ozone concentration in atmosphere;physiological response
2014-08-06
国家林业公益性行业专项“城市地带性乡土植物材料筛选与体系构建模式研究” (201004042)
郭雄飞,博士研究生 通讯作者:陈红跃,教授;E-mail:chenhongyuetz@126.com
郭雄飞, 孙同高, 杨宝仪, 等. 秋枫和木棉对大气臭氧浓度升高的生理响应[J].中南林业科技大学学报,2015,35(2):49-53.
S718.43;S664.2
A
1673-923X(2015)02-0049-05
10.14067/j.cnki.1673-923x.2015.02.010
http: //qks.csuft.edu.cn
[本文编校:吴 彬]
