大花序桉离体根培养过程中氧化酶活性分析
2015-12-26谭健晖黄寿先
谭健晖,黄寿先
(1. 广西林业科学研究院,广西 南宁 530002;2. 广西大学 林学院,广西 南宁 530005 )
大花序桉离体根培养过程中氧化酶活性分析
谭健晖1,黄寿先2
(1. 广西林业科学研究院,广西 南宁 530002;2. 广西大学 林学院,广西 南宁 530005 )
通过添加外源生长素,研究大花序桉离体根培养过程中的氧化酶的动态变化。结果表明:添加外源NAA和IBA,与无激素培养基间达到极显著差异;POD、IAAO和PPO影响离体根的形成,其中POD和IAAO活性在培养过程中呈下降→升高→下降的变化趋势,PPO的变化趋势与相反,呈升高→下降→升高趋势;3种氧化酶相互作用,从而维持、提高或降解内源激素含量,使细胞朝着有利于根的方向发展。
大花序桉;离体根培养;外源生长素;氧化酶活性
近10多年来,桉树因其生长迅速、用途广泛、经济效益好等在华南地区得到快速发展。在南方大面积推广的桉树无性系主要以巨桉、尾叶桉及其它们的杂交种为主。其用途多为纸桨和建筑材,用途单一,易受市场价格波动的影响。大花序桉Eucalyptus cloeziana,是桃金娘科Myrtaceae桉属Eucalyptus L 'Her的一个种。大花序桉仅天然分布于澳大利亚的昆士兰州,故此又名昆士兰桉。分布 于 15°45′~ 26°41′N,144°44′~ 152°52′E。 海拔25~950 m,年降雨量520~2 400 mm。夏雨型为主,3~4月为干旱季节[1]。大花序桉木材呈黄褐色,结构紧密、沉重坚固,是很好的室内装饰和锯材,适合进行大径材培养[1]。由于大花序桉种源少,且开花结实少,更重要的是,大花序桉与其他桉树一样,属异花虫媒树种,种内易杂交,实生苗后代分化严重,难以保持优良的遗传特性,严重制约了大花序桉的推广和利用。因此,无性繁殖成为大花序桉良种繁育的重要手段。国内对大花序桉的研究主要涉及大花序桉不同种源/家系对比试验[2-3]、种源材性[4]和组织培养研究[5-7]。大花序桉的组织培养虽有成功报道但研究仍处于实验室阶段[5-7]。本试验在大花序桉离体培养研究的基础上,对其根形态建成的生理学机制进行了系统研究,研究结果的应用可以有效地避免大花序桉离体培养的盲目性和随意性,为大花序桉的良种繁育和规模化推广应用提供技术支持。
1 材料与方法
1.1 实验材料
外植体取自广西钦州市3年生的大花序桉优良单株,截取半木质化的、腋芽未萌动的萌芽枝条,保鲜带回,用于无菌初代诱导。根形态建成生理实验出自第29代继代苗。
1.2 实验方法
离体根离体培养以1/3改良MS(大量元素)+NAA2.0 mg/L+IBA0.5 mg/L为培养基,设无激素为对照。蔗糖25 g/L,7.5 g/L琼脂条,调节pH值至5.8,121 ℃,1.1 kg/cm2下灭菌20 min。培养温度为24 ℃,光照时间12 h/d,光照强度1 500 lx左右。暗培养7 d,弱光照3 d,每10 d取样1次,取样时将蘸有培养基部分剪除,立即放入-80 ℃冰箱保存待测,至第40天取样结束。
1.3 测定方法
1.3.1 PPO酶活的测定
称取大花序桉试管苗2.0 g,加10 mL预冷的磷酸缓冲溶液,冰浴碾磨成匀浆,转入离心管,在 4 ℃,10 000 r·min-1离心 20 min,上清液即为酶液。取酶液0.2 mL加入3 mL磷酸缓冲溶液置水浴中10 min,再加入邻苯二酚溶液0.5 mL。混合后立即转入比色皿在波长470 nm处进行OD470时间扫描。重复3次,测定结果用SPSS数据处理系统进行方差分析和差异显著性检验。
1.3.2 IAAO酶活的测定
称试管苗0.5 g,分次加入预冷的磷酸缓冲液(pH值6.0)5 mL,冰浴研磨,4 000 r/min离心20 min,取上清液,即为粗酶液。酶液测定的反应液为MnCl21 mL、2、4-二氯酚1 mL、IAA(200 μg/mL) 2 mL、酶液 1 mL、磷酸缓冲液(pH值6.0)5 mL,对照中的酶液以磷酸缓冲液代替。25 ℃水浴保温30 min。30 min后另取2支试管,每支加入试剂B(0.5 mol/LFeCl3+35%过氯酸V∶V=1∶50)4 mL,分别加入反应液和对照各2 mL IAA的梯度浓度溶液各2 mL。于40 ℃下保温30 min,使反应液呈红色。530 nm处测OD值,分别记为OD实验、OD对照。计算公式为:

式(1)中:VT为酶液总体积;V为步骤2所得反应液体积;V1为反应所用酶液体积。
1.3.3 POD酶活的测定
称试管苗品0.2 g,加入少量石英砂和2 mL预冷的磷酸缓冲溶液,冰浴碾磨成匀浆,转入离心管,在 4 ℃,10 000 r·min-1离心 15 min,上清液即为酶液。PPO酶活性的测定加反应液3 mL(100 mL,pH值6.0的磷酸缓冲液中加入0.5 mL愈创木酚、1 mL30%H2O2),然后加入酶提取液0.05 mL,迅速混匀倒入比色皿,读取OD470值,重复3次。计算公式为:
过氧 化 物 氧 化 酶 活 性 (ΔOD470·g-1·min-1FW)={[ΔOD470×酶液体积(mL)]/[反应吸取酶液量(mL)]}/[样品重(g)×反应时间(min)]。
以上3种酶的测定均重复3次,异常数据剔除。
1.4 数据处理和分析
分别对POD活性、PPO活性和IAAO活性进行双因素方差分析(SPSS13.0软件)。
2 结果与分析
2.1 根离体培养过程中POD活性变化
大花序桉根离体培养过程中POD活性变化趋势大体相同(图1),两者的POD活性均以第0天最高,不同培养时间的POD活性差异达显著水平(表1)。培养初期处理的POD活性不断下降,第20 天时降至 45.28 ΔOD470/g·FW·min,为整个培养阶段的最低点,培养后期活性升高,之后开始下降。对照中的POD活性在培养初期直线下降至最低值58.79 ΔOD470/g·FW·min,培养中后期活性呈不断上升趋势,最终保持在 70 ΔOD470/·FW·min上下。从POD平均活性看,处理的酶活在不同培养时间中变化较大。说明POD在大花序桉根的离体培养过程起调控作用,影响根原基的形成和发育。
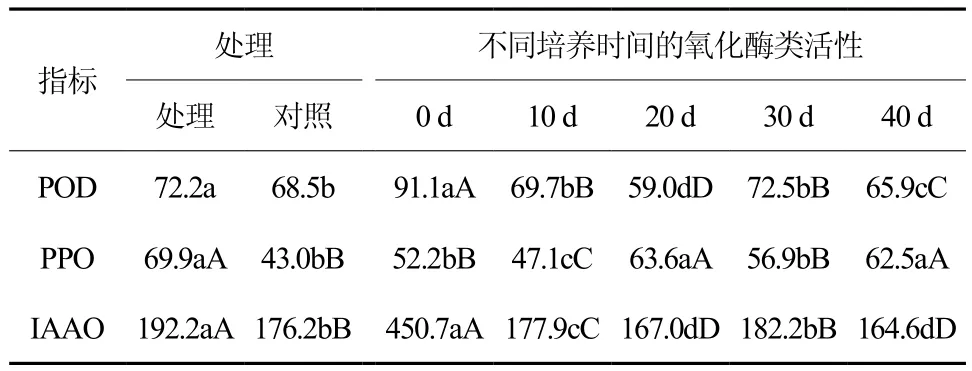
表1 氧化酶类方差分析†Table 1 Vriance analysis on different oxidases with different treatments and incubation time
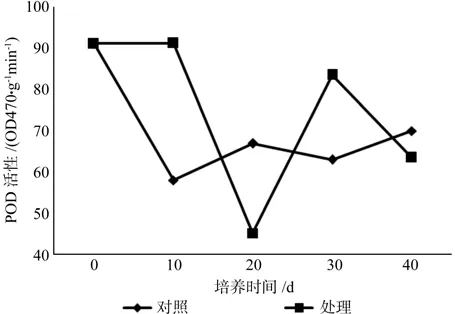
图1 根形态建成过程中POD活性变化Fig. 1 POD activty changes in the root vitro culture
2.2 根离体培养过程中PPO活性变化
在大花序桉根离体培养过程中对照和处理的PPO活性变化趋势相反(图2),不同培养时间的PPO活性差异达显著水平(表1)。处理中PPO活性呈升高-升高-下降-升高的变化趋势,培养初期PPO活性不断升高,在第20天时到达最高峰值,之后下降,培养后期酶活继续上升。对照中PPO活性在培养初期不断降低,第20天时达到最低值,培养后期酶活不断升高,第30天达到最高峰值,之后下降。均以第0天最高。从曲线上来看,培养初期处理的POD活性不断下降,第20天时降至 45.28 △ OD470/g·FW·min,为整个培养阶段的最低点,培养后期活性升高,之后开始下降。从酶活值来看,处理中PPO活性明显大于对照且在不同培养阶段变化较大,说明PPO在大花序桉根的离体培养过程起重要的调控作用,影响根原基的形成和发育。
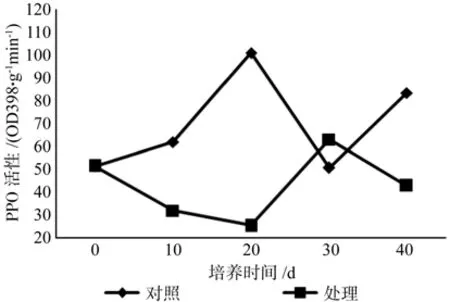
图2 根形态建成过程中PPO活性变化Fig. 2 PPO activty changes in the root vitro culture
2.3 根离体培养过程中IAAO活性变化
大花序桉根离体培养过程中对照和处理的IAAO活性变化趋势大体相同(图3),两者的IAAO活性均以第0天最高,不同培养时间的IAAO活性差异达显著水平(表1)。培养初期处理的IAAO活性不断下降,第 20 天时降至 158.18 μg/g·FW·h,培养后期活性升高,之后开始下降,第40天降至最低点。对照中的IAAO活性在培养初期直线下降至最低值 138.99 μg/g·FW·h,培养中后期活性呈不断上升趋势,最终保持在170 μg/g·FW·h上下。从平均活性看,处理的酶活在不同培养时间中变化较大,说明IAAO在大花序桉根的离体培养过程起重要的调控作用,影响根原基的形成和发育。
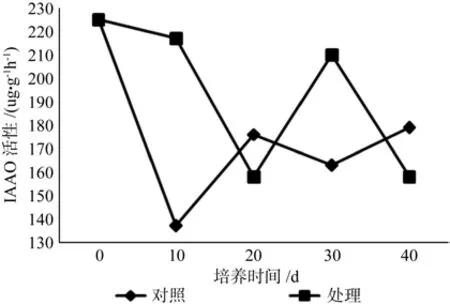
图3 根形态建成过程中IAAO活性变化Fig. 3 IAAO activty changes in the root vitro culture
3 结论与讨论
无性繁殖一直是林木良种繁育的重点研究课题,对难生根树种而言无性繁殖尤其重要。植物不定根的发生是一个极其复杂的生理生化过程,它的诱导、发生和形成与解剖学结构、内源生长素或其他促根物质、内源抑制物等多种生理反应相关。而充分认识这些相关因素并明确它们间的关系对指导不定根的研究意义重大。前期的生根机制的研究多集中在外源生长素的调控作用,而生根过程中的内源或外源调节内源等生化反应、内源激素及氧化酶间的相互关系的研究较少。过氧化物酶(POD)、吲哚乙酸氧化酶(IAAO)和多酚氧化酶(PPO)是高等植物体内普遍存在的3种酶,与植物不定根的发生及发展密切相关,相关研究多集中在桉树[8-11]、四倍体刺槐[12]、光叶楮[13]等树种的扦插生根以及逆境胁迫下的变化[14]。有研究指出,IAA的重要生理功能是促进不定根的形成,IAA含量的变化直接影响不定根的形成和分化,而POD的作用产物可能是不定根发生和发展所必须的辅助因子,促进不定根的形成,即POD能氧化IAA,消除体内过多的内源IAA,有利于根原基的诱导[15];IAAO是降解IAA的专一酶,IAAO活性升高,IAA被氧化分解,IAAO活性降低,IAA处于一种较为稳定而平衡的状态,有利于发挥IAA的生理功能[16];PPO既能催化酚类物质和IAA形成一种生根辅助因子“IAA-酚酸复和物”,又是呼吸酶的一种[17]。本研究中应用1/3改良MS(大量元素)+NAA2.0 mg/L+IBA0.5mg/L为培养基,研究外源生长素NAA和IBA在根的离体培养过程中氧化酶的动态变化,实验中POD、PPO和IAAO等氧化酶的活性与对照相比有较大变化,对根的发育起重要调控作用,其中POD和IAAO在根的离体培养过程中的变化一致,它们在离体培养初期(0~20 d)活性下降,有利于保持体内IAA的平衡或提高IAA的含量,从而促进根原基的形成,在培养中期(20~30 d),是根原基的细胞分裂和增殖过程,此时需要低IAA维持,这一时期POD和IAAO的活性迅速升高,氧化分解内源IAA,以维持内源激素的平衡,利于根原基的发育,培养后期(30~40 d),是根的生长期,活性直线下降;PPO的变化趋势与POD和IAAO相反,培养前期活性高,中期下降,后期升高,PPO活性在培养初期持续升高,是否合成了“IAA-酚酸复和物”,还是促进了呼吸作用,有待进一步研究。
在大花序桉根的离体培养过程中,POD、IAAO和PPO 3种氧化酶影响离体根的形态建成,其生理作用不是相互独立的,相互联系、相互影响。在离体根的培养初期、中期和后期段3个氧化酶呈现不同的变化,从而直接导致内源激素的变化。而这些规律在大花序桉整个根的培养阶段都相当明显。这3种与生根有关的氧化酶在大花序桉离体根培养中共同调控内源IAA的含量,与其它激素协同作用于大花序桉的形态建成过程,使细胞朝着有利于根的方向发展。
[1] 广西林学会桉树专业委员会.广西桉树[D]. 南宁:广西大学,1990: 272-276.
[2] 叶 露,陈健波,项东云,等.大花序桉种源/家系试验的早期研究[J]. 广西林业科学,2007,36(4):15-19.
[3] 翟新翠,项东云,陈健波,等.大花序桉种源/家系遗传变异与早期选择研究[J]. 广西林业科学, 2007,36(1):26-30 .
[4] 项东云,陈健波,申文辉,等.大花序桉种源间木材物理性质变异研究[J].广西林业科学,2008,37(2):57-65.
[5] 谭健晖.大花序桉离体培养及根形态建成的生理机制研究[D]. 南宁:广西大学,2009.
[6] 唐再生.大花序桉芽器官离体组培快繁技术研究初报[J].广西林业科学,2006,35(S1):22-23,33.
[7] 唐庆兰.大花序桉组织培养的研究[D]. 南宁:广西大学,2006.
[8] 黄卓烈,李 明,詹福建.不同生长素处理对桉树无性系插条氧化酶活性影响的比较研究[J].林业科学,2002,38(4):46-52.
[9] 黄卓烈,林韶湘,谭绍满.桉树等植物吲哚乙酸氧化酶活性变化与插条生根的比较研究[J].林业科学研究,1996,9(5):510-516.
[10] 李 明,黄卓烈,谭绍满,等.难易生根桉树的过氧化物酶活性及其同工酶多型性比较研究[J].华南农业大学学报, 2000,21(3): 56-59.
[11] 李 明,黄卓烈,谭绍满,等.难易生根桉树多酚氧化酶、吲哚乙酸氧化酶活性及其同工酶的比较研究[J].林业科学研究,2000, 13(5):493-500.
[12] 马振华,赵 忠,张晓鹏,等.四倍体刺槐扦插生根过程中氧化酶活性的变化[J].西北农林科技大学学报,2007,35(7):85-89.
[13] 宋丽红,曹帮华.光叶楮扦插生根的吲哚乙酸氧化酶、多酚氧化酶、过氧化物酶活性变化研究[J].武汉植物学研究,2005, 23(4):347-350.
[14] 李少锋,李志辉,刘友全,等.水分胁迫对椿叶花椒抗氧化酶活性等指标的影响[J].中南林业科技大学学报,2008,28(2):29-34.
[15] Gaspar T, Penel C, Thorpe J, et al. Peroxidase 1970-1980.Asurvey of their biochemical and physiological roles in higher plants[M]. Geneve: Universite of Geneve,1982:25-32.
[16] Bouillenne R, Bouillenne-Walrand M. Auxines etbouturages[C]//Proc 14 Int Hort Cong.[S.l.]:[s.n.],1955:231-238.
[17] Bassuk N L, Hunter L D, Howard B H. The apparent of polyphenol oxidase and phlorizin in the production of apple rooting factors[J]. J Hort Sci,1981,56(4):3-13.
Determination and analysis of oxidase activity in the course of in-vitro root cultures of Eucalyptus cloeziana
TAN Jian-hui1, HUANG Shou-xian2
(1. Academe of Guangxi Forestry Research, Nanning 530002, Guangxi, China;2. College of Forestry, Guangxi University, Nanning 530005, Guangxi, China)
The dynamic changes of Eucalyptus cloeziana oxidase activity in the process of in-vitro root cultures were investigated through adding exogenous auxin. The results show that comparing the in-vitro culture roots added exogenous NAA and IBA with the hormone-free culture roots, the differences between the former two and the latter reached very signif i cant levels; POD, PPO and IAAO all affected the root system formation, of the three, IAAO and POD activities in the culturing process presented the changing trends fi rst decreased then increased and fi nally decreased, PPO showed the opposite trend to be as fi rst increased then decreased and fi nally increased; The interactions of three different oxidases maintained, improved or degraded the endogenous hormone contents and let the cells toward conductive to root development.
Eucalyptus cloeziana; in-vitro root culture; exogenous auxin; oxidase activity
S792.39
A
1673-923X(2015)02-0012-04
10.14067/j.cnki.1673-923x.2015.02.003
http: //qks.csuft.edu.cn
2013-11-29
广西自然基金项目(2011GXNSFA018095)
谭健晖,教授级高工;E-mail:tanjianhui94@126.com
谭健晖 ,黄寿先. 大花序桉离体根培养过程中氧化酶活性分析[J].中南林业科技大学学报,2015,35(2):12-15.
[本文编校:文凤鸣]
