miR-335在急性缺血性脑卒中表达下调及对钙调蛋白的调控作用
2015-12-26海军
,,海军,
(1.南华大学附属第二医院神经内科,湖南 衡阳 421001;2.南华大学附属第二医院急诊科)
·临床医学·
miR-335在急性缺血性脑卒中表达下调及对钙调蛋白的调控作用
袁梅1,汤永红1,袁海军2*,周成芳1
(1.南华大学附属第二医院神经内科,湖南 衡阳 421001;2.南华大学附属第二医院急诊科)
目的检测微小RNA-335在急性缺血性脑卒中(AIS)患者血清中的表达,并探讨其对钙调蛋白(CaM)调控的作用机制。方法采用实时荧光定量聚合酶链反应(qRT-PCR)法测定106例AIS患者及98例健康对照组血清中miR-335表达情况;用生物信息学数据库查询分析miR-335对钙调蛋白编码基因CALM1的靶向结合关系;脂质体转染法将miR-335模拟物、抑制物以及相应阴性对照物分别转染至人脐静脉内皮细胞(HUVECs)中并进行细胞培养,采用逆转录PCR(RT-PCR)和Western blot分别检测干预后HUVECs中钙调蛋白mRNA和蛋白的表达水平。结果与健康对照组相比较,AIS组患者血清miR-335表达明显下调(P<0.01);生物信息学软件的查询分析显示CALM1存在miR-335潜在靶向结合位点;RT-PCR和Western blot检测结果显示miR-335模拟物组CaM mRNA和蛋白的表达水平较对照组显著下降(P<0.01),而miR-335抑制物组CaM mRNA和蛋白的表达水平较对照组显著增高(均P<0.05)。结论急性缺血性脑卒中患者血清miR-335表达明显下降,表达下调的miR-335可能通过上调钙调蛋白的表达从而发挥重要作用。
微小RNA-335; 钙调蛋白; 急性缺血性脑卒中
钙超载是脑缺血/缺血再灌注损伤的重要启动因素,是导致急性缺血性脑卒中(acute ischemic stroke,AIS)患者脑组织损害和神经功能障碍的病理生理过程,最终可导致神经元凋亡。而钙离子生理功能的发挥主要是由钙调蛋白(calmodulin,CaM)来调节。以往研究发现脑缺血/缺血再灌注后,钙调蛋白表达量明显升高[1-2]。近年来,研究表明微小RNA(microRNA,miRNA)调控是基因在转录后表达的非常重要的调控机制,参与了细胞的增殖、分化和凋亡等生命过程的调控,并与脑卒中密切相关[3]。这提示是否存在特定的miRNA调控CaM表达参与脑卒中后的病理生理过程。研究显示miR-335在脑缺血再灌注动物模型脑组织中表达有下调[4]。同时通过生物信息学数据库预测发现钙调蛋白编码基因(CALM1)3′UTR区存在miR-335潜在的靶向结合序列,但目前缺少文献报道。因此,本研究旨在检测miR-335在急性缺血性脑卒中患者血清中的表达水平并探讨miR-335是否靶向调控钙调蛋白的表达。
1 资料与方法
1.1一般资料连续收集2013年6月~12月本院神经内科和急诊科就诊的发病14天内(≤14天)的急性缺血性脑卒中患者共106例,其中男60例,女46例,年龄67.6±6.2岁;对照组来自同期本院体检中心健康普查的健康随机个体,共98例,男56例,女42例,年龄65.9±6.8岁,两组在性别、年龄上无统计学差异。缺血性脑卒中诊断和排除标准参考前期研究报道[3]。本研究经本院医学伦理委员会批准,所有研究对象或家属均知情同意并签署知情同意书。
1.2材料与试剂人脐静脉内皮细胞(HUVECs)购自于中南大学湘雅医院中心试验室,Trizol RNA抽提试剂(美国Invitrogen公司),逆转录试剂盒Rever Tra Ace®(日本TOYOBO公司),染料法实时荧光定量试剂盒SYBR®Premix Ex TaqTM(大连TAKARA公司),M-MLV逆转录试剂盒(美国Invitrogen公司),Lipofectamin 2000(美国Invitrogen公司),多克隆兔抗人钙调蛋白抗体和山羊抗兔IgG-HRP抗体(美国ABclonal公司),miR-335模拟物、抑制物购自上海吉玛生物工程公司,逆转录颈环引物以及PCR扩增引物由上海生工生物有限公司合成。
1.3实时荧光定量聚合酶链反应所有受测者均抽取静脉血5 mL,常温下3 000 r/min离心10 min,收集上层血清1 mL,于-20 ℃保存备用。采用Trizol法提取血清中总RNA,并用分光光度计检测所提取RNA的质量。采用qRT-PCR法检测各标本miR-335浓度。逆转录和PCR扩增均严格按照相应说明书进行操作。以cel-miR-39为内。miR-335颈环引物5′-GTC GTA TCC AGT GCA GGG TCC GAG GTA TCG CAC TGG ATA CGA CAC ATT T-3′,上游引物5′-CTC CAG CTG TCA AGA GCA ATA AC G AA-3′,下游引物5′- TCC AGT GCA GGG TCC GAG GT-3。cel-miR-39颈环引物5′-GTC GTA TCC AGT GCA GGG TCC GAG GTA TTC GCA CTG GAT ACG ACA AAG C -3′,上游引物5′-CAC TCC GTC ACC GGG TGT AAA TC-3′,下游引物5′- TCC AGT GCA GGG TCC GAG GT-3。PCR反应条件:95℃ 预变性2 min;95℃ 变性5 s,60℃退火30 s,72℃延伸40 s,40个循环。采用2-△△CT法计算各组miR-335的相对表达量。
1.4生物学软件靶基因预测通过TargetScan和Miranda两种生物信息学数据库查询来预测miR-335与钙调蛋白编码基因CALM1的靶向结合位点。
1.5细胞培养与转染HUVECs细胞接种于6孔板中,加入含10%FBS的细胞培养液培养,在37 ℃ 5% CO2细胞培养箱中培养,约80%~90%融合时,采用脂质体Lipofectamine 2000方法瞬时转染。转染分5组:①模拟物干预组(miR-335-mimic组):加入has-miR-335 mimics;②模拟物阴性对照组(NC组):加入阴性对照;③抑制物干预组(miR-335-inhibitor组):加入has-miR-335-inhibitors;④抑制物阴性对照组(NC inhibitor组):加入NC inhibitor;⑤ 空白对照组(blank组):不加干预物。严格按照脂质体法进行转染,6 h内用OMEM培养基进行培养,之后改用完全培养基培养48 h收取细胞沉淀,实验重复3次。
1.6 RT-PCR检测用Trlzol法分离各组转染培养后的HUEVC中总RNA,并用分光光度计检测所提取RNA的质量。采用RT-PCR法检各组干预后钙调蛋白mRNA的表达水平。逆转录反应及PCR均严格按照试剂盒说明书操作。用β-actin作为内参。PCR反应条件:94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,30个循环。每组样本实验重复3次。PCR扩增引物见表1。
1.7 Western blot检测蛋白提取和测定采用RIPA裂解液/BCA蛋白定量试剂盒。
表1钙调蛋白基因RT-PCR引物

引物序列(5'-3')扩增产物长度CaLM1-F5'-TGAAGTGGATGCTGATGGTAATGG-3'CaLM1-R5'-CATAGTTGACTTGTCCGTCTCCAT-3'257bpβ-actin-F5'-CACTCTTCCAGCCTTCCTTCCT-3'β-actin-R5'-ACTCGTCATACTCCTGCTTGCT-3'315bp
配制12%分离胶、5%浓缩胶,加入约15 μg蛋白样品,多余空用2×SDS上样缓冲液补齐,然后进行电泳,电泳至溴酚兰刚跑出即可终止电泳,进行转膜,冰上转膜1.5 h,室温封闭2 h,加入1∶5 000稀释的钙调蛋白抗体4℃轻摇过夜,再加1∶10 000稀释的二抗室温孵育2 h,用PBST将膜清洗3次后采用ECL化学发光法进行显色曝光。β-actin作为内参。用Amersham图像分析系统对Western blot目的条带进行光密度扫描,然后用Quantity One软件进行灰度值分析,待测蛋白的灰度值/内参灰度值代表目的蛋白的表达量。所有实验均重复3次。
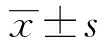
2 结 果
2.1两组miR-335表达的比较血清miR-335在病例组(0.35±0.26)表达明显低于对照组(1.21±0.32)(P<0.01)。
2.2生物学软件靶基因预测结果通过TargetScan和Miranda生物信息学数据库查询分析发现钙调蛋白编码基因CALM1存在miR-335靶向结合位点,见图1。
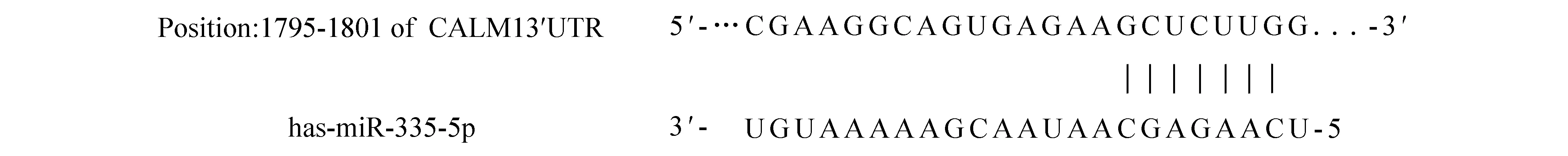
图1 生物学软件靶基因预测结果 通过生物信息数据库查询发现miR-335与CALM1存在靶向结合位点
2.3 miR-335对CALM1 mRNA表达的影响空白对照组、模拟物阴性对照组、抑制物阴性对照组3组CALM1 mRNA 表达差异无显著性 (P>0.05);转染miR-335模拟物后,HUVECs 表达mRNA的量明显低于空白对照和模拟物阴性对照组(P<0.01);而转染miR-335抑制物后,HUVECs 表达CALM1 mRNA的量明显高于空白对照和抑制物阴性对照组(P<0.05),见图2。这表明miR-335影响CALM1 mRNA稳定性。
2.4 miR-335对CaM蛋白表达的影响转染miR-335模拟物后,HUVECs 表达CaM蛋白的量明显低于空白对照组和阴性对照组(P<0.01);而转染miR-335抑制物后,HUVECs 表达CaM蛋白的量明显高于空白对照组和抑制物阴性对照组(P<0.01),见图3。这表明miR-335能显著抑制CALM1mRNA翻译影响蛋白的表达水平。
3 讨 论
本研究通过病例-对照研究发现急性缺血性脑卒中患者血清miR-335表达水平明显下降,结合前期研究及生物学信息软件分析,发现miR-335与钙调蛋白的潜在调控关系,并进一步通过体外细胞实验验证了这种调控关系。
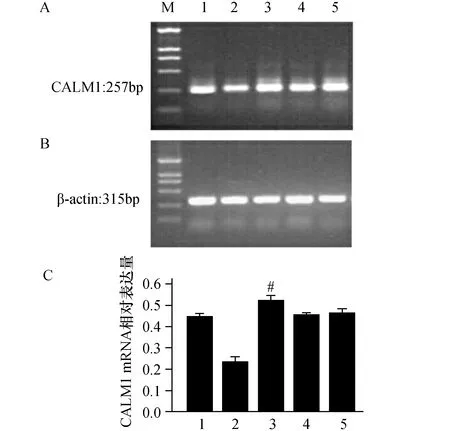
图2 不同干预组CALM1 mRNA的相对表达量 A:CALM1 mRNA PCR跑胶条带,M:Marker;1:空白对照组;2:miR-335模拟物组;3:miR-335抑制物组;4:模拟物阴性对照组;5:抑制物阴性对照组.B:为相应内参β-actin PCR跑胶条带.C:相应结果统计图.与空白对照组和模拟物阴性对照组相比较,*:P<0.01;与空白对照组和抑制物阴性对照组相比较,#:P<0.05
微小RNA(microRNA,miRNA)是一类内源性的19~25个核苷酸大小的非编码RNA分子,包含特定碱基序列,称为“种子序列”,能通过碱基互补匹配原则识别结合靶基因mRNA的3′UTR特异性序列,抑制靶mRNA的翻译或导致其降解,在转录后水平沉默靶基因,对基因表达起着重要的调控作用。miRNA参与了细胞的代谢、增殖、分化和凋亡及个体发育等生命过程的调控。研究发现miRNA参与了神经系统的生长、发育、生理功能和疾病过程,也参与了动脉斑块不稳定性、内皮功能障碍、脑水肿、炎症、细胞凋亡等脑卒中中间环节的调控,与脑卒中有密切相关性[5-7]。识别和鉴定与脑卒中相关的miRNA,并明确其作用及调控机理,并把他们整合到基因调控网络中是当前表观遗传医学研究的热点,也是脑卒中防治的热点。脑卒中患者治疗预后不佳,是临床工作长期的难题。研究miRNA从RNA干扰这一表观遗传学角度认识脑卒中后脑损害,为寻找AIS患者脑保护治疗的新靶点、研发新的药物治疗有着重要的社会意义和经济价值。Samaraweera等[8]研究发现miR-335能下调HAND1和JAG1的表达水平,阻断神经元的生长、分化,参与对神经元发育的调节,Tomé等[9]研究发现过度表达的miR-335能够下调与细胞增殖、分化和凋亡相关的AP-1的表达,而Shu等[10]的研究发现使用mir-335拮抗剂(antagomir-335)后,下调miR-335可以使肿瘤细胞生长停滞、细胞凋亡,以往这些研究提示miR-335可能是神经元重要调控因子,异常表达的miR-335可能与神经系统疾病有密切相关性。更重要的是,最近有研究显示miR-335在脑缺血再灌注动物模型脑组织中表达有下调[4],本研究通过大样本的病例-对照研究,也发现急性缺血性脑卒中患者血清miR-335水平明显下调,与健康对照组相比较有显著性差异(P<0.01)。miRNA能够自由通过血脑屏障[11],可见异常表达的miR-335可能在急性缺血性脑卒中病理生理过程中起重要作用,在进一步研究中,我们探讨了miR-335影响AIS的可能机制。
大量研究表明钙超载在脑缺血损伤的发病机制中起着重要的作用,而钙离子生理功能的发挥主要是由钙调蛋白来介导调节。以往有动物实验研究发现脑缺血再灌注后,随着神经元细胞内的钙超载,大鼠脑组织的CaM活性与含量也明显升高,再灌注后其升高较脑缺血后更为显著[1],而前期研究也发现急性缺血性脑卒中患者血清钙调蛋白表达明显上调,且与神经功能缺损程度呈正相关[2]。通过生物信息学数据库查询分析发现钙调蛋白编码基因CALM1 3′UTR存在序列(GCUCUUG)与miR-335的“种子序列”碱基互补配对(见图1),因而推测miR-335与钙调蛋白之间可能存在负向调控关系。本研究通过脂质体转染法将miR-335模拟物和抑制物转染至HUVECs中并进行细胞培养,采用RT-PCR和Western blot分别检测干预后HUVECs细胞中钙调蛋白mRNA和蛋白的表达水平,发现miR-335可在mRNA和蛋白水平负向调控CaM的表达,从而推测在急性缺血性脑卒中患者脑细胞损害和神经功能障碍机制中存在miR-335对钙调蛋白调节,下调的miR-335对钙调蛋白基因表达抑制不足,导致脑组织钙调蛋白过表达。
总之,本研究表明,在急性缺血性脑卒中下调的miR-335促进了钙调蛋白表达上调,参与急性缺血性脑卒中钙超载损害过程。本研究为开展针对急性缺血性脑卒中患者miR-335靶向治疗提供实验室依据。
[1] Tang LH,Xia ZY,Zhao B,et al.Phosphocreatine preconditioning attenuates apoptosis in ischemia-reperfusion injury of rat brain[J].J Biomed Biotechnol,2011,2011:107091.
[2] 袁梅,周成芳,夏健,等.急性缺血性脑卒中患者血清钙调蛋白水平检测及意义[J].中风与神经疾病杂志,2013,30(7):645-647.
[3] Jickling GC,Ander BP,Zhan X,et al.microRNA expression in peripheral blood cells following acute ischemic stroke and their predicted gene targets[J].PLoS One,2014,9(6):e99283.
[4] Dharap A,Bowen K,Place R,et al.Transient focal ischemia induces extensive temporal changes in rat cerebral microRNAome[J].J Cereb Blood Flow Metab,2009,29(4):675-687.
[5] Yuan M,Zhan Q,Duan X,et al.A functional polymorphism at miR-491-5p binding site in the 3′-UTR of MMP-9 gene confers increased risk for atherosclerotic cerebral infarction in a Chinese population[J].Atherosclerosis,2013,226(2):447 -452.
[6] Zhao H,Wang J,Gao L,et al.MiRNA-424 protects against permanent focal cerebral ischemia injury in mice involving suppressing microglia activation[J].Stroke,2013,44(6):1706-1713.
[7] Wang C,Ji B,Cheng B,et al.Neuroprotection of microRNA in neurological disorders (Review) [J].Biomed Rep,2014,2(5):611-619.
[8] Samaraweera L,Grandinetti KB,Huang R,et al.MicroRNAs define distinct human neuroblastoma cell phenotypes and regulate their differentiation and tumorigenicity[J].BMC Cancer,2014,14:309
[9] Tomé M,Sepúlveda JC,Delgado M,et al.miR-335 Correlates with senescence/aging in human mesenchymal stem cells and inhibits their therapeutic actions through inhibition of AP-1 activity[J].Stem Cells,2014,32(8):2229-2244.
[10] Shu M,Zheng X,Wu S,et al.Targeting oncogenic miR-335 inhibits growth and invasion of malignant astrocytoma cells[J].Mol Cancer,2011,10:59.
[11] Schwarzenbach H,Hoon DS,Pantel K.Cell-free nucleic acids as biomarkers in cancer patients[J].Nat Rev Cancer,2011,11:426-437.
NegativeRegulationofCalmodulinbymiR-335inAcuteIschemicStroke
YUAN Mei,TANG Yonghong,YUAN Haijun,et al
(DepartmentofNeurology,theSecondAffiliatedHospital,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveThe miRNA dysfunction is suspected to be a contributing factor for many CNS pathologies including ischemic stroke.The present study investigates the expression of serum miR-335 in acute ischemic stroke (AIS),and explores the underlying mechanisms of miR-335 in acute ischemic stroke (AIS).MethodsBlood samples were obtained from AIS patients (n=106) and healthy controls (n= 98).MiR-335 was measured by using a quantitative real-time PCR.Bioinformatics database assay was used to determine whether calmodulin gene (CALM1) was the direct target of miR-335.The miR-335 mimics and inhibitors were transfected into human umbilical vein epithelial cells (HUVECs) with lipofectamine respectively.Calmodulin expression was determined by Western blot and reverse transcription-PCR (RT-PCR) in the cultured HUVECs.ResultsCompared with the healthy control group,the expression of serum miR-335 was significantly lower in patients with AIS group (P<0.01).In addition,bioinformatics database assay show that the CALM1 present the binding sites,which was potentially targeted by miR-335.Finally,Transfection of the miR-335 mimic inhibited the expression of CaM mRNA and protein in the HUVEC compared to the control group (P<0.01),while transfection of the miR-335 inhibitors increased the expression of CaM mRNA and protein (P<0.05).ConclusionMiR-335 down-regulation may increase the ischemic brain injury through up-regulating the expression of CaM.
microRNA-335; calmodulin; acute ischemic stroke
10.15972/j.cnki.43-1509/r.2015.03.010
2014-10-20;
2015-03-15
衡阳市科技计划项目(2014KJ40).
*通讯作者,E-mail:yuanhaijun211@163.com.
R743.3
A
(此文编辑:朱雯霞)
