外排泵adeB基因与鲍曼不动杆菌多重耐药的关系
2015-12-26,,,
, , ,
(1.南华大学附属第一医院输血科,湖南 衡阳 421001;2.南华大学附属第一医院检验科)
·基础医学·
外排泵adeB基因与鲍曼不动杆菌多重耐药的关系
阳志勇1,尹文君2,谢海涛2,张秋桂2
(1.南华大学附属第一医院输血科,湖南 衡阳 421001;2.南华大学附属第一医院检验科)
目的探讨临床分离鲍曼不动杆菌主动外排基因adeB的表达与其多重耐药的关系。方法对临床分离的64株鲍曼不动杆菌采用纸片扩散法检测对抗菌药物的敏感性;罗丹明6G检测外排活性,RT-PCR检测外排泵基因adeB的分布和表达水平。结果64株鲍曼不动杆菌耐0~2种抗菌药物4株,耐3~5种抗菌药物33株,耐6~8种抗菌药物27株;罗丹明6G外排实验显示,外排增强的多重耐药菌株其外排基因adeB的表达明显增高。结论药物主动外排增强与鲍曼不动杆菌多重耐药相关;外排基因的过度表达可能是导致鲍曼不动杆菌多重耐药的主要原因。
鲍曼不动杆菌; 多重耐药; adeB
鲍曼不动杆菌(Acinetobacter baumannii,Ab)是常见的导致医院感染的主要条件致病菌之一,广泛存在于自然界与机体表面,当机体的抵抗力以及免疫能力低下更易导致机会感染[1-3]。近年来,随着抗菌药物及免疫抑制剂的广泛应用,多重耐药呈逐年上升的趋势,而研究报道鲍曼不动杆菌耐药的主要机制仍由主动外排作用所介导[1-3]。本研究通过罗丹明6G筛选出外排明显的菌株,再通过RT-PCR检测外排泵基因adeB的分布和表达水平,进而分析外排泵基因adeB与鲍曼不动杆菌多重耐药之间的关系。
1 材料与方法
1.1材料
1.1.1 菌株来源 64株临床分离株来自2013年1月~2014年2月南华大学附属第一医院住院患者,标本来源主要为痰、伤口分泌物、血液、引流物、大便和尿液。
1.1.2 主要试剂及仪器 罗丹明6G购自Sigma公司;DNA Marker、RT-PCR逆转录试剂盒购自北京鼎国公司;Trizol试剂盒和DNA纯化试剂盒均购自天根生物公司;ABI7500 Realtime PCR仪;法国VL公司凝胶成像分析系统。adeB引物:P1:5′-GTATGAATTGATGCTGC- 3′ ;P2:5′-CACTCGTAGCCAATACC- 3′; 内参照基因16sRNA:C1:5′-GGAGGAAGGTGGGGATGACG- 3′;C2:5′-ATGGTG TGACGGGCGGTGTG- 3′均由上海生工生物工程有限公司合成。
1.2方法
1.2.1 菌株鉴定及药敏实验 采用法国生物梅里埃ATB药敏系统进行药物敏感实验,BD CRYSTAL细菌鉴定系统进行细菌检测,质控菌株为大肠埃希菌ATCC25922;金黄色葡萄球菌ATCC25923;绿脓假单胞菌ATCC27853。根据药敏结果显示耐药种类的数量将64株受检菌分为A组(耐0~2种抗菌药物)、B组(耐3~5种抗菌药物)和C组(耐6~8种抗菌药物)。
1.2.2 罗丹明6G外排实验 将单个菌落接种于LB培养基中,37℃恒温箱培养8 h,收集2 mL在600 nm波长处的吸光值(OD600)为1.0的菌悬液,用PBS 1 mL洗涤3次。取1 mL混合PBS菌悬液,加罗丹明6 G,终浓度为5 μmol/L,放置于37 ℃震荡仪30 min,PBS水洗。将其加入1 mL含1%葡萄糖的PBS中,37 ℃水浴震荡仪15 min。取0.8 mL上清液测定其荧光强度。1%葡萄糖PBS溶液为空白对照。计算公式为:罗丹明6G外排活性ES=(样本的荧光强度一空白管的荧光强度)/OD600。
1.2.3 提取DNA 于1 mL Trizol 中加入1 mL菌液,按5∶1加入氯仿,振荡约30 S,4 ℃静置。13 000 r/min离心10 min,取上清,加入等量的异丙醇混匀,12 000 r/min离心10 min,弃去上清液,再加入75%乙醇300 μL混匀,12 000 r/min离心1 min,常温阴干10 min,加入30 μL经焦碳酸二乙酯处理过的纯水。
1.2.4 DNasel消化DNA及逆转录 DNasel消化DNA:总RNA20~50 μg;DNase(DNase-free)2 μL;10×DNase Bufer 2 μL;10×DNase1 Bufer 5 μL;RNase Inhibitor 0.55 μL;DEPC处理水50 μL,37 ℃反应20~30 min,加入DEPC 50 μL,加入异戊醇/氯仿/苯酚(1∶24∶25)10 μL混匀,12 000 r/min离心1 min,取上清液,加入异戊醇/氯仿(1∶24),同上离心取上清液,加入3M NaOAC(pH5.2)10 μL,加入250 μL无水乙醇,-20 ℃放置20~30 min,同上离心回收沉淀,75%乙醇清洗沉淀,同上离心回收沉淀,加DEPC20 μL处理沉淀,-70 ℃保存。
逆转录:按试剂盒说明加以改良进行,RP1 μL,10 mm dNTP mixture 1 μL,5×RT buffer 4 μL,酶混合液1 μL,总RNA样品1 μL,DEPC 11 μL,30 ℃保温10 min,37 ℃ 30 min,95 ℃ 5 min,4 ℃ 5 min,1个循环将上述逆转录的产物进行PCR扩增。扩增体系:25 μL,cDNA模板1 μL,adeB引物1 μL,内参引物1 μL,Master mix 12.5 μL,去离子水7.5 μL,94 ℃ 5 min;94 ℃ 30 s,55 ℃ 1 min,72 ℃ 1 min,共25个循环,延伸7 min,置4 ℃保存。在同等条件下通过凝胶成像系统测定PCR产物的密度值,计算出16sRNA与adeB的密度比值。
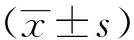
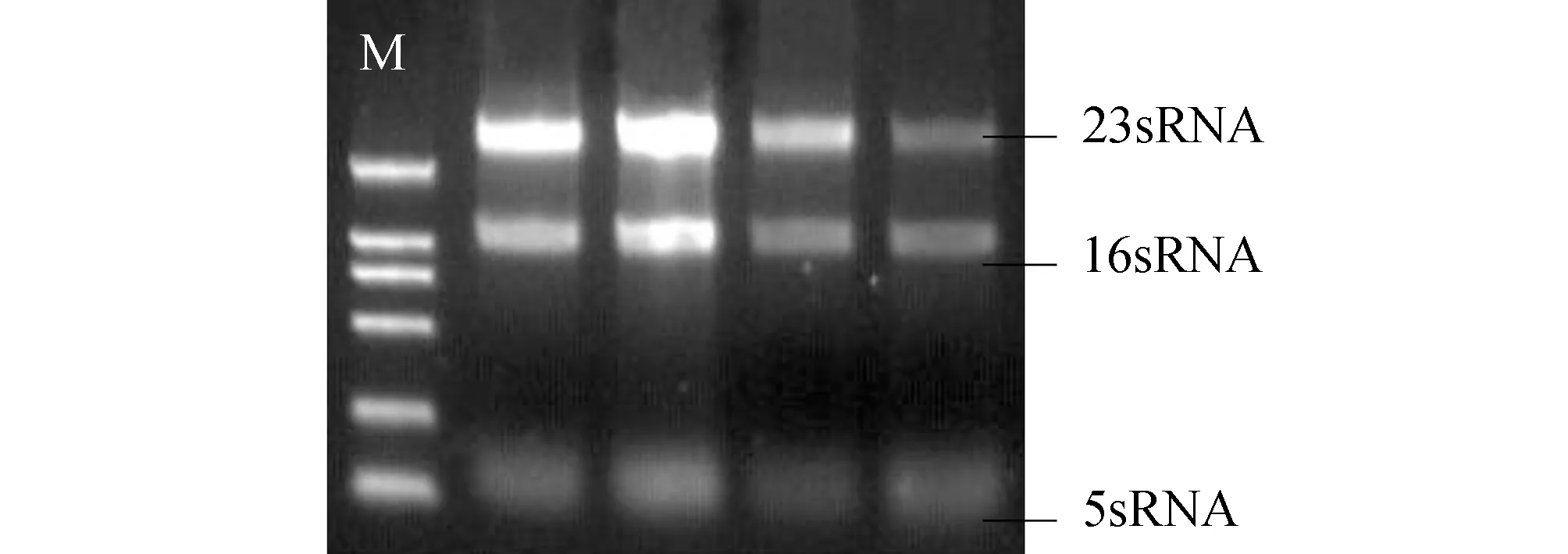
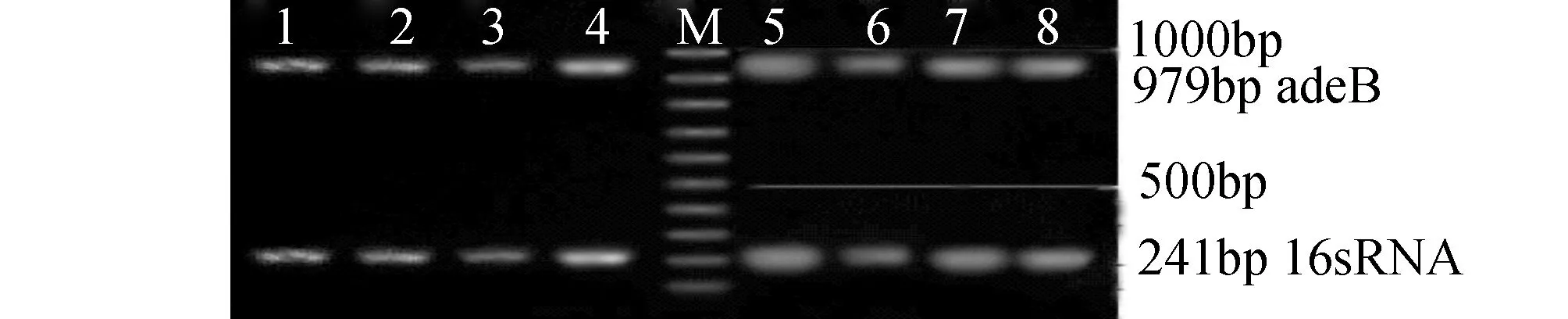
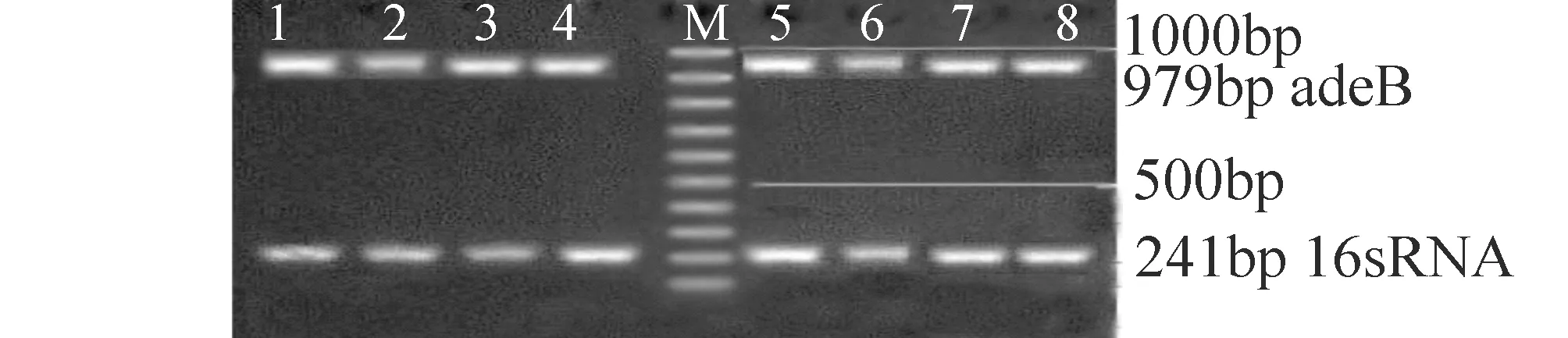
2 结 果
2.1罗丹明6G外排实验鲍曼不动杆菌罗丹明6G外排活性以公式ES=(样本的荧光强度一空白管的荧光强度)/OD600为计算依据,计算出A、B、C组的外排量分别为 0.253±0.010 μmol /L (n=4)、0.570±0.021 μmol/L(n=33)、0.793±0.035 μmol/L(n=27),可见ESA 2.2总RNA检测提取64株鲍曼不动杆菌总RNA的琼脂糖凝胶电泳结果可见16 s和23 s两个清晰的条带,说明RNA无明显降解(见图1)。 2.3 adeB基因表达A、B、C三组中,A组的4株为非多重耐药菌株,罗丹明6G外排实验无明显阳性,B组的33株与C组的27株为多重耐药菌株,罗丹明6G外排实验阳性,RT-PCR测定该三组的adeB基因的mRNA表达水平。以总DNA为模板进行逆转录,mRNA半定量结果示:C组表达量为2.506±0.253;B组表达量为2.152±0.186;A组表达量为1.652±0.175;可见B组和C组adeB mRNA的表达量均高于A组(见图2,3)。 鲍曼不动杆菌为一类生化反应不活跃的非发酵革兰阴性杆菌,广泛存在于自然界,也可存在于人体体表的条件致病菌,是引起医院感染的常见致病菌,其耐药机制复杂,主动外排机制仍然是其耐药的主要机制之一,经证实AdeA、B、C是鲍曼不动杆菌所特有的生物外排胞膜蛋白基因[3-6]。 图1 鲍曼不动杆菌总RNA琼脂糖凝胶电泳结果 图2 部分鲍曼不动杆菌adeB mRNA基因扩增图 1~4:A组; 5~8:B组;M:marker 图3 部分鲍曼不动杆菌adeB mRNA基因扩增图 1~4:A组; 5~8:C组;M:marker 有机染料罗丹明6G是常用检测微生物外排蛋白功能的一种底物,本实验将罗丹明6G作为AdeA、B、C的作用底物,筛选出由主动外排介导的多重耐药鲍曼不动杆菌,三组鲍曼不动杆菌对罗丹明6G外排量分别为0.253±0.010 μmol /L(A组)、0.570 ±0.021 μmol /L(B组)和0.793±0.035 μmol /L(C组),C组的罗丹明6G外排活性最强,B组次之,三组间差异均有统计学意义。表明多重耐药组(C组,B组)较非多重耐药组(A组)外排程度更高,进一步提示外排泵蛋白的过度表达,易致抗菌药物的外排增加,导致多重耐药的产生。 RT-PCR是将PCR和RNA的反转录相结合的技术,并广泛应用于基因检测[5-7]。为了进一步研究生物外排泵蛋白B的表达水平与外排强度的相关性,本研究采用RT-PCR技术检测该三组鲍曼不动杆菌的adeB基因的mRNA表达水平,mRNA半定量结果显示:C组表达量为2.506±0.253;B组表达量为2.152±0.186;A组表达量为1.652±0.175,C组和B组均大于A组,C组大于B组,各组间差异均有统计学意义,说明多重耐药菌株的罗丹明6G外排增加,其外排基因adeB的表达水平也较非多重耐药菌株(A组)高,结果提示该菌株耐药种类越多,其外排基因adeB的表达水平也越高。进一步证实了鲍曼不动杆菌主动外排基因的高水平表达是多重耐药的重要耐药机制之一。 鲍曼不动杆菌的耐药机制复杂,由主动外排介导的多重耐药机制仍可能是其主要的耐药机制,外排基因的高表达能导致对多种抗菌药物的外排,外排泵抑制剂能够部分逆转这种外排。因此,加强外排泵的研究,为开发更有效的外排泵抑制剂,避免药物成为外排泵的底物,为临床更有效地避免抗菌药物的耐药具有重要的意义。 [1] 匡艳华,袁秀琴.2004~2007年鲍曼不动杆菌的分布特征及耐药性分析[J ].南华大学学报:医学版,2008,36(5):646-648. [2] 葛学顺,陶晓军,陈维开,等.鲍曼不动杆菌的临床分布及耐药情况分析[J].中国实验诊断学,2014,18(7):1162-1164. [3] 张辉,张小江,徐英春,等.2011年中国CHINET不动杆菌属细菌耐药性监测[J]中国感染与化疗杂志,2013,13(5):342-347. [4] 杨爱平,李向阳.外排泵 adeB基因表达与鲍曼不动杆菌泛耐药的关系[J].浙江检验医学,2010,8(1):7-10. [5] 刘振茹,凌保东.鲍曼不动杆菌耐药性与16s rRNA甲基化酶基因表达相关性研究[J].川北医学院学报,2012,27(6):526-528 [6] Yangsoon L,Jong HY,Chang-KK.Role of OXA-23 and AdeABC efflux pump for acquiring carbapenem resistance in an Acinetobacter baumannii strain carrying the blaOXA-66 gene[J].Ann Clin Lab Sci,2010,40(1):43-48. [7] 王同慧,凌保东.碳青霉烯类耐药鲍曼不动杆菌adeB外排基因表达与多重耐药相关的研究[J].中国抗生素杂志,2013,38(11):859-862. RelationshipofMultidrugResistancewithActiveEffluxGeneadeBinClinicalIsolatesofAcinetobacterBaumannii YANG Zhiyong,YIN Wenjun,XIE Haitao,et al (TheFirstAffiliatedHospital,UniversityofSouthChina,Hengyang,Hunan421001,China) ObjectiveTo explore the relationship of multidrug resistance with abeB gene in the clinical isolates of Acinetobacter baumannii.MethodsThe agar doubling dilution method was used to identify the minimal inhibitory concentration(MIC) of 8 antibiotics for Acinetobacter baumannii.The efflux of Rhodamine 6G in 64 strains of clinical Acinetobacter baumannii was tested and the Reverse transcriptase polymerase chain reaction (RT-PCR) was used to detect the mRNA expression levels of active efflux gene adeB.ResultsAmong 64 strains of clinical Acinetobacter baumannii 4 strains was resistant to 0~2 antibiotics,33 strains was resistant to 3~5 antibiotics,27 strains was resistant to 6~8 antibiotics.The expression levels of efflux gene adeB in the multiple drug-resistant strains which enhanced the efflux were also increased.ConclusionsThe effection of active efflux system of adeB may be one of the important multidrug resistance mechanisms of Acinetobacter baumannii. Acinetobacter baumannii; multiple resistance; adeB 10.15972/j.cnki.43-1509/r.2015.03.007 2014-05-07; 2015-04-13 R378.21 A (此文编辑:秦旭平)3 讨 论