黑曲霉木聚糖酶的同源表达及其高产木聚糖酶发酵条件的优化*
2015-12-25倪大伟李瑞云白爱枝张文涛王军
倪大伟,李瑞云,白爱枝,张文涛,王军
1(内蒙古自治区离子束生物工程重点实验室,内蒙古呼和浩特,010021)
2(内蒙古大学生命科学学院,内蒙古呼和浩特,010021)3(内蒙古大学 物理科学与技术学院,内蒙古呼和浩特,010021)
黑曲霉(Aspergillus niger)具有多种活性较强的酶系,是重要的酶制剂生产菌种,也是木聚糖酶的生产菌种之一。随着真菌基因组学和基因微阵列及蛋白质组学等实验技术的发展,利用丝状真菌作为宿主表达同源和异源蛋白也得到快速发展和应用[1],黑曲霉作为丝状真菌的代表性菌种之一,其表达系统也越来越受到科技工作者的关注[2-3]。黑曲霉是国际公认的安全生产菌株[4],并且其本身具有强大的蛋白质胞外分泌能力,有完善的翻译后加工功能及成熟的发酵工艺等优点,是外源和内源蛋白表达的优良宿主。
木聚糖酶是一种重要的工业酶制剂,在食品、饮料、造纸和饲料等方面有广泛的应用。目前市场上大部分高效木聚糖酶产品的技术核心都属于国外公司,因此通过基因工程技术,构建高表达的木聚糖酶工程菌,对于降低木聚糖酶的价格促进其应用水平,是国内木聚糖酶工业所面临的最紧迫的问题。黑曲霉产木聚糖酶基因xynB的同源表达研究的甚少,2005年Anthony等[5]利用 RT-PCR 从 A.niger BRFM281 mRNA扩增的带有6个his标签的xynB基因克隆到有gpd强启动子的表达盒,将该表达盒在蛋白酶阴性突变株Aspergillus niger D15#26中进行表达,获得的1株基因工程菌的木聚糖酶产量达到900 mg/L,酶活力为625 U/mL;国内的郑瑞娟[6]从A.niger TS1中利用同样方法克隆得到xynB基因,通过构建与葡萄糖淀粉酶的融合表达质粒,在尿嘧啶缺陷型A.niger M54中表达,获得的重组菌的酶活力最高达507 IU/mL,分别是原出发菌和宿主菌的6.7倍和3.89倍。Record等[7]利用 Aspergillus nidulans gpd基因的启动子、5’非编码区和终止子将A.niger来源的阿魏酸脂酶faeA基因进行同源表达,表达量较原始菌株提高24.5 倍,达 1 g/L;Anthony Levasseur[8]采用同样的策略表达A.niger BRFM131的阿魏酸脂酶faeB基因,产量较原菌株提高了16倍;同源表达较之异源表达,可有效避免异源表达中难以解决的问题,如分泌过程中蛋白的错误折叠和被内源蛋白酶降解的可能以及物种密码子的偏好性、基因结构的复杂性等,多种蛋白酶同源表达的成功,表明该策略具有广泛的应用价值。本实验室从A.niger A327中克隆了木聚糖酶基因xynB[9],采用同源表达策略将其表达在黑曲霉菌株A.niger A327中,本文对木聚糖酶活力最高的转化子A.niger A70菌株的摇瓶发酵条件进行了优化。
1 材料与方法
1.1 菌株与载体
出发菌株黑曲霉A.niger A327,由内蒙古自治区离子束生物工程重点实验室保藏;质粒 VHb和p3SR2由中国科学院微生物所唐国敏教授惠赠。
1.2 主要仪器与试剂
TU-1800PC紫外-可见分光光度计,北京谱析通用仪器设备有限责任公司;DYY-12型电泳仪,北京六一;ZHWY-1102/1121型普通摇床,上海智诚,主要试剂:木聚糖(birchwood xylan),美国sigma公司;玉米芯麸皮购于呼和浩特市郊,玉米芯经粉碎机粉碎后备用;其他化学试剂均为国产分析纯。
1.3 表达载体的构建及其表达
从A.niger A327中克隆编码xynB结构基因及其5’调控区序列片段,总长1611bp,将其与目的载体pBS-T 连接[5],并转化 E.coli DH5α,挑取单克隆,鉴定阳性克隆子,分别将从质粒VHb和质粒p3SR2酶切得到的来源于A.nidulans的终止子TtrpC和选择标记基因amdS连接到已连入xynB基因的T载体中,得到表达载体pBS-XTP(图12,并利用原生质体转化技术将表达载体转入菌株A327中,通过摇瓶发酵筛选产木聚糖酶活力最高的转化子。
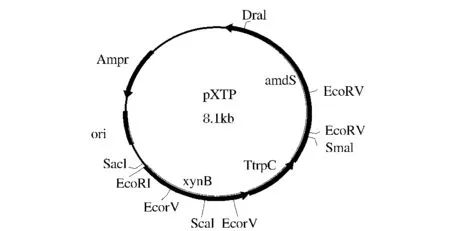
图1Fig.1
1.4 木聚糖酶活力的测定方法[10]
取适当稀释的粗酶液0.1 mL,加到1 mL、1%的桦木木聚糖悬浮液中(pH5.0,0.2 mol/L醋酸缓冲液配制)于50℃水浴反应10 min,用 DNS(3,5-二硝基水杨酸)法,测定产生的还原糖。以木糖为标准,在本实验条件下,每分钟产生1 μmol还原糖所需的酶量定义为1个酶活力单位U/mL。
1.5 培养基和培养方法
分离培养基(g/L):麸皮5,蛋白胨1,琼脂20,Manders营养盐液[11]定容 1 000 mL,pH 自然。PDA培养基(g/L):马铃薯200(去皮、切块煮30 min,纱布过滤),葡萄糖20,琼脂15,蒸馏水定容至1 000 mL,pH自然。基础产酶培养基(g/L):玉米芯75,麸皮24,Manders营养盐液 1 000 mL,pH5.5 ~6.0。以上培养基在没有添加糖蜜的情况下均在121℃灭菌30 min,添加糖蜜的培养基在115℃灭菌30 min;固体培养,置于30℃下培养4~5 d;液体培养,30℃下,摇瓶培养发酵4 d,摇床转速为200 r/min。
1.6 基因工程菌产木聚糖酶条件优化
1.6.1 培养基的单因素优化
在初始发酵培养基的基础上,保持其他条件不变,分别添加不同浓度的玉米芯(40,50,60,70,80,90 g/L),不同浓度的麸皮(15,20,25,30 g/L),不同浓度的糖蜜(0,2,4,6,8,10 g/L)以及浓度均为 6 g/L的不同氮源((NH4)2SO4、NaNO3、NH4NO3、蛋白胨、尿素),进行摇瓶发酵,研究各因子对木聚糖酶酶活的影响。
1.6.2 发酵条件优化
在基础产酶培养基的条件下,分别设置不同温度(25℃(室温)、28℃(黑曲霉A327产酶最适生长温度)、31 ℃、34 ℃),接种量(1.0、1.5、2.0、2.5 mL,孢子悬液浓度 108个/mL),装液量(30、45、60 mL)和摇床转速(180、200、220转/min)对基因工程菌A70的发酵条件进行优化。
1.6.3 培养基的正交试验
设计了4因素3水平的L9(34)正交试验(见表1),进一步对营养条件进行优化。
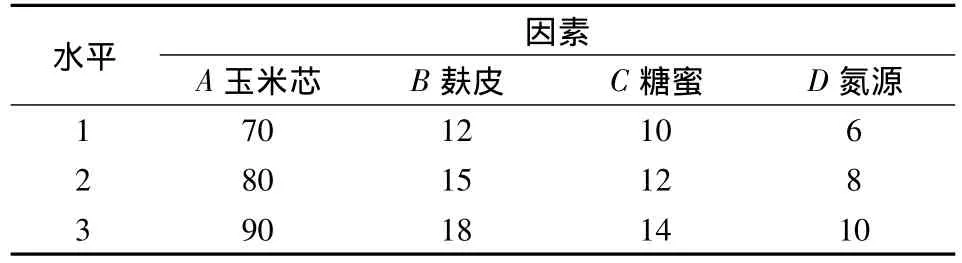
表1 正交设计方案 单位:g/LTable1 Orthogonal design project
1.6.4 最适发酵条件验证
利用上述单因素和正交试验获得的最适发酵条件和培养基组成进行最适发酵条件的验证实验。
以上发酵试验均设置3组平行试验,取平均水平,以发酵96 h上清液的木聚糖酶活力作为考核指标考察各因素对基因工程菌A70产木聚糖酶的影响。
2 结果与分析
2.1 xynB基因在A.niger A327中的同源表达
将出发菌株A327菌株和筛选的部分转化子(包括产酶水平最高的A70转化子)分别在100 mL摇瓶中,28℃,200 r/min摇床发酵培养,将发酵上清液离心得到粗酶提取液,沸水煮沸5 min,取相同体积的粗酶液进行SDS-PAGE(结果见图2)。可见菌株A37,A55,A70,A74,A75,A77,A78 均不同程度地表达了xynB基因,木聚糖酶的产量不同程度的有所提高。目的产物分子量约为21 kDa,从图中可以看出A63菌株产木聚糖酶的量较对照还要低,而A70菌株分泌木聚糖酶的量最多,这与发酵后酶活测定的结果一致(见表2)。表达程度的高低与xynB基因插入的拷贝数有关,在一定范围内插入拷贝数越多,表达量越高,当拷贝数进一步提高,或许由于调控蛋白的滴定效应,表达不再上升[12],这一基因剂量效应在外源蛋白的表达中同样成立。从图中可以看出有的菌株在表达xynB基因的同时,使其他蛋白的分泌有所提高,这可能与xynB基因所插入的位置有关,正好使其他蛋白的表达受到调控,提高了产量。
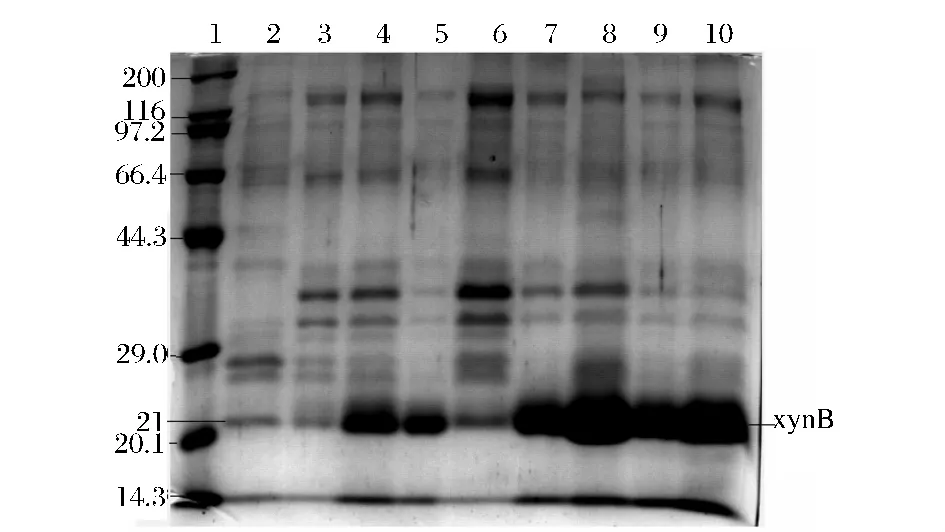
图2 转化株产酶的SDS-PAGE分析Fig.2 The SDS-PAGE detection of xylanase transformants

表2 转化株发酵的木聚糖酶活力(IU/mL)Table 2 Xylanase activity of transformants fermentation
2.2 高效表达菌株A70的遗传稳定性
基因工程菌的遗传不稳定性主要表现在重组质粒的不稳定性,这种不稳定性具有下列两种表现形式:其一是结构不稳定性,重组 DNA分子上某一区域发生缺失、重排、修饰,导致其表观生物学功能的丧失;其二是分配不稳定性,整个重组 DNA分子从受体细胞中逃逸。将A70菌株进行斜面到斜面的传代培养,传代6次后,在基础产酶培养基和培养条件下,将经不同传代次数的A70菌株同时进行发酵实验,结果(见表3)显示,该菌株的遗传稳定性较好。
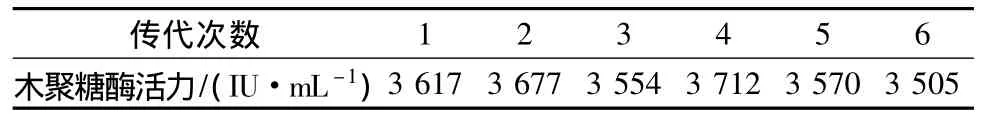
表3 Strain A70菌株的传代酶活测定Table 3 The enzyme activity from continual inoculation of A70
2.3 发酵时间对菌株A70产酶的影响
随着发酵时间的延长,微生物的代谢产物随之增加,但分泌的代谢产物量通常受到营养条件、培养条件等多种因素的影响。实验采取在相同的培养条件下,利用基础产酶培养基对出发菌株A327和基因工程菌A70的发酵特性进行比较。结果如图3和图4所示,可见发酵96 h基因工程菌A70达到产酶高峰期,较出发菌株A327的产酶周期延长24 h,这可能是由于其基因序列中插入了表达载体,使得菌体的生长变慢或者使菌体的代谢调控机制受到影响,而使产酶周期延长,工程菌A70产酶水平为360 IU/mL,较出发菌株A327提高约16倍。
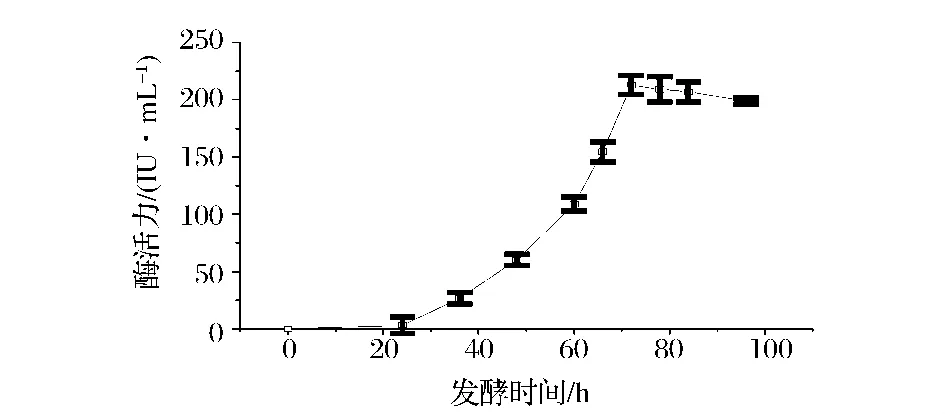
图3 黑曲霉菌株A327的产酶曲线Fig.3 The cure of Strain A327 on xylanase production
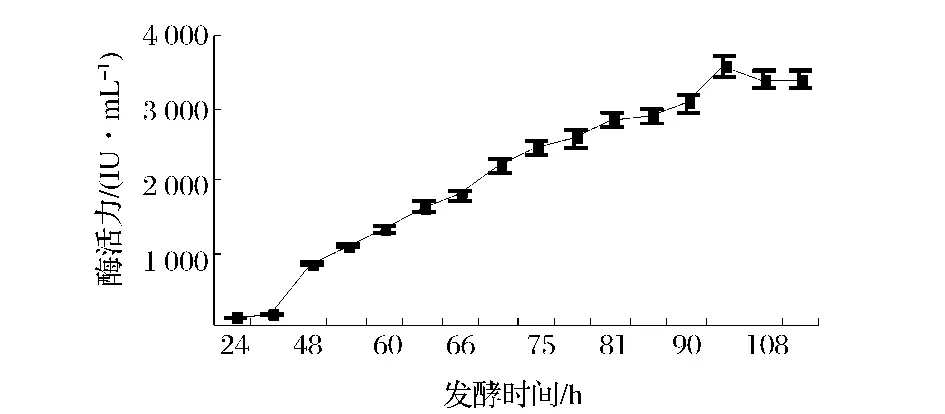
图4 黑曲霉菌株A70的产酶曲线Fig.4 The curve of A70 on xylanase production
2.4 高表达菌株发酵条件优化
在基础产酶培养基条件下,根据实验的目的添加或改变相应的条件,对产酶水平最高的基因工程菌A70的发酵条件进行优化。
2.4.1 碳源浓度对产酶的影响
在前期的研究中发现出发菌株A327以玉米芯为碳源时产木聚糖酶活力最高[13],因此以玉米芯为主要碳源考察其初始发酵浓度对基因工程菌株A70产木聚糖酶的影响,结果见图5,90 g/L的起始玉米芯浓度产酶的活力最高,同时也发现该浓度下发酵液因失水较多而变得粘稠,其次是80,40 g/L稍次之。
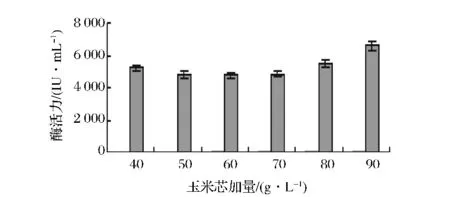
图5 玉米芯的量对产酶的影响Fig.5 Effect of corncob concentration on xylanase production
2.4.2 麸皮质量浓度对产酶的影响
本试验在2.3.1的基础上,在其它条件不变的情况下,分别以玉米芯质量浓度为40、80和90 g/L,添加不同比例的麸皮进行发酵研究,发现当玉米芯浓度和麸皮浓度为80 g/L和15 g/L时菌株A70产木聚糖酶的活力最高(结果见表4)。
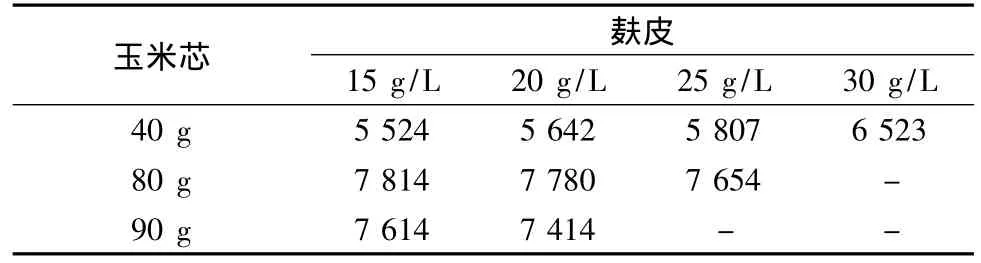
表4 麸皮质量浓度对产木聚糖酶活力的影响 单位:IU/mLTable 4 Effect of bran concentration on xylanase production
2.4.3 附加碳源浓度对产酶的影响
通常微生物发酵所需的碳源不止一种,而且不同种类的碳源对微生物代谢产物的分泌都有较大的影响。在其它条件不变的情况下,以玉米芯浓度为80 g/L,麸皮浓度为15 g/L,添加不同的速效碳源淀粉、葡萄糖、蔗糖、甜菜糖蜜、麦芽糖,发现菌株对甜菜糖蜜的利用效果最好。糖蜜是制糖工业的副产品,其组成因制糖原料、加工条件的不同而有差异,因其含有大量的蔗糖,因此是很好的微生物发酵培养基组分。对菌株A70来说,其利用甜菜糖蜜发酵产酶效果较单纯的蔗糖好的原因可能是糖蜜中还含有较多的矿物质成分以及其他营养素,对菌株的生长更有利。通过添加不同浓度的糖蜜考察其对菌株A70产木聚糖酶的影响,发现当添加的糖蜜浓度为12 g/L时,菌株产木聚糖酶的活力最高(见图6)。
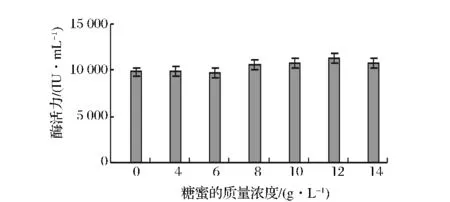
图6 糖蜜质量浓度对产酶的影响Fig.6 Effect of molasses concentration on xylanase production
2.4.4 不同氮源对产酶的影响
在上述实验结果的基础上,培养基以80 g/L玉米芯,15 g/L麸皮,Mandels盐液中去除(NH4)2SO4和 NaNO3后,分别加入(NH4)2SO4、NaNO3、NH4NO3、蛋白胨、尿素,质量浓度为6 g/L,对照为原Mandlels盐液不变,来研究氮源对产木聚糖酶的影响,结果见图7,可见菌株A70对氮源的利用以尿素的产酶效果最好,NaNO3次之;但是实验发现以尿素为氮源时,到发酵终点培养基的失水较严重,相比之下NaNO3的发酵效果更好。
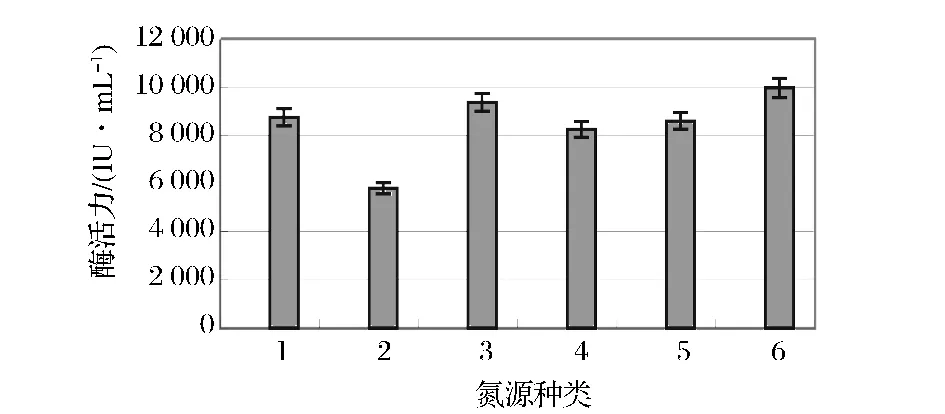
图7 不同氮源对产酶的影响Fig.7 Effect of different nitriogen source on xylanase production
2.5 发酵条件对产酶的影响
以基础产酶培养基对菌株A70的发酵温度、接种量及溶氧条件进行了研究,试验表明,产酶的最适温度为28~30℃(见表5),最适接种量为1.5 mL/瓶(见表6),最适装液量为30 mL/瓶,当摇床转速逐渐从180 r/min增加到220 r/min时,菌株的产酶水平随之提高,说明菌株对溶氧的需求较高(见表7),这也符合霉菌生长的特点。
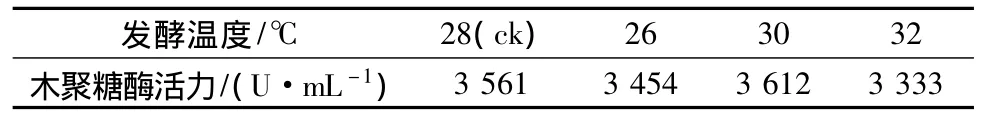
表5 不同发酵温度对酶活的影响Table 5 The effect of different fermentation temperature

表6 接种量对菌株发酵产酶的影响Table 6 The effect of inoculation quantity on xylanase production

表7 溶氧对发酵的影响Table 7 The effects of ventilation in fermentation
2.6 发酵产酶培养基的正交试验
上述实验仅考虑了各个因素单独的作用,未考虑各个因素均发生变化时,高产菌株发酵水平的变化。为了获得同源表达基因工程菌黑曲霉A70最佳的产酶营养条件,选用L9(34)表设计了4因素3水平的正交试验(见表1)进一步对营养条件进行优化。正交试验结果见表8。
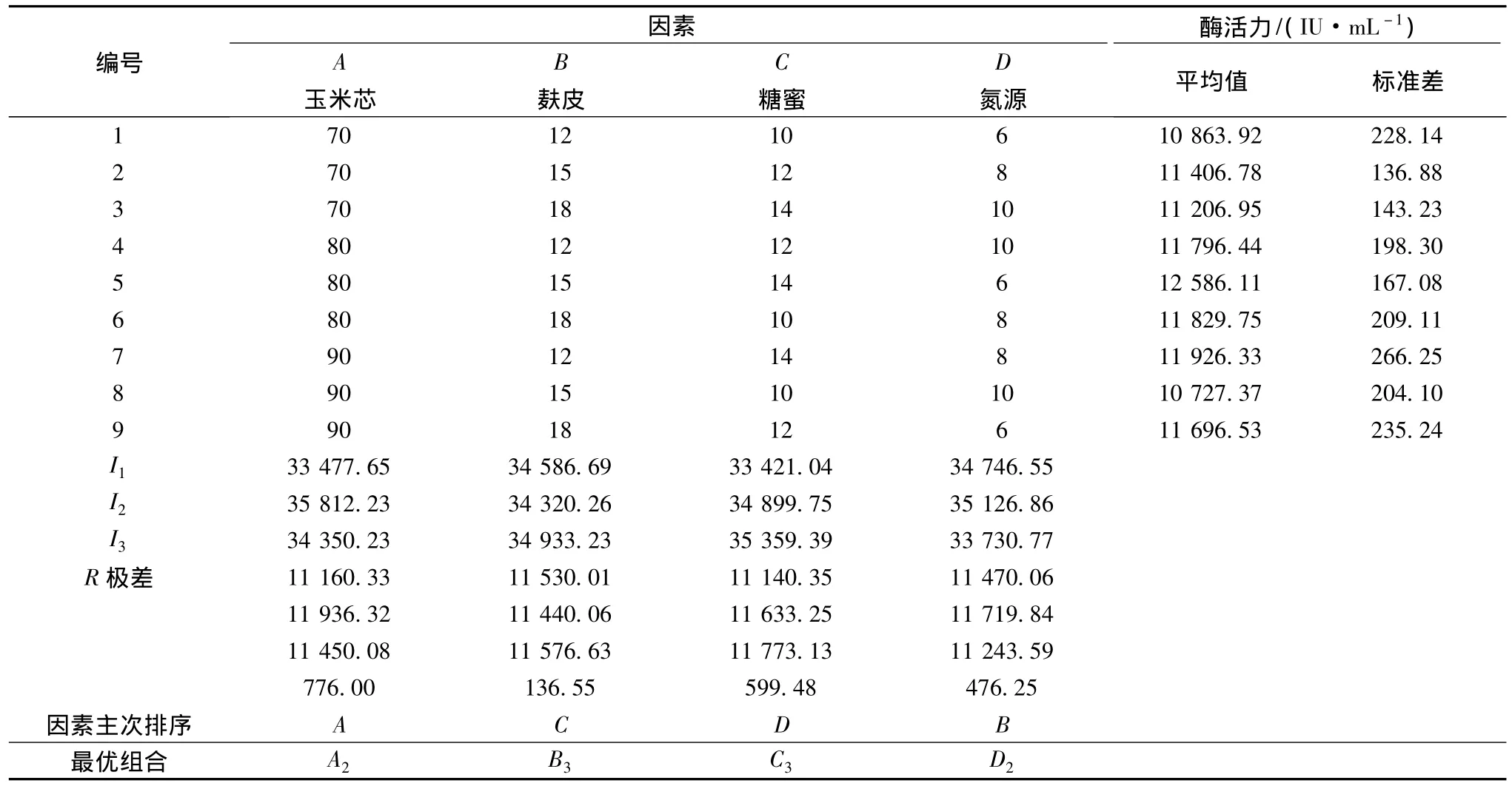
表8 正交实验结果Table 2 Results of orthogonal test design
通过直观分析正交试验的结果,可以看出影响基因工程菌A70产酶的各因素主次顺序为A>C>D>B,最优组合为玉米芯80 g/L,麸皮18 g/L,糖蜜14 g/L,NaNO38 g/L,在该组合下菌株产酶的最高水平为12586 U/mL。
2.7 最佳工艺条件验证
按2.5确定的最佳培养基配方和2.4确定的最适发酵条件进行3次平行实验,平均产酶水平为12 639 U/mL(见表9),实验结果表明,发酵工艺的重现性好,菌株的产酶水平稳定。
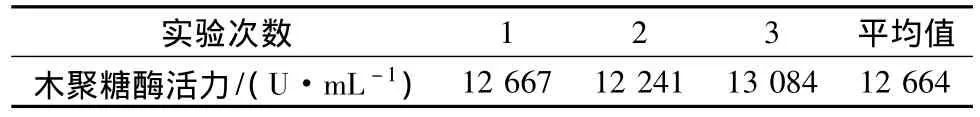
表9 最适发酵条件验证Table 9 The validation of optimal fermentation conditions
3 结论
通过对黑曲霉同源表达高产菌株培养基及发酵条件的优化,菌株的发酵周期为4天,发酵培养基以玉米芯80 g/L,麸皮18 g/L,糖蜜14 g/L,NaNO38g/L,30 mL无氮Mandels营养液为最适培养基配方。发酵温度为28~30℃,接种量为1.5 mL/瓶,摇床转速以220 r/min发酵产酶水平最高,在上述优化的条件下基因工程菌A70产酶水平为12 664 U/mL,较优化前的3 601 U/mL提高约3.5倍。同源表达木聚糖酶的黑曲霉菌株A70发酵产酶水平较高,生产成本低,该实验为用黑曲霉表达系统高效表达其他酶类提供了参考。
[1] Owen P.Ward.Production of recombinant proteins by filamentous fungi[J].Biotechnology Advances,2012,1119-1139.
[2] Roth AH.Dersch.P.A novel expression system for intracellular production and purification of recombinant affinitytagged proteins in Aspergillus niger[J].Appl Microbiol Biotechnol(2010)86:659-670
[3] Amaro-Reyes A,Garci'a-Almenda'rez BE,Va'zquez-Mandujano DG,et al.Homologue expression of a b-xylosidase from native Aspergillus niger[J].J Ind Microbiol Biotechnol,2011(38):1311-1319.
[4] Punt PJ,VAN Biezen N,Conesa A,et al.Filamentous fungi as cell factories for heterologous protein production.Trends in Biotechnology,2001,20:200-6.
[5] Levasseur A,Asther M,Record E.Overproduction and characterization of xylanase B from Aspergillus niger.Can J Microbiol,2005,51:177-183
[6] 郑瑞娟.黑曲霉木聚糖酶在同源宿主中的分泌性表达及酶学特性研究[D].上海:同济大学硕士学位论文,2006.
[7] Record E,Asther M,Sigoillot C,et al.Overproduction of the Aspergillus niger feruloyl esterase for pulp Bleaching application.Appl Microbiol Bioteehnol.20O3(62):349-355
[8] Levasseur A,Benoit I,Astger M,et al.Homologous expression of the feruloyl esterase B gene from Aspergillus niger and characterization of the recombinant enzyme..Protein Expression and purifieation.2004(37):126-133.
[9] 白爱枝,闫祖威,唐国敏,等.黑曲霉木聚糖酶结构基因和5'调控区基因克隆及其分析[J].华北农学报,2009,24(5):73-76.
[10] Bailey MJ,Biely P,Poutanen KJ.Interlaboratory testing of methods for assay of xylanase[J].J Biotechnol,1992,23:257-270
[11] Mandels M,Weber J.The production of cellulase[J].Adv Chem Ser,1969(95):391-413
[12] Verdoes J C,Punt P J,Stouthamer A H,et al.,The effect of multiple copies of the upstream region on expression of the Aspergillus niger glucoamylase-encoding gene[J].Gene,1994,145(2):179-87.
[13] 白爱枝,鲍秀珍,潘仁瑞.碳源和氮源对黑曲霉产木聚糖酶的影响[J].饲料工业,2006,27(2):17-20.
