工业化发酵生产普鲁兰多糖的提取条件优化
2015-12-25万玉军唐晓芳李镇江王刚杨晓琴郑君黄伟江源钢王宏
万玉军,唐晓芳,李镇江,王刚,,杨晓琴,郑君,黄伟,江源钢,王宏
1(四川省食品发酵工业研究设计院,四川成都,611130)
2(成都金开生物工程有限公司,四川成都,611130)
普鲁兰多糖是一种特殊的微生物胞外多糖,是由出芽短杆霉发酵产生的类似葡聚糖、黄原胶的胞外水溶性黏质多糖[1-3]。因其水溶性好、溶液黏稠稳定、优良的增稠作用[4-5]、无色无味无毒性、安全性好等特点[6],已被广泛用于医药、食品、轻工、化工和石油[7-9]等领域,另外在烟草工业、农业种子保护等领域[10-11]也逐步被应用,是一种很有前景的工业用多糖。但目前尚未实现规模化生产,原因在于普鲁兰多糖菌种产率低、发酵提取工艺有较大的局限性,比如如何除杂(菌体以及无机盐、有机残余物)、脱色(发酵液中色素沉积过多)、去蛋白(保留目的产物,去除杂蛋白)等问题[12-14]。筛选出了1株产率可达68~71 g/L的普鲁兰多糖高产菌株,已经用于5 t发酵罐规模的生产。本实验通过对普鲁兰多糖5 t发酵罐规模发酵后,对普鲁兰多糖提取过程中所遇到的难点进行研究,旨在解决提取问题,为工业化生产提供依据。
1 材料和方法
1.1 实验材料
菌株:出芽短梗霉(Aureobasidium pullulans)A-22菌株,来源于成都金开生物公司实验室。
普鲁兰发酵液。
1.2 实验试剂
NaOH、HCl、乙醇、H2SO4等均为分析纯试剂,成都市科龙试剂化工厂生产。
1.3 实验仪器
压滤机、超滤膜设备、NDJ-8S数字式黏度计,上海舜宇恒平科学仪器有限公司;高速台式离心机,上海安亭科学仪器厂;UV1800PC型紫外可见分光光度计,上海美谱达有限公司。
1.4 实验方法
1.4.1 提取工艺流程
发酵液预处理→除菌体杂质→活性炭脱色→树脂(脱色、去蛋白)→超滤→干燥
1.4.2 发酵液预处理
发酵结束后,发酵液经过80℃高温灭酶,稀释到2%,用于后续实验。
1.4.3 硅藻土的选型、用量
选取两种硅藻土进行过滤,预处理过后的发酵液分成等体积的3份,硅藻土的量选择1%、2%、3%,制成厚度不同的滤饼层,进行板框过滤,过滤后,测定发酵液的澄清度(透过率)和含糖量。
1.4.4 活性炭对普鲁兰多糖脱色效果实验
1.4.4.1 活性炭的用量
取等体积的经除菌后的发酵液6份,在自然pH,温度40℃,脱色时间30 min,搅拌条件下,活性炭的用量分别为 0.3%、0.4%、0.5%、0.6%、0.7%、0.8%(活性炭用量/发酵液体积),经过滤后,在吸光度420 nm条件下测定吸光值,得出普鲁兰多糖的脱色率、损失率。
1.4.4.2 活性炭脱色时间
取等体积的经除菌后的发酵液6份,在活性炭用量为0.5%,自然pH,温度40℃,搅拌条件下,筛选脱色时间为20、30、40、50、60、70 min 时脱色效果,经过滤后,在吸光度420 nm条件下测定吸光值,得出普鲁兰多糖的脱色率、损失率。
1.4.4.3 活性炭脱色温度
取等体积的经除菌后的发酵液6份,在活性炭用量为0.5%,自然pH,脱色时间为40 min,搅拌条件下,筛选温度为 30、40、50、60、70、80 ℃时脱色效果,经过滤后,在吸光度420 nm条件下测定吸光值,得出普鲁兰多糖的脱色率、损失率。
1.4.4.4 活性炭脱色pH
取等体积的经除菌后的发酵液6份,在活性炭添加量为0.5%,温度50℃,脱色时间为40 min,搅拌条件下,筛选 pH 为4.5、5、5.5、6、6.5、7 时脱色效果,经过滤后,在吸光度420 nm条件下测定吸光值,得出普鲁兰多糖的脱色率、损失率。
1.5 吸附树脂选型
活性炭对发酵液脱色后,用树脂进行进一步脱色、去蛋白。在实验过程中,选用了5种树脂进行实验。分别装相同柱高,选用活性炭脱色完的发酵液,每份体积相同,过柱,过完之后,观察颜色,得出多糖的得率、损失率及测定含氮量,选择作用明显的树脂。
1.6 超滤
过完树脂后的发酵液,浓度为1.5%,进行超滤,体积浓缩为4%,再次加入等体积的纯水,超滤。同样的操作进行5次,超滤完后,计算发酵液中的单二寡糖的含量及多糖损失率。
1.7 干燥方式的选择
取等体积超滤完的发酵液4份(配制成5%的浓度),分别采用冷冻干燥、喷雾干燥、滚筒干燥、微波真空干燥4种干燥方式,对其进行干燥。分析干燥成本,干燥完之后看产品的复溶性(取3 g溶于100 mL水,置于搅拌器上,800 r/min搅拌至完全溶解)。
1.8 分析方法
1.8.1 发酵液多糖的测定
普鲁兰多糖含量的测定:样品中普鲁兰多糖的定量分析采用高效液相色谱进行测定。流动相A:水;流动相 B:乙腈,其比例7∶3。取一定体积的样品,经过离心,取一定体积的上清液(普鲁兰多糖含量在0.200~0.300 g),加100 μL普鲁兰酶,定容至50 mL。在58℃下酶解4 h,经0.45 μm膜过滤备用。进样量为10 μL,流速为1.0 mL/min。利用标准曲线求普鲁兰多糖的含量。

1.8.2 发酵液的黏度测定
采用NDJ-8S数字式黏度计测定。
1.8.3 色素的测定
样品中色素测定通过UV1800PC型紫外可见分光光度计在420nm处的吸光值表示。

1.8.4 样品中含氮量测定
凯氏定氮法[16]。
1.8.5 单二寡糖测定[7]
硫酸蒽酮法。单二寡糖去除率:(超滤前单二寡糖含量-超滤后单二寡糖含量)/超滤前单二寡糖含量 ×100)。
1.8.6 普鲁兰多糖的灰分测定[17]
灼烧残渣法。
1.8.7 普鲁兰多糖的含水量测定[18]
直接干燥法。
1.8.8 普鲁兰多糖的黏度测定[7]
2 实验结果和分析
2.1 硅藻土的选型、用量
硅藻土的用量如表1所示,压滤后的发酵液的澄清度(透过率)和多糖得率,确定硅藻土的型号及用量。
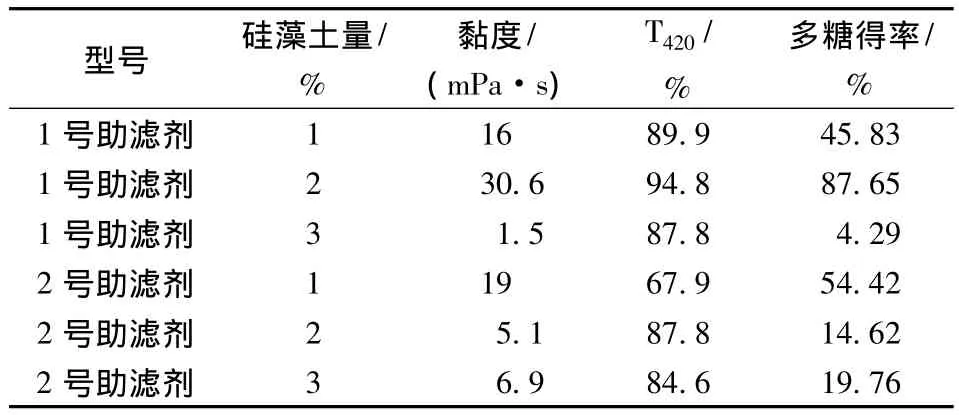
表1 助滤剂添加量对助滤效果的影响Table 1 The effect of diatomaceous earth dosage on filter
从表1可以看出,因为普鲁兰多糖性质特殊,所以滤饼层硅藻土型号和用量的不同直接影响发酵液的澄清度和目的产物的得率,实验结果表明,以1号硅藻土作为助滤剂,用量2%,此时普鲁兰多糖的得率高、澄清度较好。
2.2 活性炭用量、脱色时间、脱色温度、脱色最适pH
2.2.1 活性炭的用量
活性炭是多孔性固体吸附剂,吸附能力较强。如图1所示,随着活性炭的用量不断加大,脱色率逐渐增大,脱色效果较好,用量超过0.5%,脱色效果不稳定。活性炭量的加大,多糖的损失率不断增大,可能是活性炭吸附多糖,造成一定损失。选择用量为0.5%,既能达到良好的脱色效果,节约活性炭用量,同时还可以降低多糖的损失。
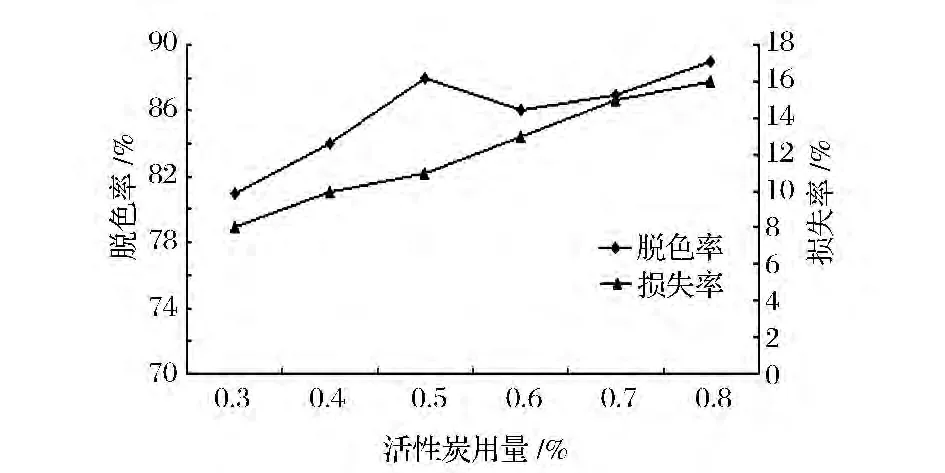
图1 不同用量的活性炭对脱色的影响Fig.1 The influence of different dosage of active carbon decoloring effect
2.2.2 活性炭脱色时间
如图2所示,随着时间的延长,40 min时是脱色效果最好,此时可能已达到活性炭吸附色素的饱和度,60 min以后脱色效果有所下降,可能是时间太长,导致发酵液中小分子糖发生褐变反应,反而有色素产生,影响脱色效果。因此选择最适脱色时间为40 min。
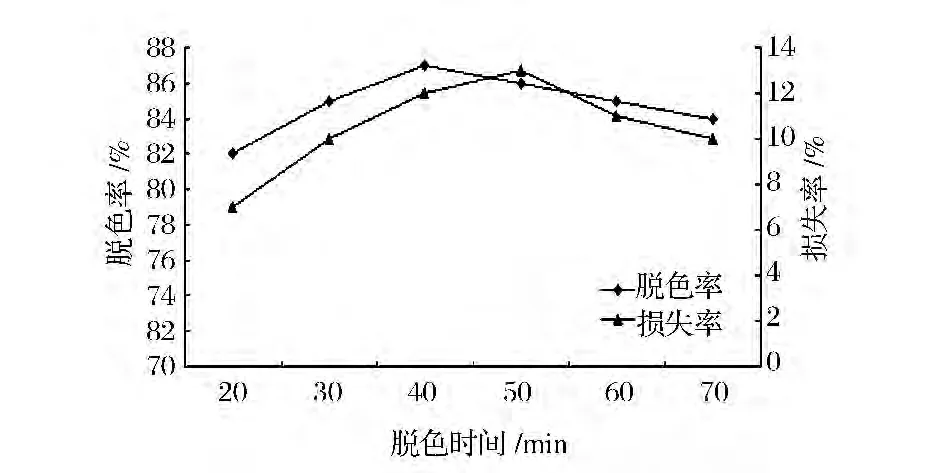
图2 脱色时间对活性炭脱色效果的影响Fig.2 Different time on the decoloring effect of activated carbon
2.2.3 活性炭脱色温度
如图3所示,温度对活性炭脱色影响较明显,在温度较低时,脱色效果不好,活性炭的吸附能力较差,到达吸附饱和的时间长。而在温度高时,脱色效果变差,可能是因为发酵液仅经过除菌预处理,液体中含有较多小分子糖类,蛋白质等其它杂质,高温下易发生反应,产生新的色素。同时,温度过高,活性炭对多糖的吸附能力也增加,损失率增大。因此选择脱色温度为50℃,多糖的脱色效果好,损失率低。
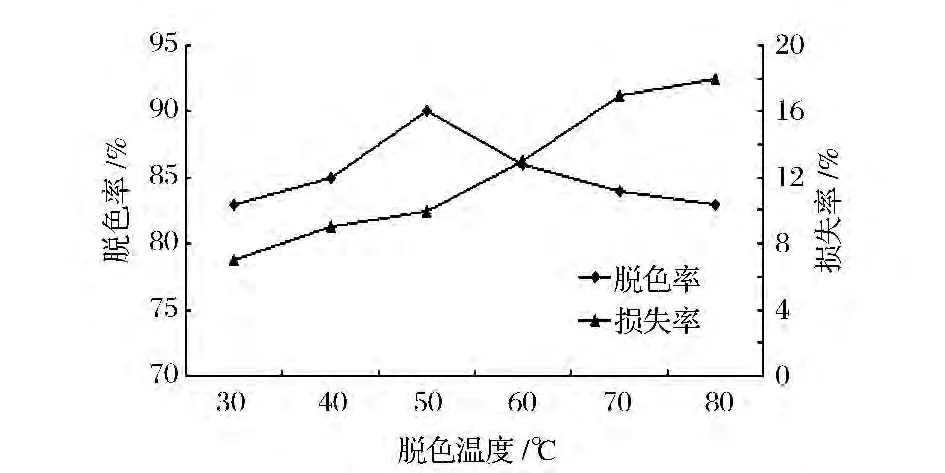
图3 不同的温度对活性炭脱色效果的影响Fig.3 Different temperature on the decoloring effect of activated carbon
2.2.4 活性炭脱色pH
如图4所示,脱色液pH5.5时,活性炭脱色效果最高,pH>6,脱色率降低,pH在5~7之间多糖的损失率较低。因此,提高脱色效果和降低多糖损失率的前提下,选择在pH为5.5作为最适活性炭脱色pH值。
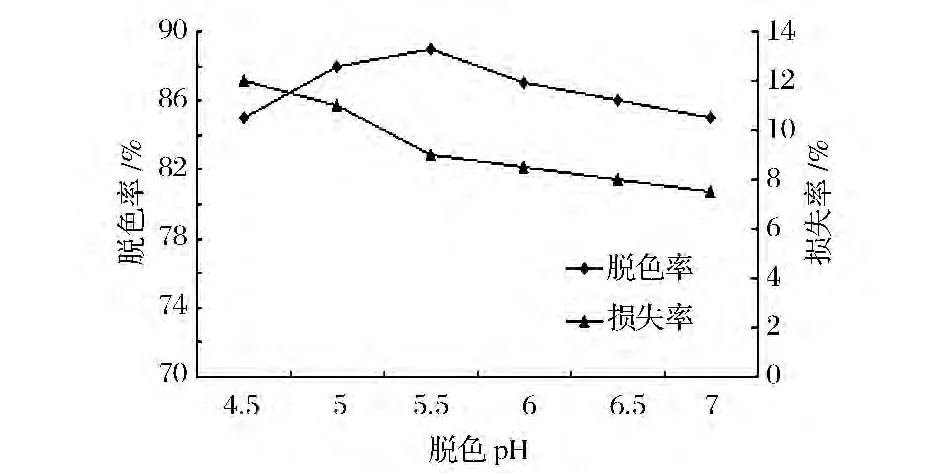
图4 不同pH对活性炭脱色效果的影响Fig.4 Different pH on the decoloring effect of a activated carbon
2.3 吸附树脂选型
从图5中可以看出,编号分别为A-E的5种树脂,对发酵液进一步脱色、去蛋白,树脂A型相对于其他4种,脱色率最高,能达到96%,C、D、E三种树脂脱色效果接近,脱色率94%左右,B型脱色率最低。脱完色后计算多糖的损失率,D型的损失率最低,C型损失率最高。对于去蛋白,A、B两种氮含量较高,C、D、E三种氮含量差距不大。依据能达到良好脱色效果,并且对于多糖的损失降到最低,达到一定去蛋白的效果,通过筛选,D型树脂能达到较佳的效果。
2.4 超滤
试验中提取的多糖分子质量在20万左右,但是经过脱色后的发酵液中,含有大量的单二寡糖等小分子糖类,因此采用超滤手段去除小分子糖类,截留目的产物,提高产品纯度,同时也可以起到浓缩的作用。图6可以看出,超滤第1次,单二寡糖的去除率达到84.8%,继续超滤,单二寡糖的去除率相比较第1次都很低了,此时去除作用已经不明显了,但是随着超滤次数的增大,多糖的损失率逐渐增加。超滤3次,能使单二寡糖的去除率达到96.6%,符合标准,同时降低多糖的损失、节约成本。
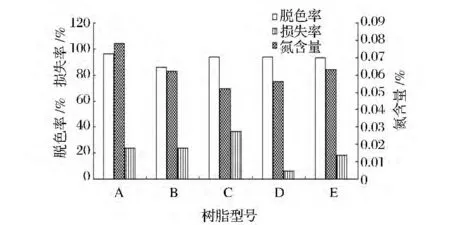
图5 不同类型的树脂对多糖脱色及蛋白去除的影响Fig.5 Different types of resin decolorization of polysaccharide and protein removal
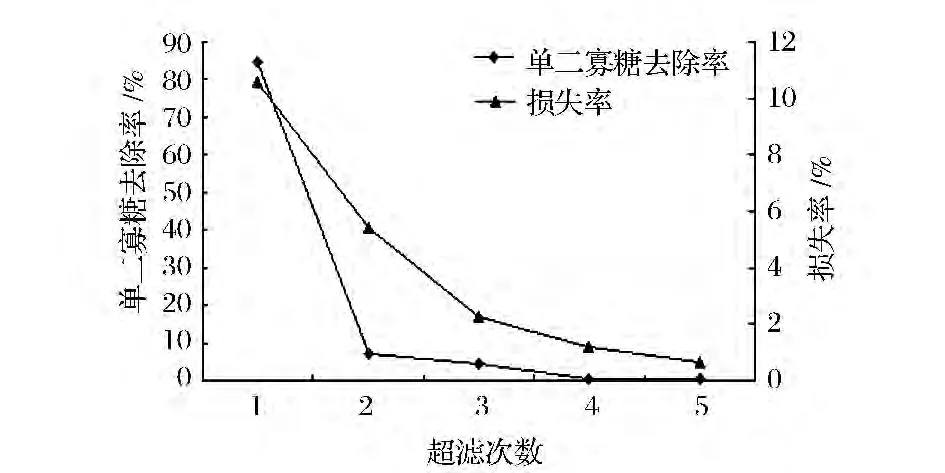
图6 超滤次数对去除单二寡糖效果的影响Fig.6 Number of times of ultrafiltration to remove(Mono-di-and oligosaccharides)effect
2.5 干燥方式的选择
实验所采用的4种干燥方式特点如下:冷冻干燥,要求很高的真空和低温,对设备要求高,干燥时间过长,这些因素无形中增加了生产成本,冷冻干燥后的多糖,复溶性好、溶液透亮;滚筒干燥,干燥时间短、可以连续操作、热效率高,但是干燥完之后得用刮刀将其刮下,干燥后的产品较硬,复溶性较好;喷雾干燥,虽然其生产过程简化,操作控制方便,但是其所需设备体积较庞大、投资大,同时热效率很低、能耗大,干燥后的产品复溶性极差;微波干燥,干燥时,能量效率不高,加热不均匀,局部温度过高,导致产品颜色不正,表面硬化,复溶性较差。综合设备、能耗成本考量,对比4种干燥方式,我们选用滚筒干燥方式,其干燥时间短、热效率高,较其他3种干燥方式干燥效果好、成本低,产品复溶性好。
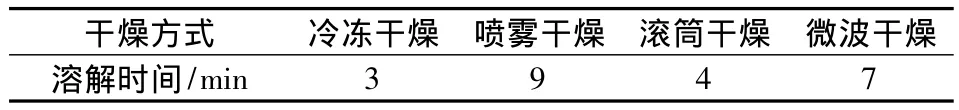
表2 不同干燥方式对复溶性的影响Table 2 The effect of different drying methods on the complex solubility
2.6 提取后成品质量参数
产品:白色粉末状、纯度 93.31%、黏度 160 mm2/s、水分 3.85%、灰分 1.34%、总氮含量0.045%、单二寡糖1.5%、pH 5.7,提取的成品质量符合国标要求。
3 讨论
随着普鲁兰多糖的使用范围不断扩大,提取成本较高、难度较大等现状,本实验对发酵液中普鲁兰多糖的提取条件进行了研究,包括除杂时所需硅藻土的型号、用量,脱色过程中活性炭的用量及最适脱色条件,均采用单因素实验。试验结果表明,选取一号硅藻土作为助滤剂,用量2%,滤液澄清度高、过滤速度快;脱色活性炭的添加量为0.5%、温度50℃、时间40 min、pH 5.5,脱色效果好、普鲁兰多糖得率高;树脂型号D,使得二次脱色效果良好,同时能去除一些杂蛋白;超滤两次,单二寡糖的去除率能达到96.6%在此条件下,发酵液除杂效果理想、澄清度较高、脱色效果好且普鲁兰多糖得率较高、损失率低;我们选用滚筒干燥方式,其干燥时间短、热效率高,干燥成本低,干燥后的成品效果好,能达到质量要求。
由于日本对普鲁兰多糖后提取工艺技术的封锁,对其后提取工艺报道很少,基本上都在实验室规模。本实验是在5 t发酵罐规模发酵后,对发酵液中普鲁兰多糖的提取工艺进行研究。在提取过程中,本实验筛选出一种高性能树脂,对发酵液进行二次脱色,同时还可以使一些胶体,杂蛋白等杂质与普鲁兰多糖分离,有别于目前普鲁兰多糖的提取工艺,具有一定的创新性。采用膜分离技术,既能够去除大量的单二寡糖以及一些小分子糖类,也能够达到一定的浓缩目的,保证了产品的纯度及质量。选用区别于传统喷雾干燥方式的滚筒干燥方法,降低了干燥成本,产品干燥效果好且复溶性更好。普鲁兰多糖的提取方法多采用醇沉法,存在乙醇用量大且重复利用成本高、生产安全性降低、产品带有乙醇的味道等缺点,本实验所研究的提取方法不使用乙醇,既降低提取成本,也使得提取过程更加安全。以上一些提取工艺的改进,为以后工业化生产(50 t发酵罐规模)提供数据参考,奠定了一定的基础。
[1] Bauer R,Physiology of Dematium pullulans de Bary[J].Zentralbl Bacteriol Parasitenkd InfektionskrHyg Abt,1938,98(2):133-167.
[2] Bender H,Lehmann J,Wallenfels K.Pullulan,all extracellular glucan from Pullularia pullulans[J].Biochim BiopHys Acta,1959,36(2):309-316.
[3] Bemier B.The production of polysaccharides by fungi activein the decomposition of wood and forest litter[J].Can J Microbio,1958,4(3):195-204.
[4] Ronen M,Guterman H,Shabtai Y.Monitntrol of pullulan production using vision sensor[J].J Biochem BiopHys Methods,2002,51(3):243-249.
[5] Leathers T D.Biotechnological production and applications of pullulan[J].Appl Microbiol Biotechnol,2003,62:(5-6).
[6] Lazaridou A,Biliaderis C G,Kontogiorgos V.Molecular weight effects on solution theology of pullulan and mechanical properties of its films[J].Carbohy7drate Polymers,2003,52(2):151-166.
[7] GB28402-2012.食品添加剂使用标准[S].
[8] 孙万儒.普鲁兰在食品加工中的应用[J].中国食品添加剂,1997(1):24-29.
[9] 汤兴俊,何国庆.茁霉多糖的微生物发酵及其在食品工业中的应用[J].粮油与食品机械,2002(7):34-36.
[10] 刘清泉.几种极具商业价值的新型微生物多糖的功能及应用[J].中国食品添加剂,2004(6):7-13.
[11] 马海蓉,李艳,高文慧,等.普鲁兰多糖生产菌种及其在农产品保鲜中的应用[J].河北省科学院学报,2000,17(2):124-128.
[12] 孙万儒.从发酵液中提取普鲁兰的技术和工艺[P].中国专利,97121607.2003-04-23.
[13] 邵伟,刘世玲,唐明,等.茁霉多糖发酵及提取工艺条件研究[J].生物技术,2004,14(5):69-70.
[14] 邵德益.微生物胞外多糖的提取[J].化工时刊,1995(8):25-26.
[15] 相茂功,邓长江,朱希强,等.普鲁兰糖无色素发酵工艺研究[J].食品与药品,2007,9(12):11-12.
[16] GB 5009.5-2010.食品安全国家标准[S].
[17] GB 5009.4-2010.食品安全国家标准[S].
[18] GB 5009.3-2010.食品安全国家标准[S].
