虫花 Isaria farinosa 04-1产糖条件优化及其胞外多糖活性研究*
2015-12-25孙洒洒沈照鹏孟蕾江晓路
孙洒洒,沈照鹏,孟蕾,江晓路,3
1(中国海洋大学食品科学与工程学院,山东青岛,266003)2(中国海洋大学医药学院,山东青岛,266003)3(青岛海洋生物医药研究院,山东 青岛,266071)
虫花Isaria farinosa 04-1是虫草的一种,其无性型为粉质拟青霉 Paecilomyces farinosus,所含营养与药用成分与野生虫草的种类相同,含量相当甚至更高[1],是冬虫夏草的潜在替代品。
虫草液态培养能产生虫草素、虫草酸、腺苷和虫草多糖等物质,其中虫草多糖是最重要、最丰富的药理活性成分,有抗氧化、抗肿瘤、抗炎、降血糖、降血脂等功效[2],它在抗氧化方面的作用越来越受到关注[3]。生物活性多糖具有营养和保湿双重功能,作为功效性添加剂应用于化妆品中,符合保湿剂的发展方向和市场需要,有较高的研究价值[4],但虫草多糖在此方面的应用研究较少。已有报道表明虫花菌丝体和发酵液中的抗菌活性物质对细菌有广谱抗性,胞外糖蛋白有一定的抑瘤作用[5],但国内外对虫花液态发酵产糖及胞外多糖(EPS)活性的研究较少。本文探讨了虫花培养过程中菌体生物量、发酵产胞外多糖能力。此外,还考察了EPS的吸湿保湿性、清除羟自由基及螯合铁离子的能力,旨在确定虫花液体培养的最佳条件及EPS的生物活性,探讨其在化妆品、医药、保健品等领域的应用价值,为其开发利用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌种
由中国海洋大学食品科学与工程学院江晓路教授提供,经形态学与ITS序列分析鉴定命名为Isaria farinosa 04-1[6]。
1.1.2 试剂
苯酚、浓 H2SO4、FeSO4、水杨酸、H2O2、VC、EDTA、菲洛嗪等均为分析纯。
1.2 方法
1.2.1 优化试验
1.2.1.1 碳源的确定
选用葡萄糖、蔗糖、麦芽糖为碳源。
1.2.1.2 氮源的筛选
以牛肉膏、蛋白胨、酵母膏、NaNO3、(NH4)2SO4、NH4Cl和NH4NO3为不同氮源进行筛选。
1.2.1.3 最佳初始pH的确定
按基础培养基配方,以确定的适宜碳、氮源,调节培养液的初始 pH 为 4.0、5.0、6.0、7.0和 8.0来确定最佳条件。
1.2.1.4 培养温度的优化
用选出的适宜碳、氮源及 pH,设置 23、25、28、30、32℃探讨温度的影响。
1.2.1.5 正交试验
以菌丝体干重及EPS含量为指标,利用L9(34)正交表确定单因素筛选出的4个因素的水平范围(见表1),根据因素水平表进行试验操作。
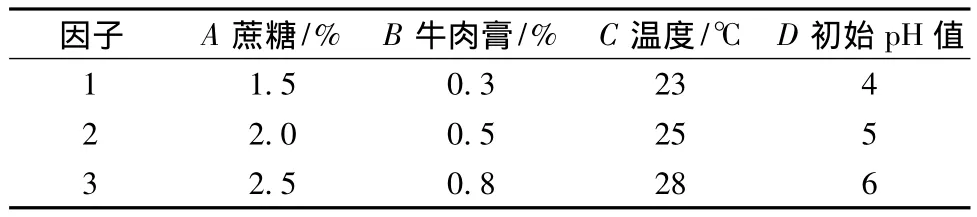
表1 正交试验的因素与水平表Table 1 Experimental factors and their levels for orthogonal design
以上试验均采用5% 的接种量,转速为160 r/min,培养时间为48 h。
1.2.2 虫花生物量及EPS含量测定
虫花生物量:以菌丝体干重来衡量,取发酵液离心(4 800 r/min,10 min),菌丝体沉淀放在干燥洁净的平板中烘干(50℃)至恒重后称重。
EPS含量测定:取发酵液离心(4 800 r/min,10 min)后的上清液,添加5倍乙醇,振荡混匀后,离心(4 800 r/min,10 min)取沉淀,加水复溶后得糖溶液,以葡萄糖为标准品,通过苯酚-硫酸法[7]进行测定。
1.2.3 多糖活性探索
1.2.3.1 多糖的吸湿保湿能力
参照 ZHAO[8]的方法以甘油(Glycerol)和透明质酸(HA)为对照。
1.2.3.2 多糖清除羟自由基的能力
Fenton法[9-10]:VC和蒸馏水分别为阳性和空白对照。EC50是清除率为50% 时的样品浓度,值越大,表明清除活性越弱;反之,越强[11]。
1.2.3.3 多糖螯合铁离子的能力
菲洛嗪法:EDTA和蒸馏水分别为阳性和空白对照[12]。螯合能力以螯合率达50% 时的样品浓度即EC50来衡量。
1.2.4 数据处理
采用SPSS Statistics 19进行数据处理。
2 结果与分析
2.1 优化结果
2.1.1 不同碳源对菌丝体干重和糖含量的影响
如图1a所示,相对葡萄糖和麦芽糖,蔗糖的作用效果较显著,转化合成的多糖较多,达1.368 g/L,菌体生长较好,菌丝体干重达10.790 g/L;而且蔗糖比葡萄糖和麦芽糖稳定,不易被氧化,能提高发酵培养基的稳定性[13],因此选用蔗糖为最佳碳源。
2.1.2 不同氮源对菌丝体干重和糖含量的影响
从图1b可看出,有机氮源比无机氮源作用效果好,菌体生长较好且转化成的EPS较多。因此,虫花液体培养的适宜氮源为牛肉膏、蛋白胨和酵母膏。当使用蛋白胨做氮源时,菌丝体干重比牛肉膏做氮源时略高,但糖含量(2.065 g/L)相对牛肉膏(2.283 g/L)较低,因此,当以获得EPS为目的时,选用牛肉膏为最佳氮源。
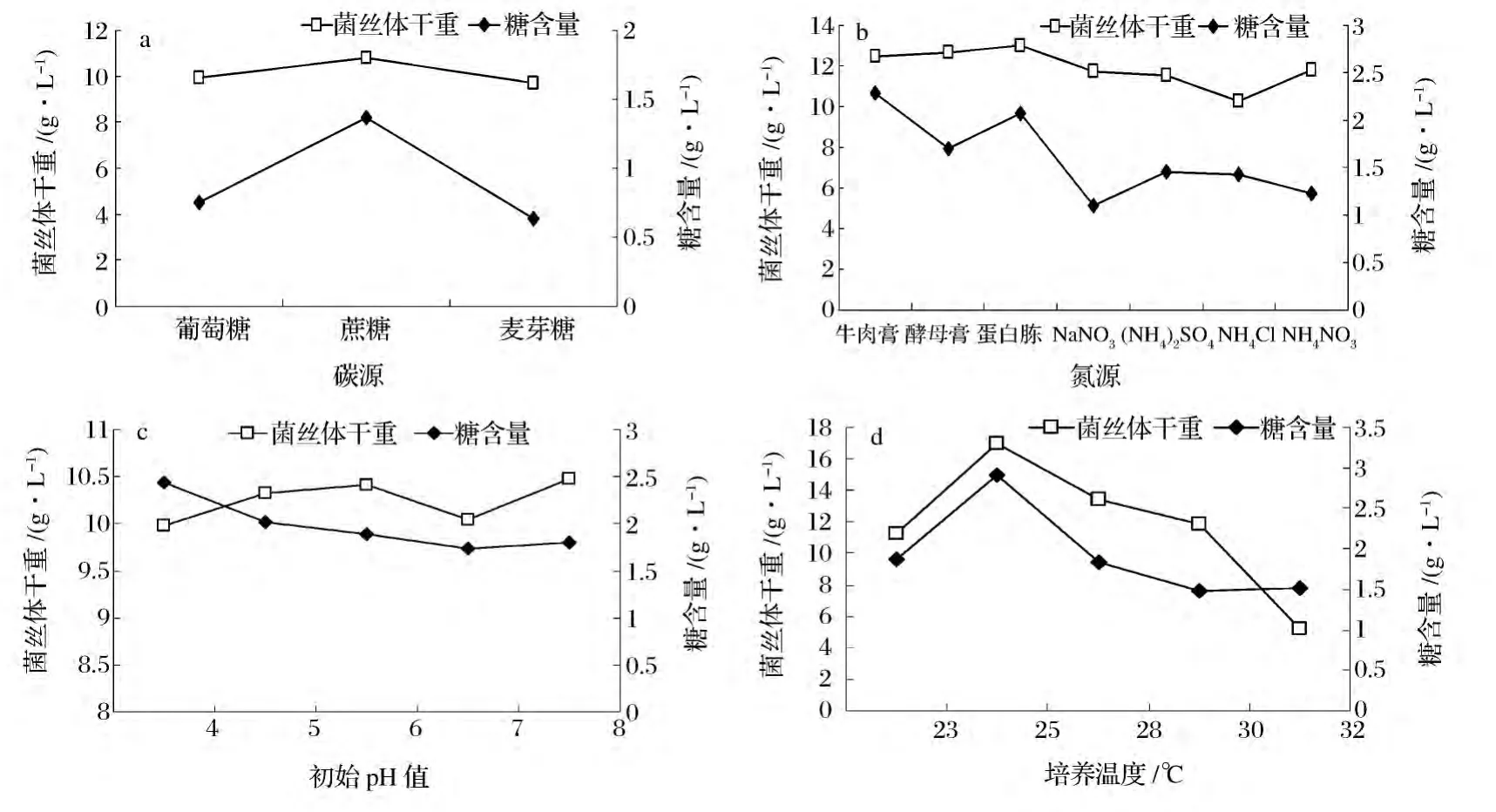
图1 不同条件对菌丝体干重和糖含量的影响Fig.1 The effect of different conditions on dry weight of mycelium and polysaccharide content
2.1.3 不同初始pH对菌丝体干重和糖含量的影响
由图1c可知,不同初始pH对菌丝体干重的影响较小,中性偏酸的环境有利于产糖,随pH值的增加,糖含量呈下降趋势。以糖含量为指标,参考菌丝体量,以pH值为6.0较适宜。
2.1.4 不同培养温度对菌丝体干重和糖含量的影响
培养温度对菌丝体干重和糖含量的影响较明显(如图1d所示)。25℃时的菌丝体干重和糖含量都比其他温度高,可见,25℃比较有利于菌株生长及产糖。此外,当温度超过30℃时,菌株生长迅速变慢,可见,高温对菌丝体生长及代谢产物的积累均有一定的抑制作用,适当控制培养温度可以提高产量并降低能耗[14]。
2.1.5 正交试验分析
2.1.5.1 直观分析
以菌丝体干重(g/L)和 EPS含量(g/L)为指标的均值及极差分析如表2所示。由极差大小可知决定菌丝体干重和 EPS含量的因子主次顺序为:蔗糖>牛肉膏 >初始 pH值 >温度,最佳组合均为A3B3C3D1,即100 mL培养基中含蔗糖2.5 g,牛肉膏0.8 g,初始pH值为4.0,培养温度为28℃。因素间的交互作用使得最佳组合与单因素确定的最优条件略有差异。
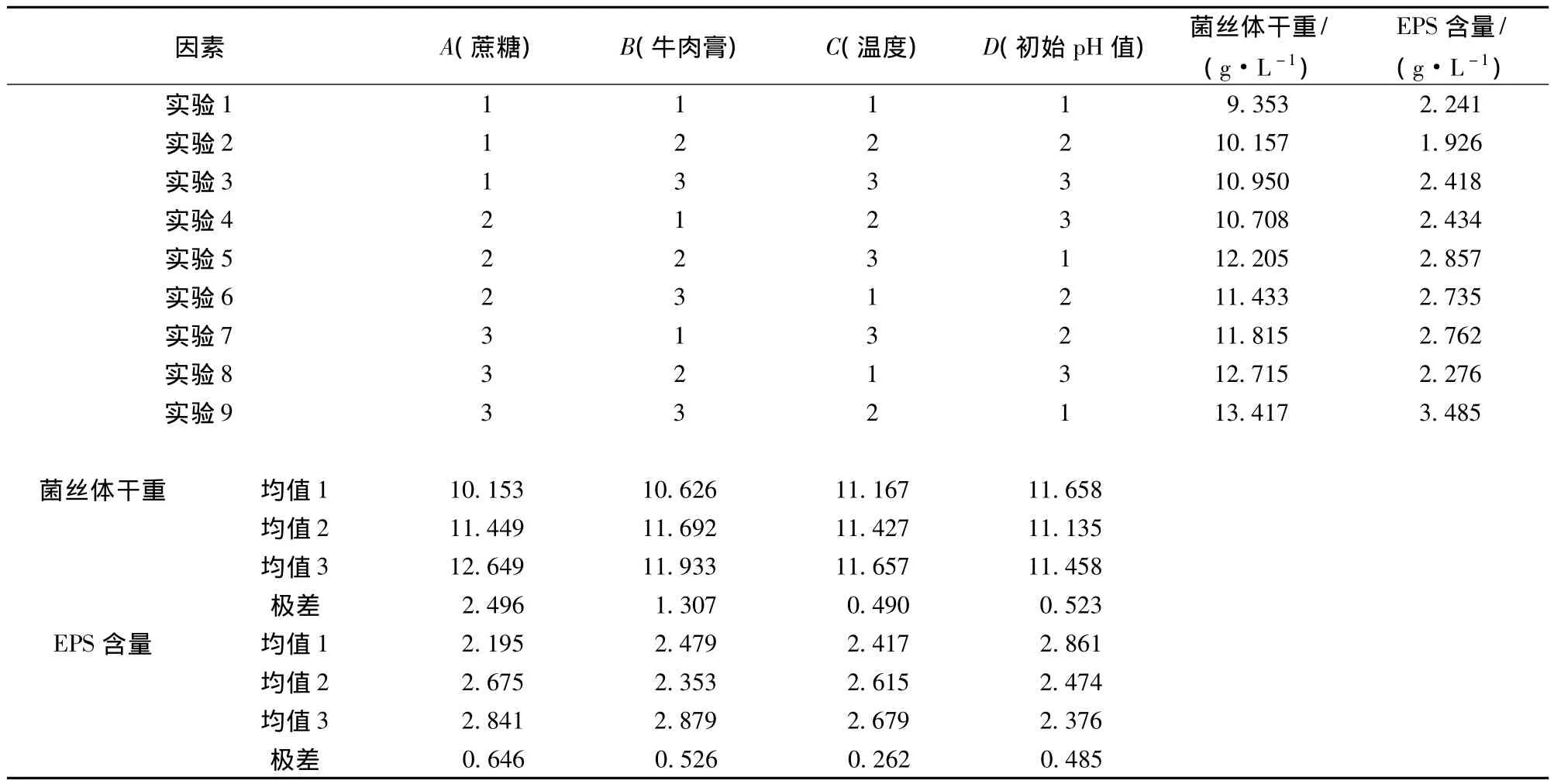
表2 菌丝体干重和EPS含量的正交试验分析Table 2 Application of L9(34)orthogonal design to dry weight of mycelium and EPS production
2.1.5.2 正交试验验证
按正交试验选出的最佳组合配制培养基并在相应条件下培养虫花,优化前后的结果如表 3所示。由表3可知,菌丝体干重和EPS含量分别比优化前提高了13.05%和37.66%。

表3 优化前后菌丝体干重及EPS含量比较Table 3 Dry weight of mycelium and EPS production comparison of optimization
2.2 多糖的吸湿保湿能力
2.2.1 多糖的吸湿能力
在饱和硫酸铵溶液(相对湿度RH=81%)环境下,由图2a所示,前12 h内,EPS比HA的吸湿率高,经缓慢增加后逐渐平衡。120 h后,最大吸湿率分别为:甘油(71.39%)>透明质酸(16.81%)>EPS(10.94%)。由图2b可知,在饱和碳酸钠溶液(RH=43%)环境下的吸湿率与在RH为81% 的环境中有相同的趋势。120 h后,最大吸湿率分别为:甘油(98.11%)>透明质酸(26.13%)>EPS(18.54%)。两种湿度下多糖的吸湿率持久稳定且无明显下降,在同一时段,RH大的环境下多糖吸湿率反而小,说明吸湿率与湿度没有必然关系,这与陈刚等[15]的研究结果一致。
2.2.2 多糖的保湿能力
在干硅胶(RH=0)环境下,由图2c可知,0~24 h内,EPS与甘油的水分残存率相当。120 h后,各样品的最大水分残存率分别为:HA(24.31%)>甘油(12.33%)>EPS(2.02%)。如图2d所示,RH=43%时,0~72 h内,EPS与HA的水分残存率相当。120 h后,各样品的最大水分残存率分别为:甘油(85.70%)>EPS(81.16%)>HA(78.87%)。由此可知,该糖具备较好的吸湿保湿能力,有开发应用的潜力。
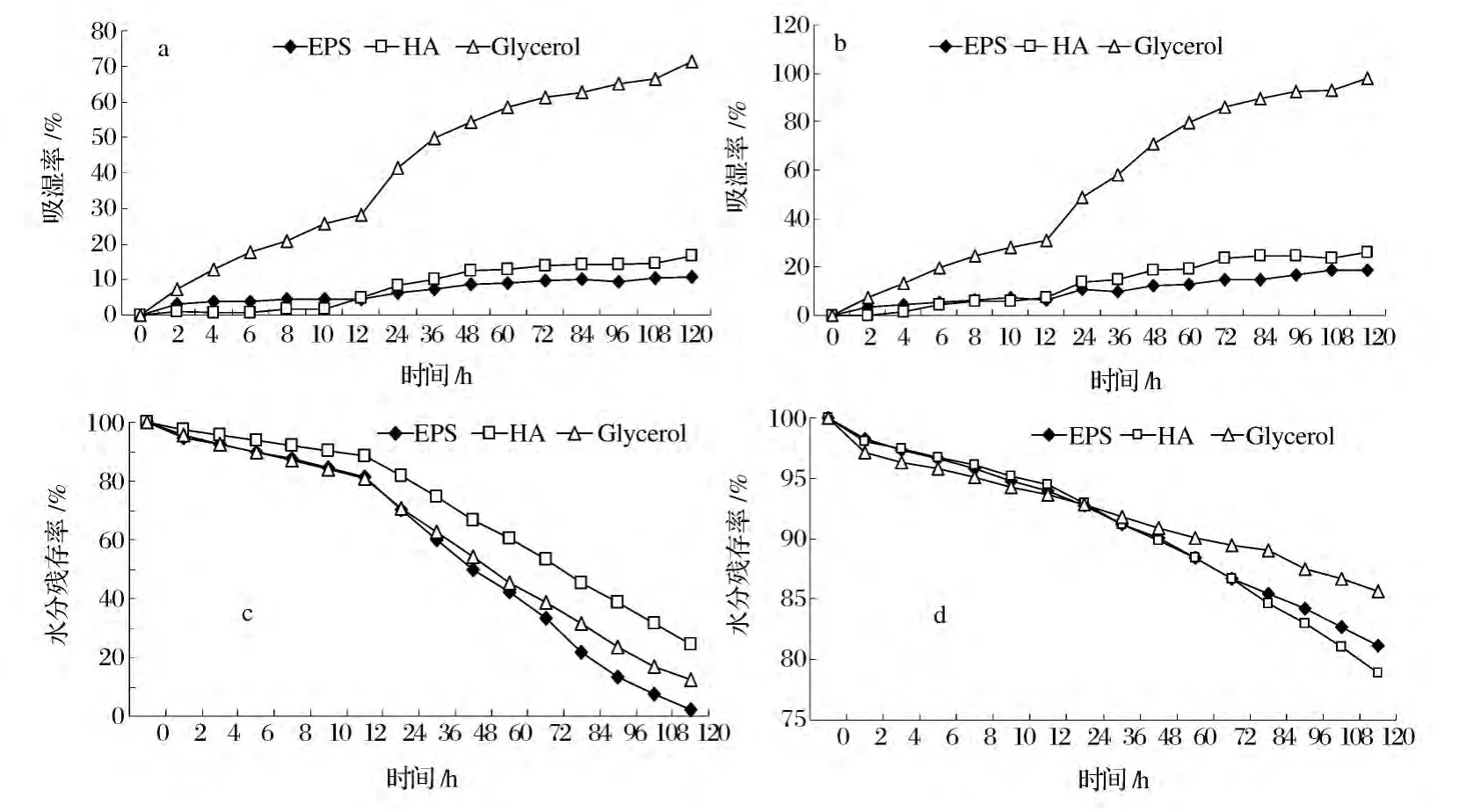
图2 不同RH下样品的吸湿和保湿能力Fig.2 Moisture absorption and retention abilities of samples at different RH
2.3 多糖对羟自由基的清除作用
虫花EPS对羟自由基的清除作用较明显,如图3所示,随糖浓度的增加而增加并呈现一定的量效关系。其EC50为1.285 mg/mL,羟基清除率大于同等浓度下张小强等[16]的研究结果。
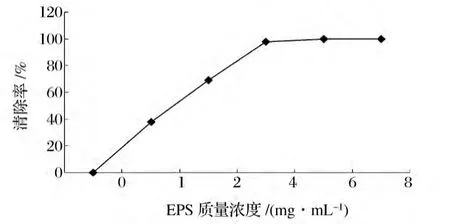
图3 EPS对羟自由基的清除作用Fig.3 Scavenging effect of EPS on hydroxyl radicals
2.4 多糖的螯合作用
在过渡金属中,铁因其高活性而被称为最重要的脂质过氧化促氧化剂,有效的亚铁离子络合剂可以避免脂质过氧化导致的损伤[17]。虫花 EPS因螯合Fe2+干扰了Fe2+-菲洛嗪复合物的形成,螯合能力跟糖浓度呈正相关,EC50值为2.606 mg/mL(见图4)。

图4 EPS对Fe2+的螯合作用Fig.4 Chelating ability of EPS on Fe2+
3 讨论
本文对1株虫花(Isaria farinosa 04-1)的产糖条件进行了优化,在实验中发现,菌丝体量跟EPS含量并不呈现严格正相关,因此在实际生产中应根据具体所需有侧重地调节培养条件,以更大限度地得到目标产物。经正交优化后,虫花菌丝体量比优化前提高了13.05%,高于已有报道[18]的冬虫夏草菌丝体量(10.200 g/L);EPS产量比优化前提高了37.66%,比赵明文等[19]研究的蛹虫草EPS产量(1.830 g/L)高38.13%。这些研究为今后虫花多糖的生产应用提供了技术支持。
从天然物质中提取的具有营养和保湿双重功能的天然保湿剂符合保湿剂的发展趋势,天然多糖正是一类不可多得的天然保湿材料[20]。对虫花多糖的研究表明,其吸湿性优于透明质酸;在饱和碳酸钠环境中,具有与透明质酸相当的保湿能力,可作为透明质酸代用品,用于医药和化妆品领域。此外,天然多糖是一类非常有前途的食药用抗氧化剂[21]。该虫花胞外多糖具有优异的羟自由基清除能力及良好的螯合铁离子能力,能减少脂质过氧化带来的损伤,为其成为新型抗氧化剂并以高档保健品形式满足市场需求提供了可能。
[1] 沈照鹏.虫草主要活性成分分析及指纹图谱研究[D].青岛:中国海洋大学,2012:60-63.
[2] 张杰,孙源.超声提取蛹虫草多糖及其抗氧化活性分析[J].食品科技,2013,38(5):203-206.
[3] YU R M,YIN Y,YANG W,et al.Structural elucidation and biological activity of a novel polysaccharide by alkaline extraction from cultured Cordyceps militaris[J].Carbohydrate Polymers,2009,75(1):166-171.
[4] 高瑞英,张秀宇,慕丹,等.透明质酸等化妆品用生物活性多糖吸湿保湿性能测定[J].广东化工,2009,36(10):230-232.
[5] 蒋毅,姚一建.冬虫夏草无性型研究概况[J].菌物系统,2003,22(1):161-176.
[6] 江晓路,沈照鹏,刘养仲.虫草属真菌指纹图谱的建立方法及其标准指纹图谱[P].中国,201210224877.X,2003-06.
[7] 丁保金,金丽琴,吕建新.苯酚-硫酸光度法测定细脚拟青霉多糖的含量[J].温州医学院学报,2004,34(1):15-16.
[8] ZHAO L,FAN F,WANG P,et al.Culture medium optimization of a new bacterial extracellular polysaccharide with excellent moisture retention activity[J].Appl Microbiol Biotechnol,2013,97(7):2 841-2 850.
[9] 马金宝,沈业寿,李峰,等.亮菌多糖-1b清除自由基作用研究[J].中国食用菌,2008,27(6):38-40.
[10] XIAO J H,XIAO D M,SUN Z H,et al.Antioxidative potential of polysaccharide fractions produced from traditional Chinese medicinal macrofungus Cordyceps jiangxiensis in vitro[J].African Journal of Biotechnology,2011,10(34):6 607-6 615.
[11] 武守华,张晓君,张平,等.四种子囊菌甲醇提取物的抗氧化活性研究[J].菌物学报,2010,29(1):113-118.
[12] 汪建中,李艳如,龚华锐,等.杏鲍菇粗多糖的抗氧化活性研究[J].安徽师范大学学报(自然科学版),2014,37(2):160-163.
[13] 王镜岩,朱圣庚,徐长法.生物化学[M].第三版.北京:高等教育出版社,2002:35-37.
[14] 王永敏,祝文兴,安利国,等.优化条件对蛹虫草菌丝体与胞外多糖得率研究[J].济南大学学报,2010,24(2):148-151.
[15] 陈刚,郭晓蕾,宝丽.银耳、麦冬、燕麦多糖的抗氧化活性及吸湿保湿性能研究[J].中华中医药学刊,2013,31(1):212-214.
[16] 张小强,浦跃朴,尹立红,等.冬虫夏草及人工虫草菌丝体对超氧阴离子自由基和羟自由基清除作用的实验研究[J].中国老年学杂志,2003,23(11):773-775.
[17] Miller N J,Castelluccio C,Tijburg L,et al.The antioxidant properties of the aflavins and their gallate esters-radical scavengers or metal chelators[J].Febs Letters,1996,392(1):40-44.
[18] 周广麒,戴娜.响应面法优化虫草培养的研究[J].中国酿造,2011(1):112-115.
[19] 赵明文,吴燕娜,李玉祥,等.蛹虫草产胞外多糖的液体优化培养条件研究[J].中国食用菌,2000,19(4):30-31.
[20] 田大听,冀小雄,毛海波,等.几种天然多糖的吸湿和保湿性能的初步研究[J].化学与生物工程,2007,24(10):46-48.
[21] 闫景坤,马海乐,吴建勇,等.冬虫夏草胞外多糖的体外抗氧化活性[J].食品与发酵工业,2012,38(6):110-113.
