鱼肉内源酶对发酵鱼糜凝胶特性的影响*
2015-12-25杨方夏文水
杨方,夏文水
(江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡,210042)
利用生物发酵技术加工及保藏鱼糜制品获得了国内外广泛的关注[1-4]。通过生物发酵产酸,大多数病原微生物的生长被抑制,产品保质期延长[3];通过发酵过程中内源酶或微生物产酶对脂肪和蛋白质的水解,产品被赋予了独特的发酵风味并提高了营养价值[5];通过发酵产酸,鱼肉蛋白交联形成具有一定强度的有序的凝胶网络结构,使产品具有弹性和良好的口感[6]。
鱼糜制品的凝胶特性决定了其自身质量以及加工特性[7]。现有文献对加热及冷藏冷冻过程中,内源酶活变化对鱼肉及鱼糜产品的凝胶特性的影响有大量报道[8-10],然而在酸性条件下,酶活变化如何影响鱼糜凝胶特性尚不清楚。随着pH下降,一些内源蛋白酶和交联酶的活性也发生变化,对凝胶特性产生重要影响。对于蛋白酶,大部分文献报道认为其破坏了蛋白的骨架结构,从而对凝胶起到劣化作用[7,11];但也有文献认为在蛋白酶有限的水解下,部分基团被酶切,从而暴露出更多的疏水基团,疏水相互作用被加强,反而提高了凝胶特性[12]。鱼糜内源蛋白酶在发酵过程中的酶活变化对凝胶形成具有积极作用还是消极作用,在何阶段发挥主要作用因而有待研究。对于交联酶,大多数研究集中在谷氨酰胺转氨酶(TG酶)上,普遍认为在低温(4~40℃)放置一段时间,TG酶会催化ε-(γ-Glu)-Lys键生成,从而提高鱼糜凝胶强度[13]。然而现有资料对TG酶的研究主要是在中性范围内[10],发酵过程pH落入酸性范围,在此条件下其如何作用鱼糜凝胶有待研究。
本文选取1株被广泛应用于鱼糜发酵的菌种——植物乳杆菌,以及食品中广泛应用的酸化剂——葡萄糖酸内酯(GDL),通过对发酵体系及酸性模拟体系的研究来解决上述问题。
1 材料与方法
1.1 材料与设备
1.1.1 主要材料
白鲢:2~3 kg/条,鲜活,购于超市。
菌种:植物乳杆菌,由江南大学食品学院提供。
1.1.2 主要试剂
亮抑肽酶、胃酶抑素 A、N-乙基马来酰亚胺(NEM),Sigma公司;葡萄糖酸内酯(GDL),上海绿宙食品添加剂有限公司;青霉素,中诺药业有限公司;链霉素,深圳华药南方制药有限公司;两性霉素B,上海金穗生物科技有限公司;TG酶(120 U/g),泰兴市东圣食品科技有限公司;其余试剂均为分析纯,购于国药集团化学试剂有限公司。
1.1.3 主要仪器和设备
SQ2119DX西贝乐食品料理机,上海帅佳电子科技有限公司;T18高速分散机,上海易丝生物科技有限公司;隔水式培养箱、DK-8AXX型电热恒温水槽,上海一恒科学仪器有限公司;4K-15高速冷冻离心机,德国Sigma公司;Fluoro Max4荧光光谱仪,美国Horiba JY公司;UV-1000分光光度计,上海天美科学仪器有限公司;电泳仪,北京六一仪器厂;电泳槽、ChemiDoc XRS+化学发光凝胶成像系统,美国Bio-Rad公司;pH计,梅特勒-托利多仪器上海有限公司;TA-XT2i质构仪,英国Stable Micro Systems公司。
1.2 实验方法
1.2.1 两个体系的建立
发酵鱼糜体系:(1)蛋白酶测定组:内源酶组配方为100 g鱼糜添加2 g NaCl,2.5 g GDL及抗生素(青霉素8000 I.U.,链霉素20 mg,两性霉素 B 50 mg);空白组在上述配方基础上添加100 μmol亮抑肽酶和1 μmol胃酶抑素A,两组均放在30℃下保温48 h;(2)TG酶测定组:内源酶组配方为100 g鱼糜添加2 g NaCl,3 g葡萄糖,1 mL活化2次的菌种液(含有107~108CFU的发酵菌),放在30℃下保温48 h。菌种活化方法为冷冻保藏菌种在液体MRS培养基中30℃培养24 h。活化菌种4℃冷藏并当天使用。空白组为内源酶组再添加1 mmol NEM。
酸性模拟体系:肌原纤维蛋白中加入质量分数为2%的NaCl,2.5%的GDL后,与内源蛋白酶粗酶液在40 ℃下反应,通过在不同时间(0、10、20、30、45 min,1、2、4 h)对8组样品添加1 mmol/L(最终浓度)亮抑肽酶和10 μmol/L胃酶抑素A终止水解进行,4 h后取出所有样品,4℃冷藏,隔天进行质构及电泳分析。肌原纤维蛋白提取方法参照文献方法[6]。内源蛋白酶粗酶液提取方法参照Sovik[14]法。
1.2.2 pH测定
参照文献方法[15]。
1.2.3 蛋白酶酶活测定方法
参照Sovik[14]法。1个蛋白酶活力单位(U)定义为在30℃下每克粗酶液中的水溶蛋白每小时水解释放1 mg多肽。多肽含量由Lowry[16]法测定。粗酶液中水溶蛋白含量由双缩脲法[17]测定,以牛血清蛋白绘制标准曲线。
1.2.4 TG酶酶活测定方法
发酵鱼糜加入质量浓度为4倍的提取缓冲液(5 mmol/L EDTA,10 mmol/L NaCl,3 mmol/L DTT,20 mmol/L Tris-HCl,pH 7.5)均质后,用冷冻离心机16 000 g离心20 min后取上清液得粗酶液。测定时,2 mL粗酶液加入2 mL反应液(2 mg/mL N,N-二甲基化酪蛋白,30 μmol/L单丹磺酰尸胺,5 mmol/L CaCl2,3 mmol/L DTT,50 mmol/L Tris-HCl,pH 7.5)在37℃下反应10 min后,在激发波长(350 nm)和发射波长(480 nm)下测定荧光值。
1.2.5 凝胶强度测定方法
将样品修整为相同尺寸(12 mm i.d.×20 mm),使用球形探头(P/0.25S)做凝胶破断实验。测前、中、后的速度为10 mm/s,触发力为5 g,形变量为80%,凝胶强度表示为破断力(g)×凹陷深度(mm)。
1.2.6 电泳测定方法
结合 Balage[18]法和 Laemmli[19]法并稍有改进。即,2 g样品加入18 mL质量浓度为50 g/L的十二烷基硫酸钠(SDS)溶液,在100℃下煮1 h后,收集12 000 g离心20 min后的上清液,调整蛋白质量浓度为4 mg/mL后,与上样缓冲液混合(0.125 mol/L Tris-HCl,pH 6.8,4%SDS,20% 甘油,10% β-巯基乙醇,0.005%溴酚蓝)。该混合液煮沸5 min后采用4%浓缩胶,10%分离胶进行电泳实验。电泳电压维持在100 V。染色液为0.125%考马斯亮蓝R250、25%甲醇和10%乙酸,染色3 h;脱色液为40%甲醇和10%乙酸,脱色1~2 h。
1.2.7 蛋白聚集状态对蛋白酶水解蛋白效率的影响的分析方法
建立3组:(1)pH 4.3蛋白聚集前组。含有0.6 mol/L NaCl的肌原纤维蛋白用HCl调至4.3后,立即与内源蛋白酶粗酶液40℃下反应;(2)pH 4.3蛋白聚集后组。含有0.6 mol/L NaCl的肌原纤维蛋白加入质量浓度2.5%的GDL在4℃平衡4 h后与酶液40℃下反应;(3)pH 7.0组。含有0.6 mol/L NaCl的肌原纤维蛋白pH调至7.0后,立即与酶液40℃下反应。比例为10 g蛋白加1 mL酶液。TCA可溶解性肽测定方法参照文献方法[15]。实验(2)组0 min取出的样品测定值已扣除4 h平衡过程中酸水解增加的肽含量值。
1.2.8 非二硫共价键测定方法
由于内源TG酶较少会导致测定系统误差偏大,所以添加质量浓度为0.25%外源TG酶进行测试。用上述方法提取的肌原纤维蛋白溶液分别添加0、0.25%、1%、1.5%、2.5%、3%GDL在30℃下放置24 h后,使pH分别达到6.91、6.13、5.53、4.89、4.51、4.18,测定此时非二硫共价键的生成比例。添加蛋白酶抑制剂和抗生素(浓度见上)抑制蛋白酶和微生物作用。
测定方法参照文献方法[6]稍作修改如下,称量鱼糜凝胶质量,记为w1,离心管质量记为w0。鱼糜凝胶加入质量浓度为5倍的溶液(0.6 mol/L NaCl+8 mol/L尿素+0.5 mol/L β-巯基乙醇)均质后,在4℃下搅拌30 min,混合液14 000 g离心20 min后倒去上清液,真空干燥至恒重(<0.02 g)后,称取沉淀和离心管总质量w2。

1.2.9 数据处理
图表由OriginPro 8.6绘制,数据分析采用SPSS 18.0,显著性差异定义为P<0.05。
2 数据与分析
2.1 发酵阶段内源酶酶活变化
2个发酵体系的pH都从最初的7.0附近下降到4.3附近(表1),分别是由GDL缓慢释酸和乳酸菌产酸造成的[20]。研究内源蛋白酶时,因为植物乳杆菌也具有一定的产蛋白酶能力,所以利用GDL产酸代替乳酸菌产酸;研究内源TG酶时因为乳酸菌不产TG酶,因此采用原态发酵体系,减少系统误差。
由表1可得,发酵期间内源蛋白酶总酶活逐渐增加,且前12 h变化剧烈,与此阶段迅速下降的pH相对应。说明pH的变化对内源总蛋白酶活的影响显著;在发酵阶段,酸性蛋白酶为关键酶类,且活性较高。表1中,空白组的蛋白酶抑制剂对酸性蛋白酶的酶活抑制率达85%以上,验证了水解实验中该抑制剂组可作为水解反应终止剂的可行性。从表1还可以看出,发酵期间内源TG酶酶活力降低,与其是中性蛋白酶有关[7],因而其在酸性条件下容易失活。10 mmol/kg NEM对酶活的抑制率在53% ~70%,与其他文献报道类似[21]。
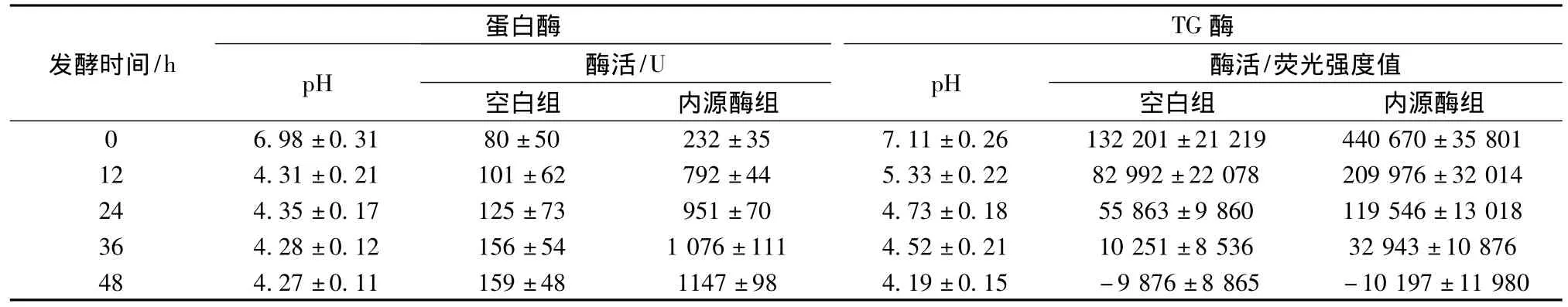
表1 发酵阶段pH及内源酶酶活变化Table 1 The change of pH and endogenous enzymatic activities during fermentation
2.2 不同水解程度对酸诱导凝胶特性的影响
肌原纤维蛋白是鱼肉肌肉蛋白中的重要组成部分,其凝胶特性与鱼糜的凝胶特性密切相关。因而理解内源蛋白酶对肌原纤维蛋白的水解与其凝胶特性的联系具有重要意义。由表2可得,该酸性模拟体系的pH变化与发酵体系的pH变化相差不大,可以用此模型理解发酵体系。
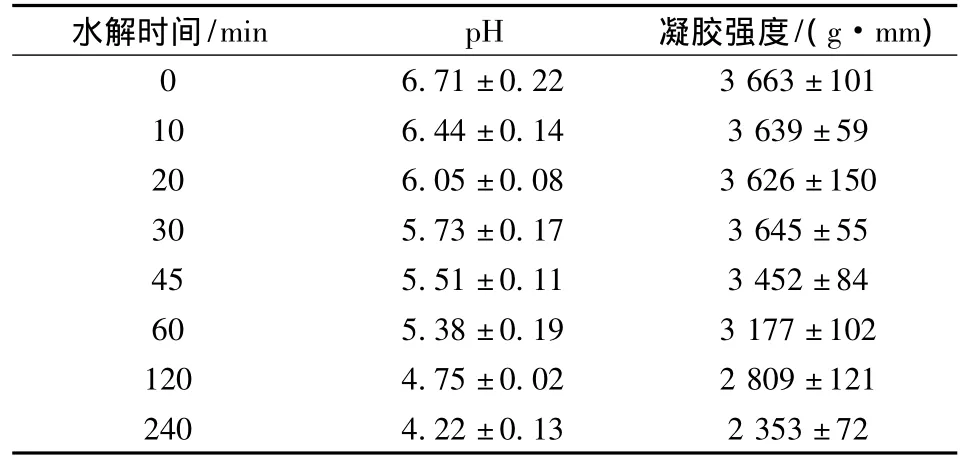
表2 酸性模拟体系pH和凝胶强度的变化Table 2 The change of pH and gel strength in the GDL acidified system
在水解初期(30 min以内),水解时间增加没有使凝胶强度加强,说明适度的内源蛋白酶水解不能增强凝胶强度。虽然酶切作用可能使蛋白暴露更多的疏水基团,但是随着pH下降,逐渐靠近肌原纤维蛋白等电点,蛋白正负电荷中和,斥力起主导作用,加之内源蛋白酶的酶切位置没有形成合适的距离,导致暴露的疏水基团之间没有形成疏水相互作用,从而没能增加凝胶强度。随着酸的释放,水解时间增长,凝胶强度下降。然而,这一改变是由于pH下降对蛋白酶的激活作用,还是肌原纤维蛋白随pH发生构象改变形成对蛋白酶水解有利的构象还不清楚,将在下面实验进行补充说明。
由图1可知,肌球蛋白重链(MHC)的降解是造成凝胶强度下降的主要原因。肌动蛋白(Actin)在酸性体系水解完毕后只有轻微降解。Montero[22]等也认为,MHC的交联与蛋白凝胶强度的增加存在正相关。
2.3 内源蛋白酶影响凝胶强度的机理初步探究

图1 酸性模拟体系水解时间对肌原纤维蛋白的影响Fig.1 Effect of hydrolysis time on myofibrillar protein in the GDL acidified system
上述实验说明了内源蛋白酶对凝胶的劣化作用,然而由于体系pH的下降会同时造成酸性蛋白酶的激活和蛋白质构象的改变,因而无法说明哪种因素为主要因素。图2实验结果解决了这一问题。由图可知,内源蛋白酶对没有进行酸性平衡的组(pH 4.3蛋白聚集前)和进行过酸性平衡后的组(pH 4.3蛋白聚集后)的水解效率没有显著差异,而pH不同组(pH 4.3蛋白聚集前和pH 7.0组)的水解效率却有显著差异。说明pH改变是造成内源蛋白酶影响发酵鱼糜凝胶特性的主要因素,蛋白质构象的改变在这个过程中起到的作用较小。
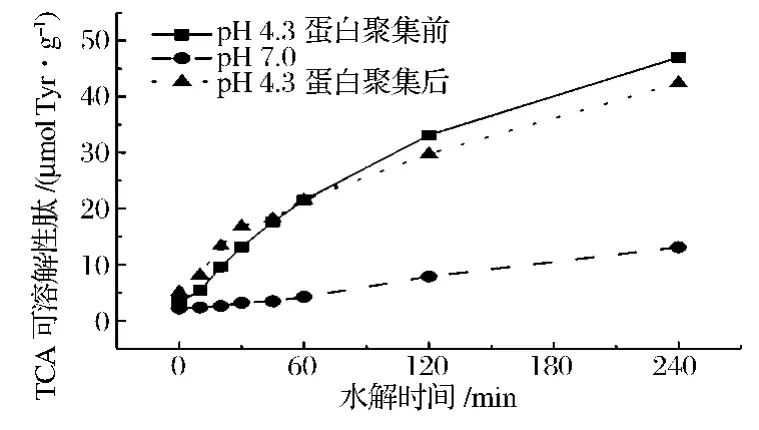
图2 pH和蛋白聚集对内源酶水解的影响Fig.2 Effect of pH and aggregation of protein on hydrolysis efficiency
2.4 酸性条件下TG酶对凝胶特性的影响
比较图3的空白组和内源酶组发现,两者的差异随着发酵时间的进行而减小,说明TG酶对蛋白的交联作用主要集中在发酵前期,在发酵后期交联能力变弱。

图3 TG酶在酸性条件下对凝胶强度的影响Fig.3 Effect of TGase on gel strength in the GDL acidified system
NaCl、尿素及β-巯基乙醇的混合试剂可以破坏离子键、氢键、疏水相互作用以及二硫共价键,但无法破坏非二硫共价键[23]。由图4可知,在中性范围附近(6.1~7.0),TG酶组和空白组差异显著,但在酸性范围内(4.2~5.5),差异变小。这说明在中性范围内,主要是由TG酶生成了ε-(γ-Glu)-Lys键,而在酸性范围内,是由其他因素导致了其他非二硫共价键的生成。

图4 不同酸性条件对非二硫共价键生成的影响Fig.4 Effect of pH on production of non-disulphide covalent bonds
3 结论
发酵鱼糜内源蛋白酶活力在发酵阶段逐渐增加,主要在后期对鱼糜凝胶起劣化作用;pH对内源蛋白酶的激活作用是造成凝胶劣化的主要因素;TG酶活力在发酵阶段逐渐降低,主要在前期增强了鱼糜凝胶强度;pH降低会减弱TG酶作用,但会诱导其他非二硫共价键的生成。本文阐明了发酵鱼糜内源酶酶活变化、对凝胶的作用效果、作用时期及原因,对后续开展如何控制内源酶活,提高发酵鱼糜制品的凝胶特性的工作具有一定指导意义。
[1] Adams M,Cooke R,Twiddy D.Fermentation parameters involved in the production of lactic acid preserved fish-glucose substrates[J].International Journal of Food Science &Technology,1987,22(2):105-114.
[2] Riebroy S,Benjakul S,Visessanguan W.Properties and acceptability of Som-fug,a Thai fermented fish mince,inoculated with lactic acid bacteria starters[J].LWT-Food Science and Technology,2008,41(4):569-580.
[3] YIN L J,PAN C L,JIANG S T.Effect of lactic acid bacterial fermentation on the characteristics of minced mackerel[J].Journal of Food Science,2002,67(2):786-792.
[4] HU Y,XIA W,GE C.Effect of mixed starter cultures fermentation on the characteristics of silver carp sausages[J].World Journal of Microbiology and Biotechnology,2007,23(7):1 021-1 031.
[5] ZENG X,XUA W,JIANG Q,et al.Chemical and microbial properties of Chinese traditional low-Salt fermented whole fish product Suan yu[J].Food Control,2013,30(2):590-595.
[6] 许艳顺.发酵鲢鱼鱼糜凝胶形成及其机理研究[D].无锡:江南大学,2010.
[7] AN H,Peters M Y,Seymour T A.Roles of endogenous enzymes in surimi gelation[J].Trends in Food Science &Technology,1996,7(10):321-327.
[8] Visessanguan W,AN H.Effects of proteolysis and mechanism of gel weakening in heat-induced gelation of fish myosin[J].Journal of Agricultural and Food Chemistry,2000,48(4):1 024-1 032.
[9] Hultmann L,Rustad T.Iced storage of Atlantic salmon(Salmo salar)-effects on endogenous enzymes and their impact on muscle proteins and texture[J].Food Chemistry,2004,87(1):31-41.
[10] Benjakul S,Chantarasuwan C,Visessanguan W.Effect of medium temperature setting on gelling characteristics of surimi from some tropical fish[J].Food Chemistry,2003,82(4):567-574.
[11] 刘海梅,熊善柏,谢笔钧,等.鲢鱼糜凝胶形成过程中化学作用力及蛋白质构象的变化[J].中国水产科学,2008,15(3):469-475.
[12] Creusot N,Gruppen H.Enzyme-induced aggregation and gelation of proteins[J].Biotechnology Advances,2007,25(6):597-601.
[13] 孔保华,南庆贤.鱼糜内源酶及凝胶机理的研究现状[J].中国畜产与食品,2005,7(5):233-235.
[14] Sovik S L,Rustad T.Proteolytc activity in byproducts from cod species caught at three different fishing grounds[J].Journal of Agricultural and Food Chemistry,2004,53(2):452-458.
[15] 戴梦婕,许艳顺,姜启兴,等.戊糖片球菌产蛋白酶对发酵鲢鱼鱼糜凝胶性能的影响[J].食品与发酵工业,2014,40(6):17-21.
[16] Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the Folin phenol reagent[J].Journal of Biochemical Chemistry,1951,193(1):265-275.
[17] Gornall A G,Bardawill C J,David M M.Determination of serum proteins by means of the biuret reaction[J].Journal of Biological Chemistry,1949,177(2):751-766.
[18] Balange A,Benjakul S.Enhancement of gel strength of bigeye snapper(Priacanthus tayenus)surimi using oxidised phenolic compounds [J].Food Chemistry,2009,113(1):61-70.
[19] Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5 259):680-685.
[20] YANG F,Rustad T,XU Y,et al.Endogenous proteolytic enzymes–A study of their impact on cod(Gadus morhua)muscle proteins and textural properties in a fermented product[J].Food Chemistry,2015,172:551-558.
[21] Benjakul S,Visessanguan W.Transglutaminase-mediated setting in bigeye snapper surimi[J].Food Research International,2003,36(3):253-266.
[22] Montero P,Gómez-Guillén C.Thermal aggregation of sardine muscle proteins during processing[J].Journal of Agricultural and Food Chemistry,1996,44(11):3 625-3 630.
[23] Pérez-Mateos M,Lourenco H,Montero P,et al.Rheological and biochemical characteristics of high-pressure-and heat-induced gels from blue whiting(Micromesistius poutassou)muscle proteins[J].Journal of Agricultural and Food Chemistry,1997,45(1):44-49.
