新疆部分地区绵羊肺腺瘤病流行病学调查
2015-12-25杨素芳司俊强郑启伟梁田张勋肖媛媛陈新凯杨霞盛金良
杨素芳 ,司俊强 ,郑启伟 ,梁田 ,张勋 ,肖媛媛 ,陈新凯 ,杨霞 ,盛金良
(1石河子大学动物科技学院,石河子832003;2新疆沙湾县兽医站,沙湾县 832100)
绵羊肺腺瘤病 (Ovine pulmonary adenomatosis,OPA)存在于各大洲,多为散发,也有地方性流行和暴发等几种流行方式,世界动物卫生组织(OIE)确定为B类传染病[1],我国农业部规定的三类法定报告的传染病。自1825年该病首次报道于南非后,除新西兰、澳大利亚和冰岛外在许多国家都有该病的报道,呈世界性分布,给全球的养羊业造成巨大经济损失。我国于1951年经甘肃农业大学朱宣人教授等首次发现本病,1957-1982年邓普辉等在新疆和青海报道了此病,描述了新疆地区ll例绵羊肺腺瘤病,之后,在我国内蒙古地也报道了本病[2]。自然状态下,本病主要感染成年绵羊,有少数发生于山羊的报道。
该病是由绵羊肺腺瘤反转录病毒(Jaagsiekte sheep retrovirus,JSRV)引起的一种慢性肿瘤性疾病[3-4]。病羊以呼吸困难、大量支气管黏液性鼻漏、咳嗽、恶病质状态为主要症状。肿瘤发展初期,驱赶病羊时,呼吸困难症状更明显,故称为“驱赶病”或“驱羊病”(Jaagsiekte),肿瘤发展后期才表现临床症状,死亡率达100%[5-8]。JSRV本身为RNA病毒全长7462-7580 bp,感染宿主细胞后合成病毒DNA并整合到宿主细胞基因组DNA中,以DNA形式稳定存在。在正常绵羊和山羊的基因组内都含有约20拷贝的与内源性绵羊肺腺瘤病毒(exJSRV)密切相关的内源性绵羊肺腺瘤病毒(enJSRV)序列。enJSRV已经被发现能够干扰JSRV复制周期的早期和晚期阶段,对外源性病毒有抑制作用。JSRV感染绵羊后,在自身编码的逆转录酶作用下形成了前病毒及其两端的长末端重复序列(LTR),RNA编码区有gag-pro-pol-env相互重叠的典型基因结构[9]。
我国在OPA领域开展研究工作稍晚,目前国内尚无有效快速检测OPA方法,这不仅制约了该病在我国的流行病学调查,也阻碍了我国种羊业的可持续发展。
目前新疆OPA流行状况尚无相关报道,本研究对新疆6个地区养殖场进行抽样检测,通过临床诊断、PCR及实时荧光定量PCR的方法对新疆部分地区OPA流行情况进行调查[10-12],旨在为选育对此病抵抗力强的绵羊品种和多发地区疾病防制提供依据。
1 材料与方法
1.1 材料
1.1.1 实验样品
2013和2014年新疆6个地区(昌吉、玛纳斯、石河子、尼勒克、乌鲁木齐、阿勒泰)10个种畜场,2534只绵羊,其中病羊11只,采集的肺脏组织保存于福尔马林以及-80℃冷存备用。
1.1.2 主要试剂
DNA Marker购自宝生物工程(大连)有限公司及北京康威世纪生物科技有限公司,PGEM-T载体购自Promega公司,快速琼脂糖凝胶DNA回收试剂盒购自康为世纪生物科技有限公司,TRIZOL购自Invitrogen公司,感受态细胞DH5α实验室自己制备,其他试剂均为分析纯试剂。
1.2 方法
1.2.1 引物设计及探针合成
参照GenBank中登录的外源性绵羊肺腺瘤病美国株(AF105220)env基因序列,应用生物软件primer premier 5.0设计引物,常规PCR检测上下游引物分别为 p1:AGTGGAAGCAAATATGGTGA,p2:GCATCTC CCCTCTCTTTATT,片段长 1004 bp。
实时荧光定量PCR探针是ACAAGCATTTAAGCATTGGCATAGGCA长 27 bp,引物是 Ef:CATACGGGAACGGATCTGG,Er:AAGGTGGCATTGGCATTATT长度是142 bp,引物及探针由生工生物工程(上海)股份有限公司合成。
1.2.2 DNA提取
按照天根基因组DNA提取试剂盒的说明操作。
1.2.3 常规PCR检测
用提取的DNA,以p1/p2为引物进行PCR扩增,检测感染情况。反应体系:DNA模板2μL、p1、p2各1μL、水 9μL和 Taq Mastermix 12μL,共 25 μL反应体系。PCR扩增条件:95℃预变性5 min;94℃变性 30 s,52.3℃退火 30 s,72℃延伸 2 min,进行35个循环,最后72℃反应8 min,降温至4℃停止反应。经琼脂糖凝胶电泳鉴定,将含有目的条带的基因一部分进行琼脂糖凝胶DNA回收。
1.2.4 实时荧光定量PCR检测
将测序正确的外源性阳性克隆重新摇菌后提取质粒,稀释100倍,平行4管,提取的内源性阳性质粒和阴性对照均平行3管,分别用Bio-Rad微量紫外分光光度计测定重组质粒和病料DNA的浓度及A260/A280值。
反应体系体积为20μL,加样过程中,先加入去离子水12μL,再依次加入 10×Buffer 2μL、dNTP Mixture 2μL、上下游引物各0.5μL、rTaq酶 0.5μL,模板 DNA 2μL,探针 0.5μL,将所有成分充分混合均匀,分装各反应管。
实时荧光定量PCR反应条件为:95℃ 10 min,95℃ 10 s 45个循环,60℃ 1 min,60℃收集Fan荧光。
1.2.5 测序和比对
将阳性PCR产物送北京六合华大基因科技股份有限公司和生工生物工程(上海)股份有限公司进行测序。并用50%甘油保存部分菌液备用。将测得的序列与GenBank已登录的enJSRV和exJSRV序列比对。
1.2.6 临床诊断和病理学观察
对畜群生理情况和生活环境进行观察,将患病绵羊解剖观察其内部病变情况,尤其是肺脏是否发生病变,并将病变肺脏组织制成切片在光学显微镜下观察组织切片。
2 结果与分析
2.1 常规PCR检测结果
(1)用特异性引物p1/p2对病料进行 PCR扩增,部分检测结果(图1)可见明显的目的条带,与预期结果一致。
(2)来自新疆6个地区的被检病料总阳性率为78.18%(1981/2534),且血样检测并测序均为enJSRV(表1),这6个地区的感染情况无明显差异,乌鲁木齐和阿勒泰的感染率较低,这与其样品采集数目较少也有一定关系。
(3)11个肺脏组织检测出4例exJSRV阳性病料,患病率36.36%(4/11),这些肺脏组织来自临床症状的患病绵羊,由检测结果(表2)可见,患致病性的外源性OPA的概率不高。
(4)不同品种绵羊的血样中内源性OPA的阳性率最高的是美利奴羊(表3)。

图1 部分病料JSRV扩增结果Fig.1 Results of the amplified portion of disease JSRV

表1 各地区血样检测结果Tab.1 Blood test results in different regions
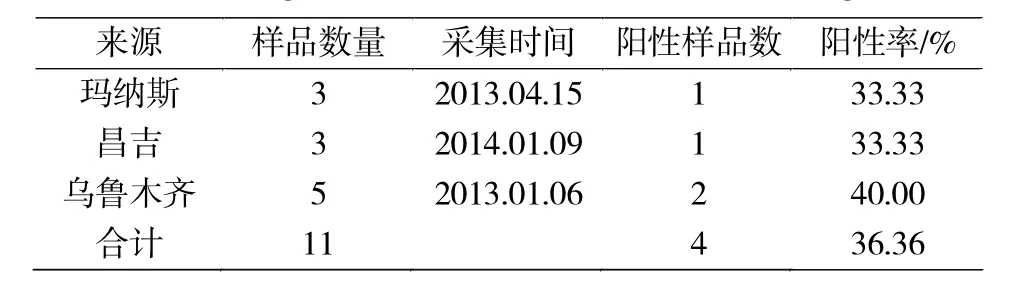
表2 各地区肺脏组织检测结果Tab.2 Lung tissue test results for each region

表3 不同品种绵羊检测结果Tab.3 Test results of different varieties of sheep
2.2 实时荧光定量PCR检测
实时荧光定量PCR检测结果见图2。

图2 实时荧光定量PCR检测结果Fig.2 Real-time quantitative PCR results
图2显示,4个exJSRV质粒荧光值在开始阶段比enJSRV和阴性样品的荧光值高,阴性对照组相较于JSRV,其内源性和外源性均明显不同,其荧光很弱,最后几个循环才有微弱荧光显现。这个检测结果与常规PCR结果相符,从而进一步排除了假阳性的存在。
2.3 测序分析
将回收的PCR产物测序,用BLAST在线比对和MEGA5及DNAMAN进行分析,结果(图3)显示6个地区外源性阳性样品env基因与exJSRV核苷酸同源性最近的是内蒙株(JQ837489)为98.1%,这与enJSRV核苷酸同源性最近的是美国株(EF680300)为86.5%,而无论与外源性还是内源性的同源性均在81%以上,两者无显著的地域性差异,与其他病毒株之间的同源性也较高,这与世界范围的引种也有关(图4)。其中致病性exJSRV的env基因TM区氨基酸序列有致病性“Y××M”序列,与exJSRV一样的区域中无致病性enJSRV为“hKNM”序列(图5)。本研究已向GenBank提交外源性新疆株全基因序列并获得登录号KP691837。

图3 exJSRV的env基因系统进化树分析Fig.3 Percentage identity of Phylogenetic tree for EXenv

图4 enJSRV的env基因系统进化树分析Fig.4 Percentage identity of Phylogenetic tree for Enenv

图5 各病毒株env基因TM区氨基酸序列Fig.5 The TM region of the amino acid sequence of env gene of the virus strains
2.4 临床症状及病理学观察
病羊经典临床症状是抬高后驱或压低头部有大量液体从鼻孔流出(图6A),观察病羊有气喘和呼吸窘迫的前期症状,羊只消瘦、精神萎靡、咳嗽并伴有鼻液流出(图6B)。剖检病羊可见增大增重实变的肺脏,表面有大量灰白色或灰红色的不规则肿瘤结节(图6C)。病变肺脏切面有大量泡沫性液体渗出,可见大小不等的实变区域及软绵的气肿区,切开的气管内也充满了泡沫状的黏液(图6D、E)。切片观察可见肺脏组织有大量形状不规则的腺瘤病灶,已不见正常的肺泡结构(图6F、×100)。肺泡壁增宽,其上皮细胞肿瘤性增生,肺泡发生融合,结构被破坏,存在大量血细胞和增生的纤维组织。肺组织内发现脱落的瘤细胞及其崩解产物,内皮细胞变性(图6G、×400)。
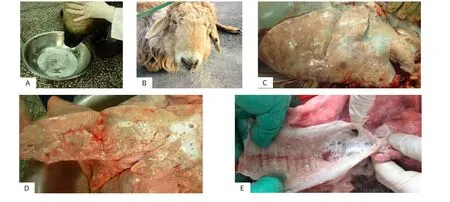
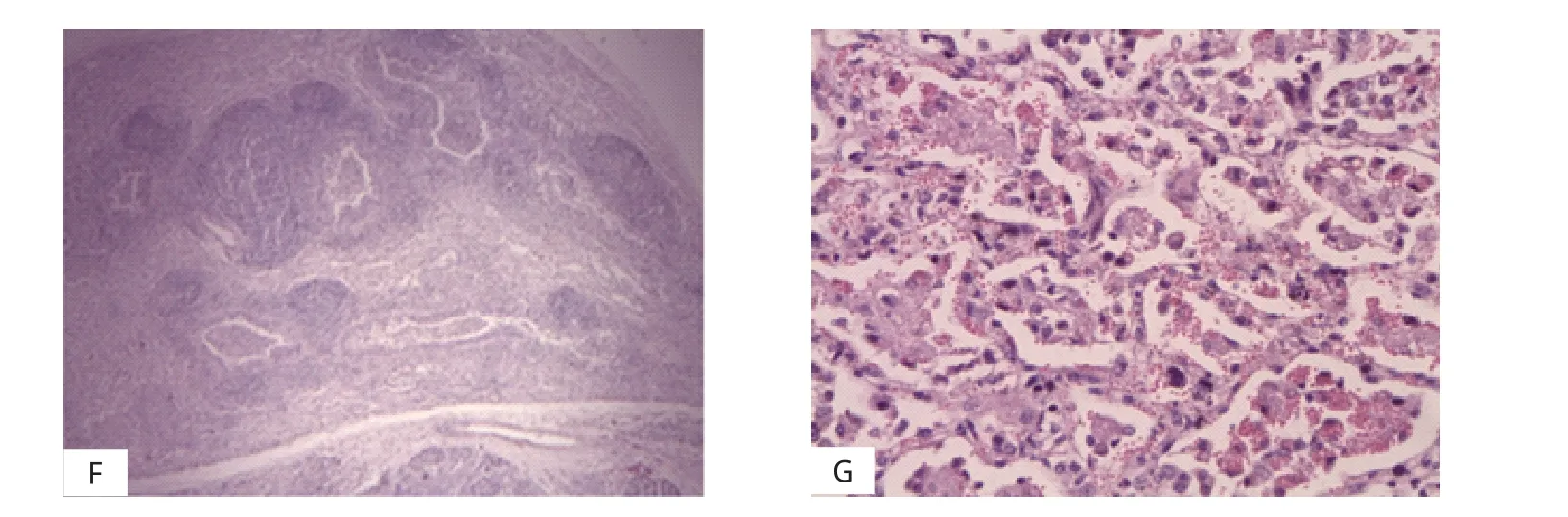
图6 临床症状及病理学观察Fig.6 Clinical anatomy and pathological observation of JSRV-infected sheep
3 讨论
(1)本研究调查了新疆6个地区的OPA总阳性率为78.18%(1981/2534),且血样检测并测序均为enJSRV,而11个肺脏组织检测出4例exJSRV阳性病料,患病率 36.36%(4/11),乌鲁木齐和阿勒泰的感染率较低,这可能与样品采集数目较少也有一定关系。美利奴羊感染率较其他品种的绵羊高,这可能与该绵羊是进口良种细毛羊对OPA抵抗力不强有关。此次实验中血液检测未发现外源性的病毒感染,而这6个地区的致死率并不高。本病的屠宰发现率较低,外源性发病率也较低,而内源性发病较为普遍,可能与此病在新疆流行多年,且对外源性OPA敏感羊减少有关。
(2)OPA是由JSRV引起的一种慢性肿瘤性疾病。在正常绵羊基因组内有约20拷贝的与exJSRV密切相关的enJSRV序列。Palmarini等[13]证实了JSRV中env基因编码的囊膜蛋白诱导成纤维细胞转化,从而使细胞增生癌变,而TM胞质尾中的YXXM基序在转化过程中是必需的,但是enJSRV的env基因中不存在YXXM基序。其可能是通过与受体的竞争作用来阻止exJSRV的复制,使病毒粒子无法释放出细胞进入机体内。所以体内有enJSRV的绵羊不易感染exJSRV,此为导致本研究中外源性的感染率很低的原因。
(3)本研究通过对该对外源性OPA的env基因PCR阳性产物测序并与国际标准株进行比对,结果显示其具有很高的同源性,这与世界范围的引种也有关,也说明了env具有很高的保守性。本研究已向GenBank提交外源性新疆株全基因序列并获得登录号KP691837。
(4)经临床及病理学观察,新疆OPA的病理变化,与青海、甘肃、内蒙古等省(区)所报道的OPA病理变化一致。病羊抬高后驱或压低头部有大量液体从鼻孔流出,病羊呼吸困难、咳嗽,剖检病羊可见增大实变的肺脏,表面有大量灰白色或灰红色的不规则肿瘤结节,切开的气管内也充满了泡沫状的黏液[14-15]。组织切片观察可见肺脏组织有大量形状不规则的腺瘤病灶,无正常的肺泡结构。
目前,未见特异性诊断该病的技术及治疗本病方法的相关报道,其综合防控的好坏直接影响到养殖场的经济效益。因此,了解我国OPA的病原诊断方法与流行现状,利用综合防控措施预防此病,努力建立无病羊群,使我国养羊业持续、健康的发展。对提升我国养羊业水平和经济效益的增加均具有十分重要的现实意义。
[1] 王慧,张亚丽,王远志,等.布鲁氏菌16MΔomp31基因缺失株的构建与鉴定[J].石河子大学学报:自然科学版,2013,31(1):30-34.WANG Hui,ZHANG Yali,WANG Yuanzhi,et al.Construction and identification of omp31-deleted mutant of Brucella standard strain 16M[J].Journal of Shihezi University:Natural Science,2013,31(1):30-34.
[1] 国际兽疫局(OIE).国际动物卫生法典[M].农业部畜牧兽医局.北京:兵器工业出版社,2000:285-289.
[2] 梁化春,邢晋凌,刘淑英,等.绵羊肺腺瘤病实验室诊断报告[J].内蒙古农业大学学报:自然科学版,2008,29(4):119-124.LIANG Hua-chun,XING Jin-ling,LIU Shu-ying,et al.Laboratory on the diagnoses ofovine pulminary adenomatosis[J].Journal of Inner Mongolia Agricultural University:Natural Science,2008,29(4):119-124.
[3]Darrick L Y,Linnerth-Petrik N M,Halbert C L,et al.Jaagsiekte sheep retrovirus and enzootic nasal tumor virus promoters drive gene expression in all airway epithelial cells of mice but only induce tumors in the alveolar region of the lungs[J].Journal of Virology,2011,85(15):7535-7545.
[4] 马学恩.家畜病理学[M].4版.北京:中国农业出版社,2007:385-386.
[5] 王金良,沈志强,刘吉山,等.德克赛尔杂交绵羊肺腺瘤的诊断[J].动物医学进展,2011,32(4):132-134.WANG Jing-liang,SHEN Zhi-qiang,LIU Ji-shen,et al.Diagnosis of ovine pulmonary Adeno-matosis in Dekesaier Cross Sheep[J].Progress in Veterinary Medicine,2011,32(4):132-134.
[6]Zhang K,Kong H,Liu Y,et al.Diagnosis and phylogenetic analysis of ovine pulmonary adenocarcinoma in China[J].Virus Genes,2014,48(1):64-73.
[7]Caporale M,Centorame P,Giovannini A,et al.Infection of lung epithelial cells and induction of pulmonary adenocarcinoma is not the most common outcome of naturally occurring JSRV infection during the commercial lifespan of sheep[J].Virology,2005,338(1):144-153.
[8]Hofacre A,Fan H.Jaagsiekte sheep retrovirus biology and oncogenesis[J].Viruses,2010,2(12):2618-2648.
[9]Palmarini M,Murgia C,Fan H.Spliced and prematurely polyadenylated Jaagsiekte sheep retrovirus-specific RNAs from infected or transfected cells[J].Virology,2002,294(1):180-188.
[10]莫敏,王静梅,李劼,等.16株猪2型圆环病毒全基因组克隆及序列分析[J].石河子大学学报:自然科学版,2012,30(1):37-42.MO Min,WANG Jingmei,LI Jie,et al.Complete genomic cloning and sequence analysis of PCV2 of sixteen strains[J].Journal of Shihezi University:Natural Science,2012,30(1):37-42.
[11]赵伊英,武万峰,汪小东等.精氨酸激酶基因的蛋白表达及实时荧光定量分析[J].石河子大学学报:自然科学版,2013,31(1):6-9.ZHAO Yiying,WU Wanfeng,WANG Xiaodong,et al.Protein expression of arginine kinaseand real-time PCR analysis[J].Journal of Shihezi University:Natural Science,2013,31(1):6-9.
[12]岳远瑞,袁晓航,周路,等.新疆7个绵羊品种MHC区段微卫星遗传多样性的分析[J].石河子大学学报:自然科学版,2014,32(4):438-443.YUE Yuanrui,YUAN Xiaohang,ZHOU Lu,et al.Genetic diversity of microsatellite in MHC region among seven Sheep Breeds in Xinjiang[J].Journal of Shihezi University:Natural Science,2014,32(4):438-443.
[13]Palmarini M,Hallwirth C,York D,et al.Molecular cloning and functional analysis of three type D endogenous retroviruses of sheep reveal a different cell tropism from that of the highly related exogenous jaagsiekte sheep retrovirus[J].Journal of Virology,2000,74(17):8065-8076.
[14]刘淑英.绵羊肺腺瘤病毒NM株基因组全序列的研究[D].呼和浩特:内蒙古农业大学,2004.
[15]Leroux C,Girard N,Cottin V,et al.Jaagsiekte Sheep Retrovirus(JSRV):from virus to lung cancer in sheep[J].Veterinary Research,2007,38(2):211-228.
