脑损伤大鼠周围血肿形态组织学特征及其PPARα的表达
2015-12-25肖智勇
脑损伤大鼠周围血肿形态组织学特征及其PPARα的表达
肖智勇
(井冈山大学临床医学院附属医院,江西吉安343000)
摘要〔〕目的探讨实验性脑损伤模型周围血肿形态组织学特征及其过氧化物酶增殖物激活α受体(PPARα)的表达。方法采用自由落体硬膜外撞击法建立大鼠脑损伤模型,免疫组化法检查周围血肿形态组织学特征,Western印迹检测大鼠脑组织PPARα 蛋白表达,RT-PCR检测PPARα mRNA表达。结果16例肉眼见血肿块体积较小,显微镜下呈大量中性粒细胞或其他炎症细胞浸润,4例肉眼见血肿块体积较大,与周围组织粘连,并呈现条索状和喷射状样,显微镜下见炎症细胞浸润,血管空腔结构。模型组PPARα蛋白、mRNA表达均明显高于假手术组(P<0.05),脑损伤后24 h PPARα蛋白、mRNA表达达到最高峰,明显高于脑损伤后2 h和6 h(P<0.05),并随着时间的延长,脑损伤后48 h较24 h的PPARα蛋白、mRNA表达明显降低,不同时段比较差异具有统计学意义(P<0.05)。结论脑损伤后诱发PPARα表达增高可能与周围血肿氧化应激反应、炎症因子的异常有关,且24 h达到高峰值。
关键词〔〕脑损伤;血肿;过氧化物酶增殖物激活α受体
中图分类号〔〕R743〔
第一作者:肖智勇(1972-),男,硕士,讲师,主要从事神经外科疾病的临床治疗及基础研究。
脑损伤容易导致周围血肿形成、血脑屏障受损和脑部血液供应能力下降,造成脑部缺血再灌注损伤,严重影响神经功能的恢复〔1〕。采用单光子发射计算机化断层显像和正电子发射断层扫描等技术证实了脑损伤致周围血肿形成〔2〕。但是,脑损伤致脑部缺血再灌注损伤的发病机制尚未明确,过氧化物酶增殖物激活α受体(PPARα)主要分布于心、肝、骨骼、动脉粥样硬化性板块、血管内皮细胞和脂肪组织等器官和组织中,具有调节脂肪组织、氨基酸代谢,参与脂质代谢异常、动脉粥样硬化和冠心病等多种疾病发生和发展的过程中〔3〕。相关研究显示,PPARα广泛性分布于脑组织中,其与神经细胞炎症和氧化应激紧密相关,对脑组织缺血缺氧性再灌注损伤具有潜在的保护作用〔4〕。但关于脑损伤致周围血肿的组织形态学特征和脑组织PPARα表达研究甚少,现报道如下。
1材料与方法
1.1动物与分组选取健康成年雄性SD大鼠(体质量200~250 g)32只,由重庆医科大学实验动物中心提供,动物许可证号SCXK 2010-0004。随机分为假手术组和模型组,每组16只。
1.2方法
1.2.1实验性脑损伤模型建立模型组采用自由落体硬膜外撞击法建立大鼠脑损伤模型,采用水合氯醛(400 mg/kg,腹腔注射)麻醉,仰卧固定大鼠,于颈部正中行3 cm切口,同时向右侧延伸2 cm,分离两侧颈总动脉和单侧颈静脉,颈静脉近心端夹闭,行“V”形切口,远心端结扎,插管入右心房,输注抗凝剂肝素,抽取30%血液,夹闭两侧颈总动脉,缺血处理20 min,取下两侧颈总动脉夹,结扎颈静脉,缝合颈部正中切口。脑损伤后2、6、12、48 h时(每个时段取4只)取脑,操作过程中由于动物死亡和模型建立失败导致实验数量不足,再次通过随机抽样方法重新建立脑损伤大鼠模型,以弥补实验动物模型的数量不足现象。假手术组不作脑损伤,仅在颅骨上行一直径约4 mm的骨窗。
1.2.2试剂与仪器Biozol RNA 提取剂(Bioflux,BSC51S1),RNA later(Qiagen,124116951),PPARα(Abcam 公司),ReverTra Ace-α-(TOYOBO,FSK-100,65890M4),ECL 化学发光试剂盒(Pierce,China),BCA 法蛋白定量试剂盒(申能博彩,中国),RT-PCR试剂盒(TaKaRa公司),PCR扩增仪(Gene Amp PCR-2400),高速冷冻离心机(Heraeus Labofuge 400)。
1.2.3周围血肿形态组织学检查制备周围血肿组织学载玻片,脑损伤大鼠缺血处理前收集血肿组织,经血肿剥离后放置于4%多聚甲醛中固定,常规脱水、透明、浸蜡、包埋和切片,获取切片厚度约为4 μm,苏木素-伊红染色,显微镜下观察周围血肿形态组织学特征。
1.2.4PPARα 蛋白表达采用Western印迹检测大鼠脑组织PPARα蛋白表达,提取脑组织蛋白,采用BCA法测定脑组织蛋白,加入缓冲液,加热变性,加膜,常温下封闭1 h,洗膜10 min×3次,加入PPARα抗体,4℃冰冻箱过夜,洗膜10 min×3次,加入标志物抗体,常温下孵育1 h,ECL 化学发光试剂处理,成像系统分析并检测β-actin与PPARα的光密度值。
1.2.5RT-PCR检测PPARα mRNA表达取脑部海马组织50~100 mg,加入1 ml Biozol RNA 提取剂和0.2 ml氯仿,提取总RNA,取其中5 ml检测RNA浓度和纯度。采用RT-PCR试剂盒合成cDNA,采用PCR扩增仪行PCR扩增,其中cDNA逆转录合成反应体系(RT缓冲液4 μl×5、10 mmol/L dNTP 2 μl、10 U/μl RNase 1 μl、10 pmol/μl Oligo 1 μl、模板RNA 1 μg、ReverTra Ace-α1 μl、RNase Free H2O 10 μl),反应条件:30℃ 10 min、42℃ 20 min、 99℃ 5 min、4℃ 5 min。PCR循环参数为 94℃ 4 min,94℃ 15 s,55.2℃ 15 s,72℃ 40 s,35个循环,72℃ 5 min。PPARα引物序列:正义5′-ACGATGCTGTCCTCCTTGATG-3′;反义5′-GCGTCTGACTCGGTCTTCTTG-3′;β-actin引物序列:正义5′-GTGGGGCGCCCCAGGCACCA-3′;反义5′-CTTCCTTAATGTCACGCACGATTTC-3′。PCR产物采用琼脂糖凝胶(经溴乙啶染色)电泳,采用成像系统分析并检测β-actin与PPARα的光密度值。
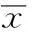
2结果
2.1周围血肿形态组织学特征16只脑损伤周围血肿形成大鼠中,其中肉眼见血肿块体积较小,显微镜下呈大量中性粒细胞或其他炎症细胞浸润,占75%(12/16)。肉眼见血肿块体积较大,与周围组织粘连,并呈现条索状和喷射状样,显微镜下见少量炎症细胞浸润,出血血管丰富,可见血管空腔结构,占25%(4/16)。
2.2两组PPARα蛋白、mRNA表达比较模型组PPARα蛋白(0.81±0.09)、mRNA表达(0.79±0.07)均明显高于假手术组(0.45±0.07,0.46±0.08)(P<0.05)。
2.3实验性脑损伤模型不同时间点PPARα蛋白、mRNA表达比较脑损伤后24 h PPARα蛋白、mRNA表达达到最高峰,明显高于脑损伤后2 h和6 h(P<0.05),脑损伤后24 h随着时间的延长,PPARα蛋白、mRNA表达明显降低,脑损伤后48 h明显低于24 h(P<0.05),见表1。
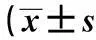

组别蛋白mRNA2h0.56±0.080.58±0.076h0.63±0.070.68±0.0924h0.96±0.071)0.99±0.081)48h0.76±0.080.73±0.07
与其他时间点比较:1)P<0.05
3讨论
随着人口老龄化的加重,高血压性脑出血发生率和致死率逐年上升,该类患者于脑动脉破裂、出血并形成周围血肿〔5〕。据相关研究显示,老年高血压出血性疾病是造成脑损伤的重要原因。入院后应警惕血肿扩大的形成,以降低脑水肿、脑积水等临床不良事件的发生,降低患者病死率〔6〕。脑损伤后血肿体积增大与血压、血肿形态具有明显的相关性。大量研究证实,脑损伤后血肿扩大与收缩压具有紧密相关性,而与舒张压无关,对于收缩压大于20 mmHg时应及时采用控制血压治疗〔7〕。但是,关于脑损伤后血肿体积与周围血肿组织形态学特征的关系研究较少。另一方面,PPARα在提示脑损伤合适治疗时间窗和改善预后中具有重要的价值,周围脑组织PPARα具有调节乙酰辅酶、Cu-Zn SOD,PPARα与神经退行性病变、氧化应激反应、炎症因子表达相关〔8〕。PPARα被激活后具有降低脑内皮一氧化氮合酶(eNOS)和蛋白激酶(PKC)eNOS和PKC在脑损伤后局部脑缺氧缺血病灶中发生异常改变〔9〕。对无PPARα受体脑损伤动物模型的影像学检查监测的研究中发现,PPARα具有重要的神经保护功能,促PPARα兴奋药物具有降低脑缺血缺氧性病灶的形成〔10〕。因此,PPARα对脑损伤后脑缺氧缺血性病变具有重要的神经保护功能,在脑损伤的治疗中具有重要的价值。促PPARα兴奋药物对脑保护作用有赖于PPARα表达程度的高低,因此,观察实验性脑损伤模型周围血肿形态组织学特征及其PPARα表达变化可能对老年高血压脑出血致脑损伤的诊治中具有重要的价值。
本研究结果显示,显微镜下周围血肿呈不同程度的炎症因子浸润,其中肉眼见血肿体积较小的炎症细胞浸润程度越明显,反之,肉眼见血肿体积较大的可见丰富的血管腔,可能导致颅脑血管腔内继续出血和脑损伤预后不良的原因。因此,脑损伤后常合并不同的氧化应激性和炎症因子的异常改变。另外PPARα蛋白、mRNA表达的增加可能与周围血肿致炎症因子形成有关。另一方面,周围血肿形成容易导致脑水肿、脑积水等颅内压的异常增高表现,在一定程度出现神经压迫症状,容易导致神经功能缺失和预后状况欠佳〔11〕。但也有研究表明,促PPARα兴奋药物对脑损伤致缺血再灌注损伤具有重要的保护作用,脑损伤后PPARα表达水平的增加降低了脑缺血再灌注损伤程度,在24 h PPARα表达高峰值中给予促PPARα兴奋药物的效果最佳〔12〕,但有待进一步的实验性研究。
4参考文献
1Lopez NE,Krzyzaniak MJ,Blow C,etal.Ghrelin prevents disruption of the blood-brain barrier after traumatic brain injury〔J〕.J Neurotrauma,2012;29(2):385-93.
2Akamatsu Y,Saito A,Fujimura M,etal.Stachybotrys microspora triprenyl phenol-7,a novel fibrinolytic agent,suppresses superoxide production,matrix metalloproteinase-9 expression,and thereby attenuates ischemia/reperfusion injury in rat brain〔J〕.Neurosci Lett,2011;203(2):110-4.
3庄瑞春,杨俊卿,潘永全,等.PPARβ mRNA 在全脑缺血/再灌注大鼠海马表达变化〔J〕.四川动物,2008;27(6):1120-2.
4Switzer JA,Hess DC,Ergul A,etal.Matrix metalloproteinase-9 in an exploratory trial of intravenous minocycline for acute ischemic stroke〔J〕.Stroke,2011;42(9):2633-5.
5Sasaki N,Sekiguchi M,Kikuchi S,etal.Effects of asialoerythropoietin on pain-related behavior and expression of phosphorylated-p38 map kinase and tumor necrosis factor-alpha induced by application of autologous nucleus pulposus on nerve root in rat〔J〕.Spine,2011;36(2):86-94.
6Copin JC,Bengualid DJ,Da Silva RF,etal.Recombinant tissue plasminogen activator induces blood-brain barrier breakdown by a matrix metalloproteinase-9-independent pathway after transient focal cerebral ischemia in mouse〔J〕.Eur J Neurosci,2011;34(7):1085-92.
7Feiler S,Plesnila N,Thal SC,etal.Contribution of matrix metalloproteinase-9 to cerebral edema and functional outcome following experimental subarachnoid hemorrhage〔J〕.Cerebrovasc Dis,2011;32(3):289-95.
8Higashida T,Kreipke CW,Rafols JA,etal.The role of hypoxia inducible factor-1alpha,aquaporin-4,and matrix metalloproteinase-9 in blood-brain barrier disruption and brain edema after traumatic brain injury〔J〕.J Neurosurg,2011;114(1):92-101.
9Pialat JB,Cho TH,Beuf O,etal. MRI monitoring of focal cerebral ischemia in peroxisome proliferator-activated receptor (PPAR)-deficient mice〔J〕.NMR Biomed,2007;20(3):335-42.
10Gelinas DS,McLaurin J.PPAR-alpha expression inversely correlates with inflammatory cytokines IL-1beta and TNF-alpha in aging rats〔J〕.Neurochem Res,2005;30(11):1369-75.McLaurin J.PPAR-alpha expression inversely correlates with inflammatory cytokines IL-1beta and TNF-alpha in aging rats〔J〕.Neurochem Res,2005;30(11):1369-75.
11Schock SC,Xu J,Duquette PM,etal. Rescue of neurons from ischemic injury by peroxisome proliferator-activated receptor-γ requires a novel essential cofactor LMO4〔J〕.J Neurosci,2008;28(47):12433-44.
12Wallace BK,Jelks KA,O′Donnell ME.Ischemia-induced stimulation of cerebral microvascular endothelial cell Na-K-Clcotransport involves p38 and JNK MAP kinases〔J〕.Am J Physiol Cell Physiol,2012;302(3):505-17.
〔2013-11-01修回〕
(编辑李相军)
