干酪用乳酸菌的特性研究及其在高达干酪模型中风味分析
2015-12-24黄宜刘振民莫蓓红郭本恒吴正钧
黄宜,刘振民,莫蓓红,郭本恒,吴正钧
(1.光明乳业股份有限公司上海乳业生物工程技术研究中心乳业生物技术国家重点实验室,上海 200436;2.上海海洋大学 食品学院,上海 201306)
干酪,又名奶酪,有各式各样的味道、口感和形式。干酪以奶类为原料,含有丰富的蛋白质和脂质,因此具有很高营养价值[1]。随着我国人民生活水平的提高,对像干酪这种高营养健康食品需求量越来越多[2]。据海关信息网统计,我国奶酪进口量从2004 年的7 244.1 t 增加到2013 年的47 330.9 t,年平均增长率为23.2%。
在干酪生产和成熟过程中,微生物菌群促进了产品的质构和风味的形成。这些微生物主要包括发酵剂微生物和非发酵剂微生物[3]。发酵剂微生物包括中温发酵剂中的乳酸乳球菌(Lactococcus lactis)和明串珠菌属(Leuconostoc.spp)等,嗜热型发酵剂中的嗜热链球菌(Streptococcus thermophilus),德氏乳杆菌(Lactobacillus delbrueckii)和瑞士乳杆菌(Lactobacillus helveticus)等[4]。发酵剂微生物的作用是在干酪生产过程中能够快速发酵乳糖,产生高浓度的乳酸,提高凝乳酶的活性,有助于排除乳清和抑制有害菌生长。非发酵剂菌群主要是指乳酸菌(LAB),在切达和荷兰式干酪中最常见的是嗜温乳酸菌,它们对干酪独特风味和眼孔的形成以及增强微生物的生存能力具有重要作用[5-6]。除了添加的发酵剂外,还存在着一些来自生产和加工过程中混入的微生物,对干酪也有一定影响。干酪中微生物的特点是大量的细菌、酵母和霉菌的共存,且许多因素影响它们的生存与生长[7]。
本研究从中国传统乳制品中分离到的嗜温性乳酸菌进行筛选,将不同特性的乳酸乳球菌与产香型明串珠菌进行组合,以达到快速产酸型和产香型发酵剂结合的目的,应用于高达干酪模型中,了解干酪在成熟期的风味变化。为天然干酪的生产、品质评定提供一定的理论依据。
1 实验部分
1.1 材料与仪器
供试菌株,乳业生物技术国家重点实验室光明乳业菌种保藏中心提供;CHOOZIT RM 32 型直投式发酵剂;MARZYME150MG 型凝乳酶;M17agar、M17肉汤培养基、氯化钠、蔗糖均为分析纯;脱脂乳粉,食品级;无抗生素鲜牛奶。
GC 6890 N 气相色谱议;5975 MSD 质谱仪;100 μm的PDMS(2 cm)固相微萃取萃取头;DELTA 320 型pH 计;UV 2300 型紫外分光光度计。
1.2 菌株活化
将实验室保存的41 株乳酸乳球菌和47 株明串珠菌从冻存管中取出,以2%(v/v)的接种量接种于经过121 ℃、15 min 灭菌的M17 肉汤培养基中,30 ℃培养36 h,连续活化三代。
1.3 菌株的初步筛选
1.3.1 模拟干酪成熟环境初筛 将活化好的菌株接种在含有NaCl 浓度4%,pH 值为5.0 的液体M17培养基中,在30 ℃培养24 h,观察菌株生长情况。
1.3.2 菌株不同温度环境生长测试 将活化好的菌株接种在M17 平板中,分别置于15,30,40 ℃恒温培养箱中,培养36 ~72 h,观察平板上面菌落的生长情况[8]。
1.3.3 菌种鉴定 将初筛符合条件的细菌进行培养,提取细菌基因组的DNA,对16 S rDNA 进行聚合酶链式反应(PCR)扩增,对扩增产物进行序列测定与分析。
1.3.4 对产香型明串珠菌的筛选 将活化好的明串珠菌按2%的量接种于装有100 mL 脱脂乳培养基的三角瓶中,培养16 h,进行产香评定。评估小组由6 名专业感官评价人员组成,对每个菌株的发酵脱脂乳香味进行评估,根据各自判断对不同菌株发酵脱脂乳的香味浓度进行打分,以“+”表示浓度的强度,最高为“+ + + + +”。
1.4 菌株的特性测试
1.4.1 菌株的产酸性能 将各菌株按1%(v/v)的量接种于装有脱脂乳液体培养基的三角瓶中,置于30 ℃恒温培养箱培养,每3 h 取出一支三角瓶,以未接种的脱脂乳液体培养基作为对照,测pH 值。以时间为横坐标,绘制各菌株在脱脂乳中pH 值的变化曲线。
1.4.2 菌株在脱脂乳中的凝乳时间和黏度测定将各供试菌株分别以1%(v/v)的量接种于灭菌脱脂乳培养基中,置于30 ℃条件下培养,直至凝乳,并于4 ℃环境下保存24 h,用旋转黏度计分别测定各发酵酸乳的黏度(mPa·s),测定时选择2 号转子,速度设置为64 r/s,每隔15 s 取值1 次,测定3 min。
1.4.3 发酵牛乳特性测试 将各供试菌株分别以1%(v/v)的量接种于灭菌脱脂乳中,置于30 ℃条件下培养,待凝乳后考察其风味、乳清析出状况及凝块质地。
1.4.4 菌株蛋白酶活力测试 福林(Folin)-酚试剂法测定蛋白酶活力:取1 mL pH 7.0、浓度为2%酪蛋白底物缓冲液,加入1 mL 酶液后迅速混匀,并立即放入40 ℃恒温水浴中,准确计时,10 min 后立即加入0.4 mol/L TCA 溶液2 mL,终止反应。离心除去酪蛋白沉淀物。取滤液1 mL,加入2. 5 mL 0.28 mol/L NaOH 溶液,混匀,于25 ℃左右放置10 min。加入0.75 mL 福林酚试剂,立即摇匀,于35 ℃左右反应15 min,在660 nm 下测定其吸光值[9]。
1.5 实验组分组
以菌株的产酸能力为主,产黏能力为辅,对筛选出的乳酸乳球菌菌株进行分组,并分别与明串珠菌进行结合,进而得到不同组合的菌株,组合出不同蛋白水解能力的菌株。
1.6 菌株的共生性能测试
将选出的菌株以1%(v/v)接种量分别接种到121 ℃灭菌15 min 的M17 培养基中,再将各菌株以1∶1∶1∶1 的比例,按1%总的添加量接种到M17 肉汤培养基中,置于30 ℃培养,每2 h 测1 次其在600 nm下的吸光度。以时间为横坐标,OD 值为纵坐标绘制生长。
将各菌株以1∶1∶1∶1 的比例,按1%总的添加量接种到脱脂乳培养基中,记录组合菌株的凝乳时间及其pH 值[10]。
1.7 高达干酪模型的制作工艺流程
制作8 个高达干酪样品:其中1 个为对照样品,对照样品使用高达干酪专用发酵剂CHOOZIT RM 32,另外7 个为实验样品,实验样品中添加的乳酸菌按照2.7 的分组结果进行,每一个干酪模型样品用无抗菌素鲜牛乳(1 000 g)来制作。
鲜牛乳(1 000 g )→过滤杀菌(72 ~75 ℃,15 ~18 min)→冷却(31 ~33 ℃)→添加氯化钙(0.1 g/L)→加入发酵剂→产酸→添加凝乳酶(20 mL/100 L)→凝乳→切割凝块→热烫(39 ~40 ℃)→排乳清→凝块破碎和盐渍(浸渍在浓度为20% 的盐水中)→成型→包装15 ℃后熟(在食品级塑料袋内真空包装)。
1.8 高达干酪模型的挥发性风味物质分析
1.8.1 色谱分析条件 程序升温条件设置:进样后以60 ℃作为初始温度保持5 min,以5 ℃/min 升温至120 ℃,保持5 min,以8 ℃/min 升温至240 ℃,保持10 min,运行总时间为47 min;色谱柱型号选用DB-5,进样口设置为250 ℃,离子源选择EI,四级杆设置为150 ℃,传输线设置为280 ℃,载气为He,选择不分流进样模式,载气流速1 mL/min,电离方式EI(70 eV),质量扫描范围30 ~350 m/z。
1.8.2 固相微萃取SPME 条件[11]使用100 μm的PDMS 固相微萃取头吸附时间为5 min。
1.8. 3 样品处理 取样品5 g,恒温水浴时间60 ℃,吸附时间为30 min。
2 结果与讨论
2.1 菌株的筛选及鉴定结果
菌株的筛选及鉴定结果见表1。
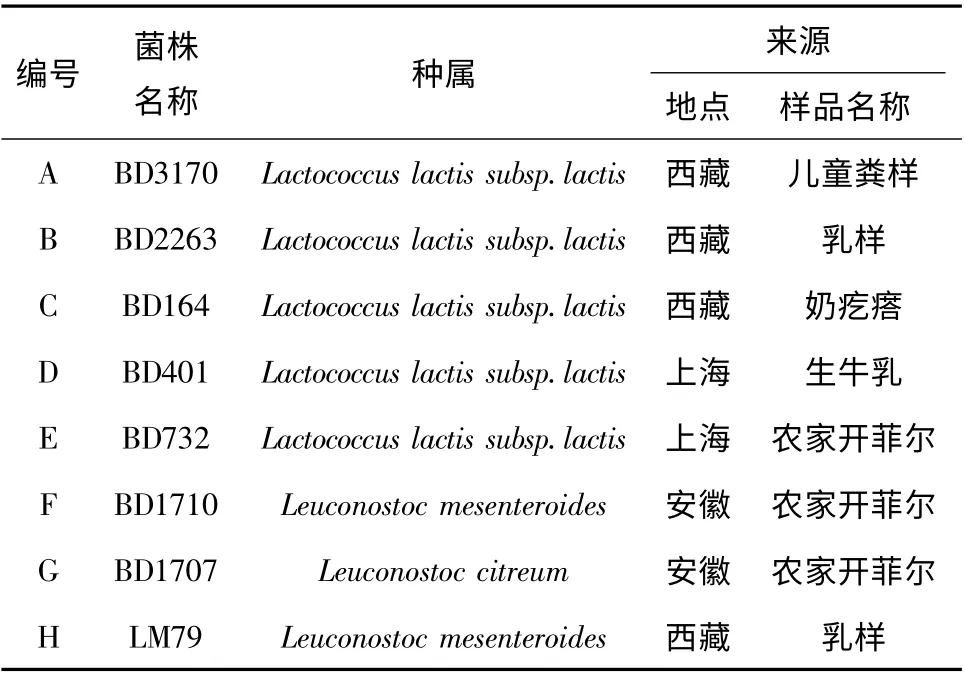
表1 菌株的筛选及鉴定结果Table 1 The result of screening and identification of the strains
2.2 明串珠菌的产香筛选
3 株明串珠菌的产香评定结果见表2。
由表2 可知,肠膜明串珠菌H 香味最佳。因此,选择此菌株H 与乳酸乳球菌进行组合。
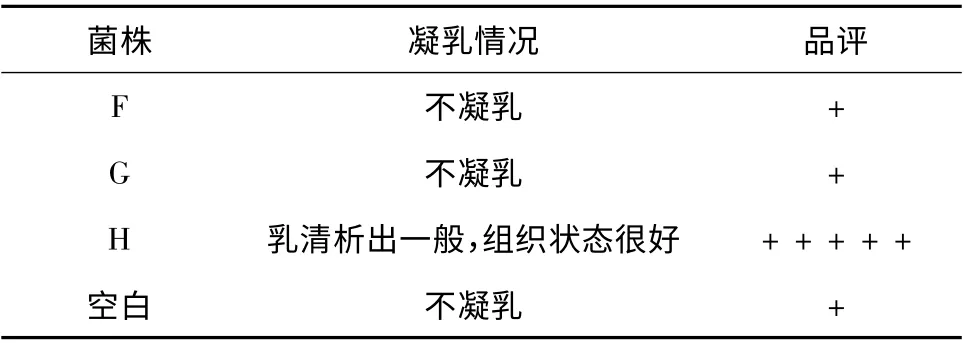
表2 明串珠菌的产香筛选结果Table 2 The result of aroma producing screening of Leuconostoc
2.3 菌株的产酸速率
优良干酪发酵剂菌株的选择,产酸速度是关键。在干酪的加工过程中,发酵剂菌株一个重要的作用是分解乳糖产生乳酸,降低牛乳的pH 值,促进凝乳酶凝乳,并且在干酪的成熟过程中,低pH 环境能够有效抑制致病菌和腐败微生物的生长。
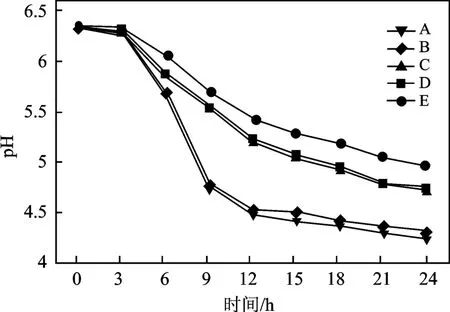
图1 菌株产酸速率Fig.1 Acid producing activity of different strains
由图1 可知,菌株A、B 产酸速度较快。24 h 后pH 最低。菌株的产酸速度影响干酪生产过程中牛乳的预酸化时间,产酸能力强,可以加快牛乳预酸化的速度,酸的形成有利于发挥凝乳酶的作用和增加乳中钙的溶解,以便于凝块形成。
2.4 菌株在脱脂乳中的凝乳时间和产黏性能测定结果
凝乳时间长,对凝乳质地和风味形成有一定的作用,但会使生产时间延长。产酸快的菌株可以缩短凝乳时间,节约生产成本,提高经济效益,但是考虑到实际生产中,如果菌株产酸太快或者凝乳不好,将不利于干酪的生产[12]。

表3 乳酸乳球菌在脱脂乳中的凝乳时间和凝乳黏度Table 3 The curding rate of different Lactococcus lactis strains and viscosity of the curd formed in skim milk
由表3 可知,菌株A、B、C 凝乳相对较快,菌株A、B、D 黏度相对较高。选择产黏能力适中的菌株是制备优质干酪的另一关键因素。
2.5 菌株的发酵性能
表4 为不同乳酸乳球菌的发酵牛乳性能。

表4 菌株的发酵性能Table 4 The fermentation performance of the strains
2.6 蛋白水解能力
由图2 可知,发酵质量浓度100 g/L 的脱脂乳,菌株蛋白水解能力A 和B 比较强。在干酪成熟过程中,发酵剂菌株将蛋白质分解为多肽、胨、氨基酸以及其它无机和有机小分子物质,对干酪风味的形成有着重要作用。
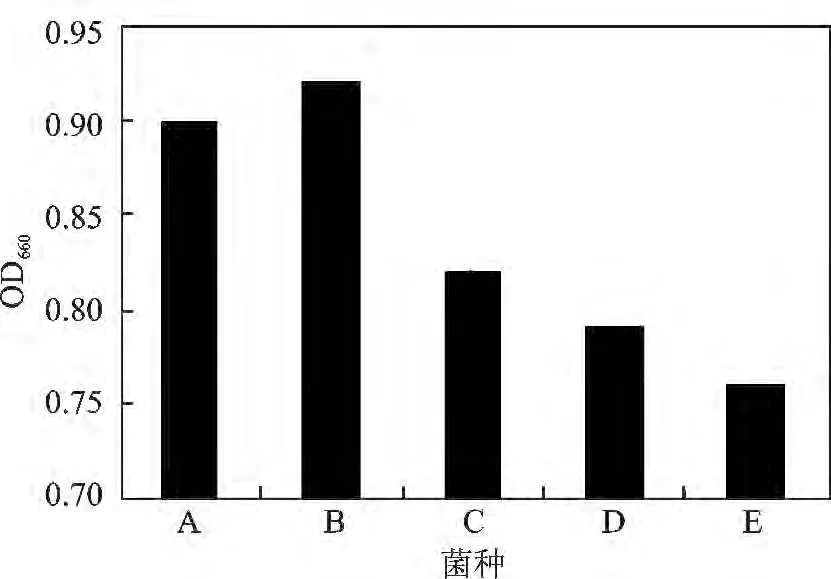
图2 乳酸乳球菌的蛋白水解能力测试结果Fig.2 The results of proteolytic ability of different strains
2.7 组合菌株生长相互作用研究
以菌株的产酸能力为主,产黏能力为辅,进行分组后,与明串珠菌进行结合,组合出了不同蛋白水解能力的菌株,见表5。以高达干酪专用发酵剂CHOOZIT RM 32 制作的干酪作为对照。

表5 对菌株的分组Table 5 The grouping result of strains
2.7.1 菌株单独培养时的生长曲线和共同培养时的生长曲线 见图3、图4。
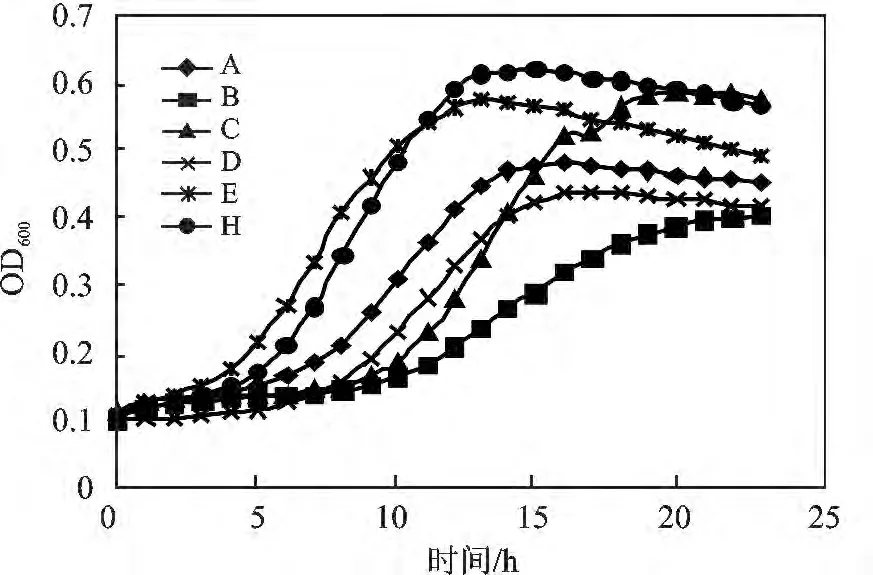
图3 各菌株的生长曲线Fig.3 The growth curve of different strains
由图3 可知,菌株A、B、C、D 在6 h 进入对数生长期,16 h 时进入稳定期,菌株E 和H 在4 h 进入对数生长期,15 h 进入稳定期,之后生长逐渐趋于平缓。
由图4 可知,各菌株组合在培养前期生长速度均较缓慢,在培养16 h 后OD 值达到最高。因此,选取16 h 为各发酵实验的发酵终点。共同培养时菌株生长量显著高于相同条件下A、B、C 的生长量,略低于E、H 的生长量。
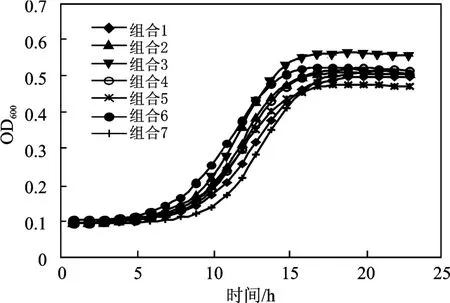
图4 不同乳酸菌组合的生长曲线Fig.4 The growth curve of different experimental groups
2.7.2 组合菌株产酸性能 见表6。
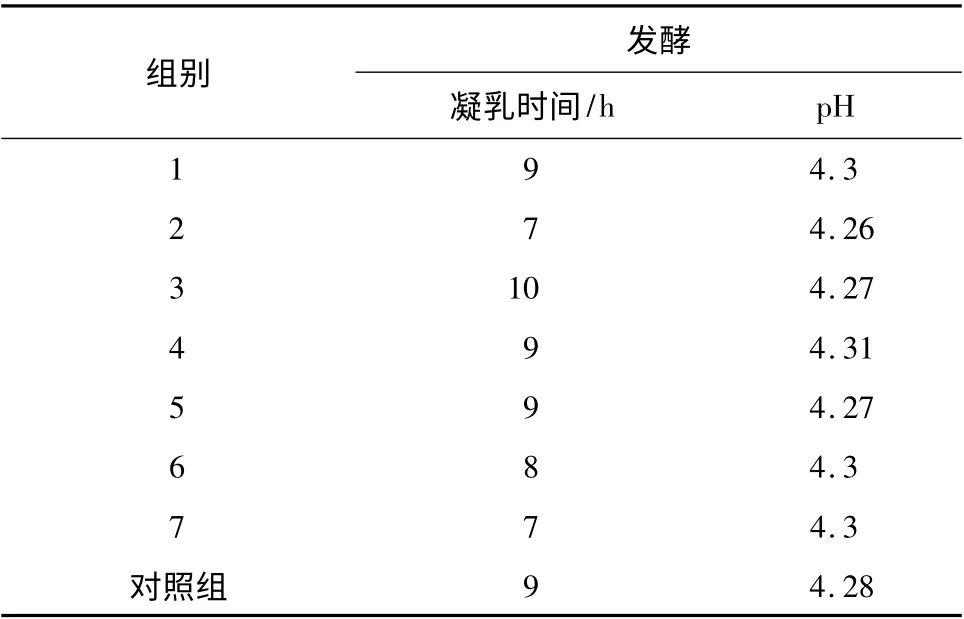
表6 组合菌株产酸性能测定结果Table 6 Acid producing result of different experimental groups
由表6 可知,菌株组合发酵脱脂乳约7 h 时使pH 值降低到4.3,而菌株单独培养时只有菌株A、B经过18 h 培养才能达到4.3 左右。因此,当菌株共同生长时,产酸能力明显强于菌株单独培养时。
2.8 干酪中的挥发性风味物质
干酪成熟6 周后产生的主要风味物质及相对含量见表7。菌株组合2 和组合3 制作的高达干酪可检出的风味物质明显多于对照组和其它实验组[13],检测到的胺类化合物含量比较低。酮、酸和酯类化合物是干酪风味的主要来源,其中对干酪的特征风味组分贡献最大的化合物有7 种(即已烷、2-戊酮、丁酸乙酯、2-丁醇、庚酮、草酰乙酸、丁酸),酮类物质的风味阈值相对较低,且在干酪样品中的含量相对较高,因此对干酪的风味贡献较大。其中,3-羟基-2-丁酮表现为奶香味和脂肪味[14]。
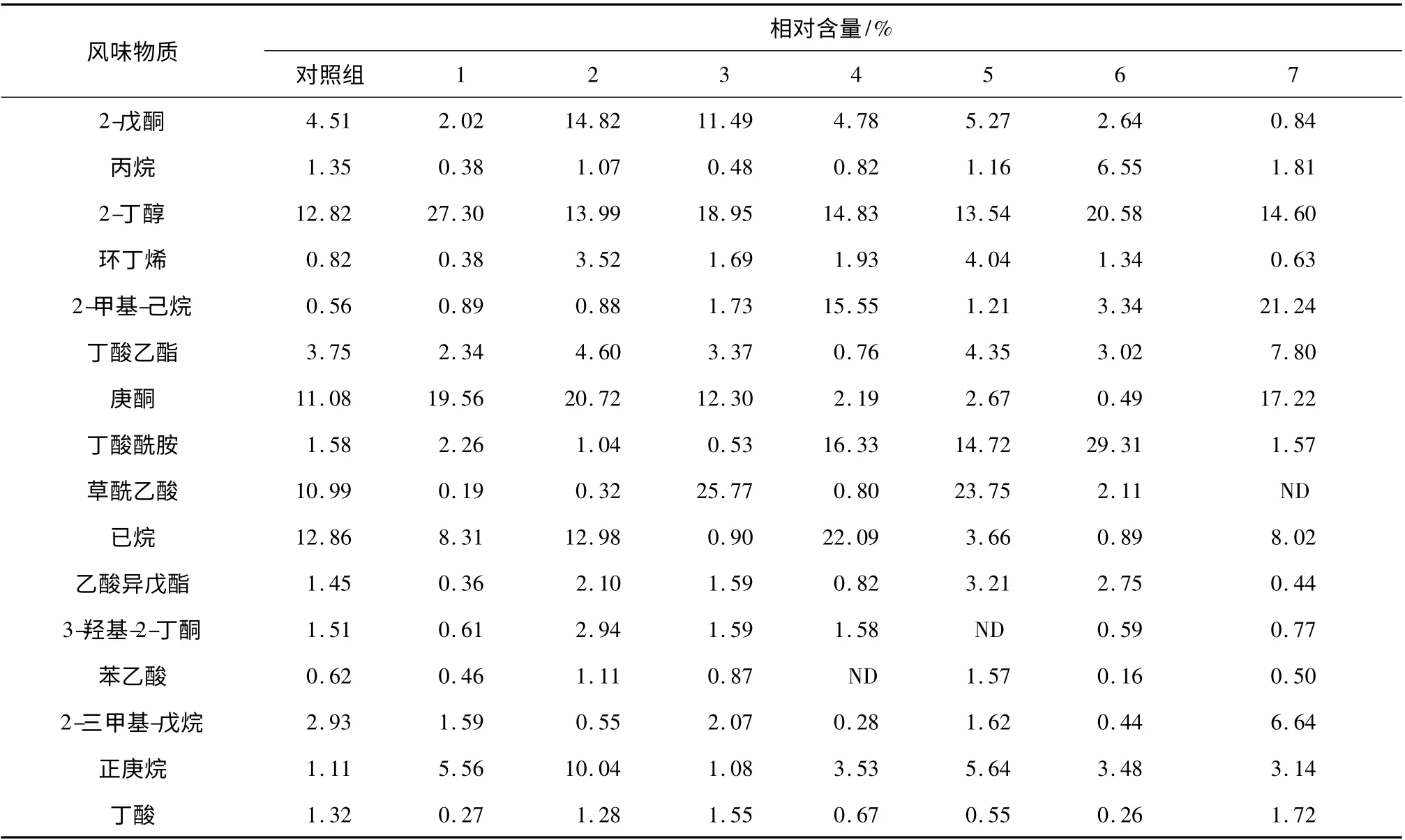
表7 SPME-GC-MS 对不同组别的干酪模型中主要挥发性风味物质的测定结果Table 7 The result of main flavor compositions of different experimental groups cheese model by SPME-GC-MS
3 结论
(1)以菌株的产酸能力为主,产黏能力为辅,组合出7 组产酸能力强,同时蛋白水解能力不同差异的菌株组合,再与产香型的肠膜明串珠菌LM 79 进行,发现将乳酸乳球菌BD 3170、BD 2263、BD 164、BD 401、BD 732 和肠膜明串珠菌LM 79 共同培养时,各组合中菌株之间具有良好的互生作用。
(2)通过SPME-GC-MS 对各不同乳酸菌组合制作的高达干酪模型进行挥发性风味物质的测定,与商业发酵剂制作的对照组干酪相比,发现组合2 和组合3 制作的高达干酪可检出的风味物质中组分平衡结果最好,其中3-羟基-2-丁酮、2-戊酮、庚酮等风味表现良好的风味物质含量较高,风味表现不好的物质如胺类的含量比较低。因此,乳酸菌组合2(BD 3170、BD 2263、BD 164、LM 79 按照1∶1∶1∶1的比例添加)和组合3(BD 2263、BD 164、BD 401、LM 79 按照1∶1∶1∶1 的比例添加)具备开发成高达干酪的发酵剂的潜力。
[1] Fortin M H,Champagne C P,Stgelais D,et al. Effect of time of inoculation,starter addition,oxygen level and salting on the viability of probiotic cultures during Cheddar cheese production[J].Int Dairy J,2011,21(2):75-82.
[2] Karimi R,Sohrabvandi S,Mortazavian A M.Sensory characteristics of probiotic cheese[J]. Compr Rev Food Sci F,2012,11(5):437-452.
[3] Delgado F J,Gonz Lezcrespo J,Cava R,et al.Changes in microbiology,proteolysis,texture and sensory characteristics of raw goat milk cheeses treated by high-pressure at different stages of maturation[J].LWT-Food Science and Technology,2012,48(2):268-275.
[4] Karimi R,Mortazavian A M,Cruz A G.Viability of probiotic microorganisms in cheese during production and storage[J].Dairy Sci & Technol,2011,91(3):283-308.
[5] Kieronczyk A,Skeie S,Langsrud T,et al.Cooperation between Lactococcus lactis and nonstarter lactobacilli in the formation of cheese aroma from amino acids[J]. Appl Environ Microb,2003,69(2):734-739.
[6] Feutry F,Oneca M,Berthier F,et al. Biodiversity and growth dynamics of lactic acid bacteria in artisanal PDO Ossau-Iraty cheeses made from raw ewe’s milk with different starters[J].Food Microbiol,2012,29(1):33-42.
[7] Ayad E H.Starter culture development for improving safety and quality of Domiati cheese[J]. Food Microbiol,2009,26(5):533-541.
[8] Burns P,Cuffia F,Milesi M,et al.Technological and probiotic role of adjunct cultures of non-starter Lactobacilli in soft cheeses[J].Food Microbiol,2012,30(1):45-50.
[9] Settanni L,Moschetti G. Non-starter lactic acid bacteria used to improve cheese quality and provide health benefits[J].Food Microbiol,2010,27(6):691-697.
[10] Speranza B,Sinigaglia M,Corbo M R. Non starter lactic acid bacteria biofilms:A means to control the growth of Listeria monocytogenes in soft cheese[J].Food Control,2009,20(11):1063-1067.
[11] Settanni L,Franciosi E,Cavazza A,et al. Extension of Tosela cheese shelf-life using non-starter lactic acid bacteria[J].Food Microbiol,2011,28(5):883-890.
[12] Alegria A,Delgado S,Roces C,et al. Bacteriocins produced by wild Lactococcus lactis strains isolated from traditional,starter-free cheeses made of raw milk[J].Int J Food Microbiol,2010,143(1/2):61-66.
[13] Dal Bello B,Cocolin L,Zeppa G,et al. Technological characterization of bacteriocin producing Lactococcus lactis strains employed to control Listeria monocytogenes in cottage cheese[J].Int J Food Microbiol,2012,153(1/2):58-65.
[14]Callon C,Saubusse M,Didienne R,et al.Simplification of a complex microbial antilisterial consortium to evaluate the contribution of its flora in uncooked pressed cheese[J].Int J Food Microbiol,2011,145(2/3):379-389.
