利用镁铝双金属氧化物去除S2 - 的研究
2015-12-24王孝华李传强汤琪李榕榕
王孝华,李传强,汤琪,李榕榕
(重庆交通大学 应用化学系,重庆 400074)
炼油、石化、制药、燃料、制革等工业生产过程中都会产生大量的含硫离子(S2-)废水。废水中的硫化物有毒性、腐蚀性,并具臭味,对环境造成极大的污染,因此含硫离子(S2-)废水必须加以妥善的处理[1]。目前常见的含硫离子(S2-)废水的物理化学处理方法主要有氧化法、碱吸收法和沉淀法。
层状双金属氢氧化物(简称为LDHs)又称水滑石,是一类具有层状结构的新型无机功能材料。双金属氧化物(LDO)则是LDHs 在500 ℃左右焙烧得到的焙烧产物。目前,LDHs 及LDO 已广泛应用于催化、离子交换、吸附以及功能助剂等诸多领域[2-8]。近年来在环境污染修复领域的研究也逐渐引起国内外学者的关注,取得了令人瞩目的成果。而将LDO用于去除S2-的研究较少。鉴于此种情况,研究LDO 用于去除S2-的性能就有着重大的实际意义和应用前景。本文研究了LDO 用于去除S2-的性能,考察了S2-去除率与去除时间、反应温度以及S2-的初始浓度的变化关系。
1 实验部分
1.1 试剂与仪器
六水三氯化铝、六水氯化镁、氢氧化钠、无水碳酸钠、盐酸、乙二胺四乙酸二钠、氨水、氯化铵、三乙醇胺、五水硫酸铜、冰乙酸、乙酸钠、硫酸、铬黑T、硫化钠、乙酸铅均为分析纯。
AL204 型电子天平;SHZ-D 循环水式多用真空泵;DHG-9076A 型电热恒温鼓风干燥箱;JJ-1 型定时电动搅拌器;DZ11-2 型恒温水浴锅;SX2-4-10 型实验室电炉。
1.2 实验方法
1.2.1 MgAl-LDO 的制备 按n(Mg)/n(Al)=2∶1的比例称取氯化镁和氯化铝溶于100 mL 去离子水中配成混合盐溶液。称取一定量的氢氧化钠和碳酸钠溶于100 mL 去离子水中配成混合碱溶液。将混合盐溶液装入分液漏斗中,在搅拌的同时将混合盐溶液在常温下2 h 内滴入混合碱溶液中,用HCl 调节pH=9,搅拌,恒温65 ℃晶化12 h,再静置12 h,去掉上层清液洗涤至中性,抽滤,并干燥,得到镁铝双金属氢氧化物(MgAl-Cl-LDHs)滤饼。将所得镁铝双金属氢氧化物放于实验室电炉(马弗炉)中在500 ℃下煅烧后得到MgAl-LDO[9-13]。
1.2.2 LDO 对S2-的去除 利用1.2.1 节制备出的镁铝双金属氧化物(MgAl-LDO)去除S2-,并考察溶液的初始浓度、去除时间以及温度对S2-去除率的影响。
1.3 分析测试
1.3.1 元素分析 准确称取LDO 样品0.3 g 于250 mL 烧杯中,加入少量水润湿,滴加1∶1 HCl 4 ~6 mL,加热使之溶解。冷却后定量地转入250 mL容量瓶中,用水稀释定容,摇匀,备用。
1.3.1.1 镁含量的测定 准确吸取25 mL 上述试样于锥形瓶中,加入20 mL 水,5 mL 三乙醇胺,摇匀。加入10 mL 氨缓冲溶液,摇匀。最后加入少许铬黑T 指示剂,然后用EDTA 标准溶液(0.02 mol/L)滴定至溶液由紫红色变成纯蓝色,即为终点,平行滴定3 次。
试样中Mg 的百分含量按下式计算:

式中 c——EDTA 标准溶液的浓度,mol/L;
1.3.1.2 铝含量的测定 (1)EDTA 标准溶液与硫酸铜标准溶液浓度的比较:先从滴定管中缓慢放10 mL EDTA 标准溶液(0.02 mol/L)于500 mL 烧杯中。用水稀释至200 mL,将溶液加热至60 ~70 ℃加入15 mL 乙酸-乙酸钠缓冲溶液,加热至沸,取下。加5 ~6 滴PAN 指示剂,以硫酸铜标准溶液(0.015 mol/L)滴定至溶液由黄色变成亮紫色即为终点。
(2)吸取40 mL 试样于500 mL 烧杯中,准确加入20 mL EDTA 标准溶液(0.02 mol/L),然后用水稀释至200 mL,将溶液加热至60 ~70 ℃加入15 mL乙酸-乙酸钠缓冲溶液(pH 约为4.3),此时溶液实际pH 值为3.8 ~4。煮沸1 ~2 min,取下。加5 ~6滴PAN 指示剂,以硫酸铜标准溶液(0.015 mol/L)滴定至溶液由黄色变成亮紫色即为终点。
试样中Al 的百分含量按下式计算:
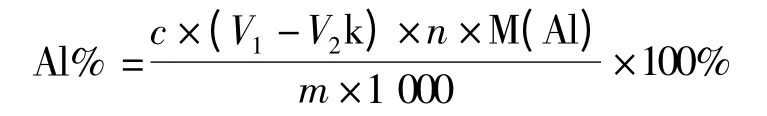
式中 c——EDTA 标准溶液的浓度,mol/L;

1.3.2 S2-去除率的测定 往含S2-的溶液(浓度c0)中加入一定量的镁铝双金属氧化物(MgAl-LDO),去除一段时间后,进行离心分离后取上层清液,加入过量醋酸铅溶液,搅拌,待充分反应后抽滤,在75 ℃干燥箱中干燥1 h,称量干燥后沉淀的质量,进而计算出去除后溶液中S2-的浓度(浓度c),即可得到S2-的去除率。
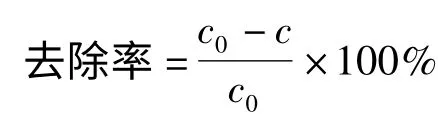
2 结果与讨论
2.1 元素分析
2.1.1 镁含量的分析 利用1.3.1.1 节中的镁元素的分析方法进行分析,称取样品的质量为0.304 4 g,配成250 mL 溶液,取其中的25 mL 进行络合滴定。平行滴定3 次,当溶液由紫红色变成纯蓝色时,所消耗的EDTA(0.02 mol/L)的量见表1。

表1 测定镁所用EDTA 的量Table 1 The amount of EDTA in determining magnesium
2.1.2 铝含量的分析 按照1.3.1.2 节(1)的方法,EDTA 标准溶液与硫酸铜标准溶液浓度的比较结果为:10 mL 的EDTA(0.02 mol/L)需要14.1 mL硫酸铜(0.015 mol/L)溶液进行络合滴定,即k =10/14.1。
按照1.3.1.2 节中分析铝的方法,取上述所配试样40 mL,加入20 mL EDTA(0.02 mol/L)溶液,以硫酸铜标准试液进行滴定至由黄色变为亮紫色,平行滴定3 次,所消耗的硫酸铜标准试液的量见表2。
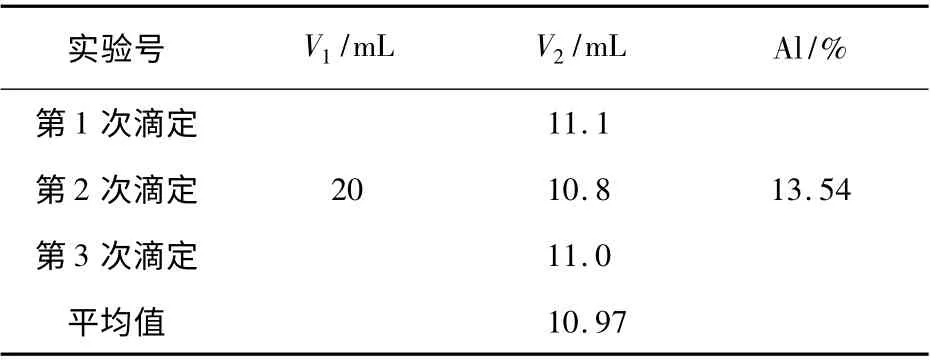
表2 测定铝所用EDTA 的量Table 2 The amount of EDTA in determining aluminum
2.1.3 结构分析 LDO 具有与二价金属氧化物相似的晶体结构,其组成通式为:

其中,M2+= Mg2+、Ni2+、Ca2+、Zn2+、Cu2+等;M3+=Al3+、Fe3+等;x 是M3+与[M2++M3+]的物质的量之比[14-15]。
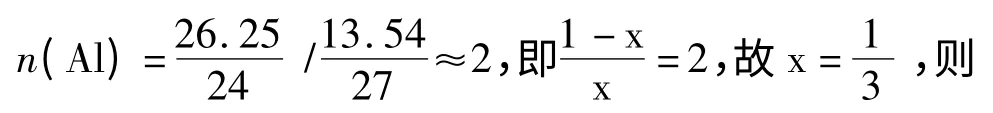
2.2 去除时间对去除率的影响
量取已配制好的10 g/L 的硫化钠溶液20 mL于试管中,加入准确称取的0.20 g LDO 粉末,常温搅拌,用稀盐酸调节pH =9。反应1,2,4,6,8 h 后分别测定S2-的去除率。去除时间对去除率的影响见图1。
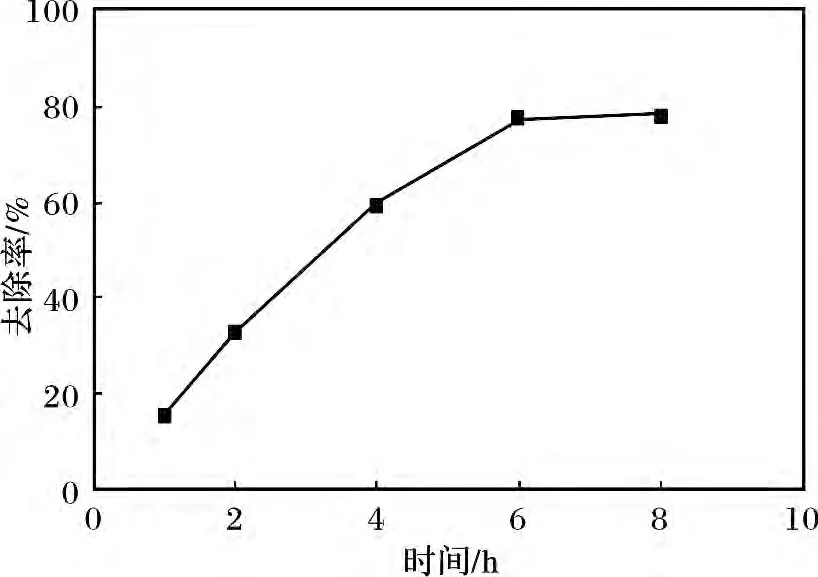
图1 去除时间对去除率的影响Fig.1 The influence of the removing time on the removal rate
由图1 可知,去除时间<2 h 时,S2-去除率增加较为缓慢,反应2 ~4 h 时,S2-去除率增大,去除时间超过6 h 后S2-去除率增加趋势趋于平缓,去除时间为8 h,去除率可达77.75%左右。
根据参考文献[1]可知,S2-去除率随时间变化的主要原因是,在pH =9 的溶液中的S2-主要以HS-形式存在,且H+的离子半径仅为10-3pm,S2-的离子半径(184 pm)与Cl-的离子半径相近,理论上为HS-而非S2-进入层间形成MgAl-HS-LDHs。随着去除时间的增加,由于S2-有还原性容易被空气中的O2氧化且MgAl-LDO 具有催化氧化性,因此在实验中不可避免的伴随有部分硫离子由-2 价被氧化成高价态进入层间使其层间间距增大,由于它和层板间有非常强的作用力,其他阴离子很难将其交换出来,因此随着时间进一步增加对硫离子的去除效果不明显。
2.3 硫离子初始浓度对去除率的影响
量取已配制好的5,10,15,20,25,30 g/L 的硫化钠溶液于点滴瓶中,加入准确称取的0.200 0 g LDO 粉末,常温搅拌,用稀盐酸调节pH=9 后,用蒸馏水定容至20 mL,静置8 h 后分别测定S2-的去除率。硫离子初始浓度对去除率的影响见图2。

图2 硫离子初始浓度对去除率的影响Fig.2 The influence of the initial concentration of S2-on the removal rate
由图2 可知,S2-的初始浓度<10 g/L 时,去除率增加极为缓慢,当S2-的初始浓度处于10 ~20 g/L 时,去除率迅速增加,并在15 g/L 达到最大值,为81.93%左右,当S2-的初始浓度>15 g/L 时,去除率开始下降。造成这种结果的原因是当S2-的初始浓度较小时,S2-主要以HS-的形式存在,HS-进入层间,形成MgAl-HS-LDHs。而当S2-的初始浓度较大时,S2-具有还原性容易被空气中的O2氧化且MgAl-LDO 具有催化氧化性,因此在实验中不可避免的伴随有部分硫离子由-2 价被氧化成高价态,进入层间使其层间间距增大,由于它和层板间有非常强的作用力,其他阴离子很难将其交换出来,因此对硫离子的去除率逐渐下降。
2.4 温度对去除率的影响
量取已配制好的10 g/L 的硫化钠溶液20 mL于试管中,加入准确称取的0.2 g LDO 粉末,常温搅拌,用稀盐酸调节pH =9。分别于常温(19.8 ℃),40,60 ℃条件下反应8 h 后分别测定S2-的去除率。温度对去除率的影响见图3。
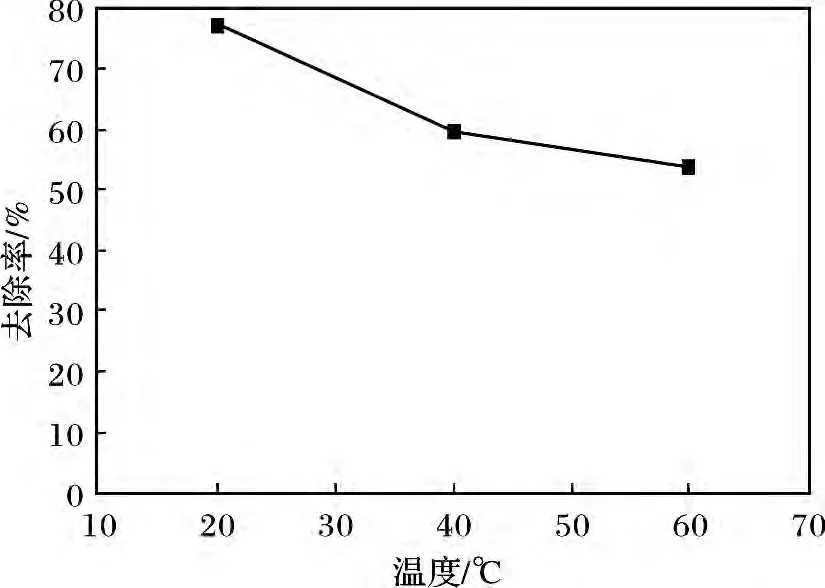
图3 温度对去除率的影响Fig.3 The influence of temperature on the removal rate
由图3 可知,随着温度的增加,S2-去除率逐步下降,在常温(19.8 ℃)下去除率最大,为78.09%左右,因此可以认为温度的升高对MgAl-LDO 的去除效果不利,其原因是温度的升高加速了S2-的催化氧化性,促使生成更多的S2O32-,S2O32-进入层间使其层间间距增大,由于它和层板间有非常强的作用力,其他阴离子很难将其交换出来,因此对硫离子的去除率逐渐下降。
3 结论
(1)通过共沉淀法合成层状双金属氢氧化物(LDHs),将nMg/nAl=2∶1 的LDHs 在500 ℃焙烧下得到产物MgAl-LDO。利用络合滴定的方法测定合成的镁铝双金属氧化物(MgAl-LDO)中镁和铝的含量,对合成的MgAl-LDO 进行元素分析,进而对结构进行了分析,得到镁铝双金属氧化物的结构式为Mg2AlO3(OH)。
(2)在溶液的pH =9 条件下,利用所制得的MgAl-LDO 去除S2-,同时考察了溶液的初始浓度、去除时间以及温度对S2-去除率的影响。结果表明,MgAl-LDO 具有较好的去除S2-能力,当去除时间为8 h,溶液初始浓度为15 g/L,常温(19.8 ℃)下,对S2-的最大去除率为81.93%。主要原因是pH=9 时,S2-发生水解且主要以HS-存在于溶液中,HS-通过LDO 结构恢复能迅速进入层间,且受MgAl-LDO 的催化氧化性能的影响,在结构恢复的同时HS-被氧化成S2O32-,可以有效去除溶液中的S2-。
由于目前实验条件下对S2-去除率比较低,主要是由于MgAl-LDO 具有催化氧化性,因此在实验中不可避免的伴随有部分硫离子由-2 价被氧化成S2O3
2-进入MgAl-LDO 样品层间,而且S2O32-和层板间有非常强的作用力,其他阴离子很难将其交换出来。因此,如何消除S2O3
2-竞争吸附的影响将成为今后研究工作的重点。
[1] 刘淼,杨俊佼,武国庆,等. 镁铝双金属氢氧化物及氧化物去除硫离子(S2-)性能及其机理研究[J].无机化学学报,2006,22(10):1771-1777.
[2] 孙媛媛,曾希柏,白玲玉. Mg/Al 双金属氧化物对As(V)吸附性能的研究[J]. 环境科学学报,2011,31(7):1377-1385.
[3] 杜宝中,王宏军,郑刚,等. 纳米层状双金属氢氧化物的制备及结构表征[J].无机盐工业,2007,39(5):26-28.
[4] 郑立波,叶瑛,季珊珊,等.Mg/Al 型双金属氧化物对六价铬的去除作用[J].地球化学,2004,33(2):208-215.
[5] 朱茂旭,李艳苹,张良,等. 水滑石及其焙烧产物对磷酸根的吸附[J].矿物学报,2005,25(1):27-32.
[6] 杜宝中,王宏军,王汝敏,等. 溶剂性质对合成纳米层状双金属氢氧化物的影响研究[J]. 无机盐工业,2009,41(7):12-14,25.
[7] 王军锋,杜宝中,王红军,等. 纳米层状双金属氢氧化物粉体制备工艺研究[J]. 西安理工大学学报,2006,22(2):219-221.
[8] 高伟,何杰,张晓梅. 层状双金属氢氧化物及其应用[J].大学化学,2012,27(4):38-45.
[9] 王军锋,李子荣,康志强.室温固相法合成纳米层状双金属氢氧化物[J]. 安徽科技学院学报,2007,21(5):33-36.
[10]李发炎,胡章文.聚乙烯醇/镁铝双金属氢氧化物复合材料的合成与性能研究[J]. 安徽化工,2013,39(2):22-24.
[11]谢建武,包永忠,黄志明. 聚苯乙烯/层状双金属氢氧化物纳米复合材料的制备与表征[J]. 高分子学报,2009(2):118-122.
[12]孙金陆,甄卫军,李进.LDHs 材料的结构、性质及其应用研究进展[J].化工进展,2013,32(3):610-616.
[13]李发炎,胡章文,刘俊.共沉淀法制备镁铝双金属氢氧化物及表征[J].轻金属,2013(6):15-17.
[14]胡小平,衡慧敏,卢涛,等. 镁铝层状双金属氢氧化物的制备及表征[J].中国粉体技术,2012,18(3):31-35.
[15]赵宁,廖立兵.水滑石类化合物及其制备、应用的研究进展[J].材料导报,2011,25(专辑17):543-549.
