硫化氢腐蚀产物氧化历程的研究
2015-12-24解树旺张振华赵杉林
解树旺,张振华,赵杉林
(辽宁石油化工大学 化学化工与环境学部,辽宁 抚顺 113001)
原油中存在的活性硫,如单质S、H2S 和低分子硫醇,能与金属发生反应引起设备腐蚀[1-3]。其中储罐内湿的H2S 气体,在无氧条件下与储罐内壁的腐蚀产物铁锈反应,生成硫铁化合物,具有很高的氧化反应活性[4-5]。国内外已发生多起由于储罐内H2S腐蚀产物氧化放热引起含硫油品储罐着火和爆炸等恶性事故[6-7]。要监测或预报H2S 腐蚀产物自燃事故的发生,必须掌握其氧化反应机理。张振华等[8]采用热重-差热分析手段研究了常温下H2S 腐蚀产物的自燃历程,根据腐蚀产物的氧化程度,将其氧化自燃过程分为初级、中级和完全氧化3 个阶段。初级氧化阶段,腐蚀产物发生不完全氧化反应,有单质硫生成;中级氧化阶段,有部分腐蚀产物发生完全氧化反应,有SO2气体生成;完全氧化阶段,腐蚀产物均发生完全氧化反应。本实验以Fe2O3、Fe3O4、Fe(OH)3的H2S 腐蚀产物为研究对象,通过通入气流氧化、控制温度氧化、不控制温度氧化三种方式进行氧化,根据分析不同氧化程度的氧化产物,研究H2S 腐蚀产物的氧化历程。
1 实验部分
1.1 试剂与仪器
Fe2O3、NaOH 均为分析纯;Fe3O4、Fe(OH)3均为化学纯。
MOT500-SO2二氧化硫检测仪;ESJ182-4 型电子分析天平。
1.2 H2S 腐蚀产物的制备
用FeS 和稀盐酸制备H2S 气体,将制得的H2S气体储存在储气袋中。为了保证H2S 气体中不含有O2,在制备前用N2吹洗圆底烧瓶和储气袋,制备后用奥氏气体分析仪分析储气袋中的H2S 和氧气含量。
称取10.0 g 试样放入三口烧瓶中,连接好装置,将烧瓶置于恒温水浴中,向实验装置内通入高纯氮气,排除空气。在25 ℃条件下,通入经缓冲瓶加湿的H2S 气体,由毛细管流量计控制流量为155 mL/min,硫化反应进行6 h。
1.3 硫铁化合物的氧化
1.3.1 H2S 腐蚀产物的通气氧化 将三口烧瓶从水浴中取出,向烧瓶通入饱和湿度的高纯氮气,吹掉腐蚀产物表面吸附的H2S 气体。将三口烧瓶连接在氧化装置上,氧化装置同硫化装置区别在于缓冲瓶中为NaOH 溶液,且装置没有受到H2S 污染,避免空气中的SO2和装置中可能存在的H2S 影响对尾气中SO2的监测。氧化时空气流量为230 mL/min。1.3.2 H2S 腐蚀产物的控制温度氧化 采用控制空气与硫化产物接触的方式,控制腐蚀产物的氧化升温。实验时,将三口烧瓶两侧的橡胶塞拔下,使空气与硫化产物接触发生氧化反应,温度升高,当温度即将达到预定温度时,用橡胶塞塞上三口烧瓶,阻止空气进入,使氧化反应速率逐渐减慢,当温度低于预定温度10 ℃时再次拔下橡胶塞,让空气进入,如此反复,直至硫化产物不再升温,待降至室温,分析产物中单质S 和SO42-的含量。
1.3.3 H2S 腐蚀产物的不控制温度氧化 将三口烧瓶两侧橡胶塞打开,让空气进入与腐蚀产物发生氧化反应,同时监控氧化升温情况,待反应温度将至室温,分析产物中单质硫和SO42-的含量。
1.4 氧化产物中单质硫含量的测定
本实验采用CS2萃取试样中的单质硫,称取约2.000 0 g 氧化产物,用CS2连续洗涤3 次,将洗涤液转入已知质量烧杯中,待CS2挥发后称量烧杯质量,直到烧杯质量不再变化,计为单质S 和已知质量烧杯的质量和,计算氧化产物中单质硫含量的百分比。
1.5 氧化产物中SO42-含量的测定
称取约1.000 0 g 氧化产物置于洁净烧杯中,加入去离子水溶解,将液体过滤,向滤液中快速加入BaCl2溶液,用定量滤纸再次过滤BaSO4浊液,去离子水冲洗2 ~3 次,将滤纸和BaSO4放入已知质量的干燥至恒重的坩埚中,放入马弗炉中加热至800 ℃煅烧,冷却至室温称量坩埚质量,计算出SO42-含量。
2 结果与讨论
2.1 H2S 腐蚀产物氧化过程
2.1.1 Fe2O3的H2S 腐蚀产物氧化过程 按1.3.1节方法,将Fe2O3的H2S 腐蚀产物氧化,监测氧化反应尾气中的SO2气体含量及氧化反应升温。氧化过程中温度、SO2浓度随时间的变化关系见图1。

图1 Fe2O3 的H2S 腐蚀产物氧化过程温度、SO2 浓度随时间的变化关系Fig.1 Temperature-time curve & SO2 concentration-time curve of the oxidation reaction of H2S corrosion products to Fe2O3
由图1 可知,氧化反应开始后试样温度迅速升高,当温度达到64 ℃时开始有SO2气体生成,随着氧化反应温度的升高,氧化尾气中SO2气体含量迅速升高。氧化反应进行到第11 min 时达到最高温度77 ℃并持续一段时间,第17 min 时温度开始下降,同时氧化尾气中SO2含量也下降。
氧化产物分析结果表明,氧化产物中单质S 含量为14.41%,SO42-含量为0.76%,XRD 表征结果表明该硫酸盐为FeSO4。实验结果表明,Fe2O3的H2S 腐蚀产物氧化过程首先发生生成S 单质的反应,当温度达到64 ℃附近时部分腐蚀产物开始发生生成SO2的反应,同时放出大量的热,升温速率加快。当达到最高温度77 ℃附近时氧化放热和环境散热达到平衡并持续一段时间,随着较高活性硫铁化合物的氧化消耗,向环境散热大于氧化放热,温度开始下降,同时生成SO2量下降。
2.1.2 Fe3O4的H2S 腐蚀产物氧化过程 按1.3.1节方法,将Fe3O4的H2S 腐蚀产物氧化,监测氧化反应尾气中的SO2气体含量及氧化反应升温。氧化过程中温度、SO2浓度随时间的变化关系见图2。

图2 Fe3O4 的H2S 腐蚀产物氧化过程温度、SO2 浓度随时间的变化关系Fig.2 Temperature-time curve & SO2 concentration-time curve of the oxidation reaction of H2S corrosion products to Fe3O4
由图2 可知,腐蚀产物温度迅速升高,第10 min时温度达到83 ℃,氧化尾气中开始有SO2气体,第12 min 时反应达到最高温度84 ℃,并持续了17 min,在此期间尾气中SO2的含量先升高后下降,与Fe2O3的H2S 腐蚀产物氧化过程相比,其氧化升温更高,但尾气中SO2浓度低,并且可能是腐蚀产物中含有的铁的硫化物不同,导致生成SO2的反应不同,生成SO2所需的温度高,这一点还需进行进一步的研究。
氧化产物中单质S 的含量为18.01%,SO42-的含量为0.48%,经XRD 分析该硫酸盐为FeSO4。实验结果表明,Fe3O4的H2S 腐蚀产物氧化温度低时以生成单质S 为主,当氧化升温高于83 ℃时部分腐蚀产物发生生成SO2的反应。
2.1.3 Fe( OH)3的H2S 腐蚀产物氧化过程 按1.3.1 节方法,将Fe(OH)3的H2S 腐蚀产物氧化,监测氧化尾气中SO2气体的含量。氧化过程中温度、SO2浓度随时间的变化曲线见图3。
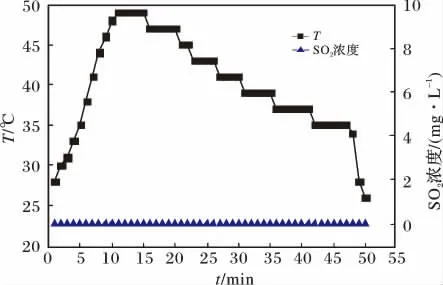
图3 Fe(OH)3 硫化产物氧化过程中温度、SO2 浓度随时间的变化关系Fig.3 Temperature-time curve & SO2 concentration-time curve of the oxidation reaction of H2S corrosion products to Fe(OH)3
由图3 可知,Fe(OH)3硫化产物氧化升温最高达到49 ℃,氧化过程中一直没有SO2气体生成。Fe(OH)3的H2S 腐蚀产物氧化升温幅度小,自燃性差,反应过程中达不到生成SO2的温度。对氧化产物进行了分析,其中单质S 含量为12.95%,SO42-含量为1.58%,XRD 表征结果表明该硫酸盐为FeSO4。该腐蚀产物氧化反应以生成S 单质为主,同时有少量腐蚀产物氧化生成FeSO4。
2.2 温度对硫化氢腐蚀产物氧化反应的影响
按1.3.3 节所述方法,对H2S 腐蚀产物进行了不控温氧化实验,腐蚀产物温度随时间的变化关系见图4。
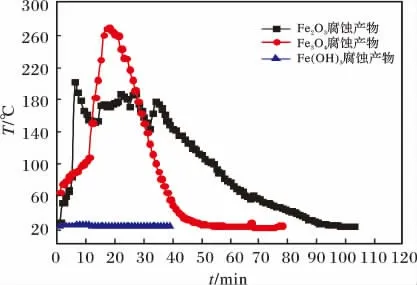
图4 H2S 腐蚀产物不控温氧化时的升温曲线Fig.4 The temperature curve of natural oxidation with H2S corrosion products
由图4 可知,由于腐蚀产物自然氧化过程中反应放出的热量不容易散失,所以Fe2O3和Fe3O4的H2S 腐蚀产物的自然氧化升温高,其中Fe3O4的H2S 腐蚀产物氧化升温达到270 ℃,自燃性高。Fe(OH)3硫化产物自然氧化时温度没有升高,自燃性低。
按1.3.2 节方法,对H2S 腐蚀产物进行了控温氧化实验。控温氧化实验选择的控温点为70 ℃,氧化反应完成后分析反应产物中的单质S 和硫酸根含量,结果见表1。
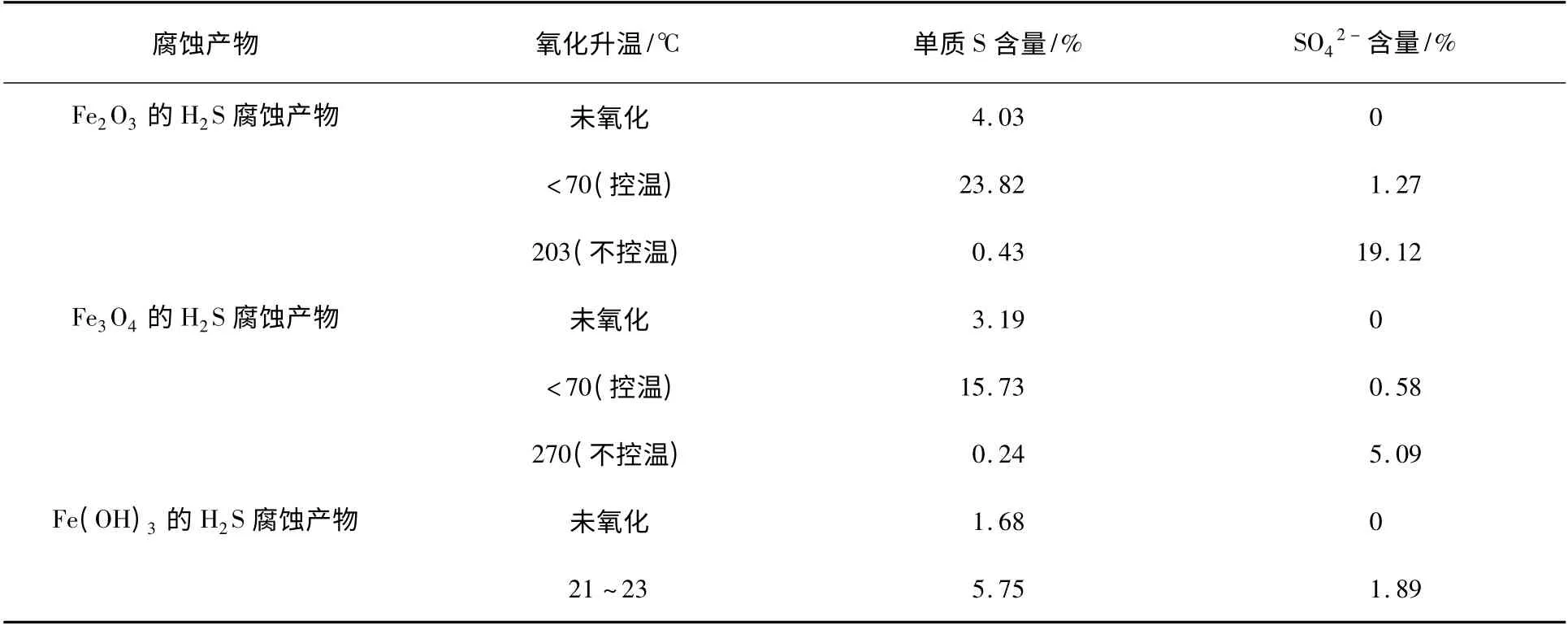
表1 氧化反应产物中正交硫和硫酸根含量随氧化反应温度的变化Table 1 The relationship between mass of orthorhombic sulfur in oxidation reaction products and oxidation temperature-rising
经XRD 分析,上述反应生成的硫酸盐均为FeSO4。由表1 可知,Fe2O3、Fe3O4和Fe(OH)3在与H2S 反应过程中均有少量的单质S 生成。Fe2O3、Fe3O4的H2S 腐蚀产物氧化过程中,当氧化升温低于70 ℃时,氧化反应产物中单质S 含量最高,以氧化反应生成单质S 为主。氧化升温至更高温度情况下氧化产物中的FeSO4含量增加。Fe(OH)3的H2S腐蚀产物自然条件下氧化比在没有湿润空气通入条件下升温更低,反应以生成S 单质为主,同时发生生成FeSO4的反应。
2.3 H2S 腐蚀产物的氧化过程
根据Fe2O3、Fe3O4的H2S 腐蚀产物氧化产物的不同,将Fe2O3、Fe3O4的H2S 腐蚀产物的氧化过程分为三个不同阶段。
Fe2O3和Fe3O4的H2S 腐蚀产物的氧化升温低时没有SO2气体生成,只有生成单质S 和少量FeSO4,主要发生如式(1)~(6)化学反应:

Fe2O3和Fe3O4的H2S 腐蚀产物的氧化温度分别高于64 ℃和83 ℃时,开始有SO2气体生成,此时主要发生了反应(4)~(6)及如下反应:

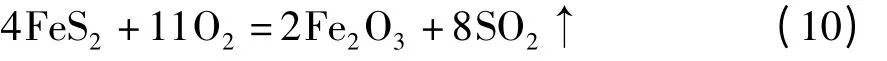
Fe2O3和Fe3O4的H2S 腐蚀产物不控制温度氧化,最高氧化温度分别达到203 ℃和270 ℃,和控制氧化温度70 ℃对比,氧化过程中生成SO2烟雾更浓,氧化反应产物中单质S 明显含量降低,表明在更高氧化温度条件下单质S 被氧化生成SO2,发生如式(11)所示的化学反应。随着氧化温度的升高,氧化产物中硫酸根含量增加,腐蚀产物发生了如式(12)所示的化学反应:

Fe(OH)3的H2S 腐蚀产物自燃性不强,且水对该腐蚀产物的氧化过程影响很大,表明该反应有水的参与,氧化过程没有SO2生成,主要产物为S 单质和FeSO4,发生如式(4)~(6)和(13)所示的反应:

3 结论
(1)常温下生成的Fe2O3、Fe3O4的H2S 腐蚀产物的氧化过程在开始时以生成单质S 为主,随着温度升高开始生成SO2和FeSO4,温度越高生成的FeSO4量越多。Fe(OH)3的H2S 腐蚀产物自燃性较差,氧化过程只有生成单质S 和FeSO4,没有SO2。
(2)不同铁锈组分制得的H2S 腐蚀产物氧化过程开始生成SO2的温度不同。SO2可以与温度有效关联,作为监测储罐中硫铁化合物氧化的标志性气体。
[1] 贾鹏林.高硫原油加工中的防腐蚀技术[J].石油化工腐蚀与防护,2001,18(5):1-4.
[2] 林海朝,余家康,史志明,等.含硫原油炼制过程中活性硫腐蚀[J]. 腐蚀科学与防护技术,2000,12(6):342-343.
[3] 杨波,田松柏,赵杉林.不同形态硫化合物腐蚀行为的研究[J].腐蚀科学与防护技术,2004,16(6):382-385.
[4] Hughes R I,Morgan T D B. The generation of pyrophoric material in the cargo tanks of crude oil carriers[J]. Tran Inst Mar Eng,1976,88:1-7.
[5] Hughes R I,Morgan T D B,Wilson R W. Is pyrophoric iron sulfide a possible source of ignition[J]. Nature,1974,248:670-673.
[6] 张凤华,马良军,张振华,等. 含硫油品储罐腐蚀产物FeS 的生成及自燃性[J]. 油气储运,2005,24(2):42-44.
[7] 张振华,陈宝智,李君华,等.含硫油品储罐腐蚀产物自燃性的研究[J]. 安全与环境学报,2008,7(3):124-127.
[8] 张振华,赵杉林,李萍,等.常温下硫化氢腐蚀产物的自燃历程[J]. 石油学报:石油加工,2012,28(1):122-126.
