MnO2 纳米颗粒的制备及其对亚甲基蓝的吸附性能
2015-12-24刘娟丽王爱军张文博
刘娟丽,王爱军,张文博
(西北民族大学 化工学院甘肃省高校环境友好复合材料及生物质利用省级重点实验室,甘肃兰州 730030)
合成染料因其使用方便、性质稳定、成本低等优点而被人们大量广泛使用,至20 世纪初,合成染料几乎已经完全取代了天然染料。但由于合成染料在生产工艺上的限制和不恰当的使用,在造成极大资源浪费的同时,对环境和人体健康也产生不容忽视的破坏作用。研究表明,染料废水中含有多种有机物和有毒物质,严重威胁鱼类和其他水生生物的生长,同时染料的颜色能抑制阳光在水中的透射,降低光合作用,从而破坏水中的生态平衡,引起环境问题。而且某些染料还是致癌和致突变的,排入水体后会影响人类的日常生活[1-3]。
吸附法因其具有去除水中污染物效率高、速度快、适应性强和易操作等优点而广泛应用于染料废水的处理。活性炭、黏土矿、水凝胶、过渡金属氧化物等均被用来作为吸附材料[4],其中,二氧化锰由于储量丰富、价格低廉被广泛应用于对染料废水及重金属废水的吸附、氧化及催化处理[5]。赵颖等用微乳液还原法,以甲苯还原KMnO4制备纳米MnO2,其对亚甲基蓝的饱和吸附量为120 mg/g,但是,其在制备过程中用到了有毒溶剂甲苯[6]。何平等采用水热法制备了MnO2纳米针,其对刚果红的最大吸附量为154 mg/g,但其在合成过程中用到了表面活性剂,并且水热合成成本较高[7]。
因此,本文采用乙二醇一步还原KMnO4室温下制备得到MnO2纳米颗粒,实验结果表明,该MnO2纳米颗粒分散度较好,粒径均一,比表面积大,呈无定型,并考察了其对水中亚甲基蓝的吸附性能。
1 实验部分
1.1 材料与仪器
高锰酸钾、乙二醇、无水乙醇、氢氧化钠、盐酸、亚甲基蓝均为分析纯;实验用水为超纯水。
DELTA320 pH 计;T6 新世纪紫外-可见分光光度计;TDL-5A 型飞鸽离心机。
1.2 实验方法
1.2.1 MnO2纳米颗粒的制备 取6.94 g 高锰酸钾溶于400 mL 水,缓慢滴加10 mL 乙二醇,超声分散2 h,离心,水洗、无水乙醇洗涤3 次,烘干,研成即得MnO2纳米颗粒。
1.2.2 MnO2纳米颗粒的表征分析
1.2.2.1 SEM 测试 样品在乙醇中分散后,滴在铜片上干燥后喷金进行测试。
1.2.2.2 TEM 测试 样品在乙醇中分散后,滴在铜网干燥后进行测试。
1.2.2.3 FTIR 分析 取少量样品与光谱纯KBr 充分混匀,压片,测定红外吸收光谱图。
1.2. 2. 4 XRD 分析 采用CuKα 辐射源,波长0.154 056 nm,管电压40 kV,管电流40 mA。
1.2.3 吸附实验 取一定浓度C0的亚甲基蓝溶液10 mL 于50 mL 锥形瓶中,加入一定质量的MnO2纳米颗粒,振荡一定时间,离心,取上清液在662 nm 下测定吸光度,并根据标准曲线法计算出吸附后亚甲基蓝溶液的平衡浓度Ce,由此计算吸附剂的吸附量qe(mg/g)和去除率η(%):
式中 C0——亚甲基蓝溶液的初始浓度,mg/L;
Ce——吸附后亚甲基蓝溶液的浓度,mg/L;
V——亚甲基蓝溶液的体积,L;
m——吸附剂用量,g。
2 结果与讨论
2.1 MnO2 纳米颗粒的结构表征
2.1.1 形貌分析 图1 为制备的二氧化锰纳米颗粒的扫描和透射电镜照片。
由图1 可知,制备的二氧化锰纳米颗粒分散性较好,颗粒分布较为均匀,粒径为10 ~40 nm。


图1 MnO2 纳米颗粒的扫描电镜(a)和透射电镜照片(b)Fig.1 SEM and TEM images of MnO2 nanoparticles
2.1.2 结构分析 图2 为二氧化锰纳米颗粒的红外谱图和XRD 谱图。
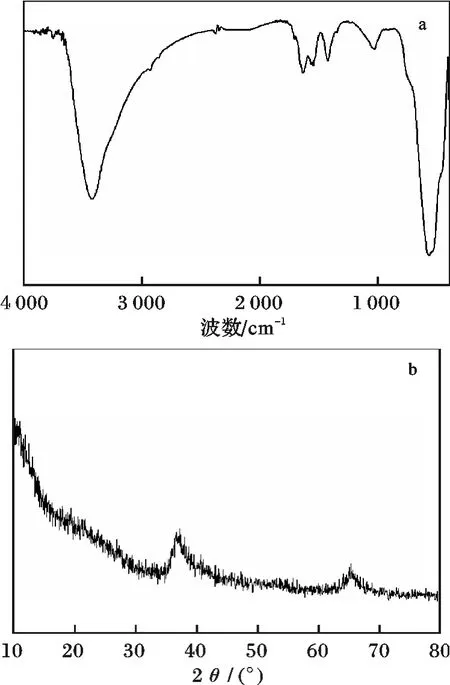
图2 MnO2 纳米颗粒的红外谱图(a)和XRD 谱图(b)Fig.2 FTIR and XRD patterns of MnO2 nanoparticles
由图2a 可知,在562 cm-1处为二氧化锰的Mn─O 特征吸收峰,在3 423 cm-1处为结晶水的特征吸收峰,说明二氧化锰的表面有结晶水的存在,同时,在1 420 cm-1为化学吸附水─OH 的特征吸收峰,在1 633 cm-1处为O─H 的弯曲振动吸收峰,说明制备的二氧化锰表面含有丰富的羟基,提供了较多的吸附位点,具有较好的吸附能力。由图2b 可知,在2θ=36.8° 和65.7° 出现了δ-MnO2的无定型特征衍射峰。
2.2 亚甲基蓝吸附实验
2.2.1 吸附剂用量对吸附性能的影响 取初始浓度为500 mg/L 亚甲基蓝溶液10 mL 于50 mL 锥形瓶中,加入不同质量的MnO2纳米颗粒,室温振荡90 min,考察不同MnO2纳米颗粒用量对吸附性能的影响,结果见图3。
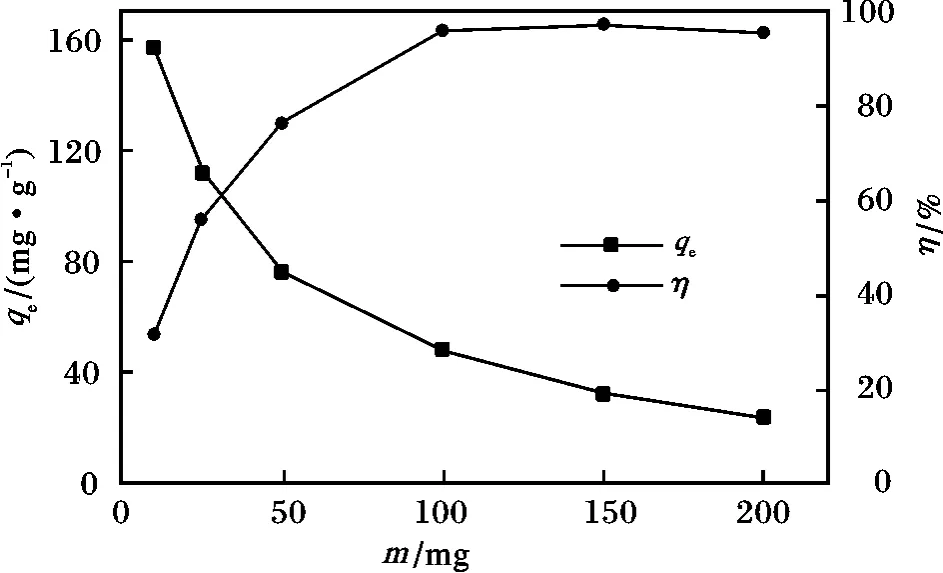
图3 不同质量MnO2 纳米颗粒对亚甲基蓝吸附性能的影响Fig.3 Influence of adsorption for methylene blue on MnO2 nanoparticles with different mass
由图3 可知,随着MnO2纳米颗粒用量的增加,吸附量逐渐降低,而去除率逐渐升高,当MnO2纳米颗粒用量>100 mg 时,去除率接近于100%,溶液中亚甲基蓝几乎被完全吸附,溶液呈现无色。这是因为当MnO2纳米颗粒用量较低时,吸附剂呈饱和吸附,吸附点位被完全占据,吸附容量达到最大值,随着吸附剂用量的增加,溶液中亚甲基蓝被完全吸附,但吸附剂中仍存在空余吸附点位,并且逐渐增多,因此导致吸附量下降。当吸附剂用量为10 mg 时,吸附量达到最大,为157. 7 mg/g。综合考虑后续实验,选择吸附剂用量为50 mg。
2.2.2 吸附等温线 取不同初始浓度的亚甲基蓝溶液10 mL 于50 mL 锥形瓶中,加入50 mg MnO2纳米颗粒,室温振荡90 min,考察制备的二氧化锰纳米颗粒对亚甲基蓝的吸附等温线,结果见图4。

图4 MnO2 纳米颗粒吸附亚甲基蓝的吸附等温线Fig.4 Adsorption isotherms for methylene blue on the MnO2 nanoparticles
由图4 可知,随着亚甲基蓝初始浓度的增加,吸附后的平衡浓度增加,平衡吸附量不断增加。同时,通过Langmuir 和Freundlich 模型对等温线进行拟合[8],拟合参数见表1。

表1 MnO2 纳米颗粒吸附亚甲基蓝的等温吸附拟合参数Table 1 Isotherm parameters of MnO2 for methylene blue adsorption
由表1 可知,Langmuir 和Freundlich 方程拟合的相关系数R2分别为0.997 和0.779,说明本实验的吸附过程更符合Langmuir 等温方程,这表明MnO2纳米颗粒吸附位活性均一,表面均匀,水中亚甲基蓝在MnO2纳米颗粒上的吸附以单层吸附为主[9]。
2.2.3 吸附动力学 取初始浓度为500 mg/L 亚甲基蓝溶液10 mL 于50 mL 锥形瓶中,加入MnO2纳米颗粒50 mg,恒温振荡一定时间,考察不同时间对吸附性能的影响,结果见图5。

图5 不同时间对MnO2 纳米颗粒吸附亚甲基蓝性能的影响Fig.5 Influence of adsorption for methylene blue on MnO2 nanoparticles with different time
由图5 可知,MnO2纳米颗粒对亚甲基蓝的吸附在最初的30 min 内速率较快,随后吸附速率趋于平缓,吸附约在90 min 内达到平衡。这是由于在吸附初期,吸附剂中存在大量的吸附点位被亚甲基蓝占据,吸附量随着时间快速增大。随着吸附时间的增加,空余吸附点位数目减少,吸附速率缓慢,直至吸附平衡。
同时,通过准二级动力学模型对吸附数据进行拟合[10],进一步分析其吸附机理。拟合结果见图6、表2。
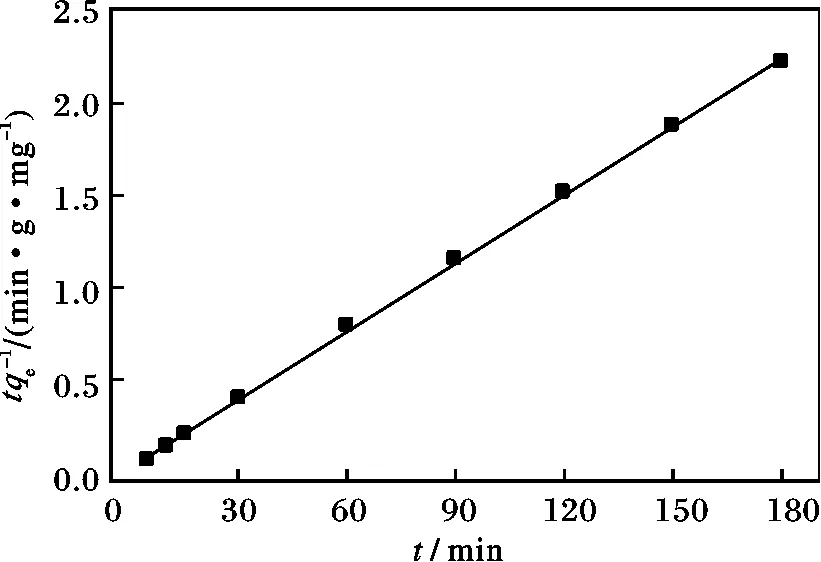
图6 MnO2 纳米颗粒吸附亚甲基蓝的准二级动力学拟合曲线Fig.6 Pseudo-second-order kinetics for adsorption of methylene blue on the MnO2 nanoparticles

表2 准二级动力学方程拟合参数Table 2 Pseudo-second-order adsorption kinetic constant of MnO2 nanoparticles
由图6 可知,拟合后的曲线线性较好,基本呈一条直线,准二级动力学方程为t/qt=1/(k2×)+t/q2e。同时,由表2 可知,计算得出的平衡吸附量q2e的数值和实验得出的吸附量qe数值非常接近,且拟合的相关系数R2为0.999,说明MnO2纳米颗粒对水中亚甲基蓝的吸附过程符合准二级动力学方程。
3 结论
通过一步氧化还原法室温下制备得到MnO2纳米颗粒,电镜结果表明MnO2纳米颗粒分散性较好,粒径为10 ~40 nm,红外结果表明其表面含有大量羟基,同时,XRD 结果表面该MnO2纳米颗粒为无定型的δ-MnO2。并将其应用于对水中亚甲基蓝的处理,结果表明,MnO2纳米颗粒吸附性能较好,最大吸附量可达157.7 mg/g,而且吸附过程符合Langmuir 等温模型和准二级动力学方程。
[1] Robinson T,Chandran B,Nigam P.Removal of dyes from a synthetic textile dye effluent by biosorption on apple pomace and wheat straw[J]. Water Research,2002,36(11):2824-2830.
[2] Forgacs E,Cserhati T,Oros G.Removal of synthetic dyes from wastewaters:A review[J]. Environment International,2004,30(7):953-971.
[3] Gong R,Li M,Yang C,et al. Removal of cationic dyes from aqueous solution by adsorption on peanut hull[J].Journal of Hazardous Materials,2005,121(1):247-250.
[4] Nguyen T A,Juang R S. Treatment of waters and wastewaters containing sulfur dyes:A review[J].Chemical Engineering Journal,2013,219:109-117.
[5] Chen R,Yu J,Xiao W.Hierarchically porous MnO2microspheres with enhanced adsorption performance[J]. Journal of Materials Chemistry A,2013,38 (1):11682-11690.
[6] 赵颖,王仁国,曾武,等. 纳米二氧化锰的制备及其对亚甲基蓝的吸附研究[J]. 水处理技术,2012,38(1):55-58.
[7] 何平,郎筠.α-MnO2纳米针的合成及其对刚果红的吸附性能[J].应用化工,2013,42(10):1875-1877.
[8] Langmuir I.The constitution and fundamental properties of solids and liquids.Part i.solids[J].Journal of the American Chemical Society,1916,38(11):2221-2295.
[9] Li K,Wang X.Adsorptive removal of Pb(II)by activated carbon prepared from Spartina alterniflora:Equilibrium,kinetics and thermodynamics[J]. Bioresource Technology,2009,100(11):2810-2815.
[10]Ho Y S,McKay G.Pseudo-second order model for sorption processes[J]. Process Biochemistry,1999,34(5):451-465.
