钛酸钙化合物合成热力学与溶出动力学行为
2015-12-23于海燕潘晓林翟玉春
张 迪,于海燕,潘晓林,翟玉春
(东北大学 材料与冶金学院,沈阳110819)
含钛高炉渣不能像普通高炉渣那样大量用于建筑材料,而大量堆积不仅造成有价元素的严重浪费,而且污染环境,因此,研究含钛高炉渣的综合利用有重大意义.
含钛高炉渣中氧化钛弥散分布于不同物相中,各物相间存在复杂的界面结合力.基于冶金渣中有价组分选择性析出,CaO-TiO2系选择性长大分离富集将炉渣成分调整到CaSiO3-Ca3Si2O7-CaTiO3区域,可以使渣中钛组分选择性富集生成钛酸钙,长大和粗化,以保证钙钛矿相的析出.文献报道多集中在CaTiO3在H2SO4中的溶解性能[1,2],而钛组分在向钛酸钙富集的过程中,由于CaTi4O9、Ca2Ti5O12、CaTi2O5、CaTiO3、Ca4Ti3O10和Ca3Ti2O7等共存和相互转化[3~7],不同钛酸钙相烧结性能和氧化钛溶出性能相差较大,严重影响氧化钛的回收.本文通过对钛酸钙合成及其与硫酸反应热力学计算,以及不同温度条件下溶出过程动力学研究,探究钛酸钙相生成难易程度和在硫酸溶液中的溶解性能,在回收钛资源过程中达到降低能耗和提高转化率的目的,为含钛高炉渣的资源回收提供理论依据.
1 试验原料与方法
1.1 钛酸钙的合成
为了 制 备 含CaTi4O9、Ca2Ti5O12、CaTi2O5、CaTiO3、Ca4Ti3O10、Ca3Ti2O7等物相的物料,以分析纯CaCO3和TiO2为原料,按氧化钙和二氧化钛的摩尔比为1.5 进行配料,将试验原料在聚乙烯混料罐中混合2 h,装进石墨坩埚并放入高温电阻炉中,在1 250 ℃时烧结1 h,再升温至1 500 ℃时烧结0.5 h,随炉冷却至200 ℃以下取出.对制备的物料进行XRD 分析,结果如图1所示.

图1 钛酸钙化合物的XRD 谱Fig.1 XRD pattern of calcium titanates
由图1 可知,采用烧结法合成的物料主要物相为CaTiO3、Ca4Ti3O10和Ca3Ti2O7,以及未反应的CaO.
1.2 钛酸钙的溶出
以硫酸为溶出液,对钛酸钙物料进行标准溶出,以考察各物相在硫酸溶液中的溶解性能.将50 ml 浓硫酸加入带冷凝装置的三口瓶中,预热至设定温度,加入5 g 物料,开启搅拌器并计时.溶出结束后,进行抽滤,用40% H2SO4洗涤滤饼3 次,再用蒸馏水洗涤多次,干燥保存.采用722S型分光光度计测定滤液中TiO2的浓度.二氧化钛的溶出率计算公式如式(1)所示:

式中,v定为硫酸氧钛溶液体积,L;m 为钛酸钙质量,g;w 为钛酸钙中TiO2的质量分数,%;
TiO2标准曲线如式(2)所示:
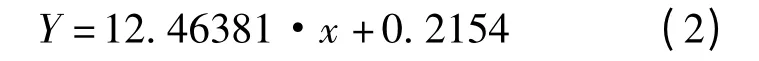
式中,x 为分光光度计测量数值.
2 热力学计算与动力学模型建立
2.1 钛酸钙相生成热力学
在CaO-TiO2二元系中,烧结过程同时存在CaTiO3、Ca4Ti3O10和Ca3Ti2O7生成的反应,其反应方程式如式(3)、(4)和(5)所示:

依据热力学数据[8]计算三种钛酸钙化合物生成反应的吉布斯自由能(△G)与温度(T)的关系,如图2所示.
由图2 可知,烧结温度在500~2 000 K 范围内,式(3)、(4)和(5)反应的△G 随烧结温度的升高逐渐降低,均小于-83.16 kJ·mol-1,表明该反应能自发进行,生成相应的钛酸钙相.
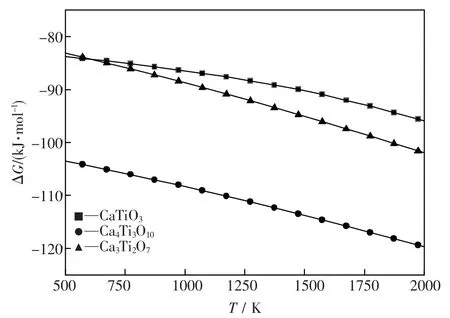
图2 反应过程吉布斯自由能与温度的关系Fig.2 Relationship between Gibbs free energy of form reactions and temperature
2.2 钛酸钙酸溶反应热力学
硫酸溶出钛酸钙物料提取氧化钛的反应过程如式(6)、(7)和(8)(TiOSO4溶于水,在热水中易水解)所示.依据热力学数据[8]计算酸溶反应在273~573 K 范围内△G 随温度的变化情况,如图3所示.
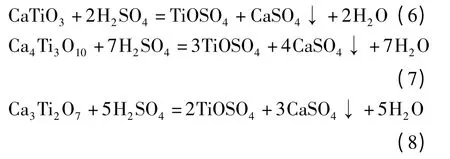

图3 酸溶反应吉布斯自由能与温度的关系Fig.3 Relationship between Gibbs free energy of acid solution reactions and temperature
由图3 可知,溶出温度在273~573 K 范围内,式(6)、(7)和(8)反应的△G 随温度的升高而增大,但都小于-116.57 kJ·mol-1,表明该反应均能自发进行.
根据X 衍射数据并采用JADE 软件晶胞精修计算钛酸钙物料中Ca4Ti3O10、Ca3Ti2O7和CaTiO3的晶胞参数,结果如表1所示.
由表1分析可知,采用烧结法制备的物料中CaTiO3属于立方晶系,空间群为Pm-3m,d=0.268 7 nm,a=b=c=0.380 3 nm;Ca4Ti3O10属于正交晶系,空间群为Pcab,d=0.271 7 nm,a=0.537 1 nm,b=2.707 6 nm,c=0.541 5 nm;Ca3Ti2O7属于单斜晶系,空间群为 Ccm21,d=0.270 9 nm,a=0.254 7 nm,b=1.934 7 nm,c=0.542 5 nm.
根据晶体稳定性可知,晶面间距越小,共用的原子数越多,面密度越小,晶胞体积越小,键能越大,在原子的置换过程中就越难,说明不同钛酸钙化合物在硫酸中的溶解性能Ca4Ti3O10>Ca3Ti2O7>CaTiO3.
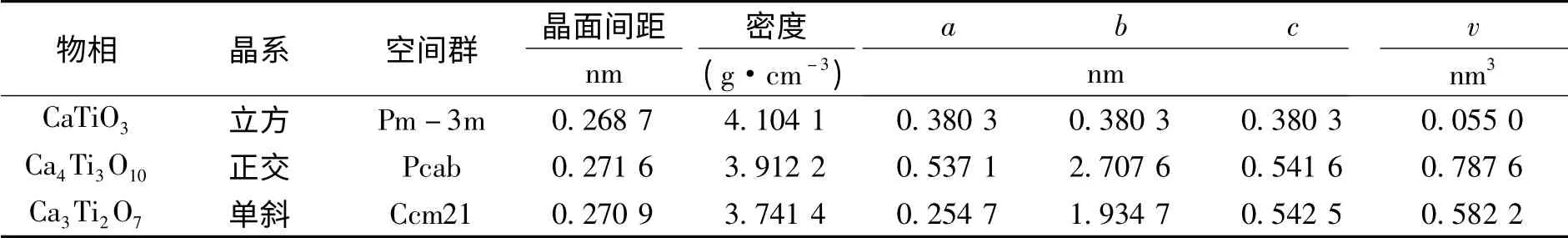
表1 钛酸钙物相晶体结构参数Table 1 Unit cell parameters of calcium titanate phase
2.3 酸溶过程动力学模型建立
根据湿法冶金动力学原理,钛酸钙的溶出过程为其与硫酸反应生成硫酸氧钛和硫酸钙的过程.反应过程中生成的硫酸钙附着在未反应核之外,按无空隙颗粒的液-固反应来处理,引入收缩未反应模型[9~11]来描述这一动力学过程,即认为物料颗粒是致密无孔或有孔但内扩散速度非常慢,所以溶解反应只发生在未反应的核外面,如图4所示.
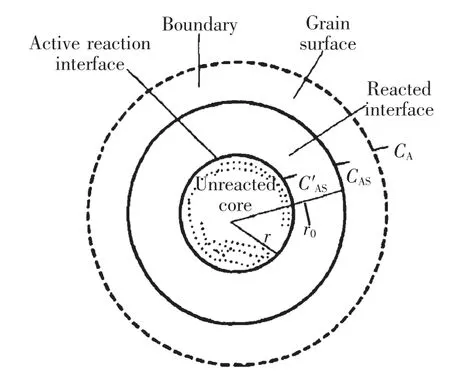
图4 生成固态产物的反应模型Fig.4 Kinetic model of solid product
反应步骤包括:
1)液态反应物A 通过液体边界层的扩散

2)液态反应物A 通过固体产物层的扩散

3)界面化学反应
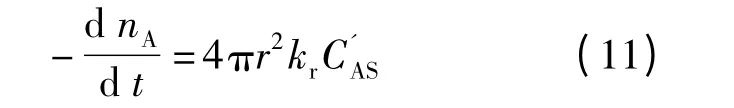
式中,r,r0,CA和如图4所示;D1和Ds分别为反应物A 通过液体边界层和固体产物层的有效扩散系数;δ 为液体边界层厚度;kr为界面化学反应速率常数.
在准稳态的情况下,假设液态反应物的浓度保持恒定,通过积分,从方程式(9)、(10)、(11)导出动力学方程见式(12)、(13)、(14).模型包含3 个控制过程:表面化学反应控制、固膜扩散控制以及二者的混合控制:
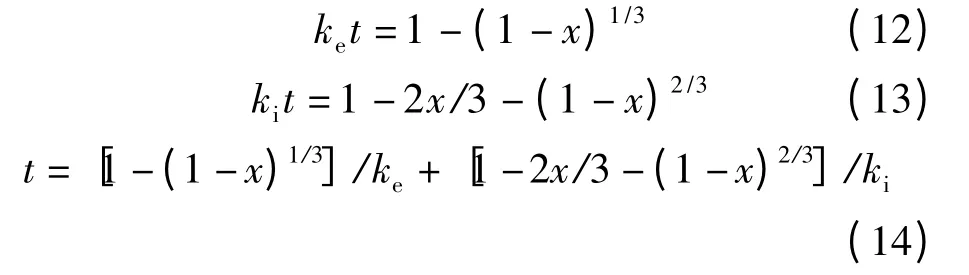
式中,ke为表观化学反应速率常数;ki为表观扩散速率常数;t 为反应时间,min;x 为TiO2的转化率,即.
3 结果与讨论
3.1 钛酸钙物料XRD 分析
由图1 可知,钛酸钙物料XRD 图谱无“馒头”峰存在,无衍射峰剩余,且峰型尖锐,表明物相结晶度较高.物料中主要物相为Ca4Ti3O10和Ca3Ti2O7,少量的CaTiO3,以及微量的未参与反应的CaO.在2θ=33.31(°),47.49(°),59.45(°)和69.84(°)处出现的物相衍射峰,对应CaTiO3的(110),(200),(211)和(220)晶面;在2θ=32.93(°),33.02(°),46.59(°),58.73(°)和69.17(°)处出现的物相衍射峰,对应Ca4Ti3O10的(002),(200),(1 12 1),(173)和(004)晶面;在2θ=32.93(°),33.02(°),46.59(°),58.73(°)和69.17(°)处出现的物相衍射峰,对应Ca3Ti2O7的(151),(002),(0 10 0),(153)和(004)晶面.其中,Ca4Ti3O10和Ca3Ti2O7物相的衍射峰重叠,但是晶面取向区别较大.
根据熟料X 衍射数据采用Rietveld 全谱拟合法对钛酸钙物料中各物相含量进行半定量分析,结果如表2所示.

表2 钛酸钙物相半定量分析(质量分数)Table 2 Semi-quantitative analysis of calcium titanate(mass fraction) %
由表2 可知,采用烧结法合成的钛酸钙物料中Ca4Ti3O10相的质量分数为61.8%,Ca3Ti2O7相的质量分数为31.6%,CaTiO3相的质量分数为6.3%.

图5 温度对氧化钛溶出率的影响Fig.5 Effect of temperature on titania leaching ratio
3.2 温度对氧化钛溶出率的影响
溶出温度对氧化钛溶出率的影响见图5.由图5 可知,在相同的溶出时间下,溶出温度越高钛酸钙物料中氧化钛的溶出率越高;在相同的溶出温度时,随着溶出时间的增加,氧化钛溶出率逐渐增加.溶出温度在338~358 K 范围内,氧化钛溶出率为40%~62%;溶出温度在403~443 K 范围内,氧化钛溶出率为80%~92%,可见,提高溶出温度能显著提高氧化钛的溶出率.
将不同温度条件下氧化钛转化率数据代入控制模型的动力学方程式(12)~(14)中,并进行拟合,结果如图6 和图7所示.

图6 1-(1-x)1/3与t 的关系Fig.6 Relationship between 1-(1-x)1/3 and time

图7 1-2x/3-(1-x)2/3与t 的关系Fig.7 Relationship between 1-2x/3-(1-x)2/3 and time
溶出温度在338~358 K 时,1-(1-x)1/3与t呈线性关系,相关系数R2=0.97,表明钛酸钙与硫酸的反应属于化学反应控制,物料中钛酸钙活性组分与硫酸的反应速率对溶出过程起主导作用;溶出温度在403~443 K 时,1-2x/3-(1-x)2/3与t 呈线性关系,R2=0.99,表明钛酸钙与硫酸的反应属于固膜扩散控制,硫酸在钛酸钙表面沉积层中的扩散速度对溶出过程起主导作用.
随着溶出温度的升高,钛酸钙酸溶过程从化学反应控制转变为固膜扩散控制.究其原因,溶出温度较低时,反应物中活化分子百分含量较低,而反应的活化能较高,导致化学反应速率低,此时溶出过程为化学反应控制.温度升高使得反应物反应活性升高,化学反应速率较快;另一方面酸溶过程生成的硫酸钙沉积逐渐形成一层结构致密、空隙率较小的“灰壳”,阻止硫酸通过“灰壳”从固体颗粒表面向待反应表面扩散,以及生成可溶性物质从反应表面向固体颗粒表层扩散,减缓酸溶反应的进一步进行,于是溶出过程转变为固膜扩散控制.
3.3 建立宏观动力学方程
依据表观反应活化能的大小可对溶出过程的控制步骤作出进一步的判断.化学反应控制时,表观活化能大于42 kJ·mol-1;固膜扩散控制时,表观活化能小于12 kJ·mol-1;混合控制时,表观活化能介于二者之间[12].
将Arrhenius 公式:
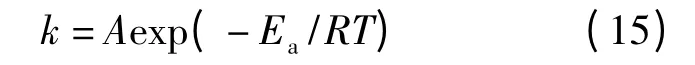
对等号两边取对数,整理得:

式中:k 为速率常数;A 为频率因子,s-1;Ea为表观活化能,J·mol-1;R=8.314 5 J·(mol·K)-1;T 为热力学温度,K.
由图6 和图7 可求得不同温度下钛酸钙与硫酸反应的速率常数ke,结果见表3.以ln k-T-1作图,见图8(a)和8(b).式中ln A 为直线的截距,斜率为-Ea/R.经计算得,溶出温度在338~358 K 时,Ea=42.40 kJ·mol-1,A=621.39 s-1,表观活化能在化学反应控制范围内;溶出温度在403~ 443 K 时,Ea=11.82 kJ·mol-1,A=0.011 5 s-1,表观活化能在固膜扩散控制范围内.

表3 钛酸钙在不同温度下溶出反应的速率常数Table 3 Rate constant of titanate solution at different temperature
化学反应控制时,将338~358 K 条件下Ea=42.40 kJ·mol-1,A=621.39 s-1代入式(12)和(15)得到溶出过程的宏观动力学方程:

固膜扩散控制时,将403~443 K 条件下Ea=11.82 kJ·mol-1,A=0.0115 s-1代入式(13)和(15),得到溶出过程的宏观动力学方程:

4 结 论
(1)烧结温度在473~2 000 K 时,CaTiO3、Ca3Ti2O7和Ca4Ti3O10均能生成;溶出温度在273~573 K 时,Ca4Ti3O10、Ca3Ti2O7和CaTiO3在硫酸中的溶解性能逐渐降低;

图8 ln k 与T -1的关系Fig.8 Relationship between ln k and T -1
(2)在本研究范围内,溶出温度对反应过程影响较大;溶出温度在338~358 K 时,溶出过程受化学反应控制,宏观动力学方程为1-(1-,反应表观活化能为42.40 kJ·mol-1;溶出温度在403~443 K 时,溶出过程受固膜扩散控制,宏观动力学方程为1-,反应表观活化能为11.82 kJ·mol-1.
[1]Jacob K T,Abraham K P.Thermodynamic properties of calcium titanates: CaTiO3,Ca4Ti3O10,Ca3Ti2O7[J].Journal of Chemical Thermodynamics,2009,41 (6):816–820.
[2]Sahoo S,Dash U,Parashar S K S,et al.Frequency and temperature dependent electrical characteristics of CaTiO3nano-ceramic prepared by high-energy ball milling[J].Journal of Advanced Ceramics,2013,2(3):291-300.
[3]Grzmil B,Grela D,Kic B.Hydrolysis of titanium sulphate compounds[J].Chemical Papers,2008,62(1):18 –25.
[4]Ropero-Vega J L,Aldana-Pérez A,Gómez R,et al.Sulfated titania[TiO2/SO2-4]:A very active solid acid catalyst for the esterification of free fatty acids with ethanol[J].Applied Catalysis A:General,2010,379(1-2):24 –29.
[5]Jung S M,Grange P.Characterization and reactivity of pure TiO2–SO2-4SCR catalyst:influence of SO2-4content[J].Catalysis Today,2000,59(3):305 –312.
[6]Tranell G,Ostrovski O,Jahanshahi S.The equilibrium partitioning of titanium Ti3+and Ti4+valency states in CaO-SiO2-TiO2slags[J].Metallurgical and Materials B,2002,33(1):60 –67.
[7]Khder A S,El-Sharkawy E A,El-Hakam S A,et al.Surface characterization and catalytic activity of sulfated tin oxide catalyst[J].Catalysis Communications,2008,9(5):769 –777.
[8]梁英教,车荫昌.无机物热力学数据手册[M].沈阳:东北大学出版社,1993:88.
(Liang Yingjiao,Che Yinchang.Handbook of thermodynamic data of inorganic materials[M].Shenyang:Northeastern University Press,1993:88.)
[9]周秋生,齐天贵,彭志宏,等.熟料烧结过程中氧化铁反应行为的热力学分析[J].中国有色金属学报,2007,17(6):973–978.
(Zhou Qiusheng,Qi Tiangui,Peng Zhihong,et al.Thermodynamics of reaction behavior of ferric oxide during sinter-preparing process[J].The Chinese Journal of Nonferrous Metals,2007,17(6):973 –978.)
[10]杜鹤桂.高炉冶炼钒钛磁铁矿原理[M].北京:科学出版社,1996:178.
(Du Hegui.Principle of V-Ti-bearing magnetite ore smelting in a blast furnance[M].Beijing:Science Press,1996:178.)
[11]王明华,都兴红,隋智通.H2SO4分解富钛精矿的反应动力学[J].中国有色金属学报,2001,11(1):131 –133.
(Wang Minghua,Du Xinghong,Sui Zhitong.Kinetics of acidolysis of rich titanium concentrate by H2SO4[J].The Chinese Journal of Nonferrous Metals,2001,11 (1):131–133.)
[12]华一新.冶金过程动力学导论[M].北京:冶金工业出版社,2004:188 –198.
(Hua Yixin.Introduction of metallurgy kinetics[M].Beijing:Metallurgical Industry Press,2004:188 –198.)
