探究乙醇-丙酮不同比例对雨生红球藻中虾青素提取速率的影响
2015-12-22李小慧孙东红鲁东大学生命科学学院山东烟台264025
李小慧,邹 宁,孙东红,张 军 (鲁东大学生命科学学院,山东烟台264025)
雨生红球藻是一种广泛分布在淡水的绿藻,有营养细胞、厚壁孢子两种。前者是绿色的,处于生长状态,不产生虾青素,只有在劣势条件下厚壁孢子才能够开始积累类胡萝卜素,其中80%以上为虾青素[1]。在雨生红球藻中,70%的虾青素以单酯的形式存在,25%以二酯存在,而只有约5%为游离虾青素[2]。目前,雨生红球藻的研究及其应用受到微藻研究界的重视,但是雨生红球藻的养殖、生产远远不能满足市场需求,而且雨生红球藻投入大规模工业生产,其培养和提取过程中尚存在许多问题亟待研究和解决。
虾青素(Astaxanthin,3,3’- 二羟基 -4,4’- 二酮基 -β,β’-胡萝卜素,C40H52O4)是一种类胡萝卜素含氧衍生物,具有超强的抗氧化活性,同时赋予虾青素特殊的生理功能,即提高动物免疫力,抑制肿瘤,清除自由基和活性氧等[3]。目前虾青素生产工艺主要有化学合成和生物提取2种,但化学合成的虾青素在结构、功能、应用和安全性等方面均较天然虾青素逊色不少,美国FDA已明文禁止化学合成的虾青素进入保健品市场。动物和人体试验的结果已证明,天然虾青素无任何毒副作用,对人体绝对安全。天然虾青素具有广泛的应用价值,不仅可以用作珍贵水产动物养殖的饵料添加剂和人类的食品添加剂,而且在药品、化妆品和高级营养保健品等领域也具有巨大的应用潜力。在特定条件下,雨生红球藻可以积累占其干重1%以上的虾青素,且所含虾青素的结构与养殖对象所需的虾青素结构一致,因此,雨生红球藻被公认为天然虾青素的最好生物来源[4]。同时,利用雨生红球藻生产虾青素已成为国内外虾青素研究的热点[5-6]。
雨生红球藻的培养过程存在不易生长和易染菌等问题,其色素的提取过程也较困难。常用方法包括有机溶剂提取、植物油提取[7]及超临界二氧化碳萃取[8-10]等。植物油提取虽然安全性较高,但植物油沸点高,后期不易分离和处理;超临界二氧化碳提取法是较流行的方法,但其成本较高[11]。有机溶剂法具有易操作、控制,且易分离,甚至可以重复利用等优点,所以目前工业生产中分离提取虾青素主要采用有机溶剂法。该种方法成本低、效率高。在虾青素的提取过程中,有机溶剂从雨生红球藻细胞中萃取虾青素的原理是有机溶剂通过细胞壁进入细胞,使得色素溶解于有机溶剂中,从而通过扩散作用进入溶液。这是一种固—液萃取的过程。雨生红球藻的细胞壁很厚且存在胶质,阻碍了提取剂向细胞内渗透,因此加大了从其中提取虾青素的难度。
在有机溶剂法中,较成熟的是采用丙酮作为提取剂,也是目前常用的有机溶剂中提取率较高的,但是丙酮的毒性大,且提取过程中易挥发,因此,笔者研究丙酮与乙醇不同比例提取虾青素的方法,并且比较不同比例提取的雨生红球藻虾青素提取物的提取率,以期探索提取雨生红球藻中虾青素较安全、毒性小、有效的有机溶剂。
1 材料与方法
1.1 材料 供试雨生红球藻(Haematococcus pluvialis)的新鲜藻液由鲁东大学大境藻类研究所提供。
1.2 虾青素提取及测定方法 取样,测定虾青素基础量。用分光光度计在可见光λ400~700 nm处测定OD值,并且通过计算得出虾青素含量。经多次虾青素吸光度的标定,在波长为473 nm处虾青素的吸光度达到峰值,因此,试验中虾青素的吸光度均在波长473 nm下测定(理论值为475 nm)。
虾青素含量的测定步骤为:①将冷冻的新鲜藻膏提前放入保鲜里,用电子天平称取8支离心管,并且编号1~8,分别记下其质量M1~M8,用移液管分别吸取少量新鲜藻膏,置于洁净的离心管中,再次分别称量其质量M1’~M8’,并且计算出M’与M的质量差即鲜藻膏的质量;②向1~8号离心管中分别加入有机溶剂1 ml,再加入少量(8~12个)玻璃珠,在振荡混匀器上振荡混匀,在振荡混匀过程中用铝箔包住离心管,边振荡边观察,振荡完成后再加入2 ml提取剂振荡混匀,提取过程需进行3次,以保证充分提取出雨生红球藻细胞中的虾青素,在不同比例的试验中均用乙醇和丙酮两管作对照,剩下不同试验中分别为1∶1(V/V)、2∶1(V/V)、1∶2(V/V);③先将提取液1~8号离心管放入80℃的水浴中加热1 min,冷却至室温后转移到0~4℃的条件下冰浴1 h;④将冰浴后的提取液在4 000 r/min的条件下离心5 min,取上清液,分别转移至1~8号10 ml定容管中;⑤重复②~④步骤3次,将3次提取的上清液合并,每次分别移入相同编号的定容管中,并且定容至10 ml,混匀,在波长400~700 nm的可见光范围内测定其吸光度,并且记录所测得的数值;⑥不同比例的各试验重复5次,然后将1∶1、2∶1、1∶2丙酮放在 1个试验中,重复5次。
1.3 虾青素含量的计算方法 在473 nm波长下测定最大吸光度值,以提取剂作为空白对照。如果吸光度值大于1.25,则必须对样品用提取剂稀释后再测,稀释倍数一般为1∶7。用下列公式计算所测溶液中虾青素含量:若原料为新鲜藻类培养液,则用虾青素(mg/L)=[4×OD(λ473)×丙酮的体积]/藻液的体积,叶绿素(mg/L)=[12.7×OD(λ664)-2.69×OD(λ647)]×稀释倍数;若原料为新鲜藻膏,则用虾青素(mg/g)=[4×OD(λ473)×丙酮的体积]/(鲜藻膏的质量×藻膏的干重)。
1.4 新鲜藻膏干重的测定方法 将称量纸置于培养皿中,于80℃下烘干12 h至恒重,记录称量纸的质量(m1);用胶头滴管吸取藻液,同样置于培养皿中,于80℃下烘干12 h至恒重,记录其质量(m2)。
鲜藻的干重公式为:m=m2-m1
采用该方法最终测得所用鲜藻的平均干重为(103.6±0.52)mg/g。
1.5 虾青素的吸收光谱 虾青素在不同的分光光度计下的最大吸收波长不同,所以在采用此分光光度计测定虾青素含量时,需要对虾青素的最大吸收波长的结果进行校对。采用分光光度计测定虾青素在可见光范围内的吸光光度值。经测定,发现当波长为473 nm(理论值为475)时吸收光谱达到最大。
2 结果与分析
由图1可知,乙醇/丙酮为1∶2(V/V)时虾青素的提取率为 15.59 mg/g,丙酮的提取率为15.06 mg/g,乙醇/丙酮为1∶1(V/V)时提取率为12.72 mg/g,乙醇/丙酮为2∶1(V/V)时提取率为12.47 mg/g,乙醇的提取率为 10.11 mg/g。由此可知,乙醇/丙酮为1∶2(V/V)时提取率最高,其次为丙酮。
研究表明,乙醇/丙酮为1∶2(V/V)时提取率最高。用添加乙醇来降低丙酮单独作提取剂的毒性,与丙酮作提取剂时虾青素的提取率要高,虽然与丙酮作有机溶剂相比不是特别显著,但仍达到预期效果,与乙醇作提取剂相比提高近50%倍,效果还是很明显的。
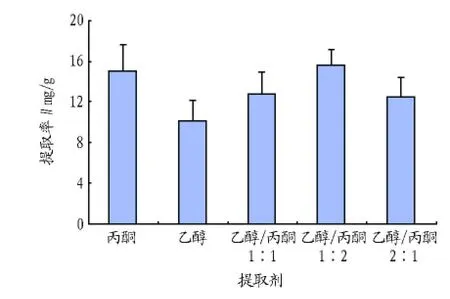
图1 不同比例有机溶剂提取率比较
目前,对虾青素的提取主要是通过有机溶剂浸提的方法。该方法操作简便易行,成本低,后期易分离和获取。常用有机溶剂是丙酮,其操作较完善和成熟。在此基础上进行的改进使得试验更具说服力。雨生红球藻在不良条件下才开始产生虾青素,同时为了度过劣势环境会产生厚壁孢子。在提取虾青素时加入丙酮和乙醇。丙酮是极性较强的溶剂,虾青素溶解度较低,亲水性溶剂乙醇渗入细胞中将虾青素溶解到有机溶剂中,从而提高提取效率,因而选择乙醇和丙酮混合作有机溶剂来提取雨生红球藻中的虾青素。这也是比较理想的有机混合溶剂。
3 结论与讨论
有机溶剂通过细胞壁渗入细胞,使得虾青素溶解在有机溶剂中,并且通过扩散作用进入有机溶剂的溶液中。这是一种固-液萃取的过程。含有虾青素的细胞是厚壁细胞。细胞壁太厚,有胶质层,便会影响有机溶剂分子进入细胞,同时影响虾青素溶液的扩散效果[12]。因此,试验前必须先进行破壁处理,破坏其细胞机构,从而利用有机溶剂将虾青素提取出来,大大提高其提取效率。
试验中,用新鲜藻膏为原料,干重为103.6 mg/g,浓度较新鲜藻液要高,提取效率有所提高,但新鲜藻膏也保存在冷冻环境。在每次试验前,都要提前将其放入保鲜环境融化,或置于室温,但要注意避光,以防止虾青素被氧化,造成试验误差。该研究对有机溶剂的比例进行优化,优化后效果明显。当乙醇/丙酮为1∶2时效果最明显,是乙醇作有机溶剂的1.5倍多,也较丙酮作有机溶剂时的效果要好些,从而筛选出最佳配比。乙醇无毒,能降低丙酮作溶剂毒性,具有更大优势。这两种溶剂均易获取,而且操作简便易行。在整个试验中,一定要注意控制温度、避光,以免使虾青素被氧化,影响提取效果。试验所用乙醇和丙酮这两种提取剂的原料廉价易得,也没有增加后续分离操作的困难,最重要的是提取效果更好。
该研究对有机溶剂比例的优化具有实际应用价值,既降低生产成本,又提高生产效率,降低毒性,提升提取率,比丙酮和乙醇单独作提取剂有更大的优势。这对日后大规模生产具有参考价值。
[1]LORENZ R T,CYSEWSKI G R.Commercial potential for Haematococcus microalgae as a natural source of astaxanthin[J].Tibtech Appil,2000,18:160-167.
[2]MIAO F P,LU D Y,LI Y G,et al.Characterization of astaxanthin esters in Haematococcus pluvialis by liquid chromatography-atmospheric pressure chemical ionization mass spectrometry[J].Analytical biochemistry,2006,352(2):176-181.
[3]孟春晓,高政权,王依涛,等.雨生红球藻中虾青素提取方法研究现状[J].水产科学,2010,29(12):745 -748.
[4]邱昌恩.6-BA对平菇和香菇菌丝体两种同工酶的影响[J].微生物学杂志,2002,22(4):89 -92.
[5]王秀奇,秦淑媛,高天慧,等.基础生物化学实验[M].北京:高等教育出版社,1999:227-232.
[6]季维智,宿兵.遗传多样性研究的原理与方法[M].杭州:浙江科学技术出版社,1999:52 -68.
[7]KANG C D,SIM S J.Directextraction of astaxanthin from Haematococcus culture using vegetable ils[J].Biotechnology letters,2008,30(3):441 -444.
[8]KRICHNAVARUK S,SHOTIPRUK A,GOTO M,et al.Supercritical carbon dioxide extraction of astaxanthin from Haematococcus pluvialis with vegetable oils as co-solvent[J].Bioresource technology,2008,99(13):5556 -5560.
[9]MACHMUDAH S,SHOTIPRUK A,GOTO M,et al.Extraction of astaxanthin from Haematococcus pluvialis using supercritical CO2and ethanol as entrainer[J].Industrial & engineering chemistry research,2006,45(10):3652 -3657.
[10]NOBRE B,MARCELO F,PASSOS R,et al.Supercritical carbon dioxide extraction of astaxanthin and other carotenoids from the microalga Haematococcus pluvialis[J].European food research and technology,2006,223(6):787-790.
[11]李婷,韩丽君,袁毅.不同有机溶剂对雨生红球藻中虾青素提取成分的影响[J].海洋科学,2012,36(7):34 -38.
[12]陈峰,姜悦.微藻生物技术[M].2版.北京:中国轻工业出版社,1999:256 -267.
