高密度固态培养产朊假丝酵母菌剂的工艺优化
2015-12-21孙立斌杨海明江连洲东北农业大学食品学院黑龙江哈尔滨50030黑龙江省轻工科学研究院黑龙江哈尔滨5000
徐 速 孙立斌 杨海明 孙 慧 江连洲(.东北农业大学食品学院,黑龙江 哈尔滨 50030;.黑龙江省轻工科学研究院,黑龙江 哈尔滨 5000)
益生菌是指有益于宿主健康的微生物活菌制剂[1]。随着抗生素滥用和残留问题的出现,益生菌剂的研究受到学术界广泛关注。已有众多实例证明,益生菌能刺激宿主肠道内生有益菌群平衡,抑制肠道中腐败菌生长[2],促进肠道中有害物质的降解与转化,调节宿主免疫力,增加抗病能力[3,4],从而提高动物的生产能力和增加养殖动物的经济效益。
产朊假丝酵母是被广泛公认的畜禽动物益生菌,早在1989年就已被美国FDA(美国食品和药品管理局)和AAFCC(美国饲料官方协会)批准为可直接饲喂动物的安全菌株,2008年中国农业部也将其列入允许饲喂的菌种目录[1]。酵母发酵饲料含有丰富的蛋白、小肽及氨基酸,增加饲料的营养价值[4];产阮假丝酵母菌体所含蛋白质和维生素B含量均较高,且生长所需营养物质更简单、可利用许多工农业副产物做原料生长繁殖[5,6],菌体代谢后常常散发出宜人的香气,可增加动物摄食欲望、提高生产能力。
中国每年加工大米、豆油、玉米后剩余大量副产物稻壳、豆粕、秸秆等,其中豆粕常用作替代玉米直接饲喂动物,原料利用率较低[6];而秸秆、稻壳常常被农民废弃或焚烧,浪费资源污染环境。J.Y.Choi等[4]研究了液态发酵益生菌剂和固态发酵益生菌剂对断奶仔猪的影响,发现在提高生产性能和肠道有益微生物菌群、降低肠道有害微生物菌群方面,固态发酵优于液态发酵。固态发酵所制益生菌更利于益生菌的保存和活性的稳定,实际应用价值则更大。目前中国因生产麸皮的企业均在河南、河北、山东、山西等地,故在东北地区利用麸皮生产饲料酵母成本较高,而以秸秆稻壳替代麸皮固态发酵制备酵母菌还未见报道。本研究拟通过正交试验、中心组合试验设计及响应面分析法优化培养条件及培养基成分,为豆粕秸秆稻壳混合制备酵母益生菌剂提供基础数据。同时,也对解决人畜争粮矛盾、减少环境污染、改善农业生态环境具有重要意义。
1 材料与方法
1.1 菌种与培养基
产阮假丝酵母2.118:黑龙江省应用微生物研究所菌种保藏中心;
酵母种子培养基:PDA液体培养基,121℃灭菌20min;
酵母菌种子液:将已活化的酵母菌斜面菌体一菌环接入PDA液体种子培养基,30℃摇床180r/min培养16h;
1.2 材料
稻壳、豆粕:购自饲料市场,豆粕粉碎过40目备用;
秸秆:取自哈市农户自然干燥贮存,粉碎平均长度1~3 mm。
1.3 试剂与仪器
NaNO3、K2HPO4、KCl、MgSO4·7H2O、FeSO4:分析纯,天津天力化学有限公司;
粉碎机:HR2168型,珠海飞利浦家庭电器有限公司;
恒温水浴锅:DK-98-1型,天津泰斯特仪器有限公司;
生化培养箱:LRH-250型,上海一恒科技有限公司;
特大容量恒温振荡器:TDHZ-2002B型,太仓市华美生化仪器厂;
超净工作台:ZHJH-1109型,深圳市朗普电子科技有限公司;
高压灭菌锅:XYRX-20型,浙江新丰医疗器械有限公司;
电热干燥箱:DHG-9240A型,上海精宏实验设备有限公司;
真空干燥箱:DZF6090型,上海精宏实验设备有限公司。
1.4 方法
1.4.1 微量元素溶液的制备
(1)1×微量元素溶液(m/V):准确称取分析纯 NaNO30.6g、K2HPO40.2g、KCl 0.1g、MgSO4·7H2O 0.1g、Fe-SO40.002g,分别用少量蒸馏水溶解、合并后定容至100 mL,即得 NaNO30.6%、K2HPO40.2%、KCl 0.1%、MgSO4·7H2O 0.1%,FeSO40.002%的1×微量元素溶液,备用。
(2)2×微量元素溶液(m/V):NaNO31.2%、K2HPO40.4%、KCl 0.2%、MgSO4·7H2O 0.2%,FeSO40.004%;3×微量元素溶液(m/V):NaNO31.8%、K2HPO40.6%、KCl 0.3%、MgSO4·7H2O 0.3%,FeSO40.006%。制备方法同1.4.1(1)。
1.4.2 秸秆添加量对酵母菌生长的影响 固定每份原料总量40g,分别将豆粕∶稻壳∶秸秆按5∶2∶1,5∶2∶2,5∶2∶3,5∶2∶4,5∶2∶5比例混匀,再分别向每份原料添加50mL水及1×微量元素溶液,葡萄糖1g,在容器中混匀封口,121℃灭菌15min,冷却,接种,铺成2cm厚度,30℃培养24h,取样,用血球计数器测定酵母菌数。每个样品重复3次取平均值。
1.4.3 稻壳添加比例对菌体数目的影响 固定每份原料总量40g,分别将豆粕∶秸秆∶稻壳按5∶2∶1,5∶2∶2,5∶2∶3,5∶2∶4,5∶2∶5比例混匀,再分别向每份原料添加50mL水及1×微量元素溶液,1g葡萄糖,在容器中混匀封口,余下步骤同1.4.2。
1.4.4 碳源对酵母菌生长的影响 取原料豆粕、秸秆和稻壳按5∶2∶2混匀,每份40g,依次加入葡萄糖1,2,3,4,5 g,再分别向每份原料添加50mL水及1×微量元素溶液,混匀,余下步骤同1.4.2。
1.4.5 氮源对酵母菌生长的影响 取原料豆粕、秸秆和稻壳按5∶2∶2混匀,每份40g,向每份原料中依次加入硫酸铵0.2,0.4,0.6,0.8,1.0g,或 尿 素 0.2,0.4,0.6,0.8,1.0g;再分别向每份原料加入50mL水及1×微量元素溶液,1g葡萄糖,余下步骤同1.4.2。
1.4.6 固态培养产朊假丝酵母活菌剂的生长曲线 取原料豆粕、秸秆和稻壳按5∶2∶2混匀,每份40g,分别向每份原料加入50mL水及1×微量元素,在容器中混匀封口,121℃灭菌15min,接种,铺成2cm厚度,30℃培养12h后每隔2 h取样,用血球计数器测定酵母菌数。每个样品重复3次取平均值。
1.4.7 正交试验确定最佳培养基成分 在碳源、氮源单因素试验基础上,对培养基成分中影响酵母菌生长数量的因素葡萄糖、硫酸铵、微量元素营养液添加倍数进行三因素三水平正交试验,以确定最佳培养基成分配比。
1.4.8 中心组合试验设计优化酵母菌固体培养条件 利用Design-Expert 7.0软件,采用中心组合设计试验方案建立关于接种量、固体培养基厚度、水分添加量和培养温度四因素变量的二次回归模型,以确定最佳培养条件,试验设计因素水平见表1。选取接种量、厚度、水分添加量和发酵温度4个因素为自变量,以酵母菌的菌数为响应值,以前期单因素试验最佳结果为中心点,根据中心组合设计原理设计试验。取5种水平自变量编码,中心点试验重复试验数为6,试验重复3次取平均值,每组试验原料用量40g。
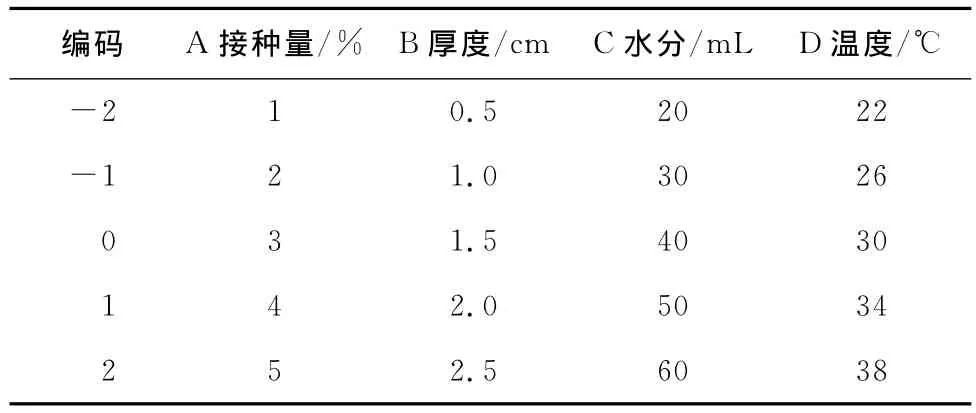
表1 中心组合试验设计因素水平编码表Table 1 Levels of independent variables of simplex-centroid design
1.4.9 酵母菌剂的干制 将最佳培养的酵母菌剂40℃真空干燥8h或常压45℃干燥24h后,平板计数测定酵母菌活菌数。重复3次取平均值。
2 结果与分析
2.1 秸秆添加比例对酵母菌生长的影响
在实际操作中,豆粕灭菌后黏度增大,容易结块,不利于氧气的传质。秸秆主要含纤维素、半纤维素、木质素等不易被酵母菌利用的成分,基质中添加适当比例的秸秆既起到机械支撑作用,又可增加培养基通透性和通气量,利于氧气的流通和酵母的增殖。由图1可知,虽然随着原料中秸秆比例的增加,酵母菌活菌数呈现下降趋势,但当秸秆比例从1/8增加到4/11时,酵母菌对数值从8.4降到8.1,活菌数从2.6×108g-1降低到1.4×108g-1,仍保持在同一数量级,说明秸秆比例增加对酵母活菌数下降并不成正比,其影响趋势较平缓。结合原料成本与活菌数量综合考虑,选择豆粕∶稻壳∶秸秆=5∶2∶2较适宜。
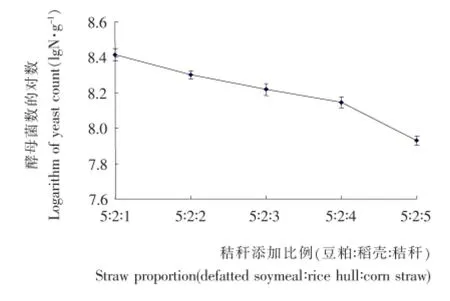
图1 秸秆添加量对酵母菌生长的影响Figure 1 Effects of corn straw on the growth of yeast
2.2 稻壳添加比例对菌种的影响
据资料[7]报道,稻壳含有大量纤维素、木质素、二氧化硅及少量的蛋白质和钙磷元素,如不经处理,应用于饲料将影响动物的消化吸收率。虽然稻壳可利用的营养成分较贫乏,但试验中发现稻壳具有良好的多孔性和吸水性,可作为固态发酵营养物质良好的载体,为固态发酵培养基提供良好的通气性和保湿性。同时试验中还观察到,培养结束时培养基表观湿度增大,分析可能是通过酵母菌的生长代谢产生了水分,增加了湿度所致。推测这将软化稻壳中纤维素等成分,释放更多的可溶性物质,增加培养基中菌体数目,从而增加菌体蛋白含量。由图2可知,随着稻壳添加量的增大,酵母菌的生长数量呈现先增加、后降低、然后趋于平稳的走势,即添加比例(豆粕∶秸秆∶稻壳)从5∶2∶1至5∶2∶2时,酵母菌对数从8.37增加到8.47,酵母菌数量从2.3×108g-1增加至3×108g-1;当增至5∶2∶3以上时,酵母菌对数在8.25~8.33,酵母数保持在1.8×108~2.15×108g-1。综合考虑,选择豆粕∶稻壳∶秸秆=5∶2∶2较为适宜。
2.3 碳源对酵母菌生长的影响
葡萄糖是酵母菌可以直接利用的碳源,在酵母生长代谢中既作为酵母菌细胞骨架,又作为代谢的能源物质。随着市场上淀粉糖生产技术的提高,葡萄糖价格不断下降,可作为酵母菌生长的辅助碳源。由图3可知,在原料比例一定的条件下,起初酵母菌的数量随着葡萄糖量的增加而增加,当葡萄糖增加到4g时,酵母菌生长数量达到最高,葡萄糖的添加量继续增高时,酵母菌数量开始下降。推测可能是随着葡萄糖添加量增加,酵母菌生长外环境碳源浓度的增大,导致酵母生长的外环境产生更高的渗透压,影响酵母菌细胞代谢的进行,致使酵母菌生长速率减缓,数量下降。因此,选择添加葡萄糖4g。
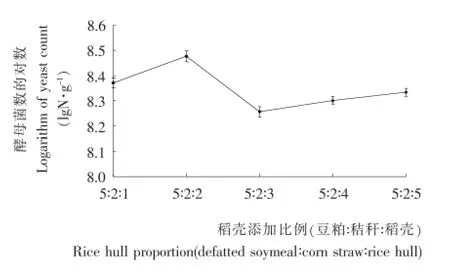
图2 稻壳添加量对酵母菌生长的影响Figure 2 Effects of rice hull on the growth of yeast
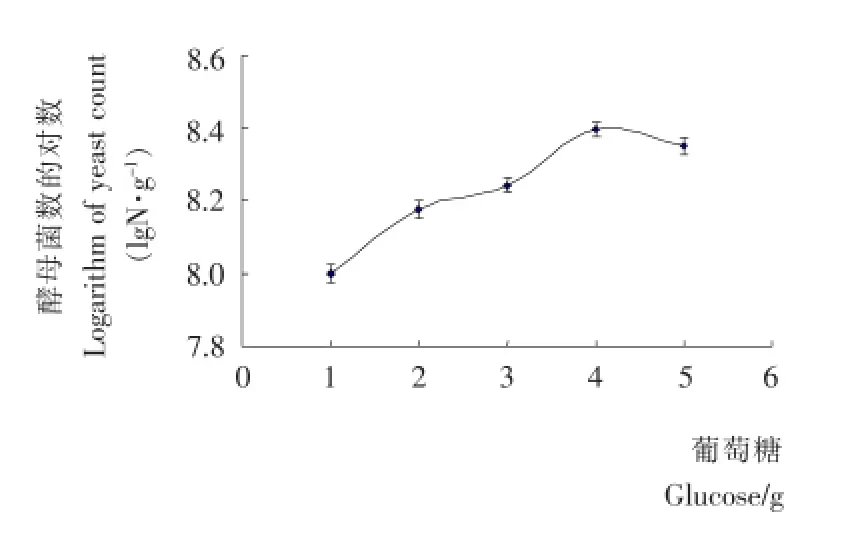
图3 葡萄糖对酵母菌生长的影响Figure 3 Effects of glucose on the growth of yeast
2.4 氮源对酵母菌生长的影响
尿素、硫酸铵、蛋白胨是常用的氮源,因蛋白胨的价格较高,而本试验的目的是通过最小的花费获得最大的酵母菌数量,所以选用尿素和硫酸铵做外加的氮源。由图4可知,添加硫酸铵的效果为先扬后平,最佳添加量为0.4g,酵母菌最大数量4.25×108g-1。而添加尿素的效果为先扬后抑,最佳添加量为0.8g,酵母菌最大数量4.0×108g-1。目前市场上尿素的价格远高于硫酸铵价格,且尿素添加量大于硫酸铵用量,不论是从经济角度还是实际效果来看,选择硫酸铵添加量0.4g更适宜。
2.5 固态培养酵母菌剂的生长曲线
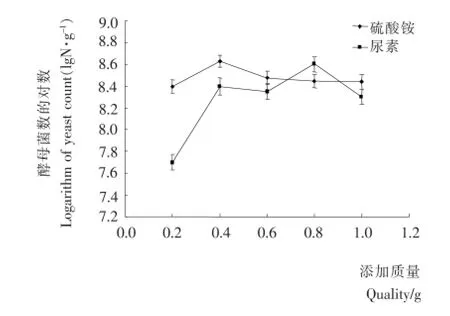
图4 氮源对酵母菌生长的影响Figure 4 Effects of inorganic nitrogen on the growth of yeast
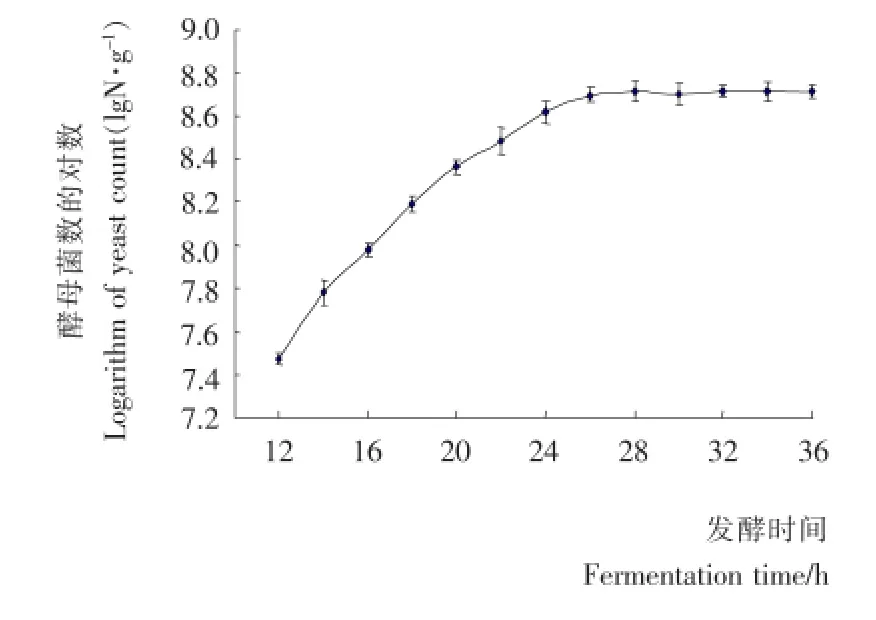
图5 酵母菌固态培养生长曲线Figure 5 The growth curve of yeast through solid-state ferment
由图5可知,当取发酵12h样品检测时,酵母菌开始进入对数生长期。当发酵时间大于28h以后,培养基中的营养成分逐渐消耗,酵母菌的生长达到平稳期。为了生产更多的酵母菌,选择26~28h终止发酵为宜。
2.6 正交试验优化培养基成分结果分析
在单因素试验基础上,通过碳源、氮源和微量元素三因素正交试验进一步优化培养基成分比例,正交试验因素水平取值见表2,结果见表3。通过极差分析可知,对酵母菌生长影响因素从大到小依次为葡萄糖>微量元素>硫酸铵。
为了检验直观分析中各因素不同水平差异是否显著,进一步采用SPSS17.0对上述影响因素进行单因素方差分析即Tukey HSD多重比较,结果显示葡萄糖水平1与水平3差异不显著,但二者均与水平2差异极显著,硫酸铵和微量元素各水平俩俩之间差异均不显著,故选择葡萄糖添加量4g、硫酸铵0.2g和微量元素1倍浓度,即A2B1CI为宜。将理论获得的A2B1CI组合重复3次实验,酵母菌数平均值(8.10±0.07)×108g-1,验证了所得组合稳定可靠。
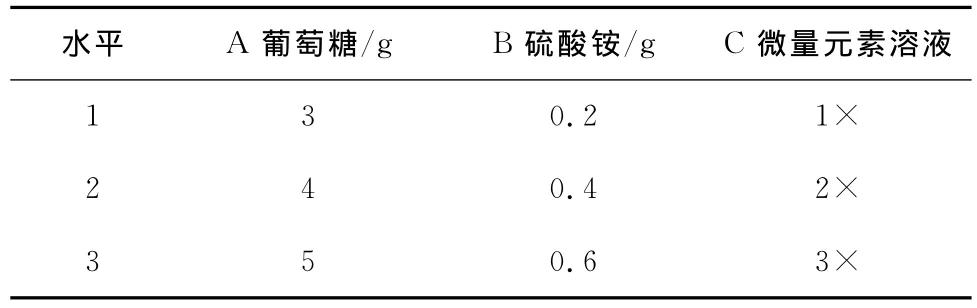
表2 正交试验因素水平表Table 2 Levels of different variables of orthogonal experiments
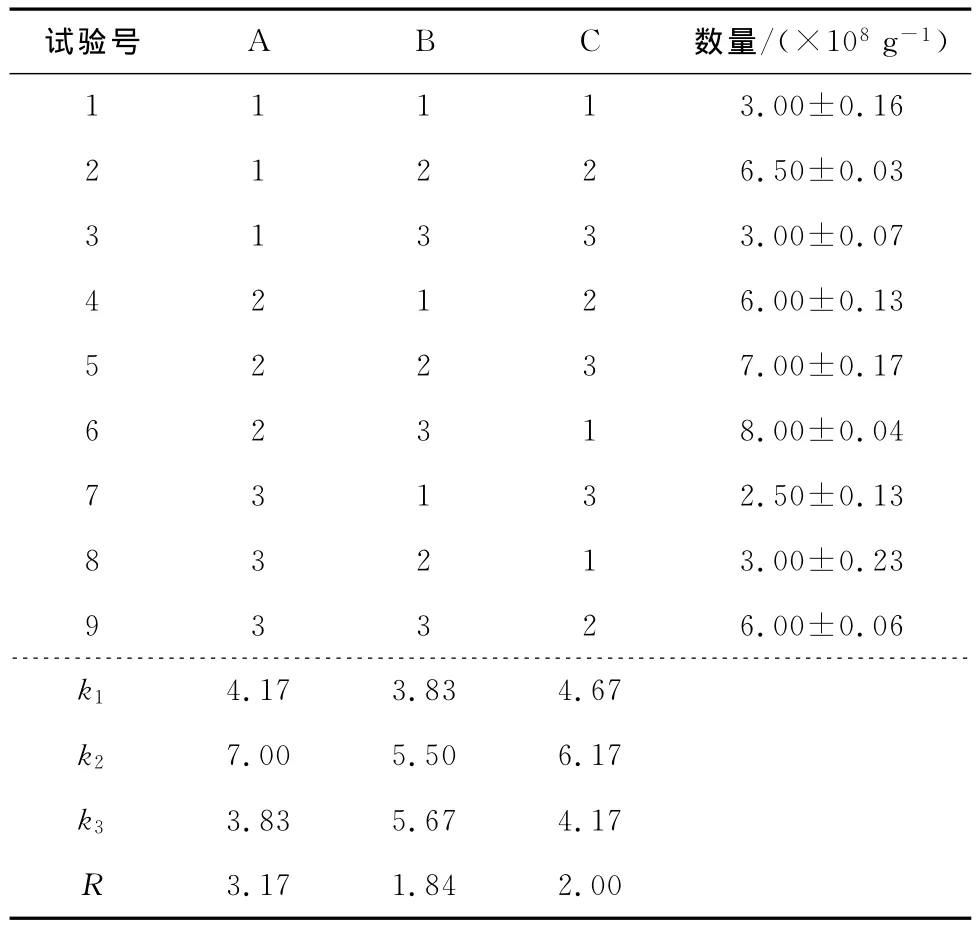
表3 正交试验结果与分析Table 3 The results and analyses of orthogonal experiment
2.7 中心组合试验设计优化酵母菌培养条件
2.7.1 中心组合试验设计及结果分析 按照1.4.8进行中心组合试验优化酵母培养条件,结果见表4。
通过Design-expert 7.0对试验数据进行回归数据分析,建立二次回归模型:
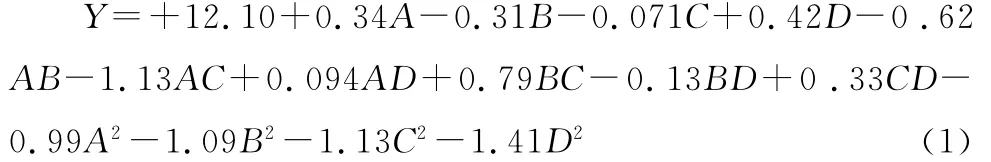
对模型数据进行方差分析,结果见表5。
由表5可知,回归模型的F值55.85,“Prob>F值”<0.000 1,说明自变量与响应值的回归关系显著;失拟项的F值为2.24、“Prob>F值”0.193 4,说明失拟项与纯误差差异不显著。该模型的决定系数R2为0.981 2,调整后的决定系数为0.963 6,变异系数5.29%。决定系数介于0至1之间,决定系数越大,说明拟合方程的参考价值越大,模型拟合度越好;变异系数越小表示试验可信度越高[8]。综上可知,所建模型拟合度良好,可以理论推测因自变量变化而对响应值的影响。
由表5中F值可知,自变量因子贡献率为D>A>B>C,即培养温度>接种量>厚度>水分添加量,即培养温度对菌种生长的影响最为显著,接种量与厚度次之,水分添加量相对影响较小。模型中自变量之间的交互作用对响应值影响明显的有AB(接种量与厚度)、AC(接种量与水分)、BC(厚度与水分)、CD(水分与温度),其3D响应面交互作用见图6~9。图6~9中的酵母菌数量均随着接种量、厚度、水分、发酵温度呈现不同程度的先增加后降低趋势。固态培养中酵母菌数的增长除了与营养成分相关外,还受氧气、水分、温度、初始菌种数量影响。酵母菌是好氧微生物,增殖需要足够的氧气,培养基厚度过大将影响氧的供应。酵母生长代谢需要一定的水分活度,水分含量越高,水分活度越大,酵母菌越易生长,但过多的水分会粘结固态培养基原料,导致氧气传质受阻,影响酵母菌生长繁殖。酵母菌生长有其最适温度,在最适温度前,随着温度升高,酵母菌生长加快,但当超过最适温度时,则影响到酵母菌自身代谢而呈下降趋势。从图6~9可以看出,图中两两因素均存在交互作用,但A(接种量)与C(水分)图形最陡,交互作用最明显。
表4 中心组合试验设计及结果Table 4 Simplex-centroid design and response values
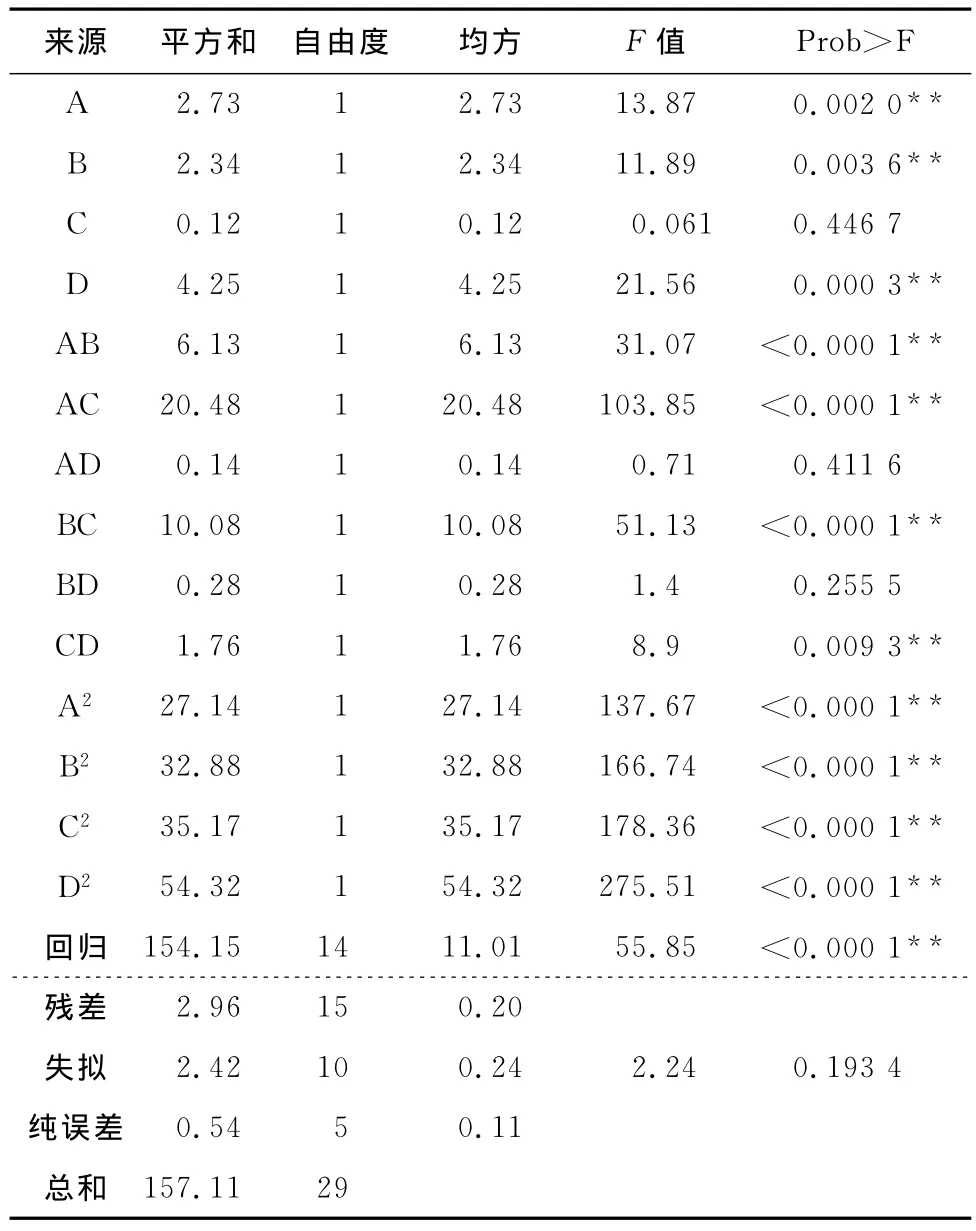
表5 中心组合试验方差分析表Table 5 ANOVA for the reduced quadratic mixture models
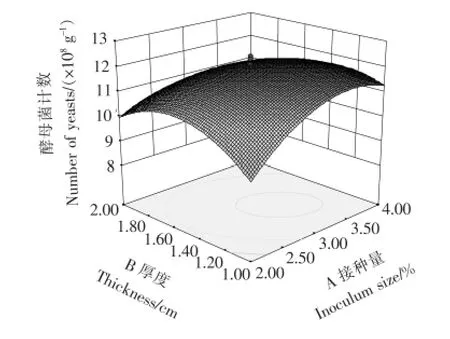
图6 接种量A与厚度B交互作用响应面三维图示Figure 6 Combined effects of inoculum size A and thickness B on yeast count
通过Design-Expert 7.0软件优化功能,得到模型的最优工艺参数和预测值:接种量3.51%,厚度1.29cm,水分36.53mL,温度30.58℃,酵母菌数理论预测值1.227×109g-1。结合实际情况,最终优化参数为接种量3.50%,厚度1.3cm,水分添加量∶原料=1∶1(m∶m),温度30.6℃。
2.7.2 验证实验 在最佳培养条件下,重复5次固体培养,平板涂布计数酵母菌数量分别为1.23×109,1.35×109,1.10×109,1.40×109,1.25×109CFU/g,平均值为(1.27±0.12)×109CFU/g,与模型预测值1.23×109CFU/g接近,说明模型拟合性较好,可以用来理论预测培养的酵母活菌数值,该模型真实有效。
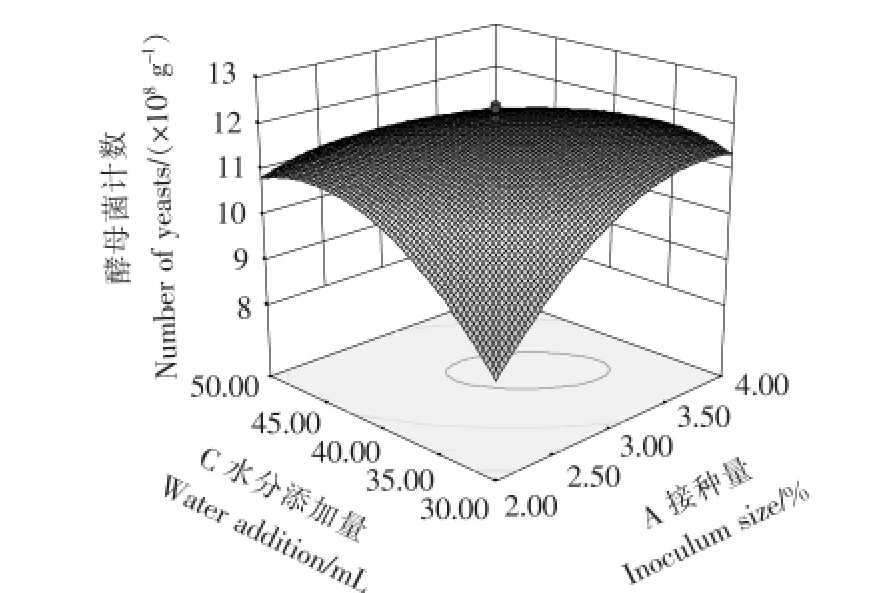
图7 接种量A与水分添加量C交互作用响应面三维图示Figure 7 Combined effects of inoculum size A and water addition C on yeast count
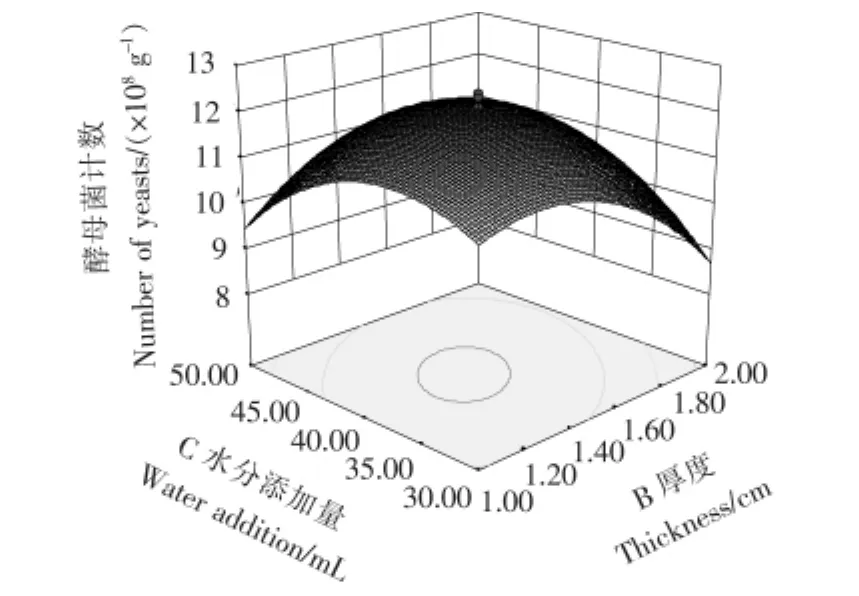
图8 厚度B与水分添加量C交互作用响应面三维图示Figure 8 Combined effects of thickness B and water addition C on yeast count
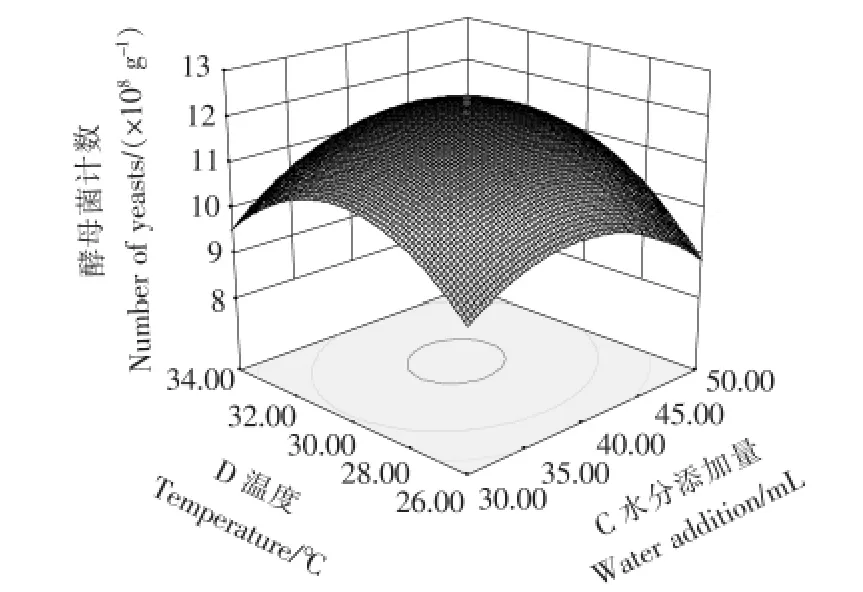
图9 水分添加量C与温度D交互作用响应面三维图示Figure 9 Combined effects of water addition C and temperature D on yeast count
2.8 酵母菌剂的干制
按最佳方法固态培养28h酵母菌数折合绝干料均值(2.92±0.05)×109CFU/g。经真空40 ℃干燥8h后测得酵母菌活菌数折合绝干料(2.34±0.03)×109CFU/g,存活率80%。常压45℃干燥24h后测得酵母菌活菌数折合绝干料(1.90±0.03)×109CFU/g,存活率65%。
3 结论
本试验开展了以秸秆稻壳替代麸皮固态培养产朊假丝酵母的研究,利用产朊假丝酵母生长条件相对简单的特点[9],采用中心组合试验设计及响应面分析法优化了酵母菌培养条件,发酵28h,酵母活菌计数(2.92±0.05)×109CFU/g绝干,试验结果表明以秸秆稻壳替代麸皮固态培养产朊假丝酵母效果良好。
目前,以豆粕、麸皮为原料,利用酵母菌或复合菌种固态发酵提高原料蛋白含量的研究居多,而利用豆粕为主要原料制备活性酵母菌剂的报道较少。杨世平等[10]利用豆粕、麸皮、红糖、酵母膏等培养沼泽生红冬孢酵母,虽然所获酵母活菌数较高,但成本偏高,发酵时间偏长。相比之下,本试验更注重低成本和短时间,且原料更切合北方实际,具有潜在的应用价值。本试验常压干制,适合中小企业的应用;真空干燥,更适宜投资大的企业应用。
Mitchell等[11]认为固态发酵中存在传热传质的问题,为此,在小试基础上扩大生产应进一步摸索参数,可通过改善通风等因素,进一步提高供氧能力,以提升酵母活菌数量,摊薄生产成本,制备高效廉价的酵母益生菌剂。
1 胡学智,王俊.益生菌饲料的现状、生产和应用效果[J].中国微生态学杂志,2011,23(9):861~864.
2 Melanie Le Bon,Helen E Davies,Caitriona Glynn,et al.Influence of probiotics on gut health in the weaned pig[J].Livestock Science,2010(133):179~181.
3 Francesca Gaggìa,Paola Mattarelli,Bruno Biavati.Probiotics and prebiotics in animal feeding for safe food production[J].International Journal of Food Microbiology,2010(141):S15~S28.
4 Choi J Y,Shinde P L,Ingale S L,et al.Evaluation of multi-microbe probiotics prepared by submerged liquid or solid substrate fermentation and antibiotics in weaning pigs[J].Livestock Science,2011(138):144~151.
5 M Ibrahim Rajoka,Sohail Hassan Khan,M A Jabbar,et al.Kinetics of batch single cell protein production from rice polishings withCandida utilisin continuously aerated tank reactors[J].Bioresource Technology,2006(97):1 934~1 941.
6 李永凯,毛胜勇,朱伟云.益生菌发酵饲料研究及应用现状[J].畜牧与兽医,2009,41(3):90~92.
7 陈洪章,徐建.现代固态发酵原理与应用[M].北京:化学工业出版社,2004:38.
8 陶发琴,王明鹏,王卫星,等.响应面法优化酵母油脂的提取工艺[J].中国粮油学报,2013,28(4):51~58.
9 Guo Hong-wei,Chang Juan,Yin Qing-qiang,et al.Effect of the combined physical and chemical treatments with microbial fermentation on corn straw degradation[J].Bioresource Technology,2013(148):361~365.
10 杨世平,刘慧玲,刘付文.沼泽生红冬孢酵母的固体培养条件[J].广东海洋大学学报,2013,33(3):22~26.
11 Gélinas P,Barrette J.Protein enrichment of potato processing waste through yeast fermentation[J].Bioresource Technology,2007(98):1 138~1 143.
