油茶叶中黄酮的超声辅助提取及其抗氧化活性研究
2015-12-21曹清明邬靖宇钟海雁包莉圆孙亚娟中南林业科技大学食品科学与工程学院湖南长沙40004经济林培育与保护省部共建教育部重点实验室湖南长沙40004
曹清明 邬靖宇 钟海雁 包莉圆 孙亚娟(.中南林业科技大学食品科学与工程学院,湖南 长沙 40004;2.经济林培育与保护省部共建教育部重点实验室,湖南 长沙 40004)
油茶叶富含黄酮类化合物[1,2],其黄酮类物质的母核主要为山奈酚[3]和槲皮素[1,3],且与之结合的糖基主要是鼠李糖、半乳糖和葡萄糖[3]。油茶叶黄酮提取物具有抗氧化[4]、抑菌[5,6]、防腐保鲜[7]和降血脂[8]等功能作用。每年4、5月间油茶树打叶产生大量的落叶,但目前此类资源仍未得到有效利用。从油茶叶中提取黄酮类化合物,可提高油茶资源的综合利用率。
超声辅助提取可在较低温度下高效率地萃取物质中的活性成分[9,10],用超声辅助从油茶叶中提取黄酮的研究也有报道,但往往存在溶剂消耗量大、耗时、耗能等缺点。如:张建良等[1]利用甲醇从油茶叶中提取得到了黄酮;李姣娟等[4]以体积分数为60%的乙醇为提取剂,在固液比1︰20(m︰V),提取温度80℃,提取2次,每次提取2h的条件下提取油茶叶黄酮,其得率为48.7mg RE/g;肖新生等[11]采用超声波辅助萃取法,在乙醇浓度60%,提取时间20min,料液比1︰20(m︰V),超声波功率450W的条件下得到的粗黄酮得率为4.17%;黄陈陈[6]选用超声波辅助提取与有机溶剂萃取相结合的方法,采用正交试验方法确定了油茶叶黄酮最佳提取条件,即在料液比1︰20(m︰V)时以75%乙醇为提取剂,在75℃温度下萃取70min,黄酮得率为46.82mg RE/g。李姣娟等[4]的方法尽管得率最高,但其所用的时间长,提取温度高;肖新生等[11]的方法得率较低;黄陈陈[6]的提取方法使用有机溶剂乙醇浓度大,为了克服上述不足,本研究拟对油茶叶黄酮的超声辅助提取工艺进行优化,并对其提取物进行抗氧化能力试验,旨为油茶叶的综合开发利用提供试验依据。
1 材料与方法
1.1 材料
1.1.1 试验原料
新鲜油茶叶:采自湖南省天际岭国家森林公园,由中南林业科技大学谭晓凤教授鉴定为普通油茶(Camellia Oleif-era Abel.)。
1.1.2 试剂芦丁标准品:HPLC纯,纯度>97%,美国Sigma公司;1,1-二苯基-2-苦味酰基苯肼(DPPH):HPLC纯,美国Sigma公司;
2 ,2-联 氮-二 (3-乙 基-苯 并 噻 唑-6-磺 酸 )二 铵 盐(ABTS):美国Sigma公司。
1.1.3 仪器
721可见分光光计,A-1402017型,上海菁华科技仪器有限公司;
旋风式样品磨:FOSS CT410型,苏州安创仪器有限公司;
旋转蒸发仪:R-205B型,上海申胜仪器公司;
恒温水浴锅:DZKW-S-8型,北京市永光明医疗仪器厂;
超声波清洗器:AS10200A型,天津奥特赛恩斯仪器有限公司。
1.2 油茶叶黄酮类化合物的提取
1.2.1 芦丁标准曲线的确定 准确称取0.007 2g芦丁标准品,用50%乙醇溶解后转移至50mL棕色容量瓶,用50%乙醇定容,即得144μg/mL的芦丁标准母液。分别取芦丁母液2.0,4.0,6.0,8.0,10.0mL至5个25mL棕色容量瓶中,分别向容量瓶中加入质量分数为5%的NaNO20.6mL,摇匀后静置6min,往各容量瓶中加入质量分数为10%的Al(NO3)30.6mL,摇匀后放置6min,加入1mol/L的 NaOH溶液8mL,用50%乙醇溶液定容,得芦丁标准溶液浓度依次为11.52,23.04,34.56,46.08,57.60μg/mL。将配好的芦丁标准溶液静置15min,于510nm波长处测吸光值,并以50%乙醇水溶液做参比。根据吸光值绘制标准曲线。
1.2.2 油茶叶黄酮类物质的提取 称取5.000g自然阴干的油茶叶粉末,加入一定体积的乙醇—水提取液。放入超声波清洗机(功率为300W)内进行超声辅助提取。提取一定时间后用定性滤纸过滤获得上清液,重复提取若干次,合并所得上清液,浓缩定容至250mL即为黄酮提取溶液。
1.2.3 油茶叶中黄酮提取率的测定 取1.2.2获得的黄酮提取液5mL于25mL容量瓶中,加质量分数为5%的NaNO20.6mL,摇匀后静置6min,加入质量分数为10%的Al(NO3)30.6mL,摇匀后放置 6min,加入 1mol/L 的NaOH溶液8mL,用50%乙醇溶液定容,15min后于510 nm处测定吸光值。以50%乙醇水溶液做参比。根据标准曲线、稀释倍数、样品质量得到总黄酮提取量,并按式(1)计算黄酮类化合物的提取量。黄酮提取量以与等量芦丁标准品(rutin equivalent,RE)相当的生物活性计。

式中:
P——油茶叶黄酮的提取量,mg RE/g;
C——通过标准曲线得到的黄酮浓度,μg/mL;
V——黄酮提取物的体积,mL;
n——稀释倍数;
m——油茶叶样品的质量,g。
1.3 油茶叶黄酮类物质提取工艺的优化
根据前期单因素试验的结果,选择超声处理时间、料液比、提取温度、乙醇浓度为试验因素,以黄酮提取量作为优化指标,进行L9(34)的正交试验。正交试验因素水平见表1。
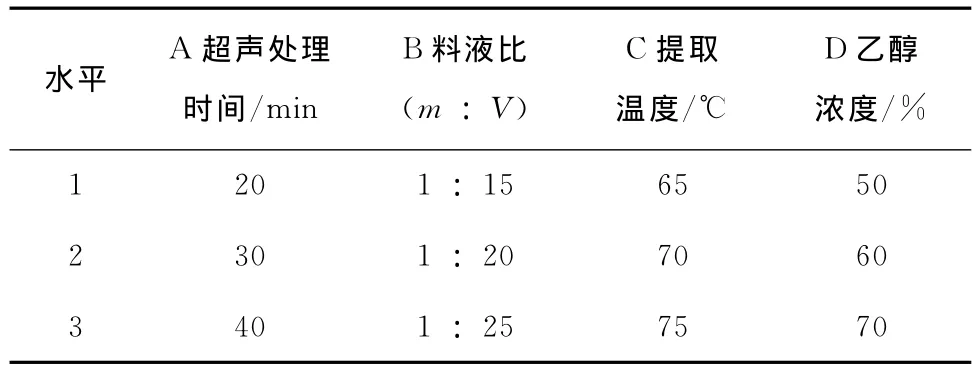
表1 因素水平Table 1 Levels of factors
1.4 油茶叶中黄酮类物质的抗氧化能力
以优化工艺得到的提取液作为原液,按其黄酮含量用蒸馏水稀释成10,20,30,40,50,60,70,80,90,100μg RE/mL,将不同浓度的黄酮提取液进行DPPH·和ABTS+自由基清除试验;按其黄酮含量用蒸馏水稀释成100,200,300,400,500,600,700,800,900,1 000μg RE/mL,将不同浓度的黄酮提取液进行羟自由基清除试验。
1.4.1 DPPH·清除能力 根据文献[12]的方法,略作修改:精密称取19.716mg DPPH粉末,用无水乙醇配制成1×10-4mol/L的DPPH·乙醇溶液。量取不同浓度的黄酮样液1mL,加入DPPH·乙醇溶液3mL,混匀,室温下避光15 min,以无水乙醇调零,517nm处测量吸光值为A1,以无水乙醇代替黄酮样液测定吸光值为A0,无水乙醇代替D PPH·乙醇溶液测定吸光值为A2。按上述方法测定相同浓度的没食子酸、BHT、Vc的DPPH·清除率,比较提取样液与BHT、Vc的DPPH·清除能力。每组试验重复3次。DPPH·清除率按式(2)计算:
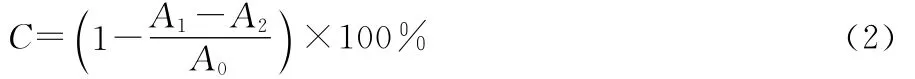
式中:
C——DPPH·清除率,%;
A1——各浓度黄酮提取液与DPPH·乙醇溶液反应后的吸光值;
A2——无水乙醇代替DPPH·乙醇溶液反应后的吸光值;
A0——无水乙醇代替黄酮样液与DPPH·乙醇溶液反应后的吸光值。
1.4.2 ABTS+清除能力 根据文献[13]的方法,略作修改:将7mmol/L的 ABTS和2.45mmol/L的过硫酸钾溶液,按体积比1︰2混合,在4℃冰箱中静置16~18h,制得ABTS+储备液。将储备液用无水乙醇稀释成在734nm波长处吸光值为0.700±0.020的工作液。准确量取0.1mL不同浓度(10~100μg/mL)的黄酮样液于10mL试管中,同时向试管中加入ABTS+工作液2.9mL,常温下避光反应6 min后,测定734nm波长处的吸光值A1;蒸馏水代替黄酮样液,测定吸光值A0;蒸馏水代替ABTS+工作液,测定吸光值A2。用上述方法测定相同浓度的BHT、Vc的ABTS+清除率,比较油茶叶提取液与没食子酸、BHT、Vc的ABTS+清除能力。每组试验重复3次。ABTS+清除率按式(3)计算:
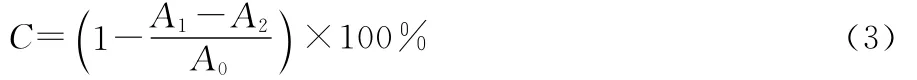
式中:
C——ABTS+清除率,%;
A1——各浓度黄酮提取液与ABTS+工作液反应后的吸光值;
A2——无水乙醇代替ABTS+工作液反应后的吸光值;
A0——无水乙醇代替黄酮样液与ABTS+工作液反应后的吸光值。
1.4.3 ·OH清除能力 用移液枪移取6mmol/L的硫酸亚铁溶液和6mmol/L的过氧化氢溶液各1mL于离心管中,将两者混合均匀后向混合溶液中加入1mL不同浓度的提取液(0.1~1.0mg/mL),静置10min,加入6mmol/L水杨酸溶液1mL,37℃水浴震荡30min,4 000r/min离心10 min,得上清液,将上清液于510nm波长处测定吸光值A1;蒸馏水代替样品液,测定吸光值A0;蒸馏水代替水杨酸,测定吸光值A2。用上述方法测定相同浓度的芦丁、BHT、Vc的·OH清除率,比较油茶叶提取液与BHT、Vc的·OH清除能力。每组试验重复3次。·OH清除率按式(4)计算:

式中:
C——·OH清除率,%;
A1——各浓度黄酮提取液与·OH反应后的吸光值;A2——无水乙醇代替水杨酸反应后的吸光值;
A0——无水乙醇代替黄酮样液与·OH反应后的吸光值。
1.5 数据分析与统计
试验数据的统计,回归方程的拟合用Excel完成,方差分析使用SPSS 17.0。以P<0.05作为显著性判断标准,结果以平均值±标准差表示。
2 结果与分析
2.1 芦丁标准工作曲线的确定
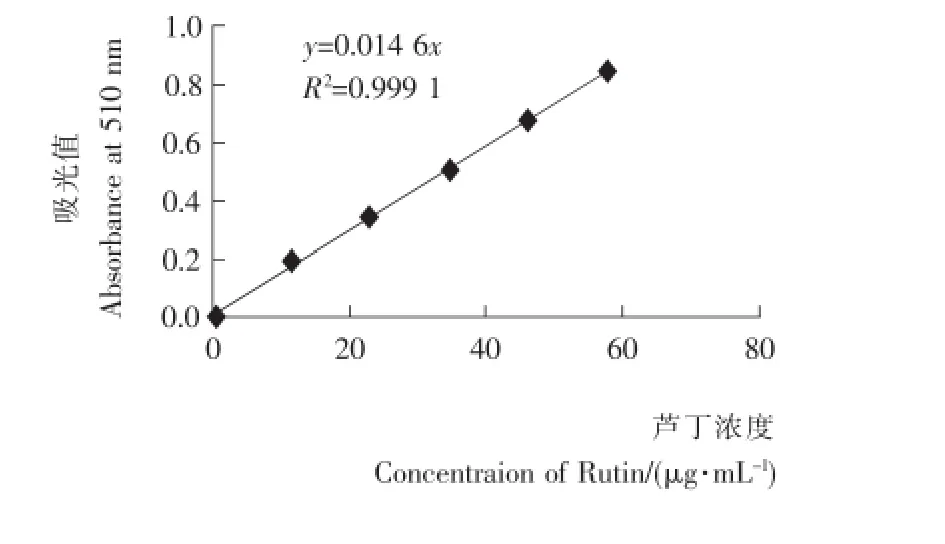
图1 芦丁标准曲线Figure 1 Rutin standard curve
芦丁的浓度与吸光度值的标准曲线见图1,回归方程为y=0.014 6x,R2=0.999 1(x为总黄酮浓度,μg/mL;y为吸光值),芦丁标准溶液在0.00~57.60μg/mL浓度范围内,浓度与吸光值存在良好线性关系,该线性方程可以用来测定提取液中黄酮类化合物的含量。
2.2 正交试验结果与分析
选择超声处理时间、料液比、提取温度、乙醇浓度4个因素进行正交试验优化,结果见表2。
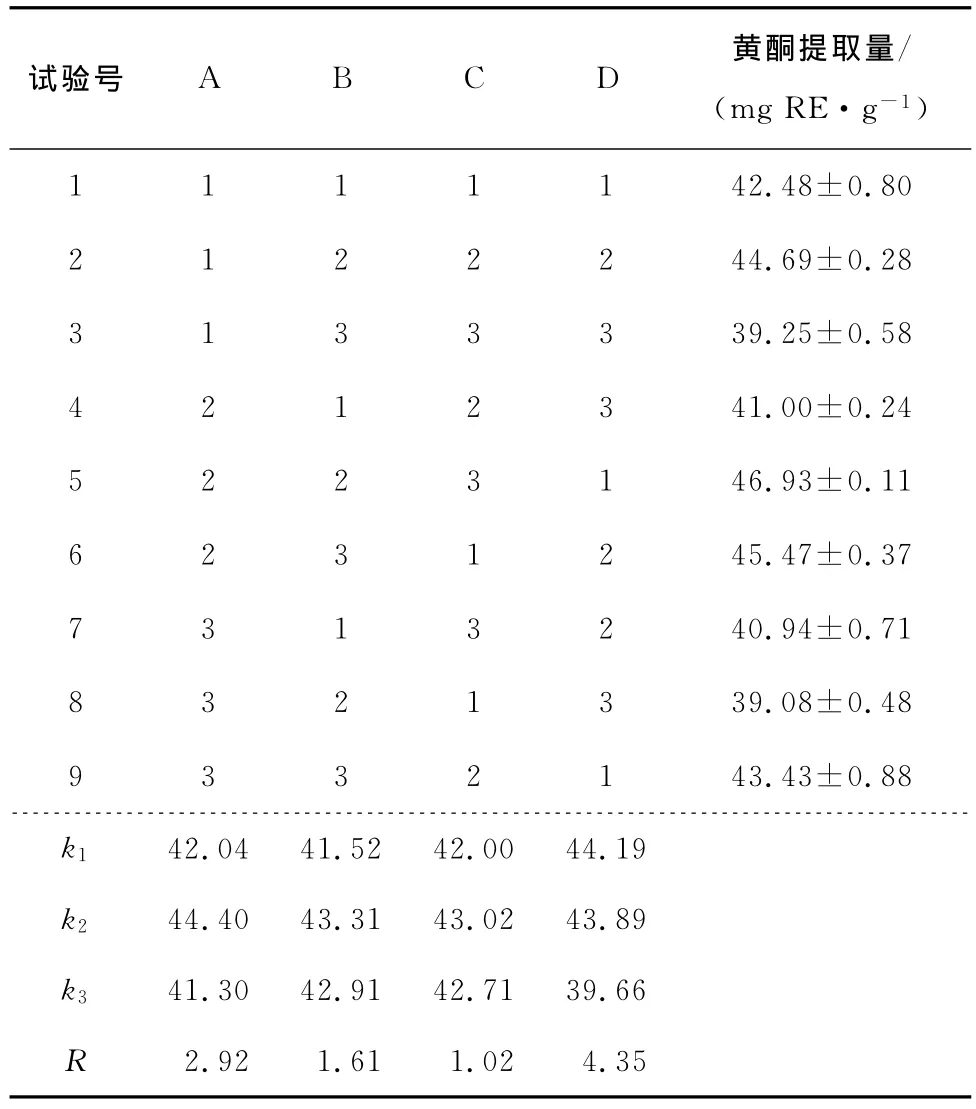
表2 正交试验结果Table 2 The results of orthogonal experiments(n=3)
由表2可知,在9次正交试验中以第5次试验中黄酮提取量最多,为46.93mg RE/g,第8次试验黄酮提取量最少,为39.08mg RE/g。直观分析表明超声处理时间、料液比、提取温度和乙醇浓度4个因素对黄酮提取量的影响大小次序为:乙醇浓度>超声处理时间>料液比>提取温度。综合各因素的k值和极差R比较,得出超声辅助提取法的最佳工艺条件为A2B2C2D1,即超声处理时间30min,料液比1∶20(m︰V),提取温度70℃,乙醇浓度50%。

表3 方差分析结果Table 3 The results of variance analysis
由表3可知,超声处理时间、料液比和乙醇浓度3个因素的不同水平对黄酮提取率的影响极显著(P<0.01),提取温度对黄酮提取率的影响显著(P<0.05)。由表4可知,选择超声处理时间30min,料液比1︰20(m︰V),提取温度70℃,乙醇浓度50%,可取得最佳提取效果。综合考虑各因素,得出超声辅助提取法上的最佳工艺条件为A2B2C2D1。比较正交试验的极差分析和方差分析结果,可以得出相同的结论。
表4 因素各水平结果的多重比较Table 4 Multiple comparison results of different levels of Factors
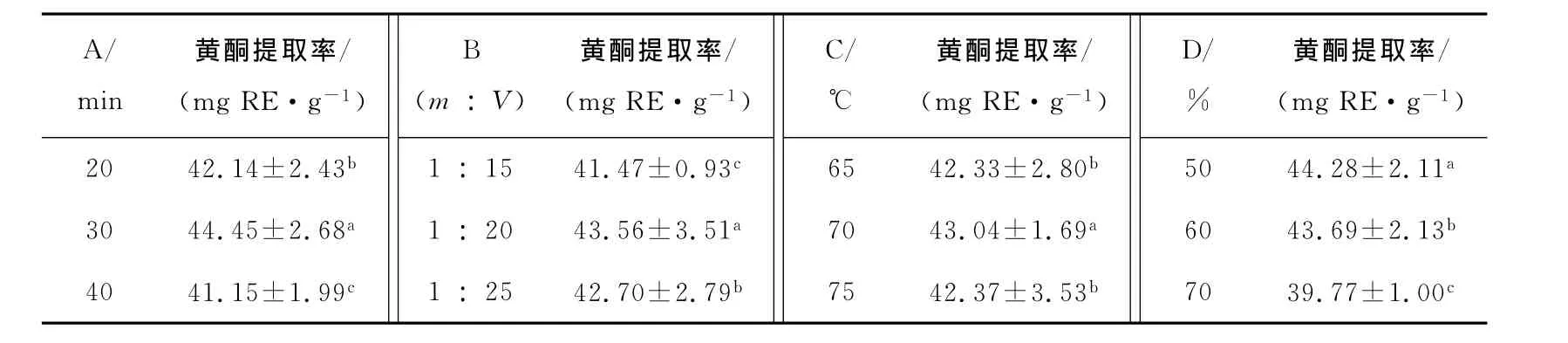
表4 因素各水平结果的多重比较Table 4 Multiple comparison results of different levels of Factors
同列不同小写字母表示差异显著(P<0.05)。
A/min黄酮提取率/(mg RE·g-1)B(m︰V)黄酮提取率/(mg RE·g-1)C/℃黄酮提取率/(mg RE·g-1)D/%黄酮提取率/(mg RE·g-1)20 42.14±2.43b 30 44.45±2.68a 40 41.15±1.99c 1︰15 41.47±0.93c 1︰20 43.56±3.51a 1︰25 42.70±2.79b 65 42.33±2.80b 70 43.04±1.69a 75 42.37±3.53b 50 44.28±2.11a 60 43.69±2.13b 70 39.77±1.00c
对选择的最佳提取方案A2B2C2D1,即超声处理时间30 min,料液比1︰20(m︰V),提取温度70℃,乙醇浓度50%,进行验证实验,采用 NaNO2—Al(NO3)3—NaOH 比色法测定黄酮含量,获得的提取率为47.01mg RE/g。结果与正交试验方案中的试验号为5的结果(46.93mg RE/g)基本一致,说明正交试验所获最佳方案的准确性。
2.3 油茶叶黄酮的抗氧化能力
2.3.1 DPPH·清除能力 DPPH·具有自由电子,有强氧化性,易被抗氧化剂还原。由图2可知,提取物、VC均具有很强的DPPH·清除能力,BHT的清除能力相对较差。前两者在较低浓度时清除率就达到90%,超过该浓度(约30μg/mL)后DPPH·清除率变化趋于平衡。选用浓度为0,10,20,30 μg/mL 4个点进行线性拟合,由Excel拟合出油茶叶黄酮浓度与DPPH·清除率的回归拟合方程为y=3.307 6x(R2=0.913 5),将y=50代入该方程,求得半数自由基清除值(IC50)为15.12μg/mL。

图2 不同浓度的提取物、BHT、VC的DPPH·清除率Figure 2 The DPPH free racial-scavenging capacity of Extract,BHT & VCin different concentrations
2.3.2 ABTS+清除能力 ABTS+可以与抗氧化剂反应褪去颜色,试验通过向反应器中加入不同浓度的提取物、VC及BHT,根据反应器中颜色的减弱情况来计算自由基的清除率。由图3可知,样品、VC及BHT均具有ABTS+清除能力,且其清除能力与浓度呈正相关。相同浓度的3种物质中BHT清除率最低。在整个试验浓度范围内油茶叶提取物的ABTS+清除率均高于BHT的清除率,但低于VC的清除率。由Excel拟合出油茶叶提取物浓度与ABTS+清除率的回归拟合方程为y=2.364x(R2=0.989),将y=50代入该方程,求得半数自由基清除值(IC50)为21.15μg/mL。

图3 不同浓度提取物、BHT、VC的ABTS+清除率Figure 3 The ABTS free radical-scavenging capacity of Extract,BHT & VCin different concentrations
2.3.3 ·OH清除能力 H2O2能与Fe2+发生Fenton反应生成活性很强的·OH,·OH能杀死红细胞,降解DNA、细胞膜和多糖化合物,对人体有一定的危害作用。本试验以VC及BHT对参照探究油茶叶黄酮提取物对该自由基的清除效果。由图4可知,3种物质都具有一定的·OH清除能力,随着浓度的增加,·OH清除率增加,当浓度达到某一值后清除率趋于稳定。各个浓度提取样品的·OH清除率都比BHT高,与VC相当。由Excel拟合出油茶叶黄酮浓度与·OH清除率的回归拟合方程为y=0.122x(R2=0.944),将y=50代入该方程,求得半数自由基清除值(IC50)为410.00μg/mL。

图4 不同浓度提取物、BHT、VC清除羟自由基能力Figure 4 The Hydroxyl free racial-scavenging capacity of Extract,BHT & VCin different concentrations
3 结论
本研究优化了油茶叶黄酮的超声提取工艺,其最优工艺条件为:以50%乙醇溶液为提取剂,料液比1︰20(m︰V),提取温度70℃,超声功率300W,提取2次,每次30min,该条件下总黄酮得率为47.01mg RE/g。说明试验采用正交分析法优化油茶叶中总黄酮的提取具有实际可行性,可为油茶叶的综合开发利用提供参考依据。该结果比肖新生等[11](4.17%)和黄陈陈[6](46.82mg RE/g)的高,原因可能与采收期、粉碎粒径等有关,还需进一步的研究。本试验中采用的微波功率为300W,乙醇浓度为50%,与肖新生等[11]的(450W和60%乙醇)相比,节省了能量和有机溶剂,与黄陈陈[6]的(75%乙醇)节省了有机溶剂。
体外抗氧化试验表明,油茶叶黄酮有很强的DPPH·、ABTS+及·OH 清除活性,IC50分别为15.12,21.15,410.00μg RE/mL。对于其活性的深入研究可以考虑进行动物试验。
随着油茶叶研究的不断深入,多种萃取方法联用,其提取率将大大提高,且节能环保。油茶叶黄酮提取物可以作为新型的天然食品防腐剂加以开发利用,不仅可以减少对环境的污染,还可以提高油茶业的收入。
1 张建良,裘爱泳.油茶叶中油脂抗氧成分研究[J].无锡轻工业学院学报,1990,9(3):37~42.
2 张婷,刘海燕,邹天才.贵州8种野生山茶叶片主要化学成分的含量[J].贵州农业科学,2010,38(11):78~80.
3 陈跃龙,冯宝民,唐玲,等.油茶叶的化学成分[J].沈阳药科大学学报,2010,27(4):292~294.
4 李姣娟,龚建良,周尽花,等.油茶叶总黄酮的提取及其抗氧化活性研究[J].食品研究与开发,2008,29(12):93~96.
5 黄陈陈,丁之恩,杨松,等.油茶叶黄酮类化合物清除自由基及抑菌作用研究[J].粮食与油脂,2011(12):12~15.
6 黄陈陈.油茶叶黄酮、油茶籽多酚的提取分离及部分特性研究[D].合肥:安徽农业大学,2012.
7 肖新生,周洁,胡绍文.油茶叶提取物对青提保鲜作用的研究[J].湖南农业科学,2011(1):94~96.
8 彭凌,朱必凤,刘主.油茶肉质果和肉质叶提取液降血糖及抗氧化作用的实验研究[J].中国药理学通报,2007,23(12):1 679~1 680.
9 朱晓阳,钟海雁,周波,等.油茶籽多酚超声辅助提取的响应面优化[J].食品与机械,2012,28(1):166~170.
10 杜若源,谢晶,王婷,等.超声波辅助提取银杏叶中总黄酮的工艺优化[J].食品与机械,2015,31(1):167~170.
11 肖新生,张敏,袁先友,等.油茶叶中黄酮类物质的提取及纯化工艺研究[J].中国食品添加剂,2012(4):93~97.
12 Liu Hai-ying,Qiu Nong-xue,Ding Hui-huang,et al.Polyphenols contents and antioxidant capacity of 68Chinese herbals suitable for medical or food uses[J].Food Research International,2008,41(4):363~370.
13 Arnao M B,Cano A,Acosta M.The hydrophilic and lipophilic contribution to total antioxidant activity[J].Food Chemistry,2001,73(2):239~244.
