超声波辅助酸性缓冲液浸提木枣多糖的工艺优化
2015-12-21李环宇李五霞王晓琴杜丽娟冀晓龙西北农林科技大学食品科学与工程学院陕西杨凌700上海交通大学农业与生物学院上海000
李环宇 王 敏 李五霞 王晓琴 杜丽娟 冀晓龙(.西北农林科技大学食品科学与工程学院,陕西 杨凌 700;.上海交通大学农业与生物学院,上海 000)
木枣(Zizyphus jujubacv.Muzao)为鼠李科植物枣的果实,盛产于山西省吕梁地区和陕西省榆林地区,作为中草药被广泛使用。枣中富含糖类、皂苷、生物碱等多种生物活性物质[1]。研究证实,枣多糖具有抗肿瘤[2]、抗氧化[3]、调节机体免疫力[4]等功效。
近年来,人们围绕木枣多糖的抗小鼠运动疲劳活性[5,6]展开了深入细致的研究,而木枣多糖的提取是对其功能进行研究的基础,目前专门针对木枣多糖提取工艺优化的报道还比较少。酶法和水提法是木枣多糖提取的常规方法[5-7],然而它们均存在耗能大、时间长、效率低等缺点,亟需得到改进优化。杨春等[8]采用超声波辅助传统水浸提法提取木枣多糖,但该研究料液pH取值范围局限于偏中性和碱性,没有考虑酸性条件对多糖提取效果的影响。樊君等[9]研究发现以缓冲液作为提取剂较传统水提法在动力学上占优势,提取率也较高。所以本试验拟采用柠檬酸盐缓冲液作为提取溶剂,利用单因素试验和响应面法优化木枣多糖的超声波辅助提取工艺,旨在为木枣多糖的进一步研究提供参考。
1 材料与方法
1.1 材料与试剂
木枣:陕西省榆林市佳县;
柠檬酸、柠檬酸钠:分析纯,天津市博迪化工有限公司;
重蒸酚:分析纯,北京索莱宝科技有限公司;
浓硫酸:分析纯,四川西陇化工有限公司;
乙醇:分析纯,国药集团化学试剂有限公司。
1.2 主要仪器与设备
数控超声波清洗器:KQ-700DE型,昆山市超声仪器有限公司;
紫外—可见分光光度计:721型,上海光谱仪器有限公司;
旋转蒸发器:SHZ-Ⅲ型,上海亚荣生化仪器厂;
低速离心机:KDC-40型,科大创新股份有限公司中佳分公司;
精密pH计:HS-3C型,上海大普仪器有限公司;
真空冷冻干燥机:ZL-1型,上海医疗器械高等专科学校试验厂。
1.3 方法
1.3.1 超声波辅助柠檬酸盐缓冲溶液浸提木枣多糖工艺
枣粉→加入柠檬酸—柠檬酸钠缓冲溶液→超声波辅助提取→离心→浓缩→脱蛋白→透析→浓缩→无水乙醇沉淀→冻干→木枣多糖
1.3.2 操作要点
(1)样品预处理:选择全熟期的木枣鲜果,剔除残次果,清洗、沥干后人工去核、60℃干燥处理,粉碎后过60目筛,再经80%乙醇回流脱脂后风干,得到的枣粉密封保存备用。
(2)缓冲溶液的配制:分别配制0.1mol/L的柠檬酸及柠檬酸钠溶液,并按比例配成不同pH的缓冲液。
(3)离心:转速为3 500r/min,时间10min。
(4)浓缩:采用旋转蒸发仪,温度45℃,将提取液处理至原体积的1/3。
(5)脱蛋白:采用传统Sevag法脱蛋白,Sevag试剂(氯仿︰正丁醇=4︰1)与提取液体积比为3︰1,重复操作5次。
(6)透析:采用透析袋(Mw<3 500Da),流水透析48h。
(7)冻干:首先将样液置于-60℃冰箱中预冻6h,然后置于冷冻干燥机处理24h。
1.3.3 多糖含量测定 采用苯酚—硫酸法[10]。
1.3.4 多糖提取率计算 为了便于操作,将提取液离心处理,直接测定上清液中的多糖含量。将其与枣粉质量的比值定义为多糖提取率,并由此作为多糖提取效果的衡量标准[11],多糖提取率按式(1)计算:

式中:
W——木枣多糖提取率,%;
ρ——葡萄糖质量浓度,mg/mL;
V——缓冲溶液的体积,mL;
n——测定时多糖液的稀释倍数;m——脱脂后枣粉的质量,g。
1.3.5 单因素试验设计 称取2.0g枣粉置于小烧杯中,在其他条件相同的情况下,分别以柠檬酸盐溶液pH、提取温度、提取时间、超声波功率、液料比为单因素进行超声辅助缓冲液浸提木枣多糖试验,以木枣多糖提取率为响应值,逐个考察不同条件对提取效果的影响。
(1)柠檬酸盐溶液pH值的选择:设定超声波功率420 W,提取时间50min,提取温度50℃,液料比25︰1(V︰m),比较pH 分别为3.2,4.0,4.8,5.6,6.4时的多糖提取率。
(2)提取温度的选择:设定超声波功率420W,提取时间50min,pH 5.6,液料比25︰1(V︰m),比较提取温度分别为40,50,60,70,80℃时的多糖提取率。
(3)提取时间的选择:设定超声波功率420W,pH 5.6,提取温度50℃,液料比25︰1(V︰m),比较提取时间分别为10,30,50,70,90min时的多糖提取率。
(4)超声波功率的选择:设定提取温度50℃,提取时间50min,pH 5.6,液料比25︰1(V︰m),比较超声波功率分别为280,350,420,490,560W 时的多糖提取率。
(5)液料比的选择:设定超声波功率420W,提取时间50min,提取温度50℃,pH 5.6,比较液料比分别为10︰1,20︰1,30︰1,40︰1,50︰1(V︰m)时的多糖提取率。1.3.6 响应面试验设计 根据单因素试验结果,筛选对提取率影响显著的单因素为变量,以多糖提取率为响应值,采用Box-Behnken试验设计方法对柠檬酸—柠檬酸盐缓冲液作为溶剂,超声波辅助提取木枣多糖工艺进行优化。
1.3.7 热水浸提木枣多糖 以蒸馏水为提取剂,在液料比23.1︰1(V︰m),浸提温度90℃,浸提时间180min条件下提取木枣多糖。其余操作均与超声波辅助柠檬酸盐缓冲溶液浸提木枣多糖一致。
1.3.8 数据分析 采用Excel 2007和SPSS19对单因素试验中的各因素进行比较分析。采用Design-Expert 8.05b进行响应面试验设计和分析。所有试验均重复3次。
2 结果与分析
2.1 单因素试验
2.1.1 柠檬酸盐溶液pH对多糖提取率的影响 由图1可知,随着pH值的升高,木枣多糖提取率呈先降低再升高而后又降低的趋势;在pH 4出现最小值,在pH 5.6时有明显最大值。这可能与某些特定基团在特定pH条件下溶解性不同有关[12];超声波作用使某些酶被激活,这些酶参与的细胞生理化学过程,在pH 5.6时协同作用最强。由于pH对多糖提取率影响不显著,所以缓冲溶液的pH不作为响应面试验设计的因素,选择固定pH为5.6进行后续试验。
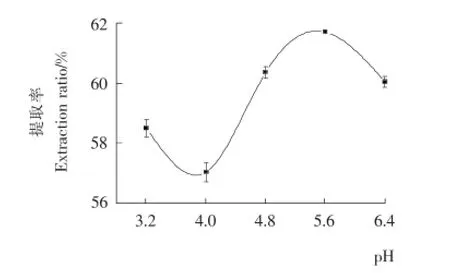
图1 pH对多糖提取率的影响Figure 1 Effect of pH on extraction rate of polysaccharides
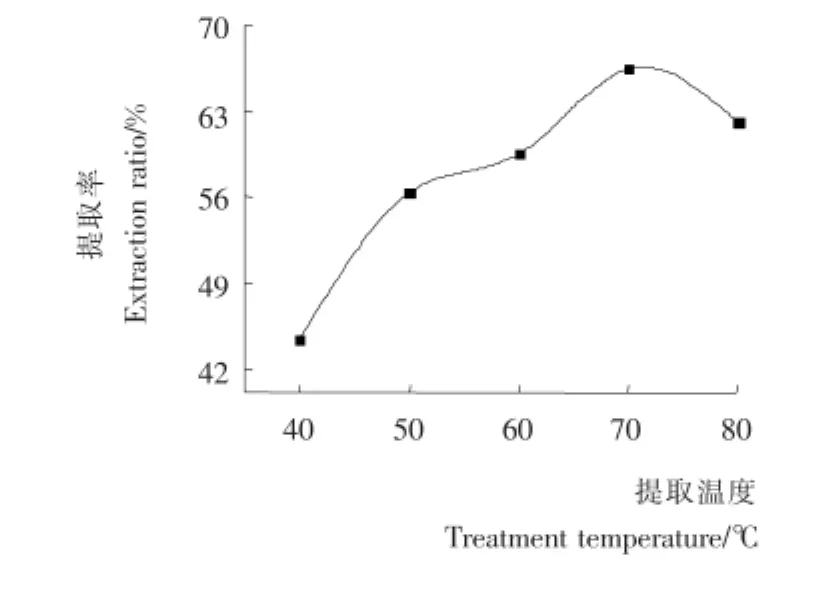
图2 提取温度对多糖提取率的影响Figure 2 Effect of treatment temperature on extraction rate of polysaccharide
2.1.2 提取温度对多糖提取率的影响 由图2可知,在40~70℃范围内,随着温度的升高,多糖的提取率升高,这可能是因为超声波引起的空化作用产生的极大压力造成生物细胞壁破裂,多糖的溶解度升高;超声波作用激活的某些酶,促使细胞的新陈代谢过程加速,提取率升高[13];在70℃达到峰值,继续升高温度,多糖提取率出现下降的情况,可能是温度过高对多糖的结构产生影响;也可能是温度过高使得某些酶活性降低,这些酶参与的生理化学反应减弱,细胞新陈代谢过程减慢导致[14]。因此提取温度应控制在60~80℃。
2.1.3 提取时间对多糖提取率的影响 由图3可知,提取时间越长,提取率越高。提取时间在30min以内,提取率增高明显,但是由30min延长至90min多糖的提取率增加缓慢。这可能是由于短时间的超声处理,介质内部的空化作用增强,溶剂中瞬间产生的空化气泡迅速崩溃,温度瞬间升高,枣粉迅速被击碎[15],多糖提取率快速升高。但是超声波处理时间过长就会产生剧烈的机械剪切作用和引起过多的热量聚集,使多糖发生降解,多糖提取率随之增长缓慢[16]。所以从提高生产效率和节约成本的角度,选择提取时间30min为宜。
2.1.4 超声波功率对多糖提取率的影响 由图4可知,随着超声波功率的增大,多糖提取率先升高而后逐渐降低,420 W时出现峰值。原因可能是:超声波功率太低时,细胞壁的破碎程度低,多糖溶出慢;随着功率的提高,产生的热作用愈强,对液体颗粒的机械作用越明显,多糖溶出速率变快[17];但是超声波功率太大时,一些能使目标物降解的酶被充分释放出来,造成多糖提取率降低[18]。综合考虑,选择超声波功率350~490W。
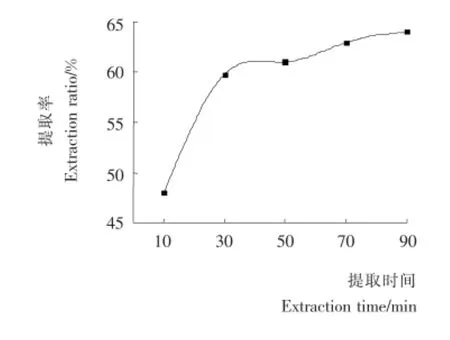
图3 提取时间对多糖提取率的影响Figure 3 Effect of treatment time on extraction rate of polysaccharides
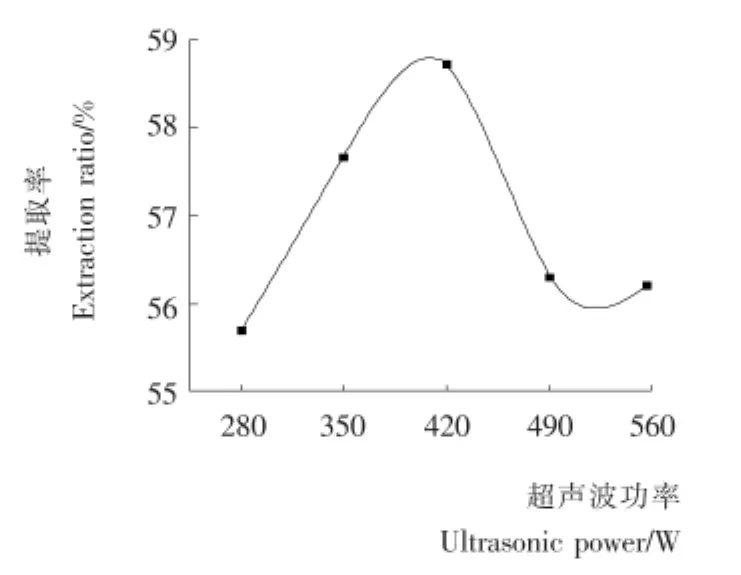
图4 超声波功率对多糖提取率的影响Figure 4 Effect of ultrasonic power on extraction rate of polysaccharides
2.1.5 液料比对多糖提取率的影响 由图5可知,液料比对多糖提取率有显著影响,随着液料比增大,木枣多糖提取率先逐渐增高而后逐渐降低,在20︰1(V︰m)时出现峰值。其原因可能是液料比为20︰1(V︰m)时,超声波在液体中形成最大比例的有效的搅动和流动,达到最高的提取率。随着液料比增大,样品溶液的浓度降低,超声波对悬浮于液体中的微粒的凝聚作用相对减弱,使得提取率降低[14]。考虑到后续处理工艺,液料比取10︰1~30︰1(V︰m)为宜。
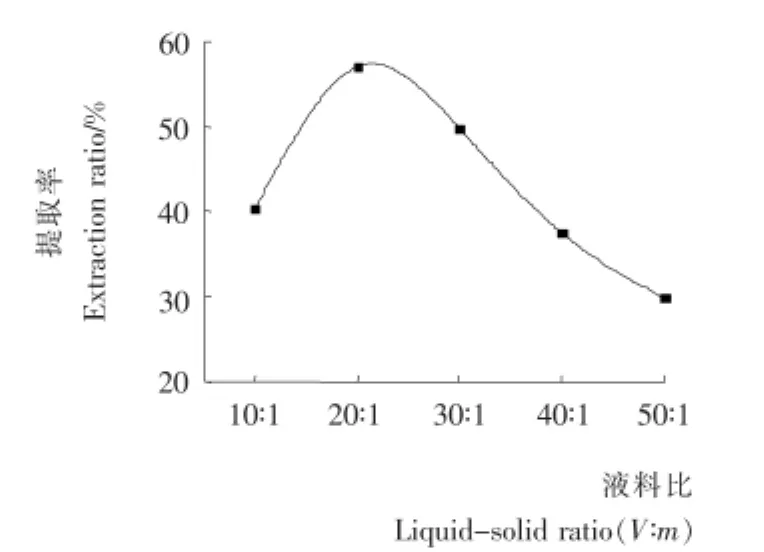
图5 液料比对多糖提取率的影响Figure 5 Effect of liquid-solid ratio on extraction rate of polysaccharides
2.2 响应面优化试验
2.2.1 响应面分析因素水平的选择 根据Box-Behnken试验设计原理,在单因素试验基础上,确定在pH 5.6、提取时间30min条件下,以提取温度、液料比、超声波功率为自变量,多糖提取率为响应值,设计三因素三水平试验,试验因素与水平见表1,试验设计及结果见表2。
2.2.2 响应面优化试验结果分析 根据表2结果,利用Design Expert 8.05b软件对所得数据进行多元回归拟合,得到木枣多糖提取率对提取温度、液料比和超声功率的二次多项回归方程为:

表1 响应面试验因素水平表Table 1 Factors and levels used in response surface analysis
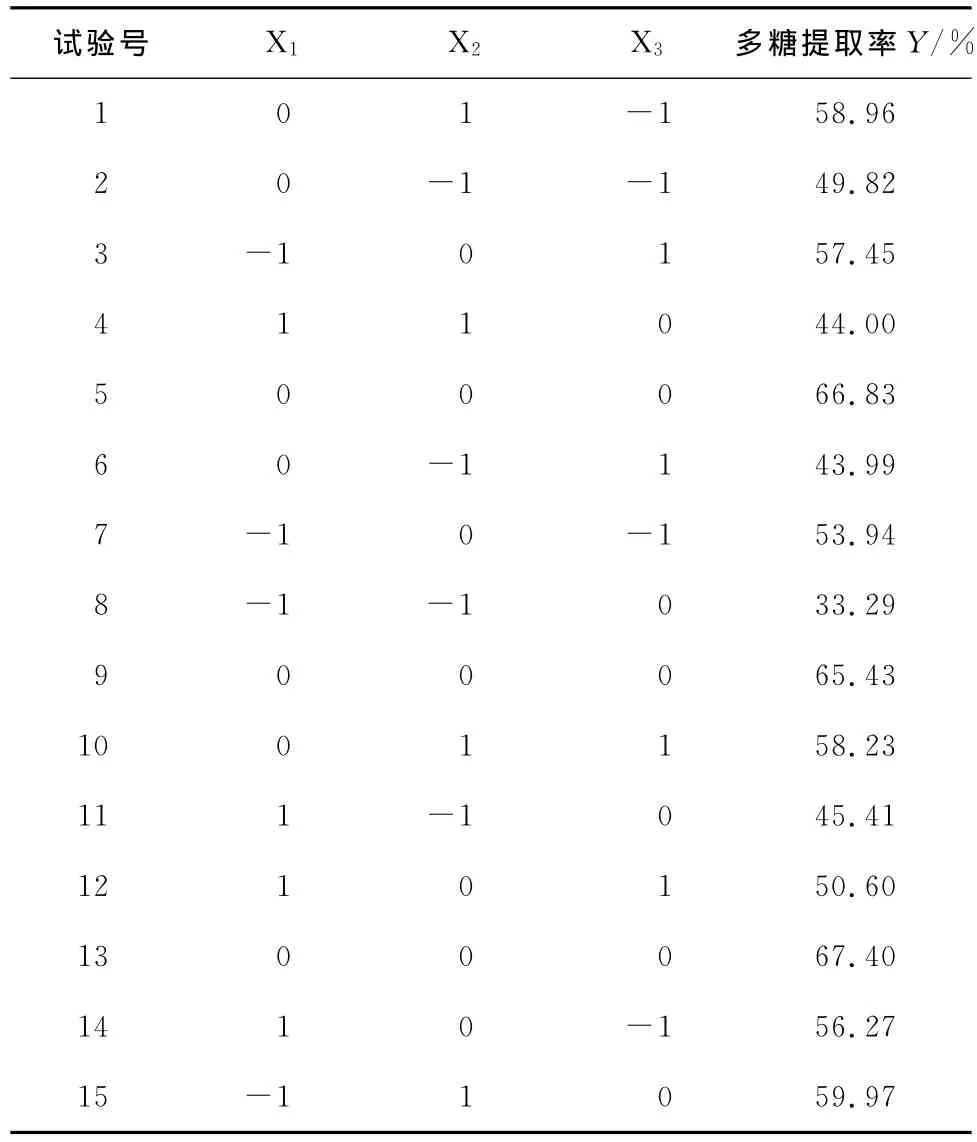
表2 Box-Behnken试验设计及结果Table 2 Experimental design and result for response surface analysis
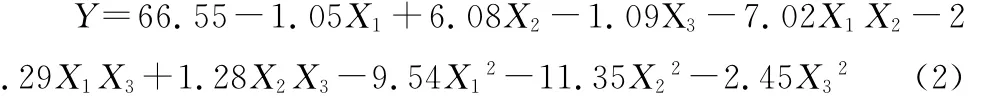
该回归模型的方差分析结果见表3。由表3可知,回归模型(P<0.01)达到极显著水平;失拟项(P=0.550 1>0.1)影响不显著,且相关系数R2=0.996 2,表明实测值与预测值高度相关。综上所述,建立的回归模型拟合度高,可用该模型较好地描述各因素与响应值之间的实际关系,可用该模型预测木枣多糖的提取工艺条件。从该回归模型的方差分析还可以看出,3个因素对木枣多糖提取率的影响均不是简单的线性关系。除了液料比和超声功率的交互作用不显著,其他一次项、交互项和二次项对木枣多糖提取率的影响均达到显著水平。各因素对多糖提取率的影响程度大小顺序为:液料比>超声波功率>提取温度。
根 据表2试验所得的响应面图见图6~8。由图6~8可知,液料比对木枣多糖提取率的影响极为显著,其绘制的曲线最为陡峭;超声波功率对木枣多糖的影响次之,而影响最小的则是提取温度,与提取温度相比,其曲线较为平滑一些。此外,图6(b)和图7(b)中的等高线呈明显的椭圆形,说明提取温度和液料比,提取温度和超声功率之间均具有非常显著的交互作用。这些结果与表3的结果相一致。
表3 方差分析表Table 3 Analysis of variance table
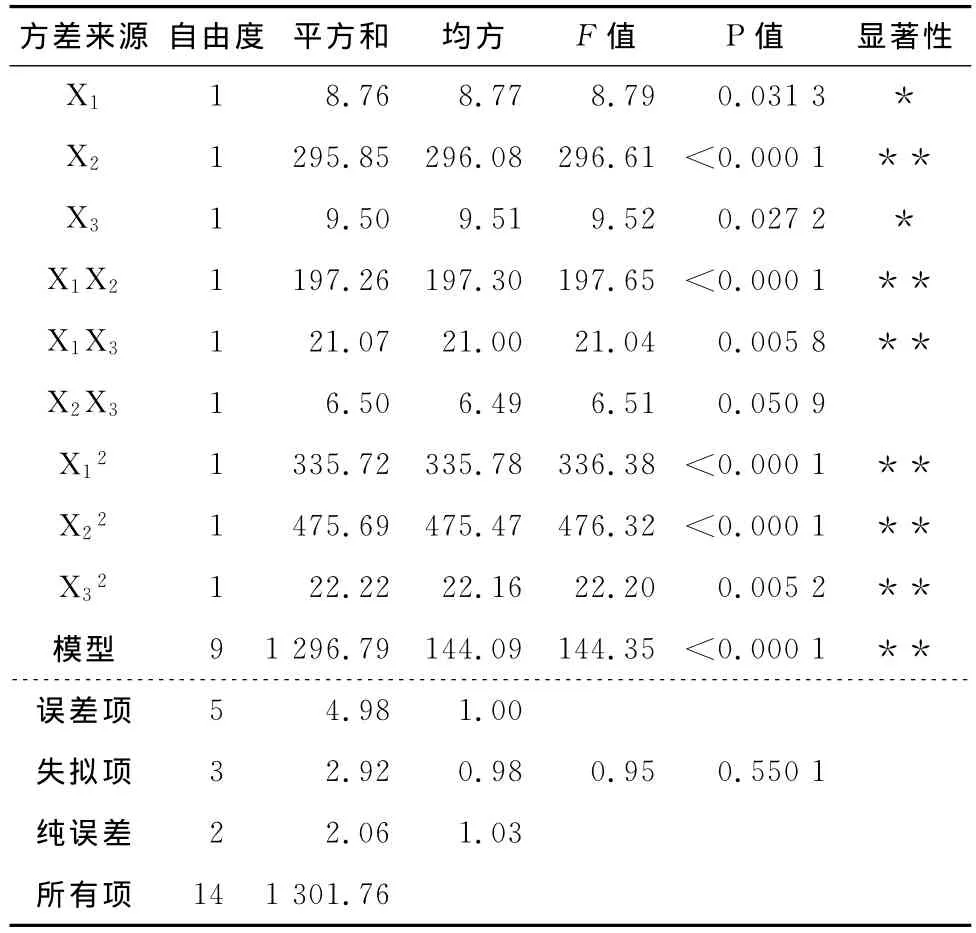
表3 方差分析表Table 3 Analysis of variance table
*显著(P<0.05);**极显著(P<0.01)。
方差来源 自由度 平方和 均方 F值 P 值 显著性X1 1 8.76 8.77 8.79 0.031 3*X2 1 295.85 296.08 296.61 <0.000 1 **X3 1 9.50 9.51 9.52 0.027 2 *X1X2 1 197.26 197.30 197.65 <0.000 1 **X1X3 1 21.07 21.00 21.04 0.005 8 **X2X3 1 6.50 6.49 6.51 0.050 9 X12 1 335.72 335.78 336.38 <0.000 1 **X22 1 475.69 475.47 476.32 <0.000 1 **X32 1 22.22 22.16 22.20 0.005 2 **模型 9 1 296.79 144.09 144.35 <0.000 1 **误差项 5 4.98 1.00失拟项 3 2.92 0.98 0.95 0.550 1纯误差 2 2.06 1.03所有项14 1 301.76
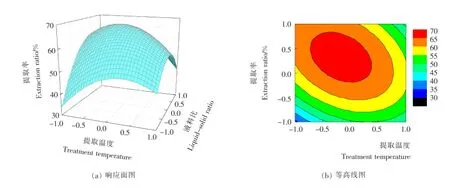
图6 提取温度和液料比交互作用对木枣多糖的提取率影响的响应面图Figure 6 Response surface plots for the interaction effects between extraction temperature and liquid-solid ratio on the polysaccharides extraction ratio of Zizyphus jujube cv.Muzao
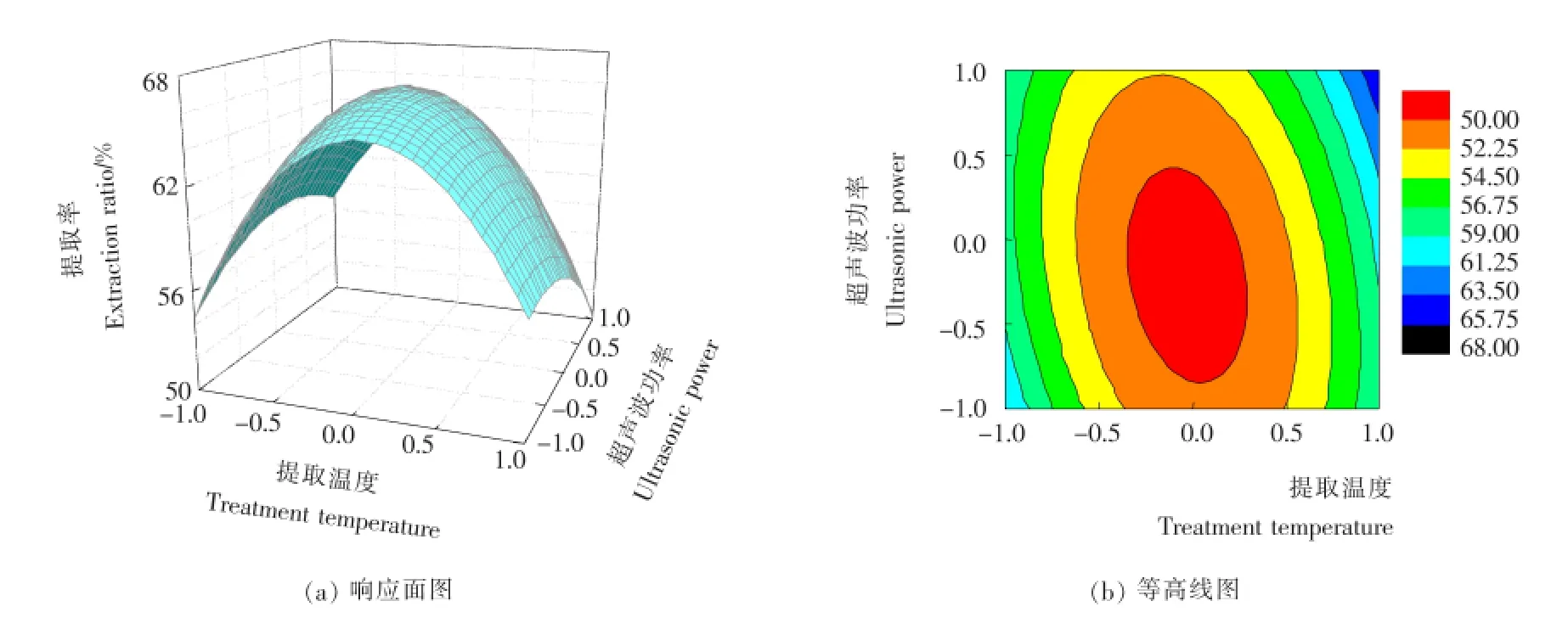
图7 提取温度和超声功率交互作用对木枣多糖的提取率影响的响应面图Figure 7 Response surface plots for the interaction effects between extraction temperature and ultrasonic power on the polysaccharides extraction ratio of Zizyphus jujube cv.Muzao
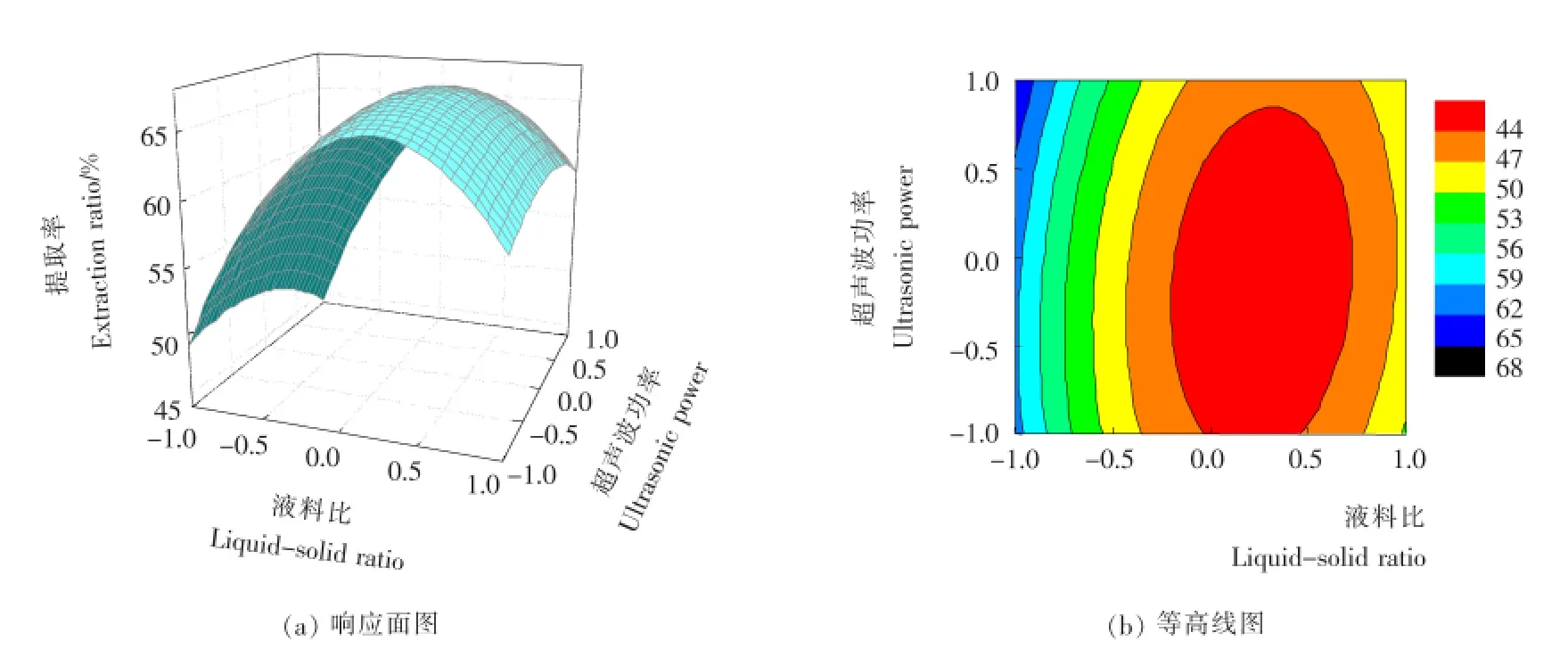
图8 液料比和超声功率交互作用对木枣多糖的提取率影响的响应面图Figure 8 Response surface plots for the interaction effects between liquid-solid ratio and ultrasonic power on the polysaccharides extraction ratio of Zizyphus jujube cv.Muzao
2.2.3 模型验证 通过Design-Expert 8.05b软件进行数据分析确定各因素的最佳取值,Y的最大估计值67.63%,稳定点(X1,X2,X3)的编码值为(-0.16,0.31,-0.06)。与之对应的提取温度68.4℃、液料比23.1︰1(V︰m)、超声波功率415.8W。考虑实际操作的便利,将提取工艺参数修正为超声波功率420W,提取温度68℃,液料比23.1︰1(V︰m),pH 5.6,时间30min,并进行3次平行验证实验,实际测得的多糖提取率为(67.38±0.16)%,实测值与预测值相对误差<1%,说明回归方程拟合度高。
2.3 不同提取方法的比较
由表4可知,与热水浸提法相比,超声波辅助柠檬酸盐缓冲溶液浸提木枣多糖可使多糖提取率提高66.41%,效果十分显著。
3 结论
本试验在单因素的基础上,利用Box-Behnken响应面法对木枣多糖的超声波辅助酸性缓冲液浸提工艺进行优化研究。结果表明,其提取工艺条件为:以pH为5.6的柠檬酸盐缓冲溶液为提取剂,液料比23.1︰1(V︰m),超声波功率420W,提取温度68℃,时间30min。该条件下木枣多糖的实测提取率为(67.38±0.16)%。与传统热水提取法相比,超声波辅助酸性缓冲溶液浸提木枣多糖能显著缩短提取时间,降低提取温度,提高多糖提取率,可为木枣的开发利用和木枣多糖的研究提供依据,但是关于此方法提取的木枣多糖的生物活性还有待于进一步的研究。

表4 不同提取方法的比较Table 4 Comparison of different extraction methods
1 柳杨,罗瑞明.长枣多糖水提工艺参数的响应面分析及优化[J].食品与机械,2010,26(5):128~130.
2 Hung Chi-feng,Hsu Bo-yang,Chang Shyh-chung.Antiproliferation of melanoma cells by polysaccharide isolated from Zizyphus jujuba[J].Nutrition,2012,28(1):98~105.
3 亓树艳,王荔,莫晓燕.大枣多糖的提取工艺及抗氧化作用研究[J].食品与机械,2012,28(4):117~120.
4 Li Jin-wei,Shan Liang,Liu Yuan-fa,et al.Screening of a functional polysaccharide from Zizyphus Jujuba cv.Jinsixiaozao and its property[J].International Journal of Biological Macromolecules,2011,49(3):255~259.
5 曹犇.木枣多糖抗小鼠运动疲劳的实验研究[J].食品科学,2008,29(9):571~574.
6 池爱平,陈锦屏,熊正英.木枣多糖抗疲劳组分对力竭游泳小鼠糖代谢的影响[J].中国运动医学杂志,2007,26(4):411~415.
7 曹奔,池爱平.酶法提取木枣多糖对游泳小鼠血清酶的影响[J].食品科学,2006,27(10):531~534.
8 杨春,丁卫英,邓晓燕,等.超声波辅助浸提木枣多糖优化工艺的研究[J].农产品加工(学刊),2008(5):24~26.
9 樊君,尚红伟,王华敏,等.大枣多糖的提取工艺研究[J].食品研究与开发,2002,23(3):29~31.
10 Li Jin-wei,Liu Yuan-fa,Fan Liu-ping,et al.Antioxidant activities of polysaccharides from the fruiting bodies of Zizyphus Jujuba cv.Jinsixiaozao[J].Carbohydrate Polymers,2011,84(1):390~394.
11 张利芳.苦瓜多糖的纯化及其免疫和抗氧化活性作用[D].武汉:华中农业大学,2010.
12 刘鹏,程显好,刘亚丽,等.虫草菌丝体多糖的提取方法[J].食品与发酵工业,2007,33(3):140~142.
13 Wang Zhao-mei,Cheung Yi-ching,Leung Po-hong,et al.Ultrasonic treatment for improved solution properties of a high-molecular weight exopolysaccharide produced by a medicinal fungus[J].Bioresource Technology,2010,101(14):5 517~5 522.
14 曾里,夏之宁.超声波和微波对中药提取的促进和影响[J].化学研究与应用,2002,14(3):245~249.
15 闪俊杰,杜振雷,李青,等.超声波在化学工业中的应用[J].河北工业科技,2009,26(2):127~130.
16 杨昱,白靖文,俞志刚.超声辅助提取技术在天然产物提取中的应用[J].食品与机械,2011,27(1):170~174.
17 Chen Xiao-ping,Wang Wan-xiang,Li Shui-bing,et al.Optimization of ultrasound-assisted extraction of Lingzhi polysaccharides using response surface methodology and its inhibitory effect on cervical cancer cells[J].Carbohydrate Polymers,2010,80(10):944~948.
18 潘利华,徐学玲,罗建平.超声辅助提取水不溶性大豆膳食纤维及其物理特性[J].农业工程学报,2011,27(9):387~392.
