营养性复合添加剂缓解霉变玉米饲粮对仔猪空肠黏膜结构的损伤
2015-12-21高亿清陈代文毛湘冰何黄能金
高亿清 陈代文 田 刚 郑 萍 虞 洁 毛湘冰何 军 黄能金 余 冰
(四川农业大学动物营养研究所,动物抗病营养教育部重点实验室,雅安 625014)
玉米等饲料原料是霉菌生长的良好基质,其从田间生长到仓库储存都容易感染多种霉菌。霉菌会产生一系列的次级代谢产物——霉菌毒素,污染玉米等饲料原料。2014年对来自全国13个省份的饲料原料及配合饲料的检测结果发现,霉菌毒素检出率高达97.67%,检测到3种及以上霉菌毒素同时存在的样品比例高达65.93%[1]。研究表明,采食被霉菌毒素污染的饲粮后,动物生产性能下降、免疫力降低、肝肾等脏器发生病变。肠道既是主要的消化器官,也是抵御经肠有害物质入侵机体的第一道防线,所面临的霉菌毒素浓度远高于其他组织,这会导致肠道氧化应激、破坏其结构完整性、影响营养物质的转运吸收等[2-3]。因此,寻求一种有效解缓解霉菌毒素对动物肠道损伤的措施显得尤为重要。已有研究报道,在霉菌毒素应激条件下分别添加精氨酸(Arg)和谷氨酰胺(Gln)等对断奶仔猪肠道具有明显的保护作用[4-5]。但是有关多种营养性添加剂同时添加对采食含有自然霉变玉米饲粮断奶仔猪肠道具有怎样的影响尚无报道。因此,本试验拟在含霉变玉米饲粮中添加以维生素C(VC)、维生素E(VE)和Gln等为主要成分的营养性复合添加剂,从断奶仔猪空肠结构功能完整性、氧化还原状态和后肠微生态平衡3个方面考察营养性复合添加剂对采食含自然霉变玉米饲粮断奶仔猪肠道的保护作用。
1 材料与方法
1.1 霉变玉米的制备
将正常玉米水分提高到20%左右,置于28℃左右的环境中使其自然霉变。霉变结束后混合均匀于4℃避光保存,并检测其毒素含量。
1.2 试验设计
试验采用单因子设计,选取初始体重为(8.57±0.21)kg的 26 日龄健康杜×长×大(DLY)断奶仔猪18头,按照体重相近、公母各占1/2的原则随机分为3个组,每组6个重复,每个重复1头猪,分别饲喂对照组(基础)饲粮、霉变玉米组饲粮和霉变玉米+0.2%营养性复合添加剂饲粮。试验期30 d。
1.3 试验饲粮
基础饲粮参照NRC(2012)7~11 kg仔猪营养需要配制而成,其组成及营养水平见表1。霉变玉米组饲粮采用自然霉变玉米100%替代基础饲粮中的玉米,霉变玉米+添加剂组饲粮在霉变玉米饲粮的基础上添加0.2%的营养性复合添加剂(添加剂添加量等量替代玉米)。各组饲粮主要霉菌毒素种类和含量见表2。
本试验所使用的营养性复合添加剂成分及含量(在全价料中添加量)如下:酵母硒0.15 mg/kg、VE 30 mg/kg、VC 100 mg/kg、糖萜素 30 mg/kg、酵母细胞壁 50 mg/kg、黄芪多糖 50 mg/kg、Gln 20 mg/kg和丁酸钠200 mg/kg。
1.4 饲养管理
试验前对圈舍进行清扫消毒。试验仔猪于每天08:00、12:00、16:00和 20:00进行饲喂,每次以吃饱后料槽中略有余料为度。试验期间猪只采用自由饮水。试验期间圈内温度控制在26~28℃。
1.5 样品采集
1.5.1 血清
每头仔猪空腹12 h后于试验第14和30天08:00,前腔静脉采血15 mL,室温静置10 min,4 000 r/min离心15 min,分离血清,待测二胺氧化酶(DAO)活性。

表1 基础饲粮组成及营养水平(饲喂基础)Table 1 Composition and nutrient levels of the basal diet(as-fed basis) %

表2 饲粮中主要霉菌毒素含量(饲喂基础)Table 2 Main mycotoxin contents in diets(as-fed basis) μg/kg
1.5.2 空肠黏膜
试验第30天早上麻醉后屠宰仔猪,剖开腹腔取空肠前段,用预冷生理盐水冲洗肠腔直至液体清亮,用手术剪剖开肠管,在生理盐水中轻轻摆动肠段,清洗干净后用滤纸小心吸干黏膜表面多余的水分,用灭菌载玻片刮取黏膜于灭菌冻存管中,投入液氮中速冻后-80℃保存待测。
1.5.3 盲肠和结肠食糜
试验第30天早上称重采血后屠宰。屠宰后立即结扎肠道,取下盲肠、结肠在冰面上收集食糜,分装于灭菌的冻存管中,投入液氮中速冻后-80℃保存待测菌群数量。
1.6 考察指标及方法
1.6.1 血清 DAO 活性
采用酶联免疫吸附法测定血清DAO活性,试剂盒购于荷兰Biocheck公司,具体操作步骤严格按照试剂盒说明书进行。试剂盒检测范围:7~260 U/L。
1.6.2 空肠黏膜氧化还原状态
空肠黏膜匀浆制备:称取0.7 g左右黏膜,按照重量(g)∶体积(mL)=1∶9加入预冷生理盐水,冰浴条件手动匀浆,3 000 r/min离心10 min,取上清待测。
空肠黏膜丙二醛(MDA)含量,总抗氧化能力(T-AOC),超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)活性采用比色法测定,试剂盒购自南京建成生物工程研究所,具体操作步骤严格按照试剂盒说明书进行。使用UV-1100紫外可见分光光度计(上海美普达仪器有限公司)进行比色。
1.6.3 肠道紧密连接蛋白和养分转运载体基因mRNA表达量
采用实时PCR(RT-PCR)技术检测空肠黏膜闭合小环蛋白(zonula-1,ZO-1)、咬合蛋白(occludin)、钠-葡萄糖共转运载体1(Na+-dependent glucose transporter 1,SGLT-1)、溶质转运载体家族7成员 7(solute carrier family 7 member 7,SLC7A7)和溶质转运载体家族7成员1(solute carrier family 7 member 1,SLC7A1)mRNA表达量。组织中总mRNA的提取和质量检测参照陈渝[6]的方法进行。cDNA的合成采用试剂盒(PrimeScriptTMreagent kit,TaKaRa,日本)进行,具体操作步骤参照说明书进行。登陆NCBI获得目的基因CDS序列,用Primer Premier 5.0软件进行引物设计,在NCBI中进行Blast比对引物特异性,筛选出特异性好的引物序列进行合成(上海英骏生物科技有限公司),引物序列及退火温度见表3。RT-PCR反应体系为10μL:5μL SYBR Premix Ex TaqTMⅡ(TaKaRa,日本),上、下游引物各 0.5 μL,cDNA 1μL,ddH2O 3μL。PCR扩增条件为:95℃ 30 s,95℃ 5 s,最佳退火温度30 s,40个循环,95℃10 s。熔解曲线:65~95℃,温度以0.5℃/s提升。以β-肌动蛋白(β-actin)为内参基因,相对荧光定量计算方法采用△△CT法计算得来[6]。
1.6.4 食糜微生物数量
采用RT-PCR技术测定盲肠和结肠食糜中大肠杆菌、乳酸杆菌、双歧杆菌和总菌数量[7]。食糜DNA提取采用试剂盒进行(Omega,美国)。Real-MasterMix(Probe)购于北京天根生化科技有限公司。大肠杆菌、乳酸杆菌反应体系:1μL Probe Ehane Solution,8 μL RealMaterMix,上、下游引物各1μL,模板 DNA 1 μL,探针 0.3 μL 和 ddH2O 7.7μL;双歧杆菌反应体系:1μL Probe Ehane Solution,8 μL RealMaterMix,上、下游引物各 1 μL,模板 DNA 1 μL,探针0.8 μL 和 ddH2O 7.2 μL;PCR条件:95℃ 10 s,95℃ 5 s,最佳退火温度25 s,50个循环,95℃ 10 s。总菌反应体系:12.5 μL SYBR Premix Ex TaqTMⅡ,上、下游引物各1 μL,cDNA 1 μL,ddH2O 9.5 μL;PCR 条件:95 ℃ 10 s,95 ℃ 5 s,最佳退火温度 25 s,40 个循环,95℃ 10 s。熔解曲线:65~95℃,温度以0.5 ℃ /s提升。
1.7 数据处理
采用SAS 8.2统计软件GLM过程对试验数据进行单因素方差分析,并用Duncan氏法进行多重比较,P<0.05为差异显著,P<0.01为差异极显著。

表3 RT-PCR基因引物序列及退火温度Table 3 Sequences of primers and annealed temperature used for RT-PCR
2 结果
2.1 自然霉变玉米及营养性复合添加剂对断奶仔猪空肠结构和功能的影响
2.1.1 血清 DAO 活性
由表4可知,在试验第14天,各组间断奶仔猪血清DAO活性无显著差异(P>0.05);在试验第30天,霉变玉米组仔猪血清DAO活性极显著高于对照组(P<0.01),而霉变玉米+添加剂组仔猪血清DAO活性极显著低于霉变玉米组(P<0.01),与对照组无显著差异(P>0.05)。
2.1.2 紧密连接蛋白mRNA表达
由表5可知,与对照组相比,霉变玉米组occludin和ZO-1 mRNA表达量下调,但差异不显著(P>0.05);与霉变玉米组相比,霉变玉米+添加剂组occludin(P<0.05)和 ZO-1 mRNA 表达量(P<0.01)显著或极显著上调。
2.1.3 养分转运载体mRNA表达
由表6可知,与对照组相比,霉变玉米组SGLT1、SLC7A7和SLC7A1 mRNA表达量降低,但差异不显著(P>0.05);与霉变玉米组相比,霉变玉米+添加剂组 SGLT1(P>0.05)、SLC7A7(P>0.05)和SLC7A7 mRNA表达量(P<0.05)不同程度的提高。
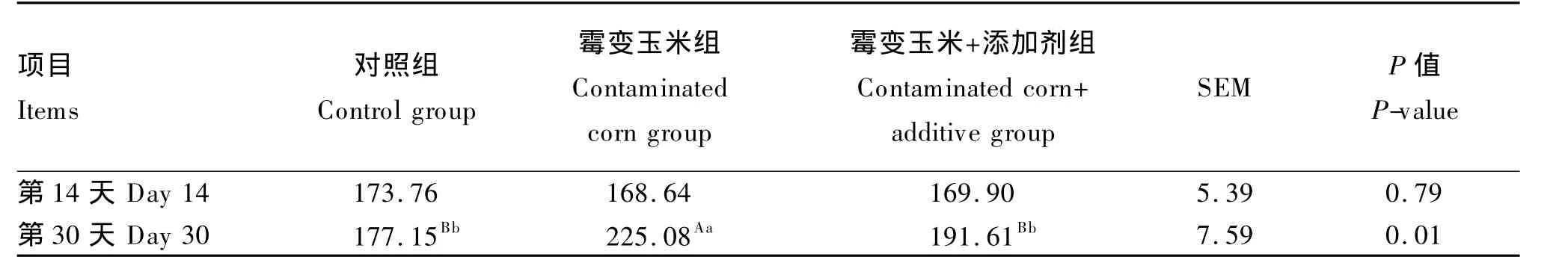
表4 不同处理对断奶仔猪血清DAO活性的影响Table 4 Effects of different treatments on serum DAO activity in weaned piglet U/L

表5 不同处理对断奶仔猪空肠黏膜occludin和ZO-1 mRNA表达的影响Table 5 Effects of different treatments on mRNA expression of jejunum mucosa occludin and ZO-1 in weaned piglet
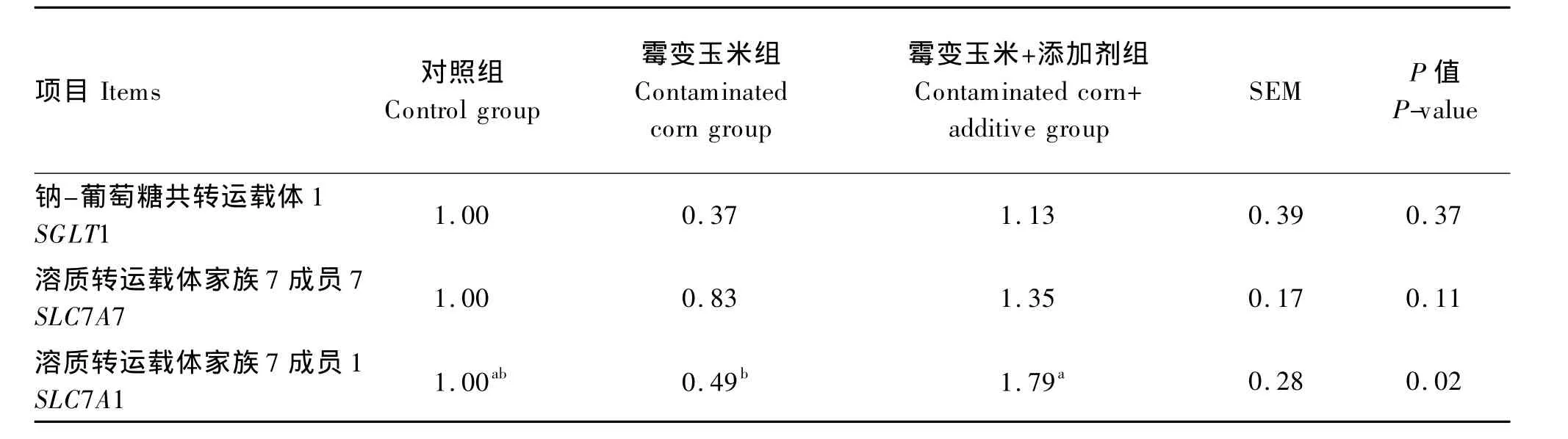
表6 不同处理对断奶仔猪空肠黏膜养分转运载体mRNA表达的影响Table 6 Effects of different treatments on mRNA expression of jejunum mucosa transporters in weaned piglet
2.2 自然霉变玉米及营养性复合添加剂对断奶仔猪空肠黏膜抗氧化能力的影响
由表7可知,与对照组相比,霉变玉米极显著提高了空肠黏膜MDA含量(P<0.01),显著或极显著降低了 T-AOC(P<0.01)、SOD(P<0.01)和GSH-Px活性(P<0.05),但是对CAT活性无显著影响(P>0.05);与霉变玉米组相比,霉变玉米+添加剂显著降低了MDA含量(P<0.05),极显著提高了GSH-Px活性(P<0.01),但是对 T-AOC 及SOD和CAT活性无显著影响(P>0.05)。
2.3 自然霉变玉米及营养性复合添加剂对断奶仔猪后肠微生物数量的影响
由表8可知,与对照组相比,霉变玉米显著降低了盲肠食糜中乳酸杆菌和总菌数量(P<0.05),极显著降低了结肠食糜中乳酸杆菌数量(P<0.01),对其他微生物数量无显著影响(P>0.05);与霉变玉米组相比,霉变玉米+添加剂对盲肠和结肠食糜中各微生物数量均无显著影响(P>0.05)。
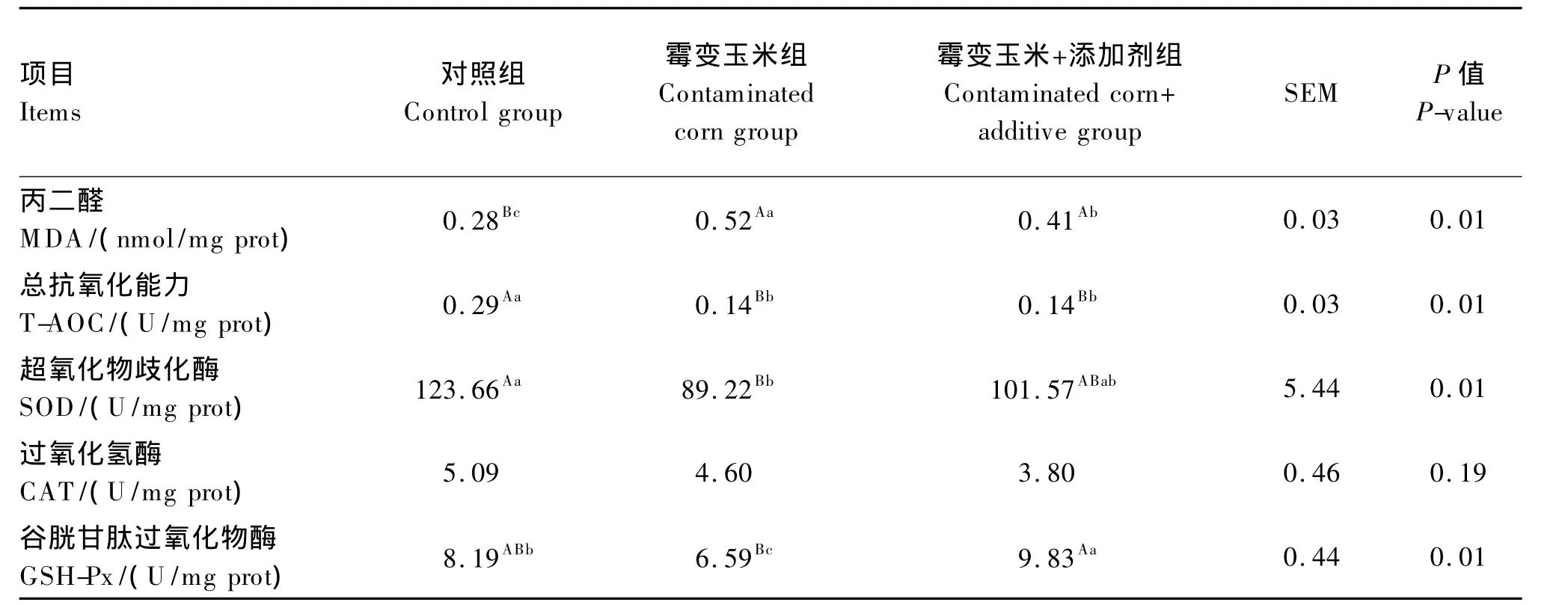
表7 不同处理对断奶仔猪空肠黏膜氧化还原状态的影响Table 7 Effect of different treatments on jejunum mucosa redox status in weaned piglet

表8 不同处理对断奶仔猪肠道菌群数量的影响Table 8 Effect of different treatments on intestinal number flora in weaned piglet lg(CFU/g)
3 讨论
3.1 自然霉变玉米及营养性复合添加剂对断奶仔猪空肠黏膜结构和功能的影响
动物饲料原料及配合饲料因霉菌毒素污染对畜禽的危害一直是畜牧养殖业所关注的重点。前人的调查发现,霉菌毒素污染呈现2个特点:一是污染普遍,检出率高;二是多种霉菌毒素同时存在。本试验所使用的自然霉变玉米主要遭受黄曲霉毒素B1(AFB1)污染,同时也含有玉米赤霉烯酮(ZEN)、脱氧雪腐镰刀菌烯醇(DON)和T-2毒素。不仅如此,在对照组饲粮中也检测到了 AFB1、ZEN、DON和T-2毒素,但是均没有超过限量标准。采食被霉菌毒素污染的饲粮会破坏动物肠道正常的结构,增加肠上皮细胞通透性,破坏肠道的正常生理功能[8]。DAO是所有哺乳动物肠绒毛中的细胞内酶,生理状态下血清中的活性很低,其活性是衡量肠道机械屏障的完整性和损伤程度的敏感性指标[9]。有研究报道,采食被DON污染的饲粮后显著提高了仔猪血清DAO活性,降低了十二指肠和空肠 DAO的活性[10]。本研究发现,在试验第30天霉变玉米组断奶仔猪血清DAO活性显著升高,说明采食霉变玉米后造成仔猪肠道上皮细胞受损,细胞内DAO透过肠黏膜进入血液。紧密连接是由ZO-1、完整的跨膜蛋白等组成,可以封闭细胞间的间隙。大量研究发现,霉菌毒素对ZO-1、occludin和claudin的表达具有不同程度的抑制作用[11-13]。本研究发现,霉变玉米组具有下调断奶仔猪空肠黏膜ZO-1和occludin mRNA表达的趋势。以上研究结果表明,霉菌毒素可以破坏肠道上皮的通透性且不同程度下调紧密连接蛋白的表达。小肠是消化吸收营养物质的主要部位,肠上皮结构的完整是确保营养物质消化吸收的前体条件。伴随着霉菌毒素对肠道结构完整性的破坏,肠道功能又会发生怎样的改变呢?养分转运载体主要分布于小肠刷状缘上,与小肠绒毛高度成正比。体内、外研究表明,霉菌毒素显著下调小肠葡萄糖转运载体(SGLT1、GLUT2)和氨基酸转运载体(SLC7A7、SLC7A1)mRNA表达[4-5,7,14],影响营养物质的转运吸收。本研究也发现,采食含自然霉变玉米饲粮后,断奶仔猪空肠黏膜SGLT1、SLC7A7和SLC7A1 mRNA表达出现不同程度下调,说明在本试验条件下,采食含霉菌毒素饲粮会影响空肠对葡萄糖和氨基酸的吸收。
前人研究表明,在应激条件下添加单一或者2种营养性添加剂对动物肠道结构和功能具有一定的保护作用。饲粮中添加Arg可以抑制脂多糖应激仔猪肠道上皮细胞凋亡,缓解肠绒毛萎缩和形态改变,维持小肠结构的完整性[15-16]。霉菌毒素应激仔猪饲粮中添加Arg和Gln显著提高氨基酸转运载体的基因表达量,提高仔猪对氨基酸的利用率[4,17]。本研究发现,霉变饲粮中添加 0.2% 营养性复合添加剂可极显著降低仔猪第30天血清DAO活性,提高 occludin和 ZO-1以及 SGLT1、SC7A7和SLC7A1 mRNA表达量。这表明,本试验所用营养性复合添加剂可以缓减霉菌毒素对肠上皮结构与养分转运功能的损伤。其可能原因在于,Gln是肠黏膜细胞代谢必需的营养物质,在霉菌毒素应激条件下肠黏膜细胞内Gln很快耗竭,本研究所用的营养性复合添加剂为肠黏膜细胞提供了充足的Gln。此外,添加剂中的丁酸钠也可为肠上皮细胞提供快速能量来源,而糖萜素具有促进蛋白质合成和小肠细胞发育的功能,有利于肠黏膜快速修复保护其结构和功能完整性。硒作为体内重要的无机微量元素主要参与GSH-Px等抗氧化酶的形成。VC和VE能够清除机体产生的自由基,有研究称它们之间具有协同作用,即VE主要负责与自由基反应,然后在VC的作用下,携带自由基的VE实现再生[18]。从前人和本研究结果可以发现,霉菌毒素可通过氧化应激损伤动物机体。本试验所用的营养性复合添加剂中的VC、VE、酵母硒可提高仔猪空肠黏膜小分子抗氧化剂含量和抗氧化酶活性,缓解霉菌毒素引起的肠道氧化损伤。α-甘露聚糖和β-葡聚糖是广泛存在于酵母细胞壁中的2种多糖,它们可通过吸附作用减少肠道对霉菌毒素的吸收,从而减少霉菌毒素对动物肠道的破坏[19]。
3.2 自然霉变玉米及营养性复合添加剂对断奶仔猪空肠黏膜抗氧化能力的影响
前人研究表明,霉菌毒素损伤会产生大量自由基,造成细胞膜和细胞器膜脂质过氧化反应引起氧化应激[20]。本研究发现,采食含霉变玉米饲粮后仔猪空肠黏膜脂质过氧化产物MDA含量极显著升高,而T-AOC及SOD和GSH-Px活性显著下降,说明霉菌毒素可能通过影响空肠黏膜抗氧化系统,损伤抗氧化能力,导致脂质过氧化增加进而破坏黏膜结构。为了抵抗氧化损伤,机体形成了一套抗氧化体系,包括小分子的非酶系统(VC、VE和谷胱甘肽)和大分子的酶系统(GSH-Px和SOD)[21]。本试验发现,添加试验所用复合添加剂可显著降低空肠黏膜MDA含量且提高GSH-Px活性。原因可能与复合添加剂中所含小分子抗氧化剂有关(VC和VE)。同时,Gln还可能作为合成体内重要非酶性抗氧化剂谷胱甘肽的前体物质,参与机体抗氧化反应。此外,添加剂中酵母硒和黄芪多糖均具有良好的抗氧化作用。Wang等[22]发现,硒显著提高 AFB1引起的肉鸡脾脏GSH-Px、SOD和CAT活性下降。黄芪多糖能够缓解黄嘌呤及黄嘌呤氧化酶引起的心肌细胞氧化损伤[23]。
3.3 自然霉变玉米及营养性复合添加剂对断奶仔猪后肠微生物数量的影响
动物健康与其肠道微生物息息相关,一旦肠道微生物平衡遭到破坏将给动物健康带来不利影响。80%DON、ZEN和AFB1等毒素在十二指肠以及空肠前段被吸收,未被吸收的毒素进入后肠增加致病菌的定植,破坏肠道微生物平衡[8]。采食霉菌毒素后显著提高了断奶仔猪肠道中大肠杆菌的数量[24]。赭曲霉毒素显著提高了蛋鸡肠道内沙门氏菌数量[25]。本试验研究发现,采食霉变玉米饲粮显著降低了断奶仔猪盲肠和结肠食糜中乳酸杆菌数量以及盲肠食糜中总菌数量。可能与乳酸杆菌具有吸附霉菌毒素的作用有关。前人研究发现,鼠李糖乳酸杆菌GG吸附AFB1的同时,其对肠道的黏附能力由30%下降至5%[26],进而有利于吸附有AFB1的乳酸杆菌排出体外,减少AFB1对肠道的损伤。同时,本试验发现营养性复合添加剂的添加对所检测肠道微生物无显著影响。可能原因在于试验所用复合添加剂主要是通过增强仔猪机体抗氧化能力和肠道细胞营养,促进霉菌毒素应激条件下断奶仔猪肠道的自我修复而发挥作用,但是营养性复合添加剂中具有吸附作用的酵母细胞壁含量较少,以至于未被肠道吸收的霉菌毒素随食糜进入后肠,进而产生与霉变玉米组类似的效应。
4 结论
①霉变玉米饲粮导致仔猪空肠通透性增加、抗氧化能力下降及后肠乳酸杆菌数量的降低。
②添加0.2%营养性复合添加剂对采食含霉变玉米饲粮断奶仔猪空肠结构具有一定的保护作用。
[1] 杜妮.2014年1-6月全国饲料及原料霉菌毒素污染及调查报告[J].中国动物保健,2014,16(9):63-66.
[2] GIRISH C K,SMITH T K.Effects of feeding blends of grains naturally contaminated with Fusarium mycotoxins on small intestinal morphology of turkeys[J].Poultry Science,2008,87(6):1075-1082.
[3] AWAD W A,BÖHM J,RAZZAZI-FAZELI E,et al.Effect of addition of a probiotic microorganism to broiler diets contaminated with deoxynivalenol on performance and histological alterations of intestinal villi of broiler chickens[J].Poultry Science,2006,85(6):974-979.
[4] YIN J,REN W K,DUAN J L,et al.Dietary arginine supplementation enhances intestinal expression of SLC7A7 and SLC7A1 and ameliorates growth depression in mycotoxin-challenged pigs[J].Amino Acids,2014,46(4):883-892.
[5] DUAN J L,YIN J,WU M M,et al.Dietary glutamate supplementation ameliorates mycotoxin-induced abnormalities in the intestinal structure and expression of amino acid transporters in young pigs[J].PLoS One,2014,9(11):e112357.
[6] 陈渝.精氨酸对免疫应激断奶仔猪细胞膜表面TLRs基因表达的影响及作用途径研究[D].硕士学位论文.雅安:四川农业大学,2012.
[7] 雷晓娅.自然霉变玉米及甘露寡糖对仔猪生长性能和肠道健康的影响[D].硕士学位论文.雅安:四川农业大学,2011.
[8] GRENIER B,APPLEGATE T J.Modulation of intestinal functions following mycotoxin ingestion:meta-analysis of published experiments in animals[J].Toxins,2013,5(2):396-430.
[9] NAMIKAWA T,FUKUDOME I,KITAGAWA H,et al.Plasma diamine oxidase activity is a useful biomarker for evaluating gastrointestinal tract toxicities during chemotherapy with oral fluorouracil anti-cancer drugs in patients with gastric cance[J].Oncology,2012,82(3):147-152.
[10] WU M M,XIAO H,REN W K,et al.Therapeutic effects of glutamic acid in piglets challenged with deoxynivalenol[J].PLoS One,2014,9(7):e100591.
[11] DIESING A K,NOSSOL C,PANTHER P,et al.Mycotoxin deoxynivalenol(DON)mediates biphasic cellular responses in intestinal porcine epithelial cell lines IPEC-1 and IPEC-2[J].Toxicology Letters,2011,200(1/2):8-18.
[12] PONTON P,BRICU C,NOUGAYREDE J P,et al.Deoxynivalenol impairs porcine intestinal barrier function and decreases the protein expression of claudin-4 through a mitogen-activated protein kinase-dependent mechanism[J].The Journal of Nutrition,2010,140(11):1956-1962.
[13] DE WALLE JV,SERGENT T,PIRONT N,et al.Deoxynivalenol affects in vitro intestinal epithelial cell barrier integrity through inhibition of protein synthesis[J].Toxicology and Applied Pharmacology,2010,245(3):291-298.
[14] AWAD W A,ASCHENBACH J R,SETYABUDI F M C S,et al.In vitro effects of deoxynivalenol on small intestinal D-glucose uptake and absorption of deoxynivalenol across the isolated jejunal epithelium of laying hens[J].Poultry Science,2007,86(1):15-20.
[15] LIU Y L,HUANG JJ,HOU Y Q,et al.Dietary arginine supplementation alleviates intestinal mucosal disruption induced by Escherichia coli lipopolysaccharide in weaned pigs[J].British Journal of Nutrition,2008,100(3):552-560.
[16] ZHU H L,LIU Y L,XIE X L,et al.Effect of L-argi-nine on intestinal mucosal immune barrier function in weaned pigs after Escherichia coli LPSchallenge[J].Innate Immunity,2013,19(3):242-252.
[17] WU L,WANG W,YAO K,et al.Effects of Dietary arginine and glutamine on alleviating the impairment induced by deoxynivalenol stress and immune relevant cytokines in growing pigs[J].PLoS One,2013,8(7):e69502.
[18] PACHER J E,SLATER T F,WILLSON R L.Direct observation of a free radical interaction between vitamin E and vitamin C[J].Nature,1979,278(5706):737-738.
[19] KOGAN G,KOCHER A.Role of yeast cell wall polysaccharides in pig nutrition and health protection[J].Livestock Science,2007,109(1/2/3):161-165.
[20] OSSELAERE A,SANTOS R,HAUTEKIET V,et al.Deoxynivalenol impairs hepatic and intestinal gene expression of selected oxidative stress,tight junction and inflammation proteins in broiler chickens,but addition of an adsorbing agent shifts the effects to the distal parts of the small intestine[J].PLoS One,2013,8(7):e69014.
[21] LYKKESFELDT J,SVENDSEN O.Oxidants and antioxidants in disease:oxidative stress in farm animals[J].The Veterinary Journal,2007,173(3):502-511.
[22] WANG F Y,SHU G,PENG X,et al.Protective effects of sodium selenite against aflatoxin B1-induced oxidative stress and apoptosis in broiler spleen[J].International Journal of Environmental Research and Public Health,2013,10(7):2834-2844.
[23] 孙成文,江岩,钟国赣,等.黄芪多糖抗氧化损伤作用的研究[J].中国药理学通报,1996,12(2):161-163.
[24] OSWALD I P,DESAUTELS C,LAFFITTE J,et al.Mycotoxin fumonisin B1increases intestinal colonization by pathogenic Escherichia coli in pigs[J].Applied and Environmental Microbiology,2003,69(10):5870-5874.
[25] FUKATA T,SASAI K,BABA E,et al.Effect of ochratoxin A on Salmonella typhimurium-challenged layer chickens[J].Avian Diseases,1996,40(4):924-926.
[26] KANKAANPÄÄP,TUOMOLA E,EL-NEZAMI H,et al.Binding of aflatoxin B1 alters the adhesion properties of Lactobacillus rhamnosus strain GG in a Caco-2 model[J].Journal of Food Protection,2000,63(3):412-414.
