零换水条件下养殖水体中碳氮比对生物絮团形成及团头鲂肠道菌群结构的影响
2015-12-21孙盛明戈贤平江晓浚
孙盛明 朱 健* 戈贤平 江晓浚
(1.中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室,无锡 214081;2.南京农业大学无锡渔业学院,无锡 214081)
生物絮团技术(biofloc technology,BFT)被认为是解决集约化养殖水质污染的有效技术,利用这种养殖技术,可以实现水产养殖少换水甚至不换水,同时还维持了养殖水体生态的稳定[1]。碳氮比一直是生物絮团技术的主要研究热点之一,控制合适的碳氮比是形成絮团的必要条件。Avnimelech[2]建立假设模型计算得出当养殖水体中碳氮比为15.75时,可以促进微生物合成菌体蛋白,并有效去除养殖水体氨氮和亚硝酸盐氮。团头鲂(Megalobrama amblycephala)是我国的四大家鱼之一,在水产养殖中占有极为重要的地位。本实验室前期研究已经证实,生物絮团技术应用于团头鲂的养殖体现出饲料系数降低、水质环境改善和生长加快等综合效应[3],而生物絮团对团头鲂肠道菌群结构的调控作用未见专门报道。
长期以来,研究者们主要通过纯培养的方法对肠道菌群的构成进行研究。然而,随着分子生物学技术的发展,目前研究人员越来越多的使用变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)等方法对肠道中的微生物进行全面的分析[3-6]。近年来,以454焦磷酸测序为代表的新一代测序技术凭借低成本、高通量、流程自动化的优势为研究微生物群落结构提供了新的技术平台[7],目前已应用到人类、昆虫和鱼类等肠道菌群结构的研究中[8-10]。本研究通过使用454焦磷酸测序技术同时结合PCR-DGGE技术研究零换水条件下养殖水体中碳氮比对生物絮团形成和团头鲂肠道菌群结构的影响,为生物絮团技术在淡水鱼养殖中的应用提供理论基础。
1 材料与方法
1.1 试验设计
根据Avnimelech[2]总结的生物絮团养殖系统的碳氮比公式计算得出碳源葡萄糖的添加量,根据饲料投喂量调整葡萄糖的添加量以保持各组的碳氮比,试验中的碳氮比指添加物质(饲料和葡萄糖)的碳元素与氮元素的质量比。水体中碳、氮含量的计算公式如下:

式中:ΔC为碳含量;ΔCH为所需要的碳水化合物的添加量;%C为碳水化合物中碳的百分含量;ΔN为氮含量;feed为每天投喂给团头鲂的饲料量;%N feed为饲料中的氮的百分含量;%N excretion为团头鲂的排泄物中氮的百分含量。
根据上述计算方法推算,本试验设置了5个碳氮比组,其碳氮比分别为8(CN8组,设为对照组)、12(CN12组)、16(CN16组)、20(CN20组)、24(CN24组),碳源葡萄糖的添加方式为每次投喂饲料后1 h,把投喂的碳源与少量养殖水体混合搅拌,全池均匀泼洒。
1.2 试验鱼与饲养管理
养殖试验在中国水产科学研究院淡水渔业研究中心大浦试验基地进行,试验所用团头鲂由中国水产科学研究院淡水渔业研究中心南泉试验基地提供,驯化14 d后,将300尾体质健康、规格一致的团头鲂幼鱼随机分入15个室内水泥池(1.0 m×4.0 m×0.6 m),平均水深 0.4 m,放养密度为20尾/池。将15个水泥池随机分为5组,每组设置3个平行,每个水泥池中设置微孔增氧管,置于水泥池的底部,微孔增氧管通过无规共聚聚丙烯管(PPR管)与池边一个5 kW的鼓风机相连接,保持连续充气。养殖期间每天定时投喂3次团头鲂商品饲料(粗蛋白质含量为30%),每天定量投食,日投饲量为团头鲂体质量的3%左右,每周根据摄食和生长情况作适当调整。试验期间不换水,只补充因渗漏、蒸发及采样而丢失的水量。试验期间24 h不间断供氧,期间水温为18~24℃,pH 为 7.7~8.5,溶解氧浓度>5 mg/L。养殖水源为经过沉淀、过滤后的池塘水。试验过程中尽量减少人为干扰,防止对鱼产生额外应激,每日观察鱼摄食及死亡情况,发现死鱼及时捞出称重记数,并检查死亡原因。
养殖周期8周,每隔1周采集水样1次。采样时,在09:00用1 L柱状采水器在水泥池四角和中央采集水样5 L,混合待用。取混合水样550 mL,冷藏带回实验室用于检测相关水质指标。检测指标包括:氨氮(NH3-N)、亚硝酸盐氮()及生物絮团含量。生物絮团含量测定用1 L柱状采水器,分别于每组3个平行中取水样3 L混合,再取混合水样1 L倒入英霍夫锥形管中,静止沉淀30 min后,根据英霍夫锥形管所标刻度读数。
1.3 样品采集
在不同碳氮比组分别随机挑选3尾鱼,无菌采集肠道内容物,装入经焦碳酸二乙酯(DEPC)处理过的 Eppendrorf管中,经液氮预冻后,-80℃保存。
1.4 DNA提取和454焦磷酸测序及数据分析
分别提取不同碳氮比组中的肠道内容物样品DNA。DNA提取和PCR扩增参照Zhang等[11]的方法。PCR产物割胶回收,测定DNA浓度。每组的3个生物学重复的PCR产物,分别取100 ng等量混合。由上海美吉生物医药科技有限公司通过高通量测序平台454 GS FLT Titanium对样品16S rRNA基因的V3区进行测序。参照文献[12-15],将获得的序列通过Mothur软件,删掉长度小于200 bp的序列,根据DNA barcode将序列确定到每个样品,并去除barcode和引物序列件。去杂后的数据与Sliva数据库比对,利用Mothur软件分别进行二次去杂和去除嵌合体。将相似度大于97%的DNA序列归为1个操作分类单元(OUT),利用Mothur软件对序列进行OUT聚类,用于样品间的相似性分析,并绘制样品的稀疏曲线,评估不同样品的多样性。将序列提交至RDP数据库得到每条序列的分类单元(RDP分类对属的域值为0.5),物种分类单元为6层(界、门、纲、目、科、属),并分析零换水养殖条件下不同碳氮比对团头鲂鱼种肠道菌群相对丰度的影响。
1.5 变性梯度凝胶电泳测定方法
1.5.1 16S rDNA-V3 可变区的 PCR 扩增
本试验采取将DNA提取物稀释100倍的纯化方法。按文献[16]提供的扩增方法,采用带GC夹(GC-clamp)细菌通用引物341F(5'-CCTACGGGAGGCAGCAG-3')和 534R(5'-ATTACCGCGGCTGCTGG-3')进行细菌基因组DNA的扩增,GC-clamp序列为 CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGG GGGGG,扩增片段为细菌的16S rDNA的V3可变区。PCR扩增采用50μL体系,其中包括:10×LAPCR Buffer(Mg2+Plus)5 μL,10 mmol/L dNTP 4μL,10μmol/L 上、下游引物各 1μL,5 U/μL LATaq DNA 聚合酶 0.5 μL,50 ng/μL 模板 DNA 2.0 μL,灭菌去离子水 37.5 μL。整个过程采用降落PCR模式(touchdown-PCR),程序如下:94℃预变性5 min,94℃变性30 s,65℃退火30 s,72℃延伸90 s,之后每个循环退火温度降低0.5℃,循环20次,在这个退火温度下再进行15个循环,72℃最终延伸5 min。扩增产物用1%琼脂糖凝胶电泳检测。从琼脂糖凝胶中回收纯化PCR产物,采用大连宝生物工程公司的胶回收纯化试剂盒(TaKaRa Agarose Gel DNA Purification Kit)进行,过程参照试剂盒中的使用说明进行操作。
1.5.2 PCR 扩增产物的 DGGE
将PCR扩增产物通过DGGE进行分离,采用的凝胶变性梯度为35%~55%,浓度为8%的聚丙烯酰胺凝胶(化学变性剂为100%尿素7 mol/L和40%的丙烯酰胺),在 1×TAE缓冲液中 150 V 60℃下电泳5 h,电泳完毕后采用银染的方法进行染色,银染结束后利用凝胶成像仪观察并记录结果。
1.6 数据统计与分析
部分试验数据采用SPSS 16.0统计软件包中的单因素方差分析(one-way ANOVA)进行统计分析,若差异显著时,再进行Tukey’s多重比较,显著水平为 P<0.05,结果以平均值±标准误(mean±SE)表示。
2 结果与分析
2.1 零换水条件下养殖水体中碳氮比对水质的影响
由图1可知,零换水条件下养殖水体中不同碳氮比形成的生物絮团含量不同,CN20和CN24组生物絮团含量高于其他组;各组氨氮和亚硝酸盐氮含量在前期都出现了一个高峰,并均在第35天降到一个较低点,之后比较稳定;不同养殖时间时CN20和CN24组氨氮和亚硝酸盐氮含量均低于对照组。结果显示,碳氮比≥16时,生物絮团在一定程度上降低了水体中的氨氮和亚硝酸盐氮含量,进而改善了水质。
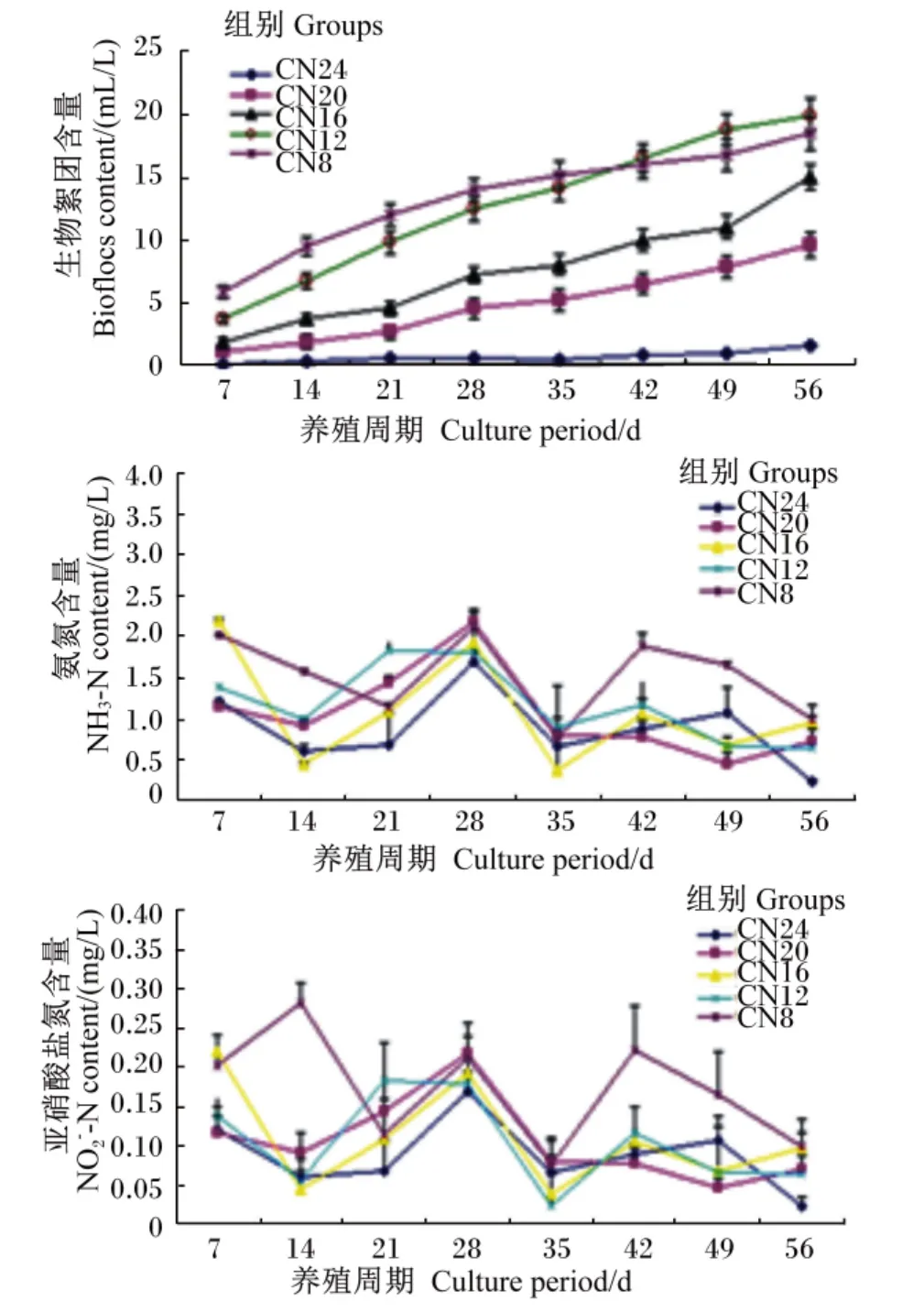
图1 各组养殖水体中生物絮团、氨氮、亚硝酸盐氮含量变化Fig.1 Changes of bioflocs,NH3-N andcontents in cultured water in different groups
2.2 零换水条件下养殖水体中碳氮比对团头鲂肠道菌群多样性的影响
图2 为不同碳氮比组团头鲂肠道菌群的稀疏曲线,横坐标代表随机抽取的测序数据量,纵坐标代表观测到的OUT数。相同序列数时低碳氮比(CN8和 CN12组)比高碳氮比(CN16、CN20、CN24组)的OUT数多,表明零换水养殖条件下高碳氮比时团头鲂肠道菌群多样性低于低碳氮比时,说明养殖水体中碳氮比能够影响团头鲂的肠道菌群的多样性。
2.3 零换水条件下养殖水体中碳氮比对团头鲂肠道菌群结构的影响
由表1可知,团头鲂鱼种肠道中厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)为优势菌,二者占菌群总量的80%以上。各组团头鲂肠道中放线菌门(Actinobateria)含量变化不显著(P>0.05)。与对照组相比,CN16和CN20组团头鲂肠道厚壁菌门含量显著增加(P<0.05),而梭杆菌门(Fusobacteria)和变形菌门含量显著减少(P<0.05)。对各组团头鲂肠道中厚壁菌门进行深入分析发现,在纲水平上其组成也各不相同(表2)。与对照组相比,CN16、CN20和CN24组团头鲂肠道中梭菌纲(Clostridia)含量显著减少(P>0.05),而芽孢杆菌纲(Baccilli)含量显著增加(P>0.05)。
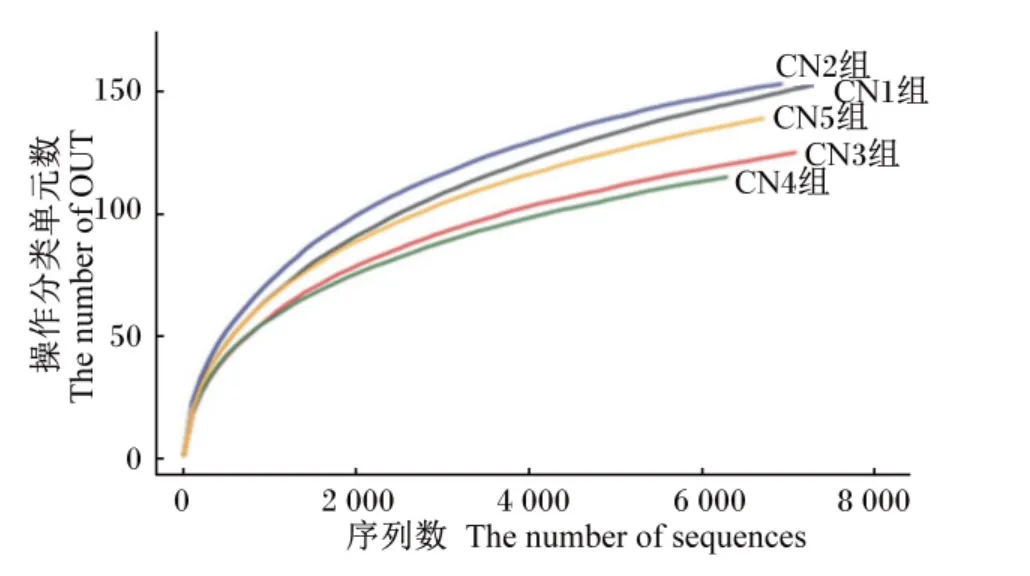
图2 各组团头鲂的肠道菌群稀疏曲线分析Fig.2 Rarefaction curve analysis of intestinal microflora of blunt anout bream(Megalobrama amblycephala)in different groups

表1 各组团头鲂的肠道菌群结构Table 1 Intestinal microflora structure of blunt anout bream(Megalobrama amblycephala)in different group %

表2 各组团头鲂肠道菌群中厚壁菌门在纲水平上的组成Table 2 Firmicutes composition by class in intestinal microflora of blunt anout bream(Megalobrama amblycephala)in different groups %
2.4 团头鲂肠道细菌16Sr DNA DGGE指纹图谱建立、聚类分析及相似系数分析
由图3可知,比较团头鲂肠道微生物16S rDNA V3可变区片段的DGGE指纹图谱中各条带的相对光密度发现,部分条带光密度变化明显受到不同养殖水体碳氮比的影响。有的条带在各组中均出现,如条带18;有的条带只在对照组中出现,如条带 1和 2,有的条带只在试验组(CN12、CN16、CN20和 CN24组)中出现,如条带 14、15和16。
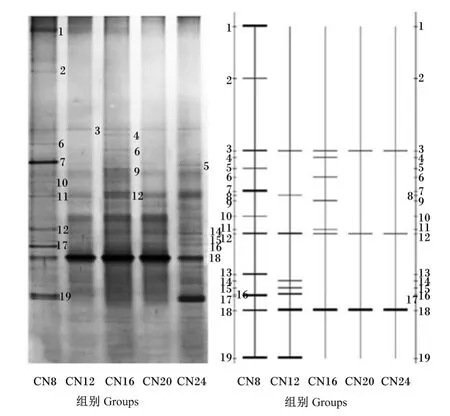
图3 不同碳氮比养殖条件下团头鲂肠道细菌16S r DNA DGGE指纹图谱Fig.3 Intestinal microflora 16S rDNA PCR-DGGE fingerprint of blunt anout bream(Megalobrama amblycephala)cultured in different C/N ratios
由图4可知,不同碳氮比养殖条件明显改变团头鲂幼鱼肠道的微生态环境,团头鲂肠道样品在聚类图上各自聚为一簇,其中碳氮比较高的2个组(CN20和CN24组)相似性最高,聚为一类后再与CN16组聚为一类;碳氮比的较低的对照组与其他组相似性最低,说明零换水养殖条件下适宜碳氮比能够保持团头鲂肠道细菌群落组成相对稳定性。

图4 不同碳氮比养殖条件下团头鲂肠道菌群的聚类分析Fig.4 Cluster anlysis of intestinal microflora of blunt anout bream(Megalobrama amblycephala)cultured in different C/N ratios
3 讨论
以色列学者Avbimelech系统地提出了养殖系统中投入的碳氮比对养殖系统水质调控的生物絮团反应机制理论,并将生物絮团技术应用到实际生产中,有效降低了养殖水体中的氨氮以及亚硝酸氮含量[2]。自2001年起,美国南卡罗来纳州已将生物絮团技术应用到海水对虾的养殖系统中,不仅可以调节水质,提高对虾成活率,而且可以转化残饵粪便,降低饲料系数,在高密度对虾养殖过程中效果尤为显著[17-18]。近几年,生物絮团技术也应用到罗非鱼(Oreochromis niloticus)[19]、草鱼(Ctenopharyngodon idellus)[20]和 鳙 (Aristichthys nobilis Richardson)[21]等淡水鱼类养殖中,本实验室近期研究表明,草食性鱼类团头鲂能够摄食生物絮团作为鱼类潜在的天然饵料,以降低鱼类的饲料系数并促进其生长[22]。生物絮团的形成需要依靠异养微生物,会消耗养殖水体的氨氮和亚硝酸盐氮作为其生长繁殖所需氮源,与此同时也需消耗大量有机碳源,合理的碳氮比是形成生物絮团的必要条件[23]。本试验结果表明,团头鲂养殖水体中适宜碳氮比能够有效增加水体中生物絮团含量,有效降低氨氮和亚硝酸盐氮含量,故此,生物絮团技术应用于团头鲂养殖适宜的碳氮比为≥16,该比值能促进生物絮团的形成,并能有效降低水中的氨氮、亚硝酸盐氮含量,这与卢炳国等[20]对草鱼的研究结果相一致。
夏耘等[24]报道,生物絮团优势菌与草鱼肠道内容物细菌构成上有相似之处。本研究发现,养殖水体中不同碳氮比形成的生物絮团对团头鲂肠道内容物中梭杆菌门和放线菌门含量无显著影响,而显著影响了厚壁菌门和变形菌门含量。当养殖水体中碳氮比为16~20时,厚壁菌门含量显著高于其他试验组,而变形菌门显著低于其他试验组。芽孢杆菌纲是厚壁菌门的一纲,包含有芽孢杆菌目和乳杆菌目2目,其下包含有芽孢杆菌属等革兰氏阳性菌,在维持动物肠道健康中起重要作用。变形菌门是革兰氏阴性细菌,是细菌中最大的一门,包括很多病原菌,如大肠杆菌、沙门氏菌、弧菌、螺杆菌等种类[25]。已有研究报道,芽孢杆菌(Bacillus)为絮团培养至10 d时的特异菌,也是一类重要的产絮菌[26-27]。沈斌乾等[28]研究发现,芽孢杆菌能改善养殖用水水质,作为饲料添加剂使用时能促进养殖动物生长,提高机体免疫及抗病能力。值得关注的是,本研究采用焦磷酸测序法发现了团头鲂肠道中存在蓝菌门,蓝菌又称蓝藻、蓝细菌、蓝绿菌或蓝绿藻,原被认为是一门藻类植物,后有人把蓝菌划为原核生物的一门,称为蓝菌门(Cyanobacteria)[25],这或许与团头鲂的草食食性相关。由此可见,整个肠道菌群的数量和适当的比例对于维持肠道内环境微生态平衡以及鱼类的肠道健康等有重要意义,而团头鲂肠道菌群结构随养殖水体环境的变化而改变,这与Wu等[15]对草鱼的研究结果相吻合。
变性凝胶电泳图谱分析结果也发现,养殖水体中适宜的碳氮比形成的生物絮团能够改变团头鲂的肠道菌群结构。江晓浚等[22]发现,团头鲂能够摄食生物絮团,并且添加不同碳源形成的生物絮团显著影响团头鲂生长、消化酶活性和抗氧化能力,故此推测,团头鲂通过摄食不同含量生物絮团改变了其肠道菌群结构。不同碳氮比形成的生物絮团存在着特定的生态位群落结构,陶金莉等[29]提供了一个比较合理的解释,芽孢杆菌属通过寡肽介导的群体效应实现自身能力维持及孢子的形成,气单胞菌属通过群体效应产生胞外蛋白酶,并能促进生物膜的形成,对生物絮团结构的维持可能起到一定作用。由此可见,零换水养殖水体中不同含量的生物絮团对维持团头鲂肠道内环境微生态平衡具有重要作用。
4 结 论
①养殖水体中碳氮比增加,团头鲂肠道菌群多样性降低,团头鲂肠道中厚壁菌门含量显著增加,梭杆菌门和变形菌门含量显著降低。
②以团头鲂肠道菌群结构为评价指标,零换水条件下团头鲂养殖水体中适宜碳氮比为16~20。
[1] DE SCHRYVER P,VERSTRAETE W.Nitrogen removal from aquaculture pond water by heterotrophic nitrogen assimilation in lab-scale sequencing batch reactors[J].Bioresource Technology,2009,100(3):1162-1167.
[2] AVNIMELECH Y.Carbon/nitrogen ratio as a control element in aquaculture systems[J].Aquaculture,1999,176(3/4):227-235.
[3] EGLI K,LANGER C,SIEGRIST H R,et al.Community analysis of ammonia and nitrite oxidizers during start-up of nitritation reactors[J].Applied and Environmental Microbiology,2003,69(6):3213-3222.
[4] FIGUEROLA E L M,ERIJMAN L.Bacterial taxa abundance pattern in an industrial wastewater treatment system determined by the full rRNA cycle approach[J].Environmental Microbiology,2007,9(7):1780-1789.
[5] STAMPER D M,WALCH M,JACOBS R N.Bacterial population changes in a membrane bioreactor for graywater treatment monitored by denaturing gradient gel electrophoretic analysis of 16S rRNA gene fragments[J].Applied and Environmental Microbiology,2003,69(2):852-860.
[6] WANG X H,WEN X H,YAN H J,et al.Bacterial community dynamics in a functionally stable pilotscale wastewater treatment plant[J].Bioresource Technology,2011,102(3):2352-2357.
[7] ROESCH L F W,FULTHORPE R R,RIVA A,et al.Pyrosequencing enumerates and contrasts soil microbial diversity[J].The ISME Journal,2007,1(4):283-290.
[8] TURNBAUGH P J,HAMADY M,YATSUNENKO T,et al.A core gut microbiome in obese and lean twins[J].Nature,2009,457(7228):480-484.
[9] 周小洁,佟颖,钱坤,等.454测序技术在医学昆虫研究中的应用[J].寄生虫与医学昆虫学报,2012,19(2):116-121.
[10] 张小平,王一冰,邓斌,等.添加不同益生菌对草鱼养殖水体菌群结构的影响[J].水生生物学报,2014,38(3):459-466.
[11] ZHANG X P,FU L Q,DENG B,et al.Bacillus subtilis SC02 supplementation causes alterations of the microbial diversity in grass carp water[J].World Journal of Microbiology and Biotechnology,2013,29(9):1645-1653.
[12] SCHLOSS P D,WESTCOTT S L,RYABIN T,et al.Introducing mothur:open-source,platform-independent,community-supported software for describing and comparing microbial communities[J].Applied and Environmental Microbiology,2009,75(23):7537-7541.
[13] PRUESSE E,QUAST C,KNITTEL K,et al.SILVA:a comprehensive online resource for quality checked and aligned ribosomal RNA sequence data compatible with ARB[J].Nucleic Acids Research,2007,35(21):7188-7196.
[14] WANG Q,GARRITY G M,TIEDJE J M,et al.Naïve Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Applied and Environmental Microbiology,2007,73(16):5261-5267.
[15] WU SG,WANG G T,ANGERT E R,et al.Composition,diversity,and origin of the bacterial community in grass carp intestine[J].PLoS One,2012,7(2):e30440.
[16] 李晓,李冰,董玉峰,等.精养团头鲂池塘沉积物微生物群落的结构特征及组成多样性分析[J].水产学报,2013,28(2):218-227.
[17] BURFORD M A,THOMPSON P J,MCINTOSH R P,et al.The contribution of flocculated material to shrimp(Litopenaeus vannamei)nutrition in a high-intensity,zero-exchange system[J].Aquaculture,2004,232(1/2/3/4):525-537.
[18] KUHN D D,LAWRENCE A L,BOARDMAN G D,et al.Evaluation of two types of bioflocs derived from biological treatment of fish effluent as feed ingredients for Pacific white shrimp,Litopenaeus vannamei[J].Aquaculture,2010,303(1/2/3/4):28-33.
[19] CRAB R,KOCHVA M,VERSTRAETE W,et al.Bioflocs technology application in over-wintering of tilapia[J].Aquacultural Engineering,2009,40(3):105-112.
[20] 卢炳国,王海英,谢骏,等.不同C/N水平对草鱼池生物絮团的形成及其水质的影响[J].水产学报,2013,37(8):1220-1228.
[21] 李朝兵.生物絮团作为鳙饵料的研究与应用[D].博士学位论文.上海:上海海洋大学,2012:27-37.
[22] 江晓浚,孙盛明,戈贤平,等.添加不同碳源对零换水养殖系统中团头鲂鱼种生长、肠道生化指标和水质的影响[J].水产学报,2014,38(8):1113-1122.
[23] HARI B,KURUP B M,VARGHESE J T,et al.The effect of carbohydrate addition on water quality and the nitrogen budget in extensive shrimp culture systems[J].Aquaculture,2006,252(2/3/4):248-263.
[24] 夏耘,郁二蒙,谢骏,等.基于PCR-DGGE技术分析生物絮团的细菌群落结构[J].水产学报,2012,36(10):1563-1571.
[25] BUCHANAN R E.伯杰细菌鉴定手册[M].8 版.中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译.北京:科学出版社,1984:729-735.
[26] SHIH I L,YAN Y T,YEH L C,et al.Production of a biopolymer flocculant from Bacillus licheniformis and its flocculation properties[J].Bioresource Techenology,2001,78(3):267-272.
[27] VIJAYALAKSHMI S P,RAICHUR A M.The utility of Bacillus subtilis as a bioflocculant for fine coal[J].Colloids and Surfaces B:Biointerfaces,2003,29(4):265-275.
[28] 沈斌乾,陈建明,郭建林,等.饲料中添加枯草芽孢杆菌对青鱼生长、消化酶活性和鱼体组成的影响[J].水生生物学报,2013,37(1):48-53.
[29] 陶金莉,迟莉丽,沈亚领,等.细菌的群体行为调控机制-Quorum sensing[J].微生物学通报,2004,31(4):106-110.
