γ-谷维素对脂多糖诱导巨噬细胞RAW264.7炎症因子表达的影响
2015-12-20刘远锦田媛媛李新华陈娅娅曾琳娜林亲录罗非君
刘远锦,田媛媛,刘 博,李新华,陈娅娅,曾琳娜,杨 涛,林亲录,罗非君,*
(1.中南林业科技大学食品科学与工程学院,稻谷及副产物深加工国家工程实验室,湖南长沙 410004;2.中南大学湘雅医院消化内科,湖南长沙 410008)
γ-谷维素对脂多糖诱导巨噬细胞RAW264.7炎症因子表达的影响
刘远锦1,田媛媛1,刘 博1,李新华2,陈娅娅1,曾琳娜1,杨 涛1,林亲录1,罗非君1,*
(1.中南林业科技大学食品科学与工程学院,稻谷及副产物深加工国家工程实验室,湖南长沙 410004;2.中南大学湘雅医院消化内科,湖南长沙 410008)
利用细菌脂多糖(lipopolysaccharide,LPS)刺激巨噬细胞RAW264.7形成炎症模型,评价γ-谷维素对巨噬细胞炎症因子表达的影响。在LPS刺激的RAW264.7细胞培养基中,添加不同浓度的γ-谷维素,分析培养基中炎症因子白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6 (interleukin-6,IL-6)的含量,以及NO2-/NO3-含量,发现γ-谷维素能抑制炎症因子的分泌;利用实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qPCR)分析mRNA表达水平,确定γ-谷维素能抑制炎症因子的基因表达;采用Western blotting分析进一步确定γ-谷维素能抑制炎症因子的蛋白表达。综上所述,γ-谷维素能明显抑制炎症因子IL-1β、TNF-α、IL-6、NO等分泌和表达。
γ-谷维素;炎症;炎症因子;米糠
米糠是稻谷加工的主要副产物之一,谷维素是米糠提取物之一,可能具有抗炎的作用。有研究发现,米糠提取物可以降低Ⅱ型糖尿病大鼠体内脂肪组织中的炎症标记物表达量[1];非绝经期的肥胖女性经常摄入糙米能降低体内炎症标记物的表达水平[2]。在临床医疗中,谷维素是调节植物神经的常用药物,但徐百胜等[3]采用谷维素与柳氮磺吡啶联用治疗溃疡性结肠炎,发现谷维素能增强抗炎疗效,提示谷维素具有抗炎的功能。在佛波酯诱导的小鼠皮炎模型中,谷维素及其主要活性成分均能显著抑制小鼠的炎症反应[4]。本课题组最近的研究也发现γ-谷维素可抑制葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的小鼠急性和慢性溃疡性结肠炎[5]。以上研究结果揭示谷维素可能具有抗炎作用,但迄今为止,其抗炎的分子机理尚不清楚。
脂多糖(lipopolysaccharide,LPS)是由脂质和多糖由共价键相连组成的,它是革兰氏阴性细菌外膜的主要组成部分,当机体被细菌感染或出现败血症时,肠道黏膜屏障破坏,导致LPS进入血液,LPS结合到CD14/Toll样受体上,促使免疫细胞大量分泌肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)、白细胞介素-1β (interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)和NO等炎症因子,导致机体全身性炎症反应[6-7]。本研究采用LPS诱导巨噬细胞RAW264.7形成炎症模型,在分子水平探讨γ-谷维素对炎症因子表达的影响。
1 材料与方法
1.1 材料与试剂
小鼠单核巨噬细胞RAW264.7 无锡博慧斯生物医药科技有限公司;γ-谷维素(纯度99%) 日本OSHA Haz有限公司;DSS(纯度99%)、LPS(纯度99%)美国Sigma公司。
高糖DMEM培养基 美国Hyclone公司;胎牛血清(fetal bovine serum,FBS) 浙江天杭生物科技有限公司;反转录试剂盒、荧光SYBR 北京全式金生物技术有限公司;鼠IL-1β酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)试剂盒、鼠TNF-α ELISA试剂盒、鼠IL-6 ELISA试剂盒 美国R&D公司;β-actin抗体、IL-1β抗体、TNF-α抗体、IL-6抗体、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗体 美国Cell Signaling公司;二抗Anti-rabbit IgG-HRP (SC-2004)、Anti-mouse IgG-HRP(SC-2005) 美国Santa Cruz公司;化学发光底物 美国Pierce公司;其他试剂均为国产分析纯。
1.2 方法
1.2.1 RAW264.7细胞培养与分组
RAW246.7巨噬细胞用含10%胎牛血清、5%青链霉素混合液的DMEM高糖培养基培养。隔天传代,生长至80%~90%时,采用磷酸盐缓冲液(phosphate buffered saline,PBS)清洗两次,加入0.25%胰酶在37 ℃消化6~8 min,用移液器打散细胞后1∶2传代,37 ℃、5% CO2培养箱中培养。LPS采用纯水溶解,γ-谷维素采用质量分数1%的四氢呋喃溶液溶解,再用纯水稀释,使四氢呋喃在培基中最终质量分数为0.1%。培养的RAW246.7细胞经胰酶消化后,接种于6 孔板,分为4 组进行处理:对照组,单纯LPS处理组,高、低浓度γ-谷维素组。高、低浓度γ-谷维素组中分别加入12.5、25 μmol/L γ-谷维素预处理30 min后加入终质量浓度为1 μg/mL的LPS,单纯LPS处理组仅加入LPS溶液和四氢呋喃,对照组加入蒸馏水和四氢呋喃,使4 组细胞培养基中四氢呋喃最终质量分数均为0.1%,细胞培养24 h后,分别收集培养基和细胞做进一步分析。
1.2.2 γ-谷维素对RAW264.7细胞的毒性
采用四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)比色法测定γ-谷维素和LPS对细胞是否有毒性作用[8-9]。取对数生长期的RAW246.7细胞,消化后吹打均匀,用培养基稀释至细胞密度为7×104个/mL,以每孔100 μL接种于96 孔板中,置于37 ℃、5% CO2培养箱中培养。待细胞贴壁后,每孔加入2 μL的γ-谷维素溶液,使得四氢呋喃最终质量分数为0.1%,γ-谷维素的终浓度分别为0、3.125、6.25、12.5、25、50、100 μmol/L。每组设置5 个重复孔。轻轻振荡,放入培养箱培养20 h后,每孔加入20 μL MTS(3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium, inner salt)溶液。再次培养4 h后,采用酶标仪在490 nm波长处测定每个孔的光密度值。
1.2.3 ELISA法检测炎症因子TNF-α、IL-6和IL-1β的含量
TNF-α、IL-6和IL-1β是重要的炎症因子。按照1.2.1节方法将RAW246.7细胞分为4 组并做相应处理,每组3 个重复,培养24 h后取细胞培养液,室温条件下1 000×g离心10 min,收集细胞培养液。严格按照试剂盒说明书步骤操作。绘制出标准曲线,测定细胞培养基中TNF-α、IL-6和IL-1β的含量。
1.2.4 NO2-/NO3-含量检测
巨噬细胞受到LPS信号的刺激会释放NO,但NO非常不稳定,会形成亚硝酸盐(NO2-)和硝酸盐(NO3-)。取对数生长期的RAW246.7细胞消化,稀释成5×105个/mL细胞悬浮液,接种于24 孔板中,每孔1 mL。24 h后,弃掉旧培养基,加入新培养基,每孔加入LPS使其终质量浓度为1 μg/mL,加入γ-谷维素使其终浓度分别为12.5、25 μmol/L,四氢呋喃终质量分数为0.1%。培养24 h后,取细胞培养液按照NO试剂盒说明书方法进行操作,测定NO含量(以NO2-/NO3-表示,为NO2-和NO3-的总量)。按照下式计算NO2-/NO3-含量。

式中:20 μmol/L为标准品浓度;n为样品测定前的稀释倍数;空白组为未加细胞只有培养基的处理。
1.2.5 实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qPCR)分析基因mRNA表达水平
6 孔板培养RAW246.7细胞,用不同浓度γ-谷维素处理,LPS刺激12 h后,用PBS清洗2 次,以Trizol提取细胞总RNA,0.8%琼脂糖胶电泳检测RNA的完整性并测定其浓度,用反转录试剂盒合成cDNA后进行PCR扩增反应。iNOS:上游引物5’-CAG CTG GGC TGT ACA AAC CTT-3’,下游引物5’-CAT TGG AAG TGA AGC GTT TCG-3’;TNF-α:上游引物5’-CAA AAT TCG AGT GAC AAG CCT G-3’,下游引物5’-GAG ATC CAT GCC GTT GGC-3’;IL-1β:上游引物5’-GAG CAC CTT CTT TTC CTT CAT CTT-3’,下游引物5’-TCA CAC ACC AGC AGG TTA TCA TC-3’;IL-6:上游引物5’-ATG GAT GCT ACC AAA CTG GAT-3’,下游引物5’-TGA AGG ACT CTG GCT TTG TCT-3’;β-actin:上游引物5’-CCA TAA ACG ATG CCG GA-3’,下游引物5’-CAC CAC CCA TAG AAT CAA GA-3’。qPCR反应条件:94 ℃,3 min;94 ℃,30 s;60 ℃,40 s;72 ℃,1 min;40 个循环。
1.2.6 Western blotting分析
将RAW264.7细胞用γ-谷维素和LPS处理24 h后,PBS清洗2 次,用含苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)的RIPA裂解液(50 mmol/L Tris-HCl (pH 7.4)、150 mmol/L NaCl、1% NP-40、0.1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS))裂解后,5 000×g离心10 min,取上清液。取10 μL蛋白质裂解液,直接采用Nanodrop仪测定蛋白质浓度,取20 μg的蛋白质样品进行SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gelelectrophoresis,SDS-PAGE),再转移到硝酸纤维素膜上。将硝酸纤维膜在含有5%脱脂奶粉的PBST(PBS和Tween-20混合)中封闭1 h。一抗孵育过夜(稀释比例为1∶1 000),孵育后用PBST清洗4 次,室温条件下二抗孵育2 h(稀释比例为1∶1 000)。继续用PBST清洗4 次。加入化学发光底物,X光片曝光、显影、定影显示阳性条带,样本结果用看家蛋白β-actin条带作为内参校正。
1.3 统计学分析
实验数据用SPSS 17.0统计软件进行处理,数据结果以±s表示,组间比较采用方差分析和t检验,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 γ-谷维素对RAW246.7细胞的毒性作用分析
如图1所示,不同浓度γ-谷维素作用于RAW246.7细胞24 h后,对照组和实验组细胞存活率分别为:(100±2.03)%、(103.99±4.98)%、(107.65±9.05)%、(103.58±3.90)%、(111.24±12.15)%、(106.38±6.37)%、(97.96±7.20)%。与对照组相比,不同浓度γ-谷维素处理后,细胞活力均无明显改变(P>0.05),提示0~100 μmol/L的γ-谷维素对RAW264.7细胞无明显的毒性作用,该模型可用于后续实验。后续研究将选用1 μg/mL LPS(经典处理剂量)刺激RAW246.7细胞建立细胞炎症模型,采用12.5、25 μmol/L γ-谷维素来评估其抗炎功效及分子机理。

图1 1 γ--谷维素对RAW264.7细胞的毒性作用Fig.1 Effect of γ-oryzanol on the viability of RAW264.7 cells
2.2 γ-谷维素对LPS诱导RAW264.7细胞炎症因子分泌量的影响
LPS和γ-谷维素处理RAW246.7细胞24 h后,收集细胞培养液,离心取上清液,测定细胞炎症因子的分泌量,结果见图2。


图2 2 γ-谷维素对LPS诱导RAW264.7细胞炎症因子分泌量的影响Fig.2 Effect of γ-oryzanol on the production of infl ammatory factors in LPS-stimulated RAW264.7 cells
如图2所示,ELISA分析结果显示,加入LPS刺激后,培养基中IL-1β含量从(15.31±3.12)pg/L增加至(96.32±14.53)pg/L,12.5、25 μmol/L γ-谷维素处理后,培养基中IL-1β含量分别为(40.15±6.56)、(35.31±5.87) pg/L,相对于单纯LPS处理组,γ-谷维素处理可极显著抑制RAW246.7细胞分泌IL-1β (P<0.01)(图2A)。γ-谷维素也能抑制TNF-α的分泌,12.5、25 μmol/L γ-谷维素处理后,培养基中TNF-α含量从(656.32±98.37) μg/L分别降至(475.86±130.78)、(290.62±75.46) μg/L,其中25 μmol/L γ-谷维素处理组与单纯LPS处理组相比具有极显著差异(P<0.01)(图2B)。LPS刺激RAW264.7细胞炎症模型中,培养基中IL-6含量从(11.13±0.19) pg/L上升至(89.28±3.75) pg/L,12.5、25 μmol/L γ-谷维素处理后,培养基中IL-6含量分别降低至(70.84±1.24)、(61.54±2.78)pg/L(P<0.01)(图2C)。在炎症反应中,巨噬细胞释放的NO非常不稳定,在培养基中形成会形成亚硝酸盐(NO2-)和硝酸盐(NO3-),NO测定试剂盒将硝酸盐还原为亚硝酸盐,确定培基中NO的释放量,结果发现γ-谷维素亦能抑制NO的释放,12.5、25 μmol/L γ-谷维素处理后,培养基中NO2-/NO3-浓度从(135.47±4.85)μmol/L分别降至(90.48±9.48)、(64.06±4.53)μmol/L(P<0.01)(图2D)。
2.3 γ-谷维素对细胞炎症因子和iNOS mRNA表达水平的影响
如图3所示,单纯LPS处理RAW246.7细胞12 h后,IL-1β mRNA相对表达量从1.00±0.31增加至15.31±3.12,12.5、25 μmol/L γ-谷维素处理后,RAW246.7细胞的IL-1β mRNA相对表达量分别为10.02±1.82和5.12±1.09,相对于单纯LPS处理组,γ-谷维素处理可极显著抑制IL-1β mRNA转录(P<0.01)。γ-谷维素也能抑制TNF-α mRNA转录,12.5、25 μmol/L γ-谷维素处理后,RAW246.7细胞的TNF-α mRNA相对表达量从4.08±0.41(单纯LPS处理组)分别降至2.61±0.54 和1.81±0.31,与单纯LPS处理组相比具有极显著差异(P<0.01)。LPS刺激RAW264.7细胞炎症模型中,IL-6 mRNA相对表达量为4.57±1.38,12.5、25 μmol/L γ-谷维素处理后,RAW246.7细胞的IL-6 mRNA相对表达量分别降至2.25±0.47和1.96±0.45。在炎症反应中,iNOS高表达是促使炎症因子NO释放的重要条件之一,本研究发现,γ-谷维素亦能抑制iNOS基因的转录,12.5 μmol/L γ-谷维素处理后,RAW246.7细胞的iNOS mRNA相对表达量从8.07±1.54下降到6.01±1.82 (P<0.05);25 μmol/L γ-谷维素处理后,iNOS mRNA相对表达量则降至3.17±1.25(P<0.01)。
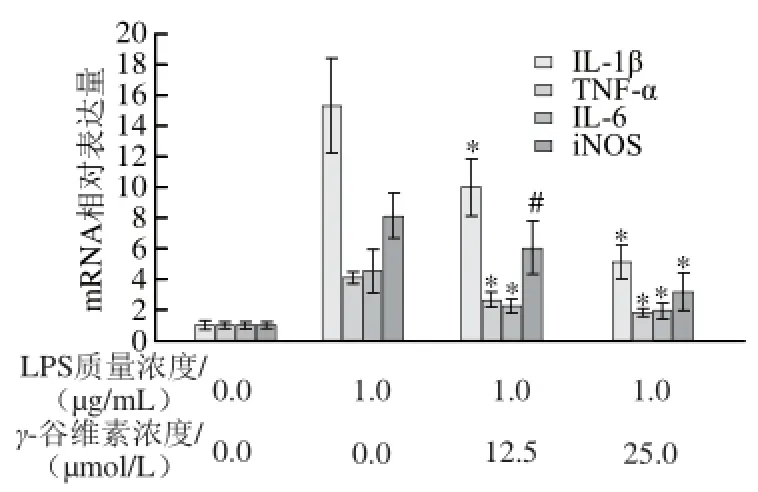
图 33 γ-谷维素对LPS刺激RAW264.7细胞炎症因子和iiNNOOSS mRNA表达水平的影响Fig.3 Effect of γ-oryzanol on mRNA expression of infl ammatory factors and iNOS in LPS-stimulated RAW264.7 cells
2.4 γ-谷维素对炎症因子和iNOS蛋白表达水平的影响


图4 Western blotting分析γ-谷维素细胞炎症因子和iNOS蛋白表达的影响Fig.4 Effect of γ-oryzanol on protein expression of infl ammatory factors and iNOS in LPS-stimulated RAW264.7 cells
如图4所示,Western blotting分析结果表明,LPS处理RAW246.7细胞24 h后,IL-1β、TNF-α、IL-6和iNOS蛋白表达水平明显上升,而在对照组(0、0)中其表达水平非常低。与单纯LPS处理组相比,γ-谷维素处理后,RAW246.7细胞中各种炎症因子水平均有所下降。
3 讨 论
炎症是机体针对外界病毒、化学物质入侵而发起的维持机体稳态的自发反应。大量研究表明,炎症因子的异常激活与众多疾病有密切的关系[10-11]。如有研究表明慢性炎症与癌变密切相关,参与机体的癌变演进[12-13]。Sun 等[14]研究发现炎症因子的高表达与癌细胞的药物抗性密切相关,IL-6的高表达可以提高乳腺癌患者对他莫昔芬(一种抗雌激素)的耐药性。溃疡性结肠炎是一种常见的慢性炎症,其病因复杂,常反复发作并逐渐加重,在溃疡性结肠炎组织中存在大量炎症因子的表达。因此,对炎症因子的调控具有非常重要的意义,特别是利用食品中的营养成分来控制炎症因子的表达具有副作用少等突出优点。
γ-谷维素主要存在于米糠油及其油脚中,米糠层中γ-谷维素的含量为0.3%~0.5%。在加温压榨米糠时,γ-谷维素溶于油中,一般毛糠油中γ-谷维素的含量约为2%~3%。随着研究的深入,目现已发现γ-谷维素具有多种药理活性,如抗氧化、降脂、调节机体植物神经紊乱等[15-18]。本研究以RAW246.7巨噬细胞为材料,明确了γ-谷维素对LPS刺激细胞所产生的炎症反应具有明显的抑制作用,为γ-谷维素抗炎功效研究提供了新的实验依据。当前已有医生在临床上将γ-谷维素用于患者的抗炎辅助治疗中[3,19],但还亟需提供这方面的实验依据支持。
本研究发现γ-谷维素能抑制主要炎症因子IL-1β、TNF-α、IL-6和NO等表达,其抗炎作用体现出了多靶点性。也有研究表明,炎症因子之间可能会存在一些自我加强的作用,如在正常情况下,细胞产生的IL-6基础分泌量很少,在有外界刺激时,如在感染、创伤、TNF-α影响下,可触发细胞内IL-6释放或合成[20-21]。NO作为一种重要的细胞间信息交流调节因子,其过量释放与炎症的产生有密切关系,其中iNOS是合成NO重要的限速酶,NO释放往往与iNOS酶高表达有关[20]。关丽华等[21]研究发现,在溃疡性结肠炎模型中,iNOS表达升高,NO释放量增加。通过对iNOS基因转录调控的研究发现其基因受核转录因子-κB(nuclear factor-κB,NF-κB)的调控[22]。Sakai 等[23]发现在牛动脉内皮细胞中γ-谷维素能抑制NF-κB的活化,减少细胞黏附分子VCAM-1和ICAM-1的表达。同时,已有研究证实IL-1β、TNF-α、IL-6和iNOS这4 个基因的启动子中均存在NF-κB的结合位点,其表达受NF-κB活性的调控[24-27],提示γ-谷维素也可能通过抑制NF-κB的活化起作用,但需要进一步证实γ-谷维素是否能抑制NF-κB的核转运及其与顺式调控元件的结合能力。虽然本实验证实了γ-谷维素能抑制巨噬细胞炎症因子的表达,但其调控炎症因子表达的信号转导通路尚需进一步探索。
本研究利用MTT实验发现在0~100 μmol/L浓度范围内,γ-谷维素对巨噬细胞均无明显毒性作用,这将有利于今后γ-谷维素相关功能性食品和保健品的研发。
总之,本研究在评估γ-谷维素抗炎功效的基础上,对γ-谷维素抗炎的分子机理进行了初步的探索,明确了γ-谷维素能明显抑制炎症因子IL-1β、TNF-α、IL-6和NO的分泌和表达。对其分子机理的深入研究,将促进含γ-谷维素的功能食品及保健品的开发,同时,也能为人们的膳食方案提供科学的理论依据。
[1] CANDIRACCI M, LUISA JUSTO M, CASTANO A, et al. Rice bran enzymatic extract supplemented diets modulate adipose tissue infl ammation markers in Zucker rats[J]. Nutrition, 2014, 30(4): 466-472.
[2] KAZEMADEH M, SAFAVI S M, NEMATOLLAHI S, et al. Effect of brown rice consumption on infl ammatory marker and cardiovascular risk factors among overweight and obese non-menopausal female adults[J]. International Journal of Preventive Medicine, 2014, 5(4): 478-488.
[3] 徐百胜. γ-谷维素、柳氮磺吡啶联用治疗溃疡性结肠炎的疗效观察[J].临床和实验医学杂志, 2011, 2(1): 127-128.
[4] YASUKAWA K, AKIHISA T, KIMURA Y, et al. Inhibitory effect of cycloartenol ferulate, a component of rice bran, on tumor promotion in two-stage carcinogenesis in mouse skin[J]. Biological & Pharmaceutical Bulletin, 1998, 21(10): 1072-1076.
[5] 李辉. 米糠γ-谷维素抗急性肠炎的功能评价及初步机理研究[D]. 长沙: 中南林业科技大学, 2014: 18-30.
[6] LI Meng, ZHANG Lei, CAI Runlan, et al. Lipid-soluble extracts from Salvia miltiorrhiza inhibit production of LPS-induced inflammatory mediators via NF-κB modulation in RAW 264.7 cells and perform antiinflammatory effects in vivo[J]. Phytotherapy Research, 2012, 26(8): 1195-1204.
[7] RYU S, SHIN J S, CHO Y W, et al. Fimasartan, anti-hypertension drug, suppressed inducible nitric oxide synthase expressions via nuclear factor-kappa B and activator protein-1 inactivation[J]. Biological & Pharmaceutical Bulletin, 2013, 36(3): 467-474.
[8] CHOU S T, PENG H Y, HSU J C, et al. Achillea millefolium L. essential oil inhibits LPS-induced oxidative stress and nitric oxideproduction in RAW 264.7 macrophages[J]. International Journal of Molecular Science, 2013, 14(7): 12978-12993.
[9] RAETZ C R H, WHITFIELD C. Lipopolysaccharide endotoxins[J]. Annual Review of Biochemistry, 2002, 71: 635-700.
[10] LI Xiaojun, JIANG Jiaye, SHI Songshan, et al. A RG-II type polysaccharide purified from Aconitum coreanum alleviates lipopolysaccharide-induced inflammation by inhibiting the NF-κB signal pathway[J]. PLoS ONE, 2014, 9(6): e99697-e99705. doi: 10.1371/journal.pone.0099697.
[11] LI Weidong, CHEN Cihui, SAUD S M, et al. Fei-Liu-Ping ointment inhibits lung cancer growth and invasion by suppressing tumor inflammatory microenvironment[J]. BMC Complementary and Alternative Medicine, 2014, 14: 153-159.
[12] LANDSKRON G, de la FUENTE M, THUWAJIT P, et al. Chronic Inflammation and cytokines in the tumor microenvironment[J/OL]. Journal of Immunology Research, 2014. http://dx.doi.org/10.1155/2014/149185.
[13] BALKWILL F,MANTOVANI A. Cancer and inflammation: implications for pharmacology and therapeutics[J]. Clinical Pharmacology & Therapeutics, 2010, 87(4): 401-406.
[14] SUN X, MAO Y, WANG J, et al. IL-6 secreted by cancer-associated fibroblasts induces tamoxifen resistance in luminal breast cancer[J]. Oncogene, 2014, 33(35): 4450-4457.
[15] 田媛媛, 林亲录, 罗非君. 米糠γ-谷维素生理功能研究新进展[J]. 粮食与油脂, 2013, 26(9): 43-46.
[16] 龚院生, 姚惠源. γ-谷维醇清除自由基作用的研究[J]. 中国粮油学报, 2003, 18(1): 10-12.
[17] ISLAM M S, NAGASAKA R, OHARA K, et al. Biological abilities of rice bran-derived antioxidant phytochemicals for medical therapy[J]. Current Topics in Medicinal Chemistry, 2011, 11(14): 1847-1853.
[18] GOUFO P, TRINDADE H. Rice antioxidants: phenolic acids, fl avonoids, anthocyanins, proanthocyanidins, tocopherols, tocotrienols, γ-oryzanol, and phytic acid[J]. Food Science Nutrition, 2014, 2(2): 75-104.
[19] 雷培森, 赵红. 甲硝唑、谷维素、维生素B1联合治疗溃疡性结肠炎[J].综合临床医学, 1995, 4(2): 215-216.
[20] 李昕, 刘佳佳. IL-6对中性粒细胞在炎症中作用的影响[J]. 国外医学免疫学分册, 2005, 28(5): 277-280.
[21] 关丽华, 龚玉芳, 张弘, 等. 结肠康对恶唑酮诱导小鼠溃疡性结肠炎MPO、NO、iNOS的影响[J]. 中成药, 2013, 35(4): 669-673.
[22] ATREYA I, ATREYA R, NEURATH M F. NF-κB in infl ammatory bowel disease[J]. Journal of Internal Medicine, 2008, 263(6): 591-596.
[23] SAKAI S, MURATA T, TSUBOSAKA Y, et al. γ-Oryzanol reduces adhesion molecule expression in vascular endothelial cells via suppression of nuclear factor-κB activation[J]. Journal of Agricultural and Food Chemistry, 2012, 60(13): 3367-3372.
[24] COGSWELL J P, GODLEVSKI M M, WISELY G B, et al. NF-kappa B regulates IL-1 beta transcription through a consensus NF-kappa B binding site and a nonconsensus CRE-like site[J]. Journal of Immunology, 1994, 153(2): 712-723.
[25] MATSUSAKA T, FUJIKAWA K, NISHIO Y, et al. Transcription factors NF-IL6 and NF-kappa B synergistically activate transcription of the inflammatory cytokines, interleukin 6 and interleukin 8[J]. Proceedings of the National Academy of Sciences, 1993, 90(21): 10193-10197.
[26] TREDE N S, TSYTSYKOVA A V, CHATILA T, et al. Transcriptional activation of the human TNF-alpha promoter by superantigen in human monocytic cells: role of NF-kappa B[J]. Journal of Immunology, 1995, 155(2): 902-908.
[27] XIE Q W, KASHIWABARA Y, NATHAN C. Role of transcription factor NF-kappa B/Rel in induction of nitric oxide synthase[J]. Journal of Biological Chemistry, 1994, 269(7): 4705-4708.
Effect of γ-Oryzanol on the Expression of Lipopolysaccharide-Induced Infl ammatory Factors in Macrophages
LIU Yuanjin1, TIAN Yuanyuan1, LIU Bo1, LI Xinhua2, CHEN Yaya1, ZENG Linna1, YANG Tao1, LIN Qinlu1, LUO Feijun1,*
(1. National Engineering Laboratory for Deep Processing of Rice and Byproducts, College of Food Science and Engineering, Central South University of Forestry and Technology, Changsha 410004, China; 2. Department of Gastroenterology, Xiangya Hospital, Central South University, Changsha 410008, China)
In this study, we used macrophage models of lipopolysaccharide (LPS)-stimulated infl ammation to evaluate the effect of γ-oryzanol on the expression of infl ammatory factors. After exposing RAW264.7 cells to different concentrations of γ-oryzanol and LPS, we analyzed the contents of IL-1β, TNF-α, IL-6 and NO2-/NO3-(NO) in the macrophage culturemedium and found that γ-oryzanol could inhibit the secretion of inflammatory factors. Real-time quantitative PCR was employed to analyzed mRNA expression levels of IL-1β, TNF-α, IL-6 and iNOS, and it was found that infl ammatory gene transcriptions were inhibited by γ-oryzanol. Western blotting analysis further confi rmed that γ-oryzanol could decrease the expression of IL-1β, TNF-α, IL-6 and iNOS protein. Our data showed that γ-oryzanol can signifi cantly inhibit the expression and secretion of infl ammatory factors such as IL-1β, TNF-α, IL-6 and NO.
γ-oryzanol; infl ammation; infl ammatory factor; rice bran
R284.1
A
1002-6630(2015)19-0238-06
10.7506/spkx1002-6630-201519043
2014-11-13
湖南省教育厅科学研究重点项目(13A124);湖南省研究生科研创新项目(122-0035);
中南林业科技大学研究生科研创新项目(CX201313357;CX2013B358;CX2013B14)
刘远锦(1990-),女,硕士研究生,研究方向为食品分子营养学。E-mail:312334609@qq.com
*通信作者:罗非君(1968-),男,研究员,博士,研究方向为食品分子营养学。E-mail:luofeijun@hotmail.com
