响应面法优化植物内生菌产α-葡萄糖苷酶抑制剂的发酵条件
2015-12-20谢皓波彭树林门思琦明辉辉林美珍
谢皓波,彭树林,门思琦,明辉辉,林美珍,魏 宁,彭 仁
(江西师范大学生命科学学院,江西 南昌 330022)
响应面法优化植物内生菌产α-葡萄糖苷酶抑制剂的发酵条件
谢皓波,彭树林,门思琦,明辉辉,林美珍,魏 宁,彭 仁*
(江西师范大学生命科学学院,江西 南昌 330022)
糖尿病是一种多病因的代谢疾病,α-葡萄糖苷酶抑制剂是一类治疗糖尿病的药物。本研究利用植物内生菌蜡状芽孢杆菌SD6进行发酵产α-葡萄糖苷酶抑制剂,并通过响应面法优化发酵条件。Plackett-Burman试验结果表明:葡萄糖质量浓度、转速与温度对发酵液的α-葡萄糖苷酶抑制率影响显著,可信度在90%以上。然后釆用Box-Behnken试验设计对发酵条件进行响应面分析试验,结果表明:最优条件为葡萄糖质量浓度48.05 g/L、转速200.44 r/min、温度27.42 ℃。α-葡萄糖苷酶抑制率的最优理论值为39%。在优化的条件下进行验证实验,测得α-葡萄糖苷酶抑制率的实际值为38.52%。模型预测值与实际值的吻合度高,说明该模型可以很好地预测实际发酵情况。
响应面法;α-葡萄糖苷酶抑制剂;植物内生菌
糖尿病是一种多病因的代谢疾病,其特点是慢性高血糖,伴随因胰岛素分泌或作用缺陷引起的糖、脂肪和蛋白质代谢紊乱[1]。世界卫生组织发布的统计数据表明,2000年全球共有1.5 亿例糖尿病患者,预计到2025年将突破3 亿例,因此糖尿病的治疗已经成为全球性的卫生保健问题[2]。
目前,治疗糖尿病的常见药物主要有胰岛素及其类似物、胰岛素增敏剂和胰岛素分泌促进剂等。这些药物虽能在短期内达到降糖的目的,但长期服用此类药物会加速胰岛组织的老化,损害身体各种器官,从而诱发并发症[3]。α-葡萄糖苷酶抑制剂是治疗糖尿病的另一类药物。α-葡萄糖苷酶抑制剂依其来源主要划分为三大类:微生物代谢产物、天然产物提取物及人工化学合成的抑制剂[4]。目前用于临床的来源于微生物的α-葡萄糖苷酶抑制剂主要有德国拜耳公司研制的阿卡波糖和米格列醇及日本武田制药公司研制的伏格列波糖[5-7]。国内学者从各种中草药中筛选α-葡萄糖苷酶抑制剂,他们发现具有葡萄糖苷酶抑制活性的中草药主要有杜仲、桑叶、虎杖、大黄、知母、茶叶、五味子、山茱萸等[8]。此外,Hohenschutz等[9]首次从栗豆树的种子中提取到澳栗精胺,它也具有葡萄糖苷酶抑制活性。Wu Ya等[10]合成出来一系列含有羟基、羟甲基和杂原子环的异甜菊醇类化合物。该类化合物具有中等到强烈的葡萄糖苷酶抑制活性,其中一种吲哚衍生物的抑制活性最强,可作为合成葡萄糖苷酶抑制剂的前体物质。在制备α-葡萄糖苷酶抑制剂的方法中,微生物发酵法具有发酵周期短、清洁生产等优点而备受青睐。为了扩大制备α-葡萄糖苷酶抑制剂的菌种来源,本研究在前期工作中首次从栗豆树种子中筛选到一株能产α-葡萄糖苷酶抑制剂的内生菌蜡状芽孢杆菌(Bacillus cereus)SD6[11]。为了进一步提高该菌产α-葡萄糖苷酶抑制剂的能力,本研究用响应面法优化该菌产α-葡萄糖苷酶抑制剂的发酵条件,为今后利用该菌开发新的α-葡萄糖苷酶抑制剂奠定良好的基础。
1 材料与方法
1.1 菌株、培养基与试剂
B. cereus SD6,从栗豆树种子中分离得到,现保存在中国典型培养物保藏中心,保藏编号为CCTCC NO: M 2015304,该菌株的16S rDNA序列在GenBank的登录号为KF668650。
斜面培养基:可溶性淀粉2%、KNO31%、K2HPO40.5%、MgSO4·7H2O 0.5%、NaCl 0.5%、FeSO4·H2O 0.001%、琼脂2%(以上均为质量分数,下同),pH值调至7.4~7.6。
种子培养基:葡萄糖2.1%、(NH4)2SO40.55%、NaCl 0.3%、K2HPO40.1%、MgSO40.1%,pH值调至7.0~7.2。
发酵培养基:葡萄糖2.1%、(NH4)2SO40.55%、NaCl 0.3%、K2HPO40.1%、MgSO40.1%,pH值调至7.0~7.2。
4-硝基苯基-α-D-吡喃葡糖苷(4-nitrophenyl-α-D-glucopyranoside,pNPG) 上海宝曼生物科技有限公司;活性干酵母 广东丹宝利酵母有限公司;其他试剂均为分析纯。
1.2 仪器与设备
手提式压力蒸汽灭菌锅 上海博迅实业有限公司;数显气浴恒温振荡器 常州博远实验分析仪器厂;离心机 上海安亭科学仪器厂;超净工作台 苏州安泰空气技术有限公司;紫外-可见分光光度计 上海元析仪器有限公司。
1.3 方法
1.3.1 B. cereus SD6生长曲线测定[12]
将B. cereus SD6接种至发酵培养基中,30 ℃、180 r/min振荡培养,每隔3~4 h取样测定600 nm波长处的吸光度。
1.3.2 α-葡萄糖苷酶的制备[13]
活性干酵母内的α-葡萄糖苷酶活性较高,因此用它制备α-葡萄糖苷酶。称取10 g活性干酵母,少许水研磨30 min,补足水至200 mL,5 000 r/min离心10min,得到的上清液为α-葡萄糖苷酶溶液。
1.3.3 发酵液对α-葡萄糖苷酶抑制率的测定
α-葡萄糖苷酶抑制率的测定参考Chapdelaine等[14]的方法。在试管中分别加入0.05 mol/L磷酸盐缓冲液(phosphate buffer solution,PBS,pH 6.8)1 500 μL、α-葡萄糖苷酶溶液150 μL、发酵液300 μL,37 ℃孵育10 min。再加入0.116 mol/L底物pNPG 150 μL,37 ℃反应10 min,最后加入0.1 mol/L碳酸钠溶液3 000 μL终止反应。由于发酵液含有色素对实验结果产生影响,因此每个样品还要测定背景吸收,其中以PBS代替底物溶液进行测定。为了计算出抑制率,还需要测定不加发酵液(即以PBS代替发酵液)时反应体系在410 nm波长处的吸光度。发酵液对α-葡萄糖苷酶抑制率的计算公式如下:
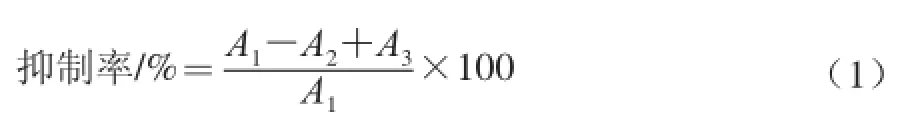
式中:A1为不加发酵液体系的吸光度;A2为加发酵液体系的吸光度;A3为背景吸光度。
1.3.4 响应面法优化产α-葡萄糖苷酶抑制剂的发酵条件[15]
1.3.4.1 Plackett-Burman试验设计
根据B. cereus SD6生长所需营养素的基本原则和发酵影响一般规律,参考B. cereus SD6的生长曲线,结合前期实验[11],本研究使用N=12的试验设计,对葡萄糖质量浓度、硫酸铵质量浓度、初始pH值、温度、转速5 个因素进行考察,每个因素选两水平,响应值为α-葡萄糖苷酶抑制率。另设3 个虚拟列,以考察试验误差。
1.3.4.2 最陡爬坡试验
响应面拟合方程只在考察的紧接邻域里才充分接近真实情形,所以要先逼近最佳值区域后才能建立有效的响应面拟合方程,由Plackett-Burman试验结果设计主要因素的最陡爬坡路径,根据主要因素效应正负、大小的比例设定它们的变化方向与步长,从而快速、经济地逼近最佳值区域。
1.3.4.3 响应面试验优化培养条件
根据Plackett-Burman试验与最陡爬坡试验确定因素与水平,釆用Box-Behnken试验设计对发酵培养基进行三因素三水平的响应面优化试验。包括12 个析因实验和3 个中心组合试验。响应面优化二阶回归分析模型为:
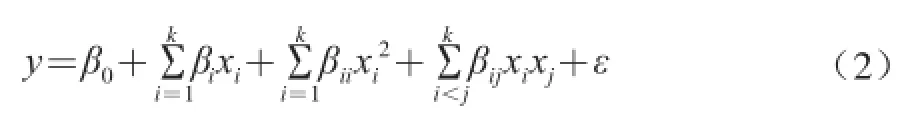
利用统计软件MINITAB对试验数据进行二次多项回归拟合,建立二次响应面回归模型,并求出最优影响因子水平。
1.3.4.4 验证实验
根据响应面优化试验得到的最优发酵条件进行B. cereus SD6发酵培养,验证模型预测值与实验实际值的吻合度。
2 结果与分析
2.1 B. cereus SD6的生长曲线
在微生物生长曲线中,微生物产生代谢产物多在对数期末期或稳定期。通过测定微生物生长曲线可以为优化微生物的发酵条件提供指导[16]。B. cereus SD6的生长曲线见图1。B. cereus SD6的迟滞期是11 h,在第14小时进入稳定期。
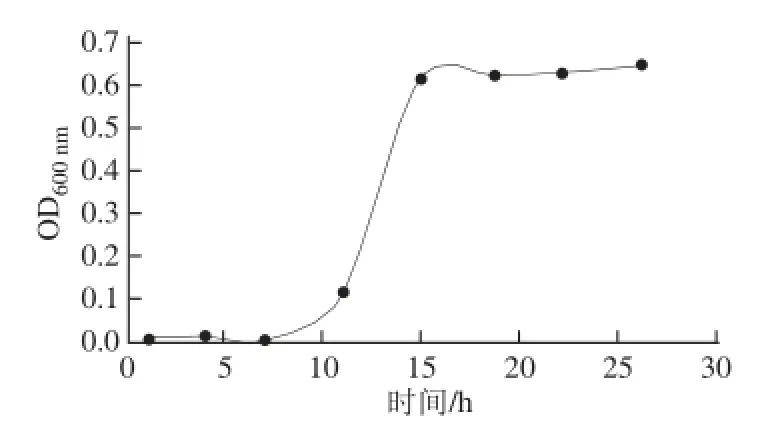
图1 1 B. cereus reus SD6的生长曲线Fig.1 Growth curve of Bacillus cereus SD6
2.2 Plackett-Burman试验和最陡爬坡试验筛选结果
对试验结果进行分析,计算得出各因素的t值和比较得出可信度水平。一般选择可信度>90%的因素作为主要影响因素。Plackett-Burman试验设计与结果见表1,各因素主效应分析结果见表2。由各因素效应分析结果可知:在B. cereus SD6产α-葡萄糖苷酶抑制剂过程中,其显著性按大小依次排列为葡萄糖质量浓度、转速、温度、初始pH值与(NH4)2SO4质量浓度,葡萄糖质量浓度、转速与温度对抑制率影响显著,可信度在90%以上,可作为主要影响因素进行最陡爬坡试验。其他次要因素取值则根据效应正负选定,正取较高值,负取较低值。由Plackett-Burman试验结果确定葡萄糖质量浓度、转速有显著正效应,应增大,温度具有显著负效应,应减小。

表1 Plackett-Burman试验设计与结果Table 1 Plackett-Burman design with experimental results

表2 Plackett-Burman试验因素效应分析结果Table 2 Signifi cance test of factors involved in Plackett-Burman design
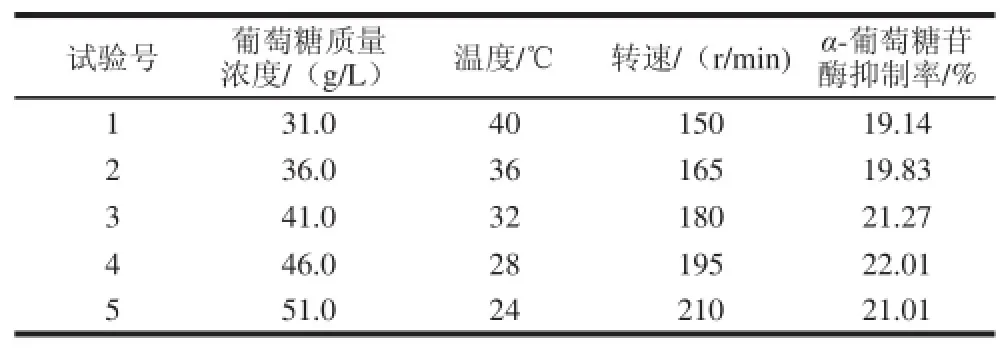
表3 最陡爬坡试验结果Table 3 Results of steepest ascent experiments
由表3可知,最优发酵条件可能在试验3与试验4之间,且试验4更接近最优条件,故以试验4为中心点进行Box-Behnken试验。
2.3 响应面试验设计优化培养条件
根据上述结果釆用Box-Behnken试验设计对发酵培养基进行三因素三水平的响应面分析试验,包括12 个析因实验和3 个中心试验。以x1葡萄糖质量浓度/(g/L)、x2温度/℃、x3转速/(r/min)为自变量,经过编码转换可得:X1=(x1-46)/5,X2=(x2-28)/4,X3=(x3-195)/15。三因素三水平的Box-Behnken试验设计及结果见表4。
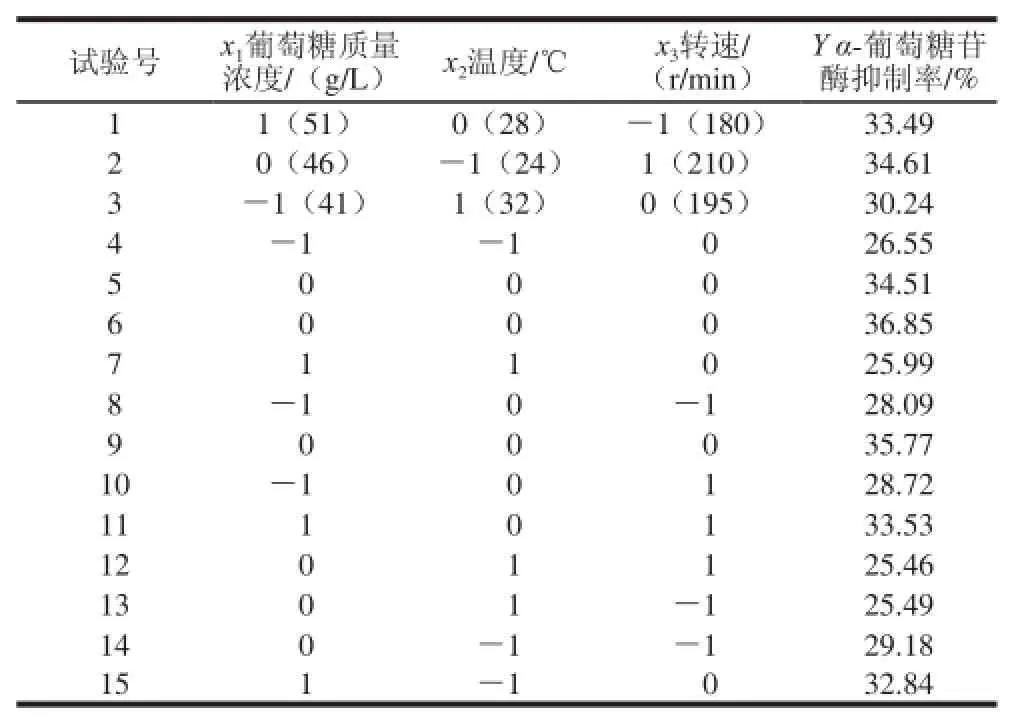
表4 三因素三水平的Box-Behnken试验设计及结果Table 4 Box-Behnken design with experimental results
利用统计软件MINTAB 15对数据进行二次多项回归拟合。建立二次响应面回归模型,寻求最优相应因子水平,所得的分析结果见表5。由表5可知,利用MINITAB拟合试验数据得到α-葡萄糖苷酶抑制率对葡萄糖质量浓度、温度、转速的三元二次回归方程:Y= 0.357 1+0.015 3X1-0.020 0X2+0.007 6X3-0.022 7X12-0.045 4X22-0.024 8X32-0.026 3X1X2-0.001 5X1X3-0.013 7X2X3。X1、X2、X3分别为葡萄糖质量浓度、温度和转速的编码水平。回归分析显著性检验表明,方程的F值>F0.01(9,5),该模型失拟不显著。为了求得最佳培养条件,用所得的回归方程分别对各自变量求一阶偏导数。并分别令得三元一次方程组,并解出X1=0.409 7、X2=-0.146 2、X3= 0.362 4,即当葡萄糖质量浓度为48.05 g/L、温度为27.42 ℃、转速为200.44 r/min时,发酵液的理论α-葡萄糖苷酶抑制率为39%。

表5 Box-Behnken试验结果回归分析Table 5 Regression analysis of the experimental results from Box-Behnken design
根据三元二次回归方程,利用MINITAB绘出响应面分析图及其等高线,如图2~4所示。

图2 葡萄糖质量浓度和温度对α-葡萄糖苷酶抑制率影响的响应曲面图和等高线图Fig.2 Surface and contour plots for the effects of glucose concentration and temperature on inhibitory rate against α-glucosidase
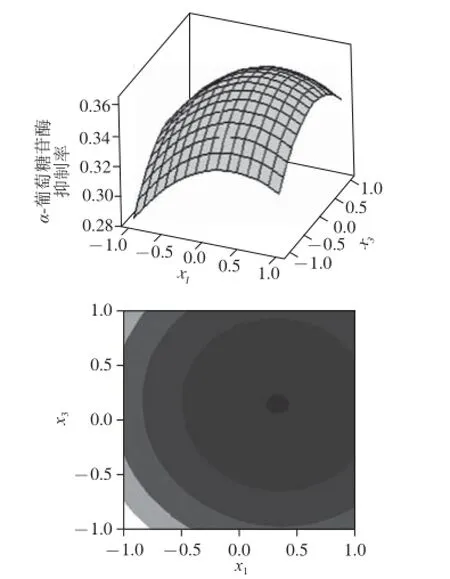
图3 葡萄糖质量浓度和转速对α-葡萄糖苷酶抑制率影响的响应曲面图和等高线图Fig.3 Surface and contour plots fore the effects of glucose concentration and rotation speed on inhibitory rate against α-glucosidase
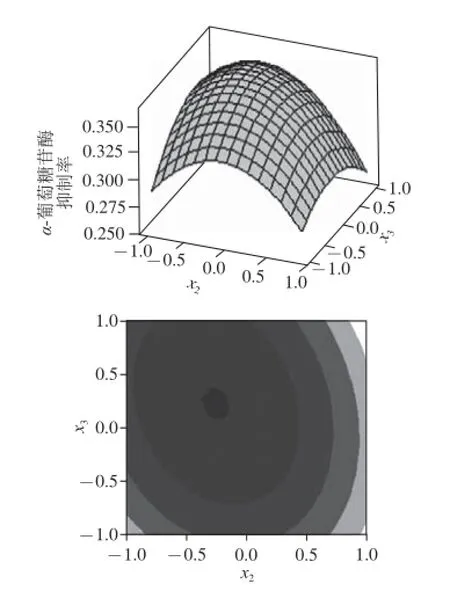
图4 温度和转速对α-葡萄糖苷酶抑制率影响的响应曲面图和等高线图Fig.4 Surface and contour plots for the effects of temperature and rotation speed on inhibitory rate against α-glucosidase
每个响应曲面或等高线图代表着两个独立变量间的相互作用,可以非常直观地看到因素交互作用对响应值影响的变化趋势。葡萄糖质量浓度与转速的等高线近似正圆形,这说明它们间的交互作用是不显著的。而葡萄糖质量浓度与温度、温度与转速的等高线则呈椭圆形,说明因素之间交互作用显著。
2.4 验证实验结果
用响应面优化过的最优条件(为方便操作,取葡萄糖质量浓度为48.05 g/L、温度为27.4 ℃、转速为200 r/min)进行验证实验,测得α-葡萄糖苷酶抑制率为38.52%。验证模型预测值与实验真实值的吻合度高,说明该模型可以很好地预测实际发酵情况。
3 讨 论
α-葡萄糖苷酶抑制剂是治疗糖尿病的一类药物。α-葡萄糖苷酶抑制剂的成分多样,如白背三七中的多糖、虎杖中的糖类和鞣质、杜仲中的槲皮素、知母中的皂苷等[17-20]。α-葡萄糖苷酶抑制剂的制备方法也有多种,从微生物中筛选α-葡萄糖苷酶抑制剂在近年来已成为比较活跃的领域之一。阿卡波糖是直接从游动放线菌的次级代谢产物中提取、分离得到的[21],伏格列波糖和米格列醇则是分别对放线菌和芽孢杆菌的次级代谢活性产物进行结构改造而得到[22-23]。郎国竣[12]从土壤中筛选出可抑制α-葡萄糖苷酶活性的微生物。该菌株为链霉菌属,与小白链霉菌16S rDNA序列同源性达到98%以上。杨明琰等[24]也从土壤中筛选出一株对猪胰淀粉酶和α-葡萄糖苷酶同时具有强烈抑制作用的菌株D0406,其每毫升发酵液的抑制活性约相当于0.6 mg阿卡波糖的抑制活性,鉴定结果表明菌株D0406为链霉菌属。倪孟祥等[25]从海洋微生物中分离出α-葡萄糖苷酶抑制剂产生菌6 株。其中菌株N-1的代谢产物对α-葡萄糖苷酶的抑制作用最强,每毫升N-1样品液中含有的活性代谢产物对α-葡萄糖苷酶的抑制作用相当于5 mg的阿卡波糖对α-葡萄糖苷酶的抑制作用。本研究利用从栗豆树种子中筛选得到的植物内生菌B. cereus SD6进行发酵产α-葡萄糖苷酶抑制剂,通过响应面法优化发酵条件后,300 μL发酵液对α-葡萄糖苷酶抑制率为38.52%,是未优化前α-葡萄糖苷酶抑制率(23.21%)的1.66倍,并且高于0.6 mg/mL阿卡波糖溶液对酿酒酵母α-葡萄糖苷酶的抑制率(25.70%)[11]。
[1] ALI M S, JAHANGIR M, HUSSAN S S, et al. Inhibitition of α-glucosidase by oleanolic acid and its synthetic derivatives[J]. Phytochemistry, 2002, 60(3): 295-299.
[2] ZIMMET P, ALBERTI K G, SHAW J. Global and societal implications of the diabetes epidemic[J]. Nature, 2001, 414: 782-787.
[3] 张翠欣, 王中孝. 降糖药的研究进展[J]. 中国药学杂志, 2002, 37(5): 328-330.
[4] 何素婷, 许激扬, 陈代杰. 具有α-葡萄糖苷酶抑制作用的抗糖尿病药物[J]. 工业微生物, 2003, 33(1): 43-49.
[5] BALFOUR J A, MCTAVISH D. Acarbose: an update of its pharmacology and therapeutic use in diabetes metlitus[J]. Drugs, 1993, 46(6): 1025-1054.
[6] 王谦, 张璐, 边晓丽, 等. α-葡萄糖苷酶抑制剂及构效关系的研究进展[J]. 中国新药杂志, 2014, 23(2): 189-195.
[7] ASANO N. Glycosidase inhibitors: update and perspectives on practical use[J]. Glycobiology, 2003, 13(10): 93R-104R.
[8] 马庆一, 陈丽华, 杨海延, 等. 山茱萸中-葡萄糖苷酶抑制活性因子的筛选(Ⅰ)[J]. 食品科学, 2007, 28(1): 167-170.
[9] HOHENSCHUTZ L D, LIZA D, BELL E A, et al. Castanospermine, A 1,6,7,8-tetrahydroxyoctahydroindolizine alkaloid, from seeds of Castanospermum australe[J]. Phytochemistry, 1981, 20(4): 811-814.
[10] WU Ya, YANG Jinghua, DAI Guifu, et al. Stereoselective synthesis of bioactive isosteviol derivatives as alpha-glucosidase inhibitors[J]. Bioorganic and Medicinal Chemistry, 2009, 17(4): 1464-1473.
[11] PENG Ren, ZHU Jianqiao, ZHOU Yanchao, et al. Screening and identification of endophytes from the seeds of Castanospermum australe producing alpha-glucosidase inhibitors[J]. BioTechnology: an Indian Journal, 2014, 9(9): 372-375.
[12] 郎国竣. 微生物源α-葡萄糖苷酶抑制剂的筛选、分离纯化及产生菌的鉴定[D]. 上海: 上海师范大学, 2007: 53-69.
[13] 司晓晶, 霍世欣, 施雅, 等.中药提取物对酵母和鼠肠α-葡萄糖苷酶的抑制作用[J]. 上海大学学报: 自然科学版, 2009, 18(4): 432-435.
[14] CHAPDELAINE P, TREMBLAY R R, DUBE J Y. p-Nitrophenolalpha-D-glucopyranoside as substrate for measurement of maltase activity in human semen[J]. Clinical Chemistry, 1978, 24(2): 208-211.
[15] 张艳. 响应面法及其在药学领域中的应用[J]. 吉林化工学院学报, 2012, 29(7): 20-26.
[16] 李娟, 刘兰, 于配配, 等. 产α-葡萄糖苷酶抑制剂菌株的筛选及发酵条件优化[J]. 食品科学, 2012, 33(23): 249-253.
[17] 刘微微, 刘旭, 曹学丽, 等. 白背三七多糖的结构表征及α-葡萄糖苷酶的抑制活性[J]. 食品科学, 2013, 34(7): 115-120.
[18] 沈忠明, 殷建伟, 袁海波. 虎杖鞣质的降血糖作用研究[J]. 天然产物研究与开发, 2004, 16(3): 45-47.
[19] WATANABE J, KAWABATA J, KURIHARA H, et al. Isolation and identifi cation of α-glucosidase inhibitors from tochu-cha (Eucommia ulmoides)[J]. Bioscience, Biotechnology, and Biochemistry, 1997, 61(1): 177-178.
[20] 杨军衡, 曾雷, 易诚, 等. 中药知母新皂苷成分的研究[J]. 天然产物研究与开发, 2001, 13(5): 18-19.
[21] 顾觉奋, 陈菁. 阿卡波糖生物合成和发酵工艺研究进展[J]. 国外医药: 抗生素分册, 2006, 27(3): 122-125; 142.
[22] 沈佳佳, 张晓军, 王浩, 等. 新型抗糖尿病药物: 米格列醇的研究进展[J]. 海峡药学, 2005, 17(6): 8-10.
[23] 顾觉奋, 陈紫娟. α-葡萄糖苷酶抑制剂的研究及应用[J]. 药学进展, 2009, 33(2): 62-67.
[24] 杨明琰, 田稼, 马瑜, 等. α-葡萄糖苷酶抑制剂产生菌的分离鉴定及其生物活性研究[J]. 中国抗生素杂志, 2010, 35(11): 831-834.
[25] 倪孟祥, 马丽娜. 海洋微生物来源的α-葡萄糖苷酶抑制剂的筛选及性质研究[J]. 化学与生物工程, 2012, 29(4): 60-67.
Optimization of Fermentation Conditions of Endophyte for Producing α-Glucosidase Inhibitor by Response Surface Methodology
XIE Haobo, PENG Shulin, MEN Siqi, MING Huihui, LIN Meizhen, WEI Ning, PENG Ren*
(College of Life Science, Jiangxi Normal University, Nanchang 330022, China)
The fermentation conditions for producing α-glucosidase inhibitor by an endophyte named Bacillus cereus SD6 were optimized using response surface methodology in the present study. The results of Plackett-Burman experiments showed that glucose concentration, rotation speed and temperature had signifi cant effects on the inhibition of α-glucosidase by fermentation liquid, with more than 90% confi dence. Bex-Behnken experiments were applied for the optimization of the fermentation conditions through response surface analysis. The optimal conditions for glucose concentration, rotation speed and fermentation temperature were determined as 48.05 g/L, 200.44 r/min and 27.42 ℃, respectively. Under these fermentation conditions, the maximum predicted inhibitory rate of the fermentation liquid against α-glucosidase was 39%, agreeing with the experimental value of 38.52%. The good consistency indicated the feasibility of the developed prediction model.
response surface methodology; α-glucosidase inhibitors; endophyte
TQ92
A
1002-6630(2015)19-0217-05
10.7506/spkx1002-6630-201519039
2015-04-14
谢皓波(1994-),男,本科生,研究方向为生物化学。E-mail:740834602@qq.com
*通信作者:彭仁(1972-),男,副教授,博士,研究方向为生物化学。E-mail:renpeng@jxnu.edu.cn
