酶法改性对小米糠膳食纤维体外胆固醇吸附活性的影响
2015-12-20郭利娜楚佳希吕凤霞陆兆新别小妹赵海珍
朱 玉,郭利娜,楚佳希,吕凤霞,陆兆新,别小妹,张 充,赵海珍
(南京农业大学食品科技学院,江苏 南京 210095)
酶法改性对小米糠膳食纤维体外胆固醇吸附活性的影响
朱 玉,郭利娜,楚佳希,吕凤霞,陆兆新,别小妹,张 充,赵海珍*
(南京农业大学食品科技学院,江苏 南京 210095)
以小米糠为原材料,采用AOAC 985.29《食物中总膳食纤维 酶-质量法》制备小米糠总膳食纤维(total dietary fi ber,TDF)。利用纤维素酶对TDF进行酶法改性,以提高其体外胆固醇吸附活性。通过单因素试验和正交试验,最终确定TDF的酶法改性条件为:酶解pH 3.8、酶添加量140 U/g、酶解温度55 ℃、酶解时间3 h,所得纤维素酶改性膳食纤维(cellulase-modified dietary fiber,CMF)的体外胆固醇吸附效果最佳,吸附量达到14.21 mg/g,比TDF的胆固醇吸附量(5.91 mg/g)提高了1.40 倍。对TDF和CMF的单糖组成、红外光谱以及超微结构等物化特性分析发现,纤维素酶的作用改变了TDF的单糖组成,形成了更多纤维二糖,产生了较多憎水基团,结构粗糙,这些组成及微观结构的改变可能与CMF胆固醇吸附活性显著提高有着密切的关系。
小米糠;总膳食纤维;纤维素酶;胆固醇吸附活性;物理化学分析
小米又名粟,起源于我国黄河流域,一年生禾本科植物,是我国地区主要的杂粮作物之一。研究表明[1],小米有增强免疫力、抗氧化、抗真菌及降血糖等多种生物活性功能。而麸皮[2]作为谷物生产过程中的主要副产物,同样也含有丰富的营养物质及植物源类生物活性物质,例如生物碱、酚醛类等可以起到预防疾病的作用。膳食纤维就是麸皮中的主要成分之一,它们可以分为水溶性膳食纤维(water-soluble dietary fiber,SDF)和水不溶性膳食纤维(water-insoluble dietary fiber,IDF)。近年来,膳食纤维被证实可降低糖尿病、心血管疾病、憩室病、结肠癌等疾病的发病率,同时具有缓解便秘、肥胖症等特性[3]。因此,谷物麸皮中膳食纤维的提取纯化、特性分析越来越受到人们的关注。而其中对大麦麸皮、小麦麸皮、大米糠、豆粕等的研究居多[4],有关小米麸皮中膳食纤维的研究报道比较少。
膳食纤维的功能特性往往受到其来源、组成和处理的影响[5]。小米糠(millet bran,MB)作为富含膳食纤维的原料之一,IDF占了主要部分,而IDF具有增加肠道蠕动、促进有毒物质及内源性化合物排出的功能[6],可以降低人体对过度供给的甘油三酯、胆固醇、胆酸盐的吸收利用,降低血胆固醇水平[7]。SDF在小米糠中含量虽然较少,却同样具有明显的降胆固醇特性[8]。为提高膳食纤维的体外吸附特性,研究者通常采用化学法(酸碱处理)、生物法(酶解、发酵)、物理法(超微粉碎、挤压蒸煮、膜浓缩、焙烤)等[9]来对其进行改性。相比较而言,酶解法操作简便快捷,所获取的产品对人体健康无害,更具有优势。因此本实验通过AOAC 985.29《食物中总膳食纤维 酶-质量法》[10]提取小米糠的总膳食纤维(total dietary fiber,TDF),利用纤维素酶对其进行改性以提高其体外胆固醇吸附活性,同时对其物化结构进行分析,从而为小米糠的有效开发及利用奠定基础。
1 材料与方法
1.1 材料与试剂
MB 山西省晋城市沁水县;鸡蛋 江苏省南京市苏果铁匠营社区店;胆固醇(≥99%) 美国Sigma公司;酶制剂 上海阿拉丁生化科技股份有限公司;其他试剂均为分析纯 国药集团化学试剂有限公司。
1.2 仪器与设备
UV-2450紫外-可见分光光度计、LCMS2020高效液相色谱仪 日本Shimadzu公司;XL-30ESEM环境扫描电子显微镜 荷兰Philips公司;NEXUS870傅里叶变换红外光谱仪 美国Nicolet公司;SHZ-88A往复式恒温水浴振荡器 太仓市强乐实验设备有限公司;TCL BCD-516WEX60冰箱 广东惠州TCL公司。
1.3 方法
1.3.1 MB中TDF的制备
1.3.1.1 MB的预处理
MB经充分研磨,过40目筛,按1∶2.5(m/V)的料液比加入正己烷,于55 ℃水浴振荡器中反应2 h后弃上清,如此重复3 次,将脱脂后的MB置于通风厨中,待正己烷挥发完全即得到脱脂小米糠(defatted millet bran,DMB),存放于-20 ℃冰箱中,用于后续研究。
1.3.1.2 TDF的酶法提取
取10 g DMB,按1∶10(m/V)的料液比加水搅拌,在95~100 ℃水浴糊化15 min后置于水浴振荡器中,于50 ℃条件下振荡30 min。调体系pH值至5.5,加入耐高温α-淀粉酶0.5 g,于95 ℃条件下振荡1 h,调pH至4.2,加入0.03 g糖化酶于60 ℃酶解1 h,调pH值至7.0,加入0.36 g中性蛋白酶,于55 ℃条件下酶解2 h,最后将反应混合物置于沸水浴中灭酶15 min,冷却至室温后,加入4 倍体积的95%乙醇,4 ℃条件下醇沉过夜,抽滤,残渣充分烘干即得到MB的TDF。
1.3.1.3 TDF及MB的常规组分测定
TDF及MB的常规分析包括水分、灰分、蛋白质、脂肪、淀粉及膳食纤维含量的测定,分别按照GB 5009.3-2010《食品中水分的测定》、GB 5009.4-2010《食品中灰分的测定》、GB 5009.5-2010《食品中蛋白质的测定》、GB/T 5009.6-2003《食品中脂肪的测定》、GB/T 5009.9-2008《食品中淀粉的测定》中的方法以及差量法进行测定分析。
1.3.2 TDF的酶法处理
以膳食纤维体外胆固醇吸附量为指标,利用纤维素酶对TDF进行改性,通过单因素试验及正交试验确定其最佳酶解温度、酶解pH值、酶解时间以及酶添加量,得到具有较高胆固醇吸附活性的改性膳食纤维(cellulasemodifi ed dietary fi ber,CMF)。
1.3.3 体外胆固醇吸附能力测定
由于胆固醇试剂水溶性较差,因此本实验根据Zhang Ning等[11]的方法,利用蛋黄溶液来测定膳食纤维对胆固醇的吸附量。将蛋黄从市售鲜鸡蛋中分离出来并加入9 倍质量蒸馏水充分搅打成乳液,取1 g TDF于100 mL锥形瓶中,加入25 g稀释蛋黄液,充分混匀,调pH值至7.0,于37 ℃水浴振荡器中振荡3 h,4 000 r/min离心20 min(实验组),以未加膳食纤维的同样方法处理的蛋黄液为空白对照组,未做处理的稀释蛋黄液为阴性对照组。取0.02 mL的上清液,采用邻苯二甲醛法[12],以胆固醇标品制备胆固醇标准曲线,测定膳食纤维对胆固醇的吸附量。

式中:ρ空白、ρ实验、ρ阴性分别为空白对照组、实验组及阴性对照组中蛋黄液胆固醇的质量浓度/(mg/mL),m为反应体系中膳食纤维的质量/g。
1.3.3.1 酶解温度对CMF胆固醇吸附能力的影响
取5 g TDF,加入40 mL 0.05 mol/L的磷酸盐缓冲液(phosphate-buffered saline,PBS)(pH 4.0),搅拌均匀后在55 ℃条件下振荡溶胀2 h,按照100 U/g TDF加入纤维素酶,混匀,在40、45、50、55、60 ℃水浴中作用4 h,然后在沸水浴中灭酶15 min。加入4 倍体积的95%乙醇醇沉过夜,抽滤,充分烘干,获得CMF,测定其体外胆固醇吸附量。
1.3.3.2 酶解pH值对CMF胆固醇吸附能力的影响
在5 g TDF中加入40 mL、0.05 mol/L的PBS (pH 3.4、3.8、4.2、4.6、5.0、5.4),搅拌均匀后在55 ℃条件下溶胀2 h,按照100 U/g TDF加入纤维素酶,混匀,在50 ℃条件下水浴4 h,然后在沸水浴中灭酶15 min。加入4 倍体积的95%乙醇醇沉过夜,抽滤,充分烘干,获得CMF,测定其体外胆固醇吸附量。
1.3.3.3 酶解时间对CMF胆固醇吸附能力的影响
在5 g TDF中加入40 mL 0.05 mol/L的PBS(pH 3.8),搅拌均匀后在55 ℃条件下溶胀2 h,按照100 U/g TDF加入纤维素酶,混匀,在50 ℃水浴中分别作用1、2、3、4、5 h,然后在沸水浴中灭酶15 min。加入4 倍体积的95%乙醇醇沉过夜,抽滤,充分烘干,获得CMF,测定其体外胆固醇吸附量。
1.3.3.4 酶添加量对CMF胆固醇吸附能力的影响
在5 g TDF中加入40 mL 0.05 mol/L的PBS (pH 3.8),搅拌均匀后在55 ℃溶胀2 h,按照60、80、100、120、140、160 U/g TDF加入纤维素酶,混匀,在50 ℃水浴作用2 h,然后在沸水浴中灭酶15 min。加入4 倍体积的95%乙醇醇沉过夜,抽滤,充分烘干,获得CMF,测定其体外胆固醇吸附量。
1.3.3.5 正交试验
在单因素试验的基础上,以胆固醇吸附量为响应值,对影响纤维素酶改性膳食纤维的酶解温度、酶解pH值、酶解时间以及酶添加量进行四因素三水平正交试验,确定TDF酶法改性的最佳条件。
1.3.4 TDF与CMF的物化性质测定
1.3.4.1 单糖组成及含量测定
按照美国谷物化学师协会(American Association of Cereal Chemists,AACC)标准32-07[13]的方法,将TDF 及CMF中的SDF部分及IDF部分分离,分别标为SDF、CM-SDF、IDF及CM-IDF,在Stepan等[14]的方法基础上加以改变来测定以上物质的单糖组成。分别取1 mg样品或标品(葡萄糖、鼠李糖、半乳糖、半乳糖醛酸、阿拉伯糖、木糖、葡萄糖醛酸以及甘露糖),加入300 μL 4 mol/L三氟乙酸,于110℃条件下水解2 h,冷却,40 ℃条件下真空浓缩4 h,用2 mL甲醇洗3 次。水解后的样品采用对氨基苯甲酸进行衍生,利用高效液相色谱法进行单糖组分测定。色谱条件为:色谱柱为ODS HyperClone C18柱(250 mm×4 mm,5 μm);检测器为RF-20AXS荧光检测器;洗脱液及洗脱程序、柱温、检测器发射波长与激发波长均与Stepan等的方法一致。最终计算出样品中每种单糖组成的物质的量百分比,用来表示其含量。
1.3.4.2 红外光谱测定
取1~2 mg干燥至恒质量的TDF或CMF于干燥的玛瑙研钵中,加入适量干燥好的KBr,在干燥的条件下混合碾磨均匀,压片,用Nexus 870 FT-IR型傅里叶变换红外光谱仪进行分析测定[15]。
1.3.4.3 扫描电镜观察
用20%、40%、60%、80%、100%的乙醇对TDF和CMF脱水,在(105±2)℃条件下干燥至恒质量[16],粉碎后取适量样品黏于观察台上,采用离子溅射方法镀金,在放大倍数为150和1 200的条件下,通过扫描电子显微镜对制备好的样品进行观察、分析。
2 结果与分析
2.1 TDF和MB的常规组分分析
酶法提取膳食纤维是现如今认为提取率最高的一种方法[17],实验中以MB为原料,采用AOAC 985.29《食物中总膳食纤维 酶-质量法》得到膳食纤维的提取率为72.20%,小米糠及TDF的基本组成成分见表1。MB中膳食纤维的含量较之大米糠(27.04%)及麦麸(44.46%)[17]中的更高,其次蛋白质和淀粉含量较多,分别占10.23% 和10.17%。经过耐高温α-淀粉酶和糖化酶的处理,MB中淀粉的去除率达到75.90%,中性蛋白酶对蛋白质的去除率达到56.79%。蛋白质及碳水化合物的去除,一定程度上加大了灰分的相对含量,使灰分含量从小米糠中的6.21%增加到7.93%,最终通过酶-质量法得到的TDF中膳食纤维的含量达到77.38%。

表1 TDF和MB的常规组分含量(x ±sx,n=3)Table 1 Proximate composition analysis of TDF and MB (x ±sx,n=3)%
2.2 TDF的体外胆固醇吸附量
以胆固醇为标品,采用邻苯二甲醛法建立标准曲线方程y=0.019 4x+0.012 7(R2=0.999 1),以酶法提取的TDF为吸附剂,采用1.3.3节的方法,在pH 7.0、37 ℃条件下(模拟小肠环境),测定TDF体外胆固醇吸附量,结果为5.91 mg/g,略低于大豆皮不溶性膳食纤维的吸附量(7.40 mg/g),但明显高于麦麸不溶性膳食纤维的胆固醇吸附量(3.48 mg/g)[12]。
2.3 TDF酶法改性条件的确定
2.3.1 酶解温度对CMF胆固醇吸附量的影响

图1 酶解温度对CMF体外胆固醇吸附量的影响Fig.1 Effect of hydrolysis temperature on cholesterol-binding capacity in vitro of CMF
由图1可知,在40~60 ℃的范围内,随酶解温度的上升,CMF对胆固醇的吸附量先上升再下降。当温度为50 ℃时,纤维素酶改性产物CMF的胆固醇吸附量最高,为9.30 mg/g。与TDF相比,胆固醇吸附量提高了60%左右。这主要因为酶在较低温度时随着温度升高而酶解能力加强,当温度超过50℃时,纤维素酶受热变性因素的影响,酶解能力下降[18],对TDF的降解能力降低,导致所得CMF的胆固醇吸附量降低。
2.3.2 酶解pH值对CMF胆固醇吸附量的影响

图2 酶解pH值对CMF体外胆固醇吸附量的影响Fig.2 Effect of hydrolysis pH on cholesterol-binding capacity in vitro of CMF
纤维素酶的最适pH值一般在3.0~6.0,但会因具体底物的不同而有所差别。pH值对CMF胆固醇吸附量的影响如图2所示,在pH 3.4~4.2之间,CMF的胆固醇吸附量随酶解pH值升高而缓慢上升,当pH值为3.8时,CMF的胆固醇吸附量达到最大(9.47 mg/g),而后随pH值上升,CMF体外胆固醇吸附量急剧下降,这可能是酶促反应的pH值通过影响酶蛋白结构、活性部位的解离状态而影响了其催化效果[18],当超过一定pH值时,酶活性受到破坏,使得其对TDF的降解率降低,导致改性得到的CMF的结构或组成不利于吸附胆固醇。
2.3.3 酶解时间对CMF胆固醇吸附量的影响
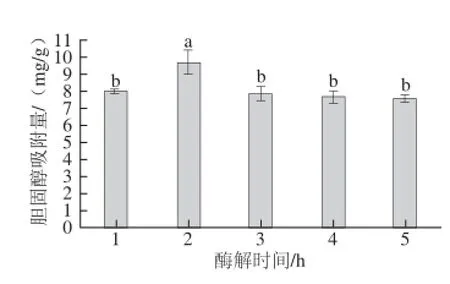
图3 酶解时间对CMF体外胆固醇吸附能力的影响Fig.3 Effect of hydrolysis time on cholesterol-binding capacity in vitro of CMF
如图3所示,CMF的胆固醇吸附量随酶解时间的延长先上升后下降,酶解时间为2 h时,CMF的胆固醇吸附量达到最大(9.77 mg/g),显著高于其他处理组,随着酶解时间的延长,底物浓度会不断降低,部分酶在反应过程中失活,水溶性多糖不断积累,纤维素酶所受到的反馈抑制效应逐渐增强,酶促反应效率减慢[19],改性得到的CMF体外胆固醇吸附量随之受到一定影响。
2.3.4 酶添加量对CMF胆固醇吸附量的影响
在酶法改性中,酶添加量即反应体系中的生物酶浓度,是决定酶处理效果的一个关键因素。由图4可知,随着纤维素酶用量的加大,其与膳食纤维中的特定底物吸附反应速率增加,得到的CMF结构更疏松,体外胆固醇吸附能力升高,当酶添加量达到140 U/g时,效果最好,此时CMF的胆固醇吸附量达到12.48 mg/g。由于纤维素等底物分子与纤维素酶分子的结合位点是一定的,这些结合点全部被纤维素酶分子占据而达到饱和后,继续加酶则不会再有大量相应的细胞壁被降解[20],因此得到的CMF的体外胆固醇吸附量保持稳定。

图4 酶添加量对CMF体外胆固醇吸附能力的影响Fig.4 Effect of enzyme amount on cholesterol-binding capacity in vitro of CMF
2.3.5 正交试验结果与分析

表2 L 2 L9(334)正交试验设计结果及极差分析Table 2 L 2 L9(3 (34) orthogonal array design with range analysis of experimental results lts

表3 正交试验方差分析结果Table 3 Analysis of variance (ANOVA) for the orthogonal array design
从表2、3可知,对纤维素酶改性TDF提高其体外胆固醇吸附量的影响因素主次顺序为A>D>C>B,即酶添加量是影响改性效果的主要因素,且差异显著(P<0.05),酶解pH值次之。根据k值可以得出纤维素酶改性TDF的最佳条件组合是A2B3C3D2,进行验证实验,与第6组试验(CMF体外胆固醇吸附量最高组)组合A2B3C1D2对比,按照A2B3C3D2组合条件改性TDF测得其体外胆固醇吸附量为14.21 mg/g,高于A2B3C1D2条件下改性效果(14.18 mg/g),所以确定在酶解温度55 ℃、酶解pH 3.8的条件下,按140 U/g的酶添加量利用纤维素酶对TDF酶解3 h,得到CMF的体外胆固醇吸附效果最佳。
2.4 TDF与CMF的物化性质
2.4.1 单糖组分分析

表4 IDF、CM-IDF、SDF和CM-SDF的单糖组分分析(x ±sx,n=33)Tabbllee 44 Monosaccharide composition of IDF, CM-IDF, SDF and CM-SDF ((x ± sx,, n =3) %
由表4可知,TDF中的IDF和SDF都包含有6 种单糖,即半乳糖、甘露糖、葡萄糖、阿拉伯糖、木糖和鼠李糖,但两者单糖组成在含量上差异较大。IDF中木糖和阿拉伯糖的含量最多,分别达到73.92%及14.97%,这是因为在IDF很大一部分由木质素组成,而阿拉伯木聚糖(araboxylan,AX)则是木质素的主要组成部分,且AX具有高黏度、高持水性等特征,能起到降低血清胆固醇含量、调节血糖水平、增强免疫力等作用[21]。SDF中葡萄糖和半乳糖含量最高,木糖和阿拉伯糖含量次之,说明在SDF中可能存在大部分果胶及少量水溶性AX,因为果胶作为一组聚半乳糖醛酸往往会被水解成大量葡萄糖、半乳糖等单糖,且被证实具有明显降胆固醇作用[22]。经纤维素酶改性后,CMF单糖组成发生了明显变化,CM-IDF中阿拉伯糖和木糖含量有所下降,葡萄糖和半乳糖的相对含量有所增加,而CM-SDF中的阿拉伯糖含量提高了37.14%,半乳糖相对含量也有所增加。由此可以说明,经纤维素酶改性后的膳食纤维中有部分IDF(尤其是水不溶性AX)水解为SDF,其内在组成发生了改变,从而提高了其体外胆固醇吸附量。
2.4.2 红外光谱分析
如图5所示,TDF和CMF的红外光谱图(4 000~500 cm-1)中均包含了烃基、吡喃糖环所含乙醇基的C-O伸缩振动,吡喃糖环状结构的特征键C-O-C的不对称收缩振动,脂肪族类C-H对称和非对称伸缩振动,C-H不对称和对称弯曲,C-C伸缩振动等一系列典型多聚糖的吸收峰[23]。3 400~3 300 cm-1处是O-H伸缩振动吸收峰,是由氢原子和强电负性的氧原子上的孤对电子相吸引而形成,纤维素则以此缔合状态的氢键相连接形成巨分子,CMF在此波数处的吸收峰相对TDF明显减弱,另外,CMF在1 655 cm-1处出现的结晶水吸收峰明显增强,在1 160 cm-1及1 048 cm-1处的吸收峰相对减少,它们分别为纤维素和半纤维素的C-O-C伸缩振动和C-O的伸缩振动[24],这些都说明纤维素酶对膳食纤维中的纤维素和半纤维素可能起到了水解作用,而分子链间氢链断裂和单一基元纤维的分离,产生更多纤维二糖及短链糖类,造成纤维素聚集结构态的改变,形成更多憎水基团[24],可能因此导致CMF体外胆固醇吸附作用明显高于TDF。

图5 TDF和CMF 的红外 光谱图Fig.5 FT-IR spectra of TDF and CMF
2.4.3 TDF和CMF的超微结构

图6 TDF和CMF的扫描电镜图Fig.6 SEM images of TDF and CMF
Zhou Kequan等[25]的研究表明,膳食纤维的功能作用往往受其结构的影响。TDF和CMF的超微结构如图6所示,TDF的纤维表面明显光滑,而经纤维素酶改性后的CMF则表面粗糙,帚化微纤维增加[26],这主要是由于TDF在纤维素酶的作用下,纤维表面受到一定水解,纤维素酶中的外切葡萄糖苷酶和内切葡萄糖苷酶分别作用于纤维素的结晶区和无定型区,使得膳食纤维的超微结构表现出更疏松的状态,形成更强的毛细管吸附作用,从而使得CMF对胆固醇的吸附作用明显高于TDF。
3 结 论
采用AOAC 985.29《食物中总膳食纤维 酶-质量法》得到MB的TDF的提取率为72.20%,膳食纤维含量为77.38%,在体外模拟小肠环境下其胆固醇吸附量为5.91 mg/g。在酶解温度55 ℃、酶解pH 3.8的条件下,按140 U/g的酶添加量对TDF进行纤维素酶酶解,3 h后得到改性CMF,其体外胆固醇吸附量达到14.21 mg/g,是TDF 的2.40倍(提高了1.40倍)。通过对CMF和TDF的单糖组分及结构分析发现,CMF相对TDF在单糖组分上发生明显变化,产生了更多的纤维二糖及短链糖,形成更多憎水基团。同时改性后的CMF表面更为粗糙,结构相对疏松,这些组成及微观结构的变化与CMF体外胆固醇吸附能力的提高之间可能有密切的关系。
[1] SHAN Shuhua, LI Zongwei, NEWTON I P, et al. A novel protein extracted from foxtail millet bran displays anti-carcinogenic effects in human colon cancer cells[J]. Toxicology Letters, 2014, 227(2): 129-138.
[2] PATEL S. Cereal bran: the next super food with signifi cant antioxidant and anticancer potential[J]. Mediterranean Journal of Nutrition and Metabolism, 2012, 5(2): 91-104.
[3] DEVI P B, VIJAYABHARATHI R, SATHYABAMA S, et al. Health benefits of finger millet (Eleusine coracana L.) polyphenols and dietary fi ber: a review[J]. Journal of Food Science and Technology, 2014, 51(6): 1021-1040.
[4] YALEGAMA L L W C, KARUNARATNE D N, SIVAKANESAN R, et al. Chemical and functional properties of fi bre concentrates obtained from by-products of coconut kernel[J]. Food Chemistry, 2013, 141(1): 124-130.
[5] GALISTEO M, DUARTE J, ZARZUELO A. Effects of dietary fi bers on disturbances clustered in the metabolic syndrome[J]. The Journal of Nutritional Biochemistry, 2008, 19(2): 71-84.
[6] BROWNLEE I A. The physiological roles of dietary fiber[J]. Food Hydrocolloids, 2011, 25(2): 238-250.
[7] HAMAUZU Y, MIZUNO Y. Non-extractable procyanidins and lignin are important factors in the bile acid binding and radical scavenging properties of cell wall material in some fruits[J]. Plant Foods for Human Nutrition, 2011, 66(1): 70-77.
[8] SHOBANA S, MALLESHI N G. Preparation and functional properties of decorticated fi nger millet (Eleusine coracana)[J]. Journal of Food Engineering, 2007, 79(2): 529-538.
[9] 杜崇旭, 牛铭山, 刘雪娇. 膳食纤维改性与应用的研究进展[J]. 大连民族学院学报, 2005, 7(9): 18 -21.
[10] American Association of Cereal Chemistry International. AOAC 985.29 Total Dietary Fiber in Foods Enzymatic-Gravimetric Method[S]. Gaithersburg: AOAC International 18th Edition, 1986.
[11] ZHANG Ning, HUANG Caihuan, OU Shiyi. In vitro binding capacities of three dietary fibers and their mixture for four toxic elements, cholesterol, and bile acid[J]. Journal of Hazardous Materials, 2011, 186(1): 236-239.
[12] PARK Y W. Cholesterol contents of US and imported goat milk cheeses as quantified by different colorimetric methods[J]. Small Ruminant Research, 1999, 32(1): 77-82.
[13] ST PAUL M N. AACC Method 32-07-1980[S]. Amercian: American Association of Cereal Chemistry International, 2000.
[14] STEPAN H, STAUDACHER E. Optimization of monosaccharide determination using anthranilic acid and 1-phenyl-3-methyl-5-pyrazolone for gastropod analysis[J]. Analytical Biochemistry, 2011, 418(1): 24-29.
[15] 陶颜娟. 小麦麸皮膳食纤维的改性及应用研究[D]. 无锡: 江南大学, 2008: 11-13.
[16] GIL N, GIL C, AMARAL M E, et al. Use of enzymes to improve the refi ning of ableached Eucalyptus globulus kraft pulp[J]. Biochemical Engineering Journal, 2009, 46(2): 89-95.
[17] ELLEUCH M, BEDIGIAN D, ROISEUX O, et al. Dietary fibre and fibre-rich by-products of food processing: characterisation, technological functionality and commercial applications: a review[J]. Food Chemistry, 2011, 124(2): 411-421.
[18] 陈银霞. 影响酶促反应速度的外因研究[J]. 现代农业科技, 2008(18): 238-239.
[19] 张世仙, 从凯龙, 曾启华, 等. 酶法提取茅台酒糟中水溶性膳食纤维的工艺研究[J].中国酿造, 2012, 31(3): 97-99.
[20] 刘欢, 贺连斌, 魏静, 等. 纤维素酶和半纤维素酶改性胡萝卜纤维的研究[J].食品与发酵工业, 2011, 37(2): 78-81.
[21] IZYDORCZYK M S, BILIADERIS C G. Cereal arabinoxylans: advances in structure and physicochemical properties[J]. Carbohydrate Polymers, 1995, 28(1): 33-48.
[22] WIKIERA A, IRLA M, MIKA M. Health-promoting properties of pectin[J]. Postepy Higieny i Medycyny Doswiadczalnej, 2014, 68: 590-596.
[23] 李雁, 熊明洲, 尹丛林, 等. 红薯渣不溶性膳食纤维超高压改性[J].农业工程学报, 2012, 28(19): 270-277.
[24] 张艳荣, 魏春光, 崔海月, 等. 马铃薯膳食纤维的表征及物性分析[J].食品科学, 2013, 34(11): 19-23.
[25] ZHOU Kequan, XIA Wenshui, ZHANG Can, et al. In vitro binding of bile acids and triglycerides by selected chitosan preparations and their physico-chemical properties[J]. LWT-Food Science and Technology, 2006, 39(10): 1087-1092.
[26] RASHMI S, NISHI B. Enzymatic treatment of secondary fibers for improving drainage: an overview[J]. Journal of Indian Pulp and Paper Technical Association, 2011, 23(2): 121-125.
Effect of Enzymatic Treatment on Cholesterol-Binding Capacity of Di etary Fiber from Millet Bran
ZHU Yu, GUO Lina, CHU Jiaxi, LÜ Fengxia, LU Zhaoxin, BIE Xiaomei, ZHANG Chong, ZHAO Haizhen*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Total dietary fi ber (TDF) was prepared from millet bran by enzymatic-gravimetric method. In order to improve its in vitro cholesterol-binding capacity, TDF was modifi ed with cellulase. Based on single factor experiments, an L9(34) orthogonal array design was employed to optimize four parameters for enzymatic modification. The optimal e nzymatic treatment conditions that provided a 2.40-fold increase in cholesterol-binding capacity compared with the original TDF (14.21 versus 5.91 mg/g) were determined as 3.8, 140 U/g, 55 ℃ and 3 h for initial pH, cellulase amount, hydrolysis temperature and time, respectively. Comparative studies between the native and modifi ed TDF showed the cellulase treatment changed the monosaccharide composition of TDF and resulted in formation of more cellobioses in the cellulase-modifi ed dietary fi ber (CMF). Compared with TDF, CMF was rougher and had more hydrophobic groups. These physicochemical changes may be closely related to high cholesterol-binding cap acity of CMF in vitro.
millet bran; total dietary fi ber; cellulase; cholesterol-binding capacity; physicochemical analysis
TS209
A
1002-6630(2015)19-0211-06
10.7506/spkx1002-6630-201519038
2014-12-19
朱玉(1990-),女,硕士研究生,研究方向为食品生物技术。E-mail:2012108080@njau.edu.cn
*通信作者:赵海珍(1975-),女,副教授,博士,研究方向为食品生物技术。E-mail:zhaohz@njau.edu.cn
