甜瓜细菌性果斑病病原菌的分离鉴定及16S rDNA序列分析
2015-12-20王新绘刘晓颖
王新绘,刘晓颖,李 冠,*
(1.新疆大学生命科学与技术学院,新疆 乌鲁木齐 830046;2.新疆大学资源与环境科学学院,新疆 乌鲁木齐 830046)
甜瓜细菌性果斑病病原菌的分离鉴定及16S rDNA序列分析
王新绘1,刘晓颖2,李 冠1,*
(1.新疆大学生命科学与技术学院,新疆 乌鲁木齐 830046;2.新疆大学资源与环境科学学院,新疆 乌鲁木齐 830046)
从新疆昌吉甜瓜实验田中采集发病甜瓜样品12 份,对甜瓜细菌性果斑病病原菌进行分离纯化,并根据形态观察、致病性测定得到甜瓜细菌性果斑病病原菌1 株。以该菌总DNA为模板,采用细菌16S rDNA通用引物进行聚合酶链式反应扩增,并克隆到pGM-T载体,测序结果表明:克隆的16S rDNA序列长度为1 493 bp,通过GenBank上序列比对搜索工具分析,并构建系统发育树,对该菌株进行鉴定,结果表明该菌属于Acidovorax avenae subsp. citrulli Willems(Aac),即燕麦嗜酸菌西瓜亚种。
甜瓜;细菌性果斑病;燕麦嗜酸菌西瓜亚种;鉴定
瓜类细菌性果斑病是危害西瓜、甜瓜等葫芦科植物的一种毁灭性病害,也是世界各国公认的检疫性病害。该病主要引起西瓜、甜瓜、籽瓜果实的腐烂,导致减产,给农业生产造成巨大经济损失。在高湿高温条件下,细菌性果斑病具有发病快、防治难、危害重等特点[1]。该病最早于1969年在美国佛罗里达州被发现[2]。1978年Schaad等[3]将其病原菌鉴定为类产碱假单胞菌西瓜亚种。1992年Willems等[4]根据rRNA-DNA和DNA-DNA分子杂交的结果,将该病原菌更名为燕麦嗜酸菌西瓜亚种(Acidovorax avenae subsp. citrulli,Aac)。近年来,我国新疆、宁夏、内蒙古、海南等地都有瓜类细菌性果斑病的发生[5-7],田间发生瓜类细菌性果斑病主要是由于病原菌通过伤口和气孔侵染寄主[8]。病害远距离传播是通过种子带菌进行传播[9-12],对瓜类作物的生产构成了严重威胁。
新疆作为甜瓜的主产区,由于近年来细菌性果斑病的发生,瓜农种植的积极性受到严重影响,特色优势产业出现萎缩。赵延昌等[5]最早对新疆甜瓜细菌性果斑病病原菌进行了鉴定,认为引起甜瓜细菌性果斑病发生的病原是燕麦嗜酸菌西瓜亚种(Aac),属革兰氏阴性菌,菌体短杆状,属rRNA组I,他们主要是依据细胞的表型特征及生理生化性质等传统方法进行病原菌鉴定。
近年来,随着分子生物学的发展,人们开始在分子水平对细菌进行分类鉴定。16S rDNA是研究细菌进化和亲缘关系的重要指标[13]。16S rDNA序列的比较分析已经成为鉴定细菌种属和分类的重要方法之一,被广泛应用于细菌的系统发育和分类研究[14-17]。本研究利用细菌16S rDNA的通用引物对实验田中发病甜瓜中采集的菌株进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,并对扩增产物进行序列测定。将获得的序列在GenBank中进行比对和同源分析,用Neighbour-Joining法构建系统发育树,对分离的菌株进行鉴定。
1 材料与方法
1.1 材料、试剂与培养基
实验所用发病甜瓜为新疆厚皮甜瓜“皇后”,采集于新疆昌吉国家瓜类工程研究中心实验田,病状为发病中期,即瓜体表皮出现褐色凹陷病斑。
T4 DNA连接酶、Taq DNA聚合酶、限制性内切酶、pGM-T克隆试剂盒 宝生物工程(大连)有限公司;EZ-10柱式细菌基因组DNA抽提试剂盒 生工生物工程(上海)股份有限公司;PCR产物纯化试剂盒 天根生化科技(北京)有限公司;大肠杆菌感受态细胞 北京全式金生物技术有限公司。其余试剂均为国产分析纯。
实验所用培养基为KB培养基:蛋白胨20.0 g、甘油10.0 g、磷酸氢二钾1.5 g、MgSO4·7H2O 1.5 g、琼脂17.0 g,蒸馏水1 000 mL,pH 7.2。
1.2 仪器与设备
C1000 PCR仪、凝胶成像分析仪及Quantity One 4.5.0成像软件 美国Bio-Rad公司。
1.3 方法
1.3.1 菌株的分离纯化
参照方中达[18]的方法,取发病的甜瓜,用70%酒精进行表面消毒,然后放入无菌操作台,将病瓜纵向切开,切取瓜内部病健交界组织,75%酒精消毒2 min,放入灭菌水中连续漂洗3 次,放入灭菌研钵研碎,加无菌水浸泡20~30 min,然后用灭菌的接种环蘸取该组织液在KB培养基表面上划线,28 ℃恒温箱内培养,1~2 d后观察待分离菌生长情况。
用灭菌环挑取单菌落,再用平板划线法纯化3 次,28 ℃条件下培养,培养基上出现单菌落时即为纯菌种,4 ℃条件下保存备用。
1.3.2 菌株形态学观察
在菌株生长平板上观察菌落的形态。再经过革兰氏染色,通过光学显微镜观察菌体形态特征。
1.3.3 菌株致病性测定
参照方中达[18]的方法,将分离纯化的菌株在KB培养基上培养24h,然后将菌株配成3×108个/mL的菌悬液。无菌栽培“皇后”品种甜瓜,在苗龄为4~6 叶期时将菌悬液喷雾接种到叶片上,以无菌水喷雾作对照,套袋保湿48 h,鉴定温度在25~30 ℃之间,喷雾接种后的第15天观察记录发病情况。每菌株接种4钵,重复3次。
1.3.4 菌株DNA提取及16S rDNA扩增
病菌的总DNA提取使用EZ-10柱式细菌基因组DNA抽提试剂盒,按试剂盒说明书方法操作。16S rDNA扩增采用细菌通用引物(由生工生物工程(上海)股份有限公司合成)27F (5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R (5’-GGTTACCTTGTTACGACTT-3’)。PCR反应体系(50 μL):DNA 模板约2.0 μL、10×PCR缓冲液5.0 μL、10 mmol/L的P1和P2各0.5 μL、dNTP (10 mmol/L)4 μL、Taq DNA聚合酶(2.5 U/μL)0.5 μL,加灭菌双蒸水至50.0 μL。PCR反应条件:94 ℃5 min;94 ℃30 s,55 ℃30 s,72 ℃90 s,30 个循环;72 ℃10 min。反应结束后,取2~3 μL PCR扩增产物在1.0%琼脂糖凝胶电泳上检测。
1.3.5 PCR产物的克隆和测序
用PCR产物纯化试剂盒纯化回收的PCR产物,与pGM-T克隆载体连接(连接体系10 μL:PCR产物4 μL、T4 DNA连接酶1 μL、Buffer 1 μL、载体1 μL、双蒸水3 μL),转化大肠杆菌DH5α感受态细胞,提取质粒进行重组克隆的筛选与酶切鉴定。操作步骤按试剂盒说明书及《分子克隆实验指南》[19]的常规方法进行。选取阳性的重组子,对扩增片段进行序列测定,测序工作由深圳华大基因科技有限公司完成。
1.3.6 16S rDNA测序结果分析
测序结果在GenBank数据库中进行序列比对搜索工具(Basic Local Alignment Search Tool,BLAST)同源性比对分析(http://blast.ncbi.nlm.nih.gov/Blast.cgi),获得相似性高的序列,用MEGA5.0的Neighbor-Joining法构建系统发育树,自展数为1 000。
2 结果与分析
2.1 菌株的分离纯化结果
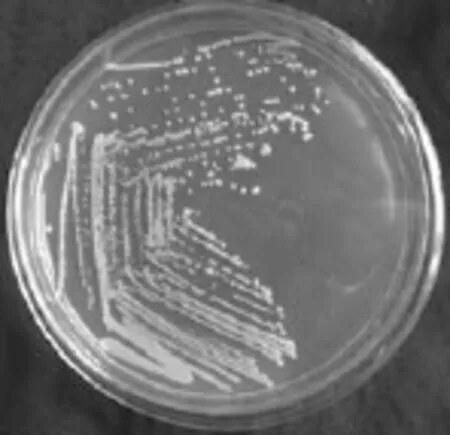
图1 分离纯化菌株的菌落形态Fig.1 Colony morphology of isolated strains
将所采病样12 份经过3 次单菌落的分离和纯化,通过菌落特征和显微细胞形态观察,分离统计结果,共得到细菌3 株,编号为xjgb-wy2、xjgb-wy3、xjgb-wy6。菌株在KB培养基上形成的菌落较多,且菌落形态单一。菌落呈现乳白色、圆形、全缘、隆起、光滑、不透明,对光观察周围有透明圈(图1)。革兰氏染色阴性。菌株的形态特征与已报道的甜瓜细菌性果斑病病原菌形态特征较一致[5]。
2.2 菌株致病性测定结果
将分离纯化得到的3 个菌株接种到甜瓜叶片后,5~6 d后观察只有菌株xjgb-wy6接种的甜瓜叶片开始出现发病症状。第15天观察发病症状,发现甜瓜叶部病斑表现为从叶缘开始沿叶脉向内扩展的黄褐色病斑,为圆形或多角形,后期中间变薄易开裂,褐色焦枯,严重时连片,可以脱离穿孔(图2),与田间甜瓜细菌性果斑病发病症状一致。取病斑的病健交界处又分离到了此病原细菌。上述结果表明菌株xjgb-wy6对甜瓜具有致病性。

图2 分离纯化菌株的致病性Fig.2 Pathogenicity assay of isolated strains
2.3 病原菌DNA的PCR扩增结果
收集活化的病原菌xjgb-wy6,培养菌株至OD600 nm达到0.6~0.8后利用细菌基因组DNA抽提试剂盒提取总DNA,琼脂糖凝胶电泳结果显示病原菌xjgb-wy6总DNA条带清晰、无弥散带,杂质较少,可以用于后续PCR扩增(图3)。

图3 病原菌xjgb-wy6基因组DNA的琼脂糖凝胶电泳图Fig.3 Agarose gel electrophoresis of total DNA of pathogenic strain xjgb-wy6

图4 PCR扩增产物的琼脂糖凝胶电泳图Fig.4 Agarose gel electrophoresis of PCR amplifi cation products
如图4所示,以提取的病原菌总DNA为模板,使用16SrDNA通用引物27F和1492R进行PCR扩增,琼脂糖凝胶电泳结果显示PCR产物分子质量大小与预期一致,在1500bp左右。
2.4 PCR扩增产物的克隆和测序
PCR扩增产物经纯化回收后,连接于pGM-T载体上,转化至感受态细胞E. coli DH5α中,提取质粒,电泳鉴定,挑选阳性克隆质粒进行双酶切(EcoRI和PstI)鉴定,结果如图5所示,获得了PCR产物和连接载体的条带,其中PCR产物被EcoRI切为了2 条条带,进一步验证了PCR产物与pGM-T载体连接成功,送深圳华大基因科技有限公司测序。

图5 PCR连接产物的双酶切结果Fig.5 Double restriction enzyme digestion of pGM-T-16S rDNA
2.5 16S rDNA测序结果及分析
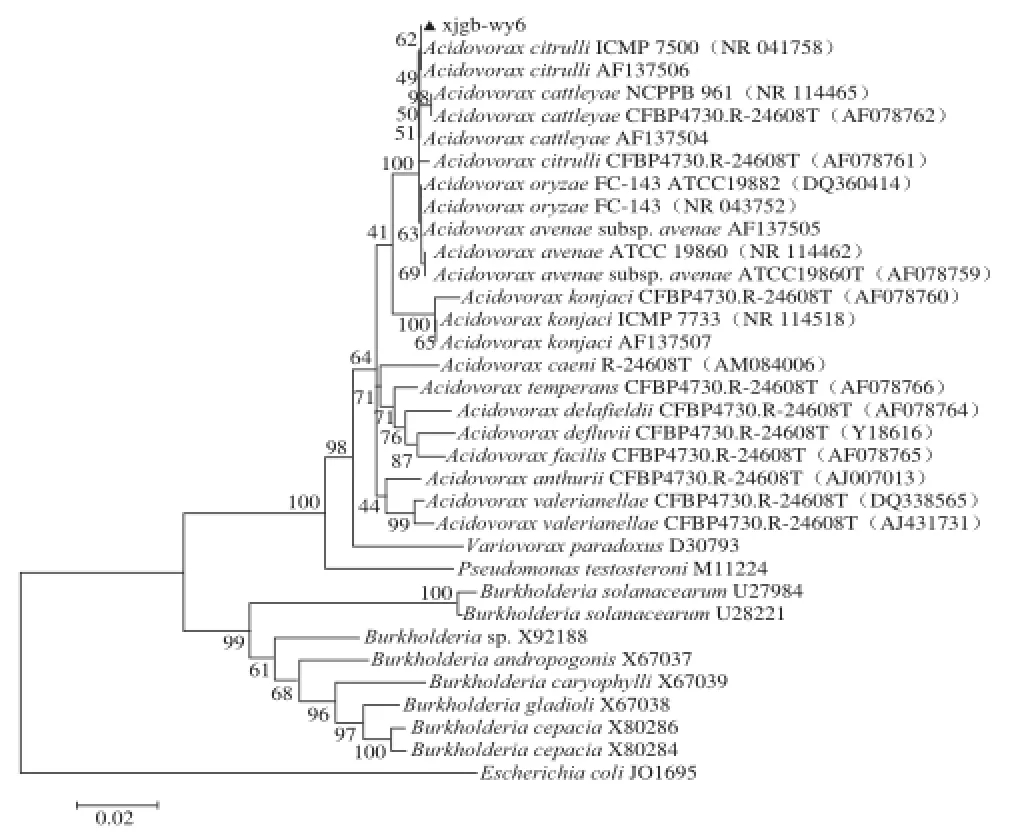
图6 基于菌株xjgb-wy6的16S rDNA序列和Neighbor-Joining法构建的系统发育树Fig.6 Phylogenetic tree based on the 16S rDNA sequence of xjgb-wy6 and Neighbor-Jioning analysis
将克隆的病原菌(xjgb-wy6)16S rDNA片段测序,结果表明该菌株16S rDNA由1 493 个核苷酸组成,测序结果上传至GenBank,登录号为KP862624。将该序列在GenBank中进行BLAST比对,结果显示与Acidovorax cattleyae、Acidovorax citrulli及Acidovorax avenae的一些致病变种的相似性为99%。用MEGA5.0的Neighbor-Joining法构建系统发育树(图6),从进化树中可看出与xjgb-wy6菌株进化关系最为接近的细菌是Acidovorax citrulli,其次是Acidovorax cattleyae,这些菌均属于燕麦嗜酸菌属(Acidovorax),这与BLAST比对结果一致。
3 讨 论
甜瓜细菌性果斑病菌对幼苗和果实均能侵染,构成了其病害循环的一部分[20],病菌可以由果实的气孔或伤口感染,发病初期病斑只局限在果皮,发病中后期,病菌可以蔓延至果肉,引起全果腐烂。本实验中分离菌采用的部位为发病中期的果实,回接菌的部位为幼苗。根据上述致病性测定结果,将从果实中分离纯化的菌株xjgb-wy2、xjgb-wy3和xjgb-wy6接种甜瓜叶片后,只有xjgb-wy6产生发病症状,且症状与田间果实自然发病症状相同,与文献报道的症状也一致[21]。接种后从叶片产生的病斑中又分离到了此病原菌,表明菌株xjgb-wy6对甜瓜具有致病性,同时依据形态学特征分析,确定该菌是甜瓜细菌性果斑病的病原菌。
将菌株xjgb-wy6的16S rDNA序列在GenBank数据库中进行BLAST同源性比对,结果显示其与Acidovorax cattleyae、Acidovorax citrulli及Acidovorax avenae的一些致病变种的相似性为99%。同时用MEGA5.0的Neighbor-Joining法构建系统发育树[22-23],结果显示与该菌株进化关系最为接近的细菌是Acidovorax citrulli。综上所述,可以确定菌株xjgb-wy6属于Acidovorax avenae subsp. citrulli Willems,即燕麦嗜酸菌西瓜亚种。此结果也与赵廷昌等[5]报道的在哈密瓜上得到的鉴定结果相同。对不同细菌的16S rDNA序列进行同源性比较分析是推断细菌系统发育及进化关系的重要方法,本研究对甜瓜细菌性果斑病菌16S rDNA序列进行同源性分析,建立了其在细菌系统演化树上的分类地位,明确了不同菌种之间的同源程度,从而确定了它们之间的亲缘关系和进化地位。
甜瓜细菌性果斑病在我国发生较为普遍,一些甜瓜种植区发病严重。我国从1987年开始有该病的报道,新疆作为甜瓜的主产区,雨水较多的年份细菌性果斑病发生较为严重。目前针对甜瓜细菌性果斑病的研究主要集中在病原菌检测、生理生化特性及致病性等方面[24-28]。为进一步明确新疆甜瓜细菌性果斑病病原菌的分类地位,本研究分离纯化了病原菌并对其进行致病性测定,利用细菌16S rDNA的通用引物对分离纯化的菌株进行PCR扩增,并对扩增产物进行序列测定和分析,为从分子水平进行甜瓜细菌性果斑病病原菌鉴定和分类提供了依据。
[1] 林德佩. 瓜类作物细菌性果实腐斑病(BFB)防治研究概述[J]. 中国瓜菜, 2005(4): 35-37.
[2] CRALL J, SCHENCK N. Bacterial fruit rot of watermelon in Florida[J]. Plant Disease Reporter, 1969, 53(1): 74-75.
[3] SCHAAD N W, POSTNIKOVA E, SECHLER A, et al. Reclassification of subspecies of Acidovorax avenae as A. avenae (Manns 1905) emend., A. cattleyae (Pavarino, 1911) comb. nov., A. citrulli Schaad et al., 1978) comb. nov., and proposal of A. oryzae sp. Nov.[J]. Systematic and Applied Microbiology, 2008, 31(6): 434-446.
[4] WILLEMS A, GOOR M, THIELEMANS S, et al. Transfer of several phytopathogenic Pseudomonas species to Acidovorax as Acidovorax avenae subsp. avenae subsp. nov., comb. nov., Acidovorax avenae subsp. citrulli, Acidovorax avenae subsp. cattleyae, and Acidovorax konjaci[J]. International Journal of Systematic Bacteriology, 1992, 42(1): 107-119.
[5] 赵廷昌, 孙福在, 王兵万, 等. 哈密瓜细菌性果斑病病原菌鉴定[J].植物病理学报, 2001, 31(4): 357-364.
[6] 蔡学清, 黄月英, 杨建珍, 等. 福建省西瓜细菌性果斑病的病原鉴定[J].福建农林大学学报: 自然科学版, 2005, 34(4): 434-437.
[7] REN Y Z, LI H, LI G Y, et al. First report of Acidovorax avenae subsp. citrulli infecting edible seed watermelon (Citrullus lanatus var. lanatus) in China[J]. Plant Disease, 2006, 90(8): 1112.
[8] 翟艳霞, 胡俊, 黄俊霞, 等. 哈密瓜叶片结构与细菌性果斑病抗性的研究[J]. 内蒙古农业大学学报: 自然科学版, 2006, 27(1): 47-50.
[9] HOPKINS D, THOMPSON C. Seed transmission of Acidovorax avenae subsp. citrulli in cucurbits[J]. HortScience, 2002, 37(6): 924-926.
[10] HOPKINS D, THOMPSON C, HILGREN J, et al. Wet seed treatment with peroxyacetic acid for the control of bacterial fruit blotch and other seedborne diseases of watermelon[J]. Plant Disease, 2003, 87(12): 1495-1499.
[11] WALCOTT R, GITAITIS R, CASTRO A. Role of blossoms in watermelon seed infestation by Acidovorax avenae subsp. citrulli[J]. Phytopathology, 2003, 93(5): 528-534.
[12] LESSL J, FESSEHAIE A, WALCOTT R. Colonization of female watermelon blossoms by Acidovorax avenae ssp. citrulli and the relationship between blossom inoculum dosage and seed infestation[J]. Journal of Phytopathology, 2007, 155(2): 114-121.
[13] CLARRIDGE J E. Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases[J]. Clinical Microbiology Reviews, 2004, 17(4): 840-862.
[14] ARMOUGOM F, BITTAR F, STREMLER N, et al. Microbial diversity in the sputum of a cystic fibrosis patient studied with 16S rDNA pyrosequencing[J]. European Journal of Clinical Microbiology & Infectious Diseases, 2009, 28(9): 1151-1154.
[15] WEISBURG W G, BARNS S M, PELLETIER D A, et al. 16S ribosomal DNA amplification for phylogenetic study[J]. Journal of Bacteriology, 1991, 173(2): 697-703.
[16] 戴欣, 陈月琴. 海洋细菌的分子鉴定分类[J]. 中山大学学报: 自然科学版, 2000, 39(1): 68-71.
[17] 严雪瑞, 陈文峰, 陈文新, 等. 小叶锦鸡儿根瘤菌的分离及其16S rDNA PCR-RFLP分析[J]. 华中农业大学学报, 2007, 26: 141-146.
[18] 方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998: 64; 179-181.
[19] 萨姆布鲁克J, 拉塞尔D W. 分子克隆实验指南[M]. 黄培堂, 译. 3版.北京: 科学出版社, 2002: 627-628.
[20] WALL G C. Control of watermelon fruit blotch by seed heattreatment[J]. Phytopathology, 1989, 79(1): 191.
[21] SOMODI G C, JONES J, HOPKINS D, et al. Occurrence of a bacterial watermelon fruit blotch in Florida[J]. Plant Disease, 1991, 75(10): 1053-1056.
[22] MAKIZUMI Y, IGARASHI M, GOTOH K, et al. Genetic diversity and pathogenicity of cucurbit-associated Acidovorax[J]. Journal of General Plant Pathology, 2011, 77(1): 24-32.
[23] HU F P, YOUNG J, TRIGGS C, et al. Relationships within the proteobacteria of plant pathogenic Acidovorax species and subspecies, Burkholderia species, and Herbaspirillum rubrisubalbicans by sequence analysis of 16S rDNA, numerical analysis and determinative tests[J]. Antonie van Leeuwenhoek, 2001, 80(3/4): 201-213.
[24] HENSON J M, FRENCH R C. The polymerase chain reaction and plant disease diagnosis[J]. Papers in Plant Pathology, 1993, 31(1): 81-109.
[25] WALCOTT R, GITAITIS R. Detection of Acidovorax avenae subsp. citrulli in watermelon seed using immunomagnetic separation and the polymerase chain reaction[J]. Plant Disease, 2000, 84(4): 470-474.
[26] RANE K K, LATIN R X. Bacterial fruit blotch of watermelon: association of the pathogen with seed[J]. Plant Disease, 1992, 76(5): 509-512.
[27] 伍永明, 张祥林, 罗明. 西瓜细菌性果斑病菌Taq Man探针实时荧光PCR检测鉴定方法的建立[J]. 新疆农业大学学报, 2006, 29(3): 68-72.
[28] 赵丽涵, 王笑, 谢关林, 等. 免疫捕捉PCR法检测西瓜细菌性果斑病[J].农业生物技术学报, 2006, 14(6): 946-951.
Isolation, Identifi cation and 16S rDNA Sequence Analysis of Bacterial Fruit Blotch Pathogen in Melon
WANG Xinhui1, LIU Xiaoying2, LI Guan1,*
(1. College of Life Science and Technology, Xinjiang University, Ürümqi 830046, China; 2. College of Resource and Environment Sciences, Xinjiang University, Ürümqi 830046, China)
Twelve fruits of melon with bacterial fruit blotch collected from Changji, Xinjiang were investigated for the isolation and purifi cation of the pathogen. The pathogenic strain was subjected to polymerase chain reaction (PCR) amplifi cation with the bacterial 16S rDNA universal primer using its total DNA as the template and the products were cloned into pGM-T vector. Sequencing analysis revealed that the fragment had a length of 1 493 bp. Basic Local Alignment Search Tool (BLAST) and phylogenetic tree analysis showed that the strain belongs to Acidovorax avenae subsp. citrulli Willems (Aac).
melon; bacterial fruit blotch; Acidovorax avenae subsp. citrulli Willems; identifi cation
Q945.8
A
1002-6630(2015)19-0186-04
10.7506/spkx1002-6630-201519033
2015-04-01
新疆维吾尔自治区自然科学基金项目(2011211B09)
王新绘(1979-),男,博士研究生,研究方向为资源植物学。E-mail:wangxh@xju.edu.cn
*通信作者:李冠(1949-),男,教授,硕士, 研究方向为植物生理生化与分子生物学。E-mail:guanli@xju.edu.cn
