草酸脱羧酶促进草酸钙结晶溶解的体外研究
2015-12-20贺俊斌林日辉梁宇薇陈阳阳黄奇良
贺俊斌,龙 寒,林日辉,梁宇薇,陈阳阳,高 华,黄奇良
(1.广西民族大学海洋与生物技术学院,广西高校微生物与植物资源利用重点实验室,广西 南宁 530006;2.广西民族大学化学化工学院,化学与生物转化过程新技术广西高校重点实验室,广西 南宁 530006)
草酸脱羧酶促进草酸钙结晶溶解的体外研究
贺俊斌1,龙 寒1,林日辉2,*,梁宇薇1,陈阳阳1,高 华1,黄奇良2
(1.广西民族大学海洋与生物技术学院,广西高校微生物与植物资源利用重点实验室,广西 南宁 530006;2.广西民族大学化学化工学院,化学与生物转化过程新技术广西高校重点实验室,广西 南宁 530006)
在体外实验条件下,考察了加酶量、反应pH值、反应温度及其产物甲酸根等因素对草酸脱羧酶催化草酸降解从而促进草酸钙结晶重新溶解过程的影响。结果表明,在10 mL反应体系中,添加4 U草酸脱羧酶,反应pH 3.0,反应温度为37 ℃,反应进行1 周(168 h),可使近5%的草酸钙结晶重新溶解;实验结果表明,草酸降解产物甲酸根对草酸脱羧酶促进草酸钙结晶溶解产生抑制作用。
草酸脱羧酶;草酸钙;溶解
泌尿系结石是泌尿外 科的常见病和多发病,该病的主要特点是临床治愈后具有明显的复发倾向,大约25%~75%的患者在初次发病后的10~20 a内会再次发生结石,给患者带来了极大的痛苦。研究表明,泌尿系结石中大约有70%~80%为草酸钙结石[1-2]。目前,虽然这类疾病可通过物理、化学方法,如化学药物治疗、体外冲击波碎石术、输尿管镜碎石术、经皮肾镜取石术等[3]方法治疗,并取得一定疗效,但物理化学方法对人体副作用较大、治疗费用昂贵,且结石复发率高。因此,寻求较温和的治疗方法,减轻结石病患者的痛苦显得尤为重要。生物酶具有高效性、专一性和温和性等作用特点,且已经有服用某种酶制剂进行降解人体内的草酸盐以预防治疗草酸盐结石症的报道[4-5]。因此,利用可分解草酸的酶制成酶制剂,以预防治疗草酸钙结石症已成为重要的研究方向。
草酸脱羧酶(oxalate decarboxylase,Oxdc,EC 4.1.1.2)是一种包含Mn2+的均一聚合酶,催化草酸转化为甲酸和CO2(图1),属cupin蛋白超家族,是植物、微生物中草酸代谢降解的主要催化酶之一[6]。该酶最早由Shimazono[7]发现于白腐菌中,它主要来源于黑曲霉、核盘菌、金针菇和褐腐菌等真菌[8],枯草芽孢杆菌(Bacillus subtilis)在低pH值条件下也能诱导合成Oxdc[9],动物中只在豚鼠(天竺鼠)的肝脏中发现该酶[10]。基于Oxdc广泛的微生物来源、对底物的高度特异性以及酶促反应的高效性等特点,将该酶应用于农业、食品、工业生产、医疗等领域中的草酸盐降解获得了广泛的关注[11-12]。

图1 Oxdc催化草酸的脱羧反应Fig.1 Decarboxylation of oxalic acid catalyzed by oxalate decarboxylase
溶解与结晶是一个反应平衡,只要不断移除或破坏溶质分子,就可以使平衡向溶解方向移动。为了探讨Oxdc催化草酸降解对草酸钙结晶重新溶解的促进作用,本实验在体外模拟尿液环境,采用来源于Bacillus subtilis 的Oxdc处理草酸钙结晶物,通过电感耦合等离子体原子发射光谱法[13-14](inductively coupled plasma-atomic emission spectrometry,ICP-AES)测定反应体系中Ca2+浓度的变化,评价Oxdc在体外促进草酸钙结晶溶解的能力及影响因素,以期为Oxdc酶制剂应用于防治草酸钙结石症提供理论参考。
1 材料与方法
1.1 材料、试剂与仪器
基因工程菌E. coli BL21(DE3)/pET32a/YvrK广西高校微生物与植物资源利用重点实验室保存;LB培养基组成:1 L培养基含蛋白胨10 g、酵母提取物5 g、NaCl 10 g;LB固体培养基添加18 g琼脂粉。
草酸钾、甲酸脱氢酶(formate dehydrogenase,FDH) 美国Sigma公司;氨苄青霉素 美国Amresco公司;异丙基硫代-β-D-半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG) 德国Merck公司;烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD) 瑞士Roche公司;其他试剂均为国产分析纯。模拟尿液:配制pH 4.0的醋酸盐缓冲液,添加尿液中的主要成分[15]:NaCl、枸橼酸三钠、Na2SO4、NaH2PO4、MgSO4、KCl、NH4Cl。
HisTrap HP亲和柱和凝胶成像系统 美国Bio-Rad公司;快速蛋白液相色谱系统 美国通用公司;TU-1901紫外-可见分光光度计 北京普析通用仪器公司;CR-22G高速冷冻离心机 日本日立公司;Sigma 1-13高速台式离心机 美国Sigma公司;超低温冰箱 美国Beckman公司;4 ℃冰箱 中国海尔集团;JY92-Ⅱ超声波细胞粉碎机 宁波新芝生物科技股份有限公司;HH-2数显恒温水浴锅 国华电器有限公司;电子天平梅特勒-托利多仪器有限公司;iCAP 6300型电感耦合等离子体发射光谱仪 美国Thermo Scientific公司。
1.2 方法
1.2.1 Oxdc的制备与酶活力检测
Oxdc的制备参考文献[16-17]方法,培养发酵基因工程菌E. coli BL21(DE3)/pET32a/YvrK,添加IPTG至终浓度0.4 mmol/L,诱导表达4 h后,离心收集菌体,以pH 8.0磷酸盐缓冲液重悬菌体,超声破碎,收集上清即为粗酶液,用快速蛋白质液相色谱系统AKTA-FPLC对粗酶液进行纯化。使用AKTA-FPLC系统对Oxdc粗酶液进行纯化前,预先用 0.45 μm孔径水性滤膜对Oxdc粗酶液进行抽滤,去除部分颗粒杂质。方法:1)平衡,在亲和柱上样前先用缓冲液A过柱,平衡至基准线基本形成一条直线;2)上样,将预处理的粗酶液在冰浴条件下以1 mL/min流速过柱,蛋白质即吸附在亲和柱上;3)洗脱,亲和柱先用A液洗脱80 mL,含A液90%、B液10%的混合缓冲液洗脱40 mL,再将B液体积分数从10%升至100%进行线性洗脱。具体溶液配制:A液,配制50 mmol/L pH 8.0磷酸盐缓冲液,加入咪唑至终浓度20 mmol/L,NaCl至终浓度0.5 mol/L,调节pH值至8.0;B液,配制50 mmol/L pH 8.0磷酸盐缓冲液,加入咪唑至终浓度500 mmol/L,NaCl至终浓度0.5 mol/L,调节pH值至8.0。收集出峰的对应管即为Oxdc纯化酶。
Oxdc的酶活力测定参考文献[18]方法。酶活力单位( U)定义为:每分钟催化转化草酸产生1 μmol甲酸的酶量为一个酶活力单位。
蛋白质含量采用考马斯亮蓝法测定,以牛血清白蛋白作为标准。实验测得Oxdc纯化酶活力为14.33 U/mL,蛋白质含量为2.26 mg/mL。
1.2.2 标准溶液的制备及标准曲线的绘制
Ca标准储备液:准确称取甲酸钙结晶0.130 1 g(精确至0.000 1 g),放入100 mL容量瓶中,用上述模拟尿液定容。标准工作液:配制不同浓度的Ca标准溶液,供电感耦合等离子体发射光谱仪测定。
以模拟尿液作为零点,测定系列浓度的Ca2+标准溶液,以Ca2+浓度为横坐标,信号强度为纵坐标,建立标准曲线。结果表明,在谱线373.69 nm波长处进行测定,Ca灵敏度高,无其他光谱干扰;Ca2+的浓度在0.005~2.56 mmol/L范围内时,线性关系良好,其回归方程为:y=288 301x+6 882.5,相关系数为0.999 0。
1.2.3 Oxdc溶解草酸钙结晶的实验
1.2.3.1 加酶量对Oxdc溶解草酸钙结晶的影响
准确称取25 mg(精确至0.000 1 g)草酸钙结晶置于锥形瓶中,加入10 mL模拟尿液,再分别加入1、2、4 U Oxdc,混匀后,37 ℃恒温振荡进行溶解反应,设计3 组平行实验,定时取样检测体系中Ca2+浓度的变化,取平均值。
1.2.3.2 反应pH值对Oxdc溶解草酸钙结晶的影响
准确称取25 mg(精确至0.000 1 g)草酸钙结晶置于锥形瓶中,加入10 mL模拟尿液,调节pH值分别至2.5、3.0、3.5、4.0、4.5、5.5、6.5,分别加入4 U Oxdc,混匀后,37 ℃恒温振荡进行溶解反应1 周,并做空白对照实验(不加Oxdc);设计3 组平行实验,测定体系中Ca2+的浓度,取平均值。
1.2.3.3 反应温度对Oxdc溶解草酸钙结晶的影响
准确称取25 mg(精确至0.000 1 g)草酸钙结晶置于锥形瓶中,加入10 mL模拟尿液,加入4 U Oxdc,混匀后,分别在30、33、35、37、40 ℃条件下恒温振荡进行溶解反应1 周,并做空白对照实验(不加Oxdc),设计3 组平行实验,测定体系中Ca2+的浓度,取平均值。
1.2.3.4 反应产物对Oxdc溶解草酸钙结晶的影响
准确称取25 mg(精确至0.000 1 g)草酸钙结晶置于锥形瓶中,加入10 mL模拟尿液,分别加入0.2、0.4、0.6、0.8、1.0 mmol/L的甲酸钠,再分别加入4 U Oxdc,混匀后,37 ℃恒温振荡进行溶解反应1 周;并做空白对照实验(不加Oxdc),设计3 组平行实验,测定体系中Ca2+的浓度,取平均值。
2 结果与分析
2.1 不同加酶量对Oxdc溶解草酸钙结晶的影响
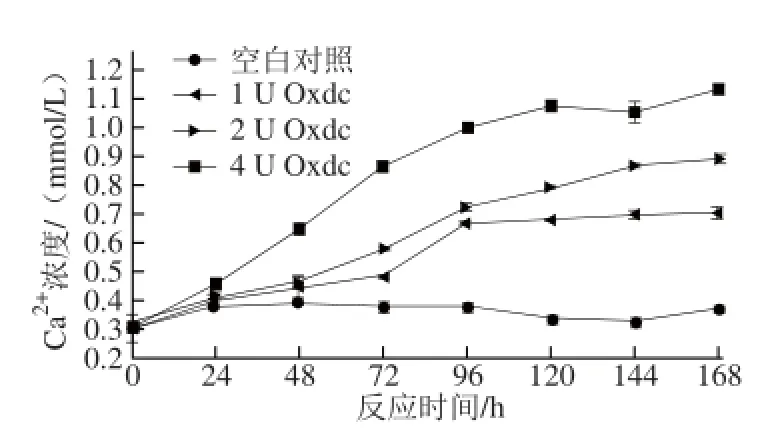
图2 加酶量对Oxdc溶解草酸钙结晶的影响Fig.2 Effect of Oxdc dosage on the dissolution of calcium oxalate crystals
如图2所示,添加不同酶量的Oxdc对催化草酸钙结晶溶解的速率有很大的影响。随Oxdc用量的增加及反应时间的延长,催化草酸钙结晶溶解产生的Ca2+增多;添加1 U Oxdc的催化反应在96 h前Ca2+浓度呈现逐渐上升的趋势,随后基本保持平衡。添加2 U Oxdc的催化反应中,随着反应时间的延长,体系中Ca2+的浓度逐渐上升,并在168 h后Ca2+浓度达到最大值0.89 mmol/L,相当于溶解了1.30 mg的草酸钙结晶。添加4 U Oxdc的催化反应中,随着反应时间的延长,草酸钙结晶溶解的速率明显加快,并在120 h时趋于平缓,反应进行168 h后,体系中Ca2+浓度达到最大值1.14 mmol/L,相当于溶解了1.67 mg的草酸钙结晶。而不加Oxdc的空白对照组中Ca2+浓度基本保持不变,说明Oxdc可催化草酸钙结晶进行进一步的溶解。
2.2 不同反应pH值对Oxdc溶解草酸钙结晶的影响

图3 反应pH值对Oxdc溶解草酸钙结晶的影响Fig.3 Effect of pH on the dissolution of calcium oxalate crystals
如图3所示,在不同反应pH值的模拟尿液中进行Oxdc溶解草酸钙结晶的反应,未加Oxdc的空白对照组在pH 2.5~4.5之间Ca2+浓度基本保持不变,之后随着pH值的增加,草酸钙结晶的溶解速率迅速减小,这可能是因为模拟尿液中的枸橼酸盐等相关成分影响了草酸钙结晶的溶解,从而降低了体系中Ca2+的含量。而添加4 U Oxdc的反应体系中Ca2+浓度在pH 3.0时达到最大值(约1.08 mmol/L),随后逐渐下降,并在pH 5.5时体系中Ca2+的浓度与未加Oxd c的空白对照组相比无明显变化,这与Oxdc的酶活力相关,因为Oxdc进行催化反应的pH值偏酸性(最适pH 3.5),当pH>4.5时酶促反应速率随pH值升高而下降,pH 6.5时酶活力基本丧失。
2.3 不同反应温度对Oxdc溶解草酸钙结晶的影响

图4 反应温度对Oxdc溶解草酸钙结晶的影响Fig.4 Effect of temperature on the dissolution of calcium oxalate crystals
如图4所示,随着反应温度的升高,添加4 U Oxdc的反应体系中Ca2+浓度呈现逐渐上升的趋势,并在37 ℃时其溶解速率趋于平缓,而未加Oxdc的反应体系中Ca2+浓度基本保持不变。说明Oxdc在37~40 ℃条件下进行催化反应,可达到相对较高的酶活力,这与Oxdc在35~40 ℃条件下,既可达到相对较高的酶活力,又可避免高温对酶结构破坏的结果一致[16]。
2.4 反应产物浓度对Oxdc溶解草酸钙结晶的影响
Ox dc催化草酸钙结晶转化为甲酸钙和CO2,其催化反应速率在某种程度上受产物的抑制作用[19]。研究表明,产物甲酸根可能与Oxdc结构中的锰离子结合位点结合,从而抑制Oxdc的酶活性[20]。产物影响Oxdc溶解草酸钙结晶 反应的结果如图5所示,随着体系中甲酸根的增多,未加Oxdc的空白对照实验中Ca2+浓度逐渐下降,这是由于甲酸根对草酸钙结晶具有较强的聚集作用,从而减小草酸钙结晶的溶解性;而添加4 U Oxdc的反应体系中Ca2+浓度也随着产物甲酸根的增多而减小,并在甲酸根达到0.8 mmol/L时Ca2+浓 度达到最小值,随后趋于平衡,说明催化反应体系中添加的甲酸根与产物甲酸根达到一定浓度时会对Oxdc的结构产生 影响,当添加的甲酸根达到0.8 mmol/L时,Oxdc的酶活力可能基本丧失,草酸钙结晶溶解的速率降低,这与添加200 μg Oxdc于10 mL pH 4.2的醋酸盐缓冲液中进行草酸钙结晶溶解反应5 d后,体系中再添加10 U FDH和1 U NAD+进行将甲酸盐转化为碳酸氢盐,从而减小产物抑制作用,增加草酸钙结晶溶解速率的结果一致[21]。

图5 反应产物对Oxdc溶解草酸钙结晶的影响Fig.5 Effect of reaction product on the dissolution of calcium oxalate crystals
3 结 论
本实验在体外模拟尿液体系中采用来源于Bacillus subtilis的Oxdc进行了草酸钙结晶重溶解的实验,通过测定催化反应体系中Ca2+的浓度变化,评价了Oxdc在体外溶解草酸钙结晶的能力及影响因素。结果表明,随着加酶量的增加,Oxdc催化草酸钙结晶溶解的速率加快,添加4 U Oxdc进行催化草酸钙结晶溶解168 h后,可溶解约6.68%的草酸钙结晶,而未加Oxdc的空白对照组中溶解了约1.8%的草酸钙结晶。考察影响因素研究发现,当模拟尿液pH值为3.0,反应温度在37~40 ℃条件下,Oxdc催化草酸钙结晶溶解的速率最快;而产物甲酸根是影响Oxdc催化草酸钙结晶溶解速率的重要因素,当反应体系中产生的甲酸根达到一定浓度时,Oxdc的结构可能受到影响,因而影响了Oxdc的酶活性,减小了草酸钙结晶溶解的速率。因此,Oxdc催化草酸钙结晶溶解的过程中,应通过添加其他分解甲酸根的酶或替代品,减少产物抑制酶活性的作用,以提高草酸钙结晶溶解的速率。此外,来源于Bacillus subtilis的Oxdc催化草酸分解的Km为15 mmol/L[20],在上述实验中获得的最大反应速率未达到该酶真正的最大反应速率。因此,对来源于Bacillus subtilis的Oxdc进行突变改造或化学修饰,降低反应Km,改善其催化性能是后续研究的重要工作之一。本实验为Oxdc应用于防治草酸钙结石症提供了理论基础。
[1] ASPLIN J R. Hyperoxaluric calcium nephrolithiasis[J]. Endocrinology and Metabolism Clinics of North America, 2002, 31(4): 927-949.
[2] COE F L, EVAN A, WORCESTER E. Kidney stone disease[J]. Journal of Clinical Investigation, 2005, 115(10): 2598-2608.
[3] 杨寿佐. 泌尿系结石治疗新进展[J]. 临床合理用药杂志, 2011(32): 130-131.
[4] SHENOY B C, CACHERO T G, SHIN J, et al. Crystallized oxalate decarboxylase and methods of use: US, 8142775[P]. 2012-03-27.
[5] GRUJIC D, S ALIDO E C, SHENOY B C, et al. Hyperoxaluria is reduced and nephrocalcinosis prevented with an oxalate-degrading enzyme in mice with hyperoxaluria[J]. American Journal of Nephrology, 2009, 29(2): 86-93.
[6] 赵树田, 张士青. 草酸代谢酶的研究进展[J]. 上海交通大学学报: 医学版, 2007, 27(10): 1274-1277.
[7] SHIMAZONO H. Oxalic acid decarboxylase, a new enzyme from the mycelium of wood destroying fungi[J]. Journal of Biochemistry, 1955, 42(3): 321-340.
[8] MÄKELÄ M R, HILDÉN K, LUNDELL T K. Oxalate decarboxylase: biotechnological update and prevalence of the enzyme in filamentous fungi[J]. Applied Microbiology and Biotechnology, 2010, 87(3): 801-814.
[9] TANNER A, BORNEMANN S. Bacillus subtilis YvrK is an acidinduced oxalate decarboxylase[J]. Journal of Bacteriology, 2000, 182(18): 5271-5273.
[10] MURTHY M, TALWAR H S, NATH R, et al. Oxalate decarboxylase from guinea-pig liver[J]. IRCS Medical Science-Biochemistry, 1981, 9(8): 683-684.
[11] 曹茂新, 洪枫, 朱利民. 草酸脱羧酶及其应用[J]. 中国生物工程杂志, 2005, 25(B04): 170-175.
[12] 舒佳宾, 官春云. 草酸脱羧酶的性质及应用[J]. 中国油料作物学报, 2012, 34(1): 109-113.
[13] 胡友波, 李东刚, 孙长华. 电感耦合等离子体发射光谱法分析小麦粉制品中的K、Na、Ca、Mg、Al、Ti[J]. 化学分析计量, 2011(1): 29-31.
[14] 郭琳, 赵怀颖, 温宏利, 等. 电感耦合等离子体发射光谱法同时测定卤水中锂钠钾钙镁硼硫氯[J]. 岩矿测试, 2012, 31(5): 824-828.
[15] BURNS J R, FINLAYSON B. A proposal for a standard reference artificial urine in in vitro urolithiasis experiments[J]. Investigative Urology, 1980, 18(2): 167-169.
[16] 林日辉, 许丽莉, 农勉, 等. 重组草酸脱羧酶的表达及酶学性质研究[J].食品与发酵工业, 2011, 37(2): 57-61.
[17] 梁跃. 草酸脱羧酶的无载体固定化及化学修饰的研究[D]. 南宁: 广西民族大学, 2012: 1-36.
[18] SVEDRUZIC D, LIU Y, REINHARDT L A, et al. Investigating the roles of putative active site residues in the oxalate decar boxylase from Bacillus subtilis[J]. Archives of Biochemistry and Biophysics, 2007, 464(1): 36-47.
[19] CLELAND W W. The kinetics of enzyme-catalyzed reactions with two or more substrates or products: III. Prediction of initial velocity and inhibition patterns by inspection[J]. Biochimica et Biophysica Acta (BBA)-Specialized Section on Enzymological Subjects, 1963, 67: 188-196.
[20] TANNER A, BOWATER L, FAIRHURST S A, et al. Oxalate decarboxylase requires manganese and dioxygen for activity. Overexpression and characterization of Bacillus subtilis YvrK and YoaN[J]. Journal of Biological Chemistry, 2001, 276(47): 43627-43634.
[21] THALJI N K, RICHARDS N G, PECK A B, et al. Enzymatic dissolution of calcium and struvite crystals: in vitro evaluation of biochemica l requirements[J]. Urology, 2011, 78(3): 713-721.
Oxalate Decarboxylase Promotes the in vitro Dissolution of Calcium Oxalate Crystals
HE Junbin1, LONG Han1, LIN Rihui2,*, LIANG Yuwei1, CHEN Yangyang1, GAO Hua1, HUANG Qiliang2
(1. Guangxi Colleges and Universities Key Laboratory of Utilization of Microbial and Botanical Resources, School of Marine Sciences and Biotechnology, Guangxi University for Nationalities, Nanning 530006, China; 2. Key Laboratory of New Techniques for Chemical and Biological Conversion Process, School of Chemistry and Chemical Engineering, Guangxi University for Nationalities, Nanning 530006, China)
Crystallization of calcium oxalate in the urinary system is one of the important causes of urinary stones, and enzymatic degradation of oxalic acid for preventing calcium oxalate stones has become a research hotspot. Under in vitro experimental conditions, the factors that affect the re-dissolution of calcium oxalate crystals catalyzed by oxalate decarboxylase were studied. The results indicated that when 4 U of oxalate decarboxylase was added to the 10-mL reaction system which was subsequently allowed to react at pH 3.0 and 37 ℃ for a week, the re-dissolution rate of calcium oxalate crystals was approximately 5%. The experimental results showed that the degradation product formate produced an inhibitory effect on the re-dissolution of calcium oxalate crystals catalyzed by oxalate decarboxylase. This experiment provides a theoretical reference for the study of enzyme preparation to control calcium oxalate stones.
oxalate decarboxylase; calcium oxalate; dissolution
Q814
A
1002-6630(2015)19-0159-04
10.7506/spkx1002-6630-201519028
2014-10-22
教育部留学回国人员科研启动基金项目(教外司留[2012]1707号);广西自然科学基金项目(2014jjAA20030)
贺俊斌(1992-),男,硕士研究生,主要从事生物化工研究。E-mail:hejunbin556298@163.com
*通信作者:林日辉(1972-),男,研究员,博士,主要从事化学与生物转化研究。E-mail:rihuilin@aliyun.com
