高产甘油低产H2S葡萄酒优良酵母菌株筛选及其酿酒特性
2015-12-20刘延琳
宫 雪,江 璐,刘 宁,刘延琳,2,*
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨 凌 712100)
高产甘油低产H2S葡萄酒优良酵母菌株筛选及其酿酒特性
宫 雪1,江 璐1,刘 宁1,刘延琳1,2,*
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨 凌 712100)
为获得中国本土优良酵母,提高葡萄酒感官特性,通过对采自新疆鄯善地区、宁夏广夏三基地的40 株野生酵母菌株进行实验室酿酒实验,筛选到两株高产甘油、低产H2S的葡萄酒优良酵母菌株H02、E22。分别于2010、2011年连续2 a对这2 株菌进行了10~20 L酒厂发酵实验并研究其酿酒特性。酒样理化指标结果符合国家标准GB 15037-2006《葡萄酒》要求,感官品尝分析结果与对照商业酵母V L1、RC212、C2C的差异性不显著(P>0.05),感官品质相当,筛选出的野生酵母菌株有着优良的酿酒特性。
甘油;葡萄酒;酵母菌;筛选;酿酒
甘油是酵母菌酒精发酵过程中的正常副产物,主要在葡萄汁发酵初期产生。甘油存在于各类葡萄酒中,在葡萄酒中含量通常为l~15 g/L[1-3],其甜味阈值为5.2 g/L,是葡萄酒中除水、酒精、CO2以外含量最丰富的成分[4]。甘油具有甜味和黏稠性,由于其甜味和葡萄糖相似[5],所以葡萄酒中高的甘油含量有利于提高葡萄酒的口感,改善葡萄酒的感官特性,从而显著影响葡萄酒的质量,尤其对提高干、半干葡萄酒的质量具有重要意义。硫化氢(H2S)是对葡萄酒风味有重要影响的挥发性硫化物,在葡萄酒酿造过程中,酿酒酵母通过硫代谢过程产生痕量的H2S,它的挥发性很强,具有不愉快的气味,通常被描述为臭鸡蛋味、臭鼬味、大蒜味或洋葱味[6]。因此,提高葡萄酒中甘油含量、降低H2S含量均有利于提高葡萄酒质量。
国内外提高葡萄酒中甘油含量的方法主要有改变发酵条件[7]、热激法[8-11]、构建高产甘油的基因工程菌[12-13]与适应性演化菌种法[14],另外,还有混合菌种发酵、改变葡萄汁成分等方法。但这些方法或多或少都存在着一些不足,如热激法会使葡萄酒中的香气蒸发而丧失;转基因技术在食品饮料中的应用有一定限制且会导致某些发酵副产物增加,如琥珀酸酯和醋酸酯[15];混合菌种发酵导致乙酸等挥发性副产物的增加,给葡萄酒带来不愉悦的香气[16]。去除葡萄酒中H2S的工艺主要有铜沉淀法和惰性气体去除法,铜沉淀法可能会造成葡萄酒中铜离子超标,因此,必须将其降至国家标准允许范围内;惰性气体去除法可能会同时带走其他重要的挥发性物质,从而造成葡萄酒香气物质的损失。
本研究对分离自新疆鄯善地区、宁夏广夏三基地的野生酿酒酵母菌株进行实验室酿酒实验,从中筛选优良酵母菌株,并进一步对优选菌株进行10~20 L酒厂发酵实验,研究其酿酒特性。从中国本土野生酵母中筛选高产甘油、低产H2S的葡萄酒优良酵母,对于提高葡萄酒感官质量,酿造具有中国产区特色的葡萄酒具有重要意义,并为后续相关研究提供一定的参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株
新疆鄯善地区、宁夏广夏三基地2 个地区的不同葡萄品种自然发酵过程中分离的40 株野生酵母菌株,分离源见表1;对照菌株:商业酵母X16、RC212、VL1、C2C法国Laffort公司;不产H2S酿酒酵母UCD932和高产H2S酿酒酵母UCD819 美国UCDavis大学。

表1 菌株采样分离记录Table 1 Details of the isolated strains
1.1.2 试剂
Megazyme甘油检测试剂盒 英国Megazyme公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)试剂:3.25 g 3,5-二硝基水杨酸、2 mol/L氢氧化钠162.5 mL、22.5 g丙三醇,用蒸馏水定容至500 mL,棕色瓶4 ℃恒温放置;葡萄酒理化指标检测试剂的配制和使用参考国家标准GB/T 15038-2006《葡萄酒、果酒通用分析方法》;Triple M模拟汁的配制参考文献[17]。
1.1.3 仪器与设备
MJ-250B型霉菌培养箱 上海跃进医用光学器械厂;H2S检测管 上海豫东电子科技有限公司;普通光学显微镜 重庆光电仪器有限公司。
1.2 方法
1.2.1 高产甘油菌株的筛选
小白玫瑰葡萄除梗破碎取澄清汁,检测总糖含量为187 g/L,总酸含量为6.3 g/L(以酒石酸计),pH值为2.65。将葡萄汁按500 mL/瓶分装到灭过菌的容量为1 L三角瓶中,添加20 mg/L SO2。每瓶按5×105CFU/mL(本实验菌落计数方法均采用血球计数板法计数对数期培养的菌株数量)接种量接入小白玫瑰葡萄汁进行扩大培养,每个菌株重复2 次,商业酵母X16为对照菌株。接种量在较小变化范围内对酵母甘油含量没有显著差异变化[18]。控制温度在20 ℃条件下进行发酵,每隔12 h称量失重(发酵糖转化为CO2气体损失的质量),监测发酵进程,以72 h净失质量总和不超过0.5 g作为发酵终点;发酵结束后自然澄清并分离。按GB/T 15038-2006标准检测每个菌株发酵酒样的相关理化指标,Megazyme甘油检测试剂盒检测甘油含量。
1.2.2 低产H2S菌株的筛选
对1.2.1节中筛选出的高产甘油酵母菌株进一步进行低产H2S特性的相关研究。取500 mL灭菌三角瓶,向其中注入300 mL经过滤除菌的Triple M模拟汁,每瓶按5×105CFU/mL接种量接入模拟葡萄汁活化酵母菌液,用两孔硅胶冒封好口,其中H2S检测管通过球形玻璃弯管与发酵罐内部相连,球形玻璃弯管在硅胶冒下方露出2~3 mm,注意要和液面有较大距离,以免在摇床培养时接触模拟汁,另一孔中插入长不锈钢注射针头到发酵液面以下。将小瓶放入摇床中20 ℃、120 r/min进行培养,DNS法检测还原糖含量监控发酵[19],还原糖含量低于2 g/L终止发酵,测量H2S检测管的显色长度[20]。每菌株3 个重复,不产H2S的酿酒酵母UCD932和高产H2S的酿酒酵母UCD819为对照菌株。
1.2.3 优选菌酿酒特性研究
将筛选出的高产甘油、低产H2S的优选菌在2010、2011年分别在宁夏御马酒厂、山西戎子及甘肃莫高酒厂进行10~20 L酿造实验。新鲜酿酒葡萄除梗破碎,分3 次逐次添加亚硫酸,至游离硫含量达到45 mg/L,并添加20 mg/L果胶酶,混匀后,测定葡萄汁的总酸、总糖含量。采用新鲜调硫的葡萄汁进行菌株活化,将待测菌株以3%投料量加入到适量葡萄汁中,28℃恒温培养箱中培养24h后,将活化好的待测菌株以106CFU/mL的接种量加入到发酵罐中,每个待测菌株设2 个平行。每日分早、中、晚3 次对发酵罐进行压帽,并在压帽后取样监控发酵液的品温和比重,比重到0.990~0.996时测定还原糖含量,还原糖含量小于2 g/L时结束发酵,酒精发酵结束后按GB/T 15038-2006检测酒精体积分数、还原糖、总酸、挥发酸及干浸出物,其中总酸以酒石酸含量计,挥发酸以乙酸含量计。甘油检测试剂盒测定甘油含量;由于大型发酵罐不能安装H2S检测管装置,因此,酒样中H2S的检测参考GB/T 16489-1996《水质硫化物的测定》,采用亚甲基蓝分光光度法。
1.2.4 感官品尝
2010、2011年的小试酒样由西北农林科技大学葡萄酒学院专业品尝员组成品尝小组从外观、香气、口感等方面对不同酒样进行综合感官评价。
2 结果与分析
2.1 高产甘油低产H2S优良酵母菌株筛选
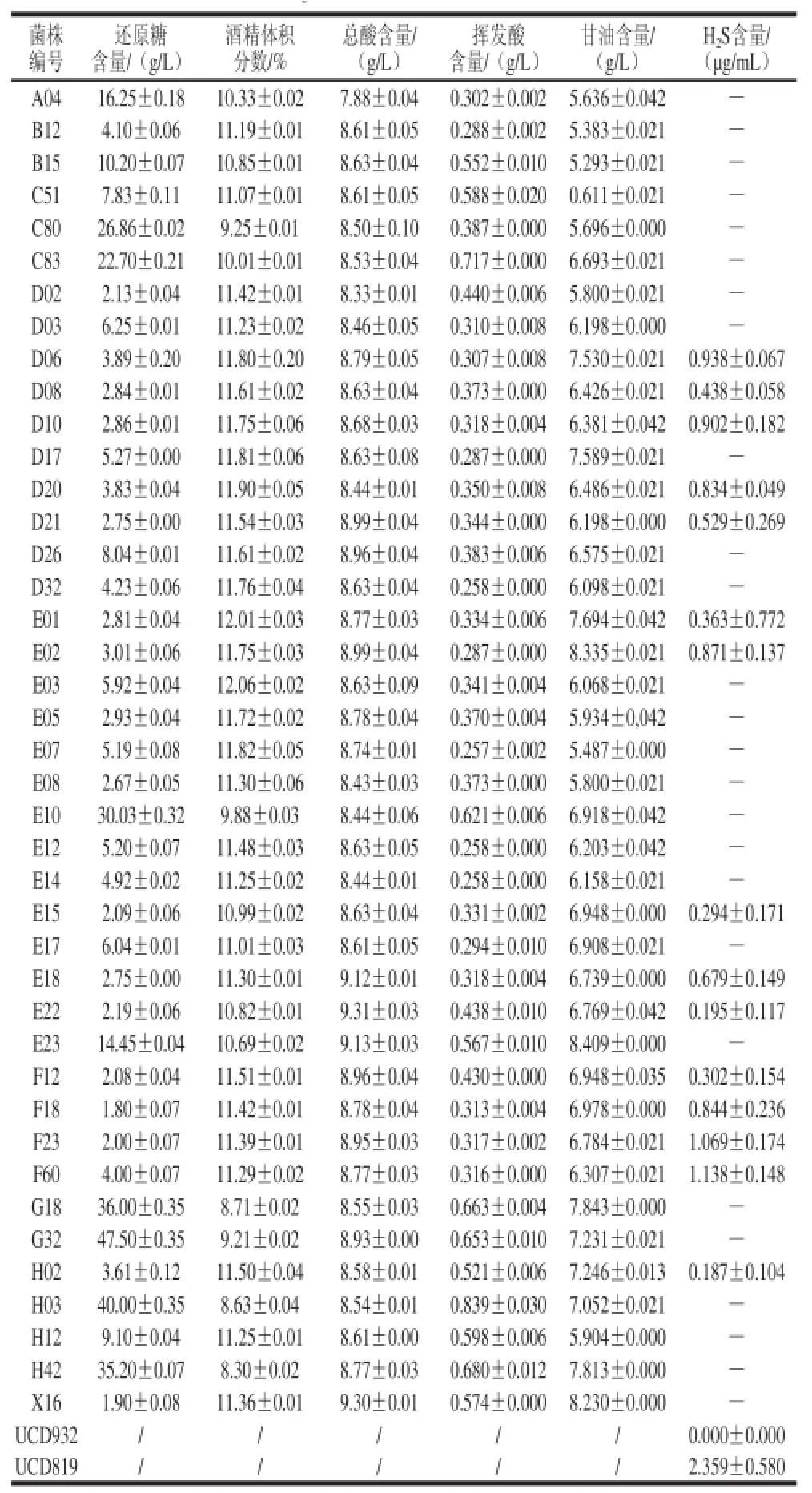
表2 菌株发酵酒样的理化指标Table 2 Physical and chemical indicators of wine fermented by the isolated strains
由表2可知,在供试野生酵母菌株的小白玫瑰葡萄汁发酵中,酒精体积分数为8.30%~12.06%;还原糖含量为1.80~47.50 g/L;挥发酸含量0.257~0.717 g/L低于GB 15037-2006《葡萄酒》规定的1.2 g/L,甘油含量为0.611~8.409 g/L。结合菌株发酵特性和高产甘油特性,将产生酒精体积分数大于10.00%、还原糖含量小于4.00 g/L、挥发酸含量低于0.60 g/L,甘油含量高于6.00 g/L(甘油的甜味阈值为5.2 g/L)的菌株判定为高产甘油的优良菌株,初步筛选出D06、D08、D10、D20、D21、E01、E02、E15、E18、E22、F12、F18、F23、F60、H02共15 株高产甘油的优良野生酵母菌株。
对上述筛选出的高产甘油酵母菌株进一步进行低产H2S特性的相关研究,在Triple M模拟葡萄汁的发酵中,各菌株H2S产量见表2。根据对照高产H2S菌株UCD819 的H2S产量为2.359 μg/mL,将H2S产量低于0.2 μg/mL的菌株定为低产H2S的优选菌株,最终筛选出E22、H02为高产甘油低产H2S的优选菌株。H2S含量分别为(0.195±0.117)μg/mL和(0.187±0.104)μg/mL;甘油含量分别为(6.769±0.042)g/L和(7.246±0.013)g/L。
2.2 优选菌株酿酒特性研究
2.2.1 发酵特性评价
优选菌株2010、2011连续2 a酒厂小试发酵实验各项理化指标检测结果见表3。发现H02、E22的酿酒特性稳定,酒样的酒精体积分数≥11%,还原糖含量≤4.0 g/L,挥发酸含量≤1.2 g/L,符合GB 15037-2006中与酿酒微生物相关的各项指标要求,具有优良的发酵特性;其表现得到厂家的认可,前期的简单观察可初步确认优选菌的应用推广潜力,后续分析尚待进行。
运用SPSS19.0数理分析统计软件对优选菌和商业酵母原酒的各项理化指标在α=0.05显著水平进行t检验,分析结果见表3。
酒精体积分数与H2S指标中,优选菌在2010、2011年赤霞珠和霞多丽中的表现与相应的对照商业酵母差异性都不显著,查t检验临界值表得:t(0.05,2)=4.303。由于优选菌2010、2011年酒精体积分数对应的各t值分别为-2.56、-1.79、2.33、-1.00、-2.39、1.41均小于t(0.05,2)= 4.303,及H2S对应的各t值分别为4.24、4.12、-0.45、2.12、-2.83、-1.90均小于t(0.05,2)=4.303,所以优选菌在2010、2011年赤霞珠和霞多丽中的表现与相应的对照商业酵母差异性都不显著。
甘油和挥发酸指标,H02在2010年赤霞珠品种中的甘油和挥发酸含量与商业酵母RC212的差异性显著(t=-4.88、-5.43,|t|≥t(0.05,2)=4.303),且甘油和挥发酸含量都明显高于商业酵母RC212;优选菌在其他年份及品种中与各自相应的对照商业酵母均差异性不显著(|t|<t(0.05,2)=4.303)。

表3 葡萄原料及葡萄酒理化指标检测结果Table 3 Physical and chemical indicators of grape and wine fermented by selected strains
还原糖和干浸出物指标,H02在2011年霞多丽品种中还原糖含量显著高于VL1(t =-4.32);H02在御马产区2011年霞多丽和2010年赤霞珠中干浸出物含量分别显著低于对应商业酵母VL1和RC212(t = 4.33、26.39)。
总酸指标中,H02在2010、2011年赤霞珠及2011年霞多丽中,总酸含量都分别显著低于对应商业酵母RC212与VL1(t=15、6.43、5.66)。这可能是由于不同酵母在不同条件下有着不同的增酸或者降酸能力,导致最后酒样中酸度差异较大。优选菌在其他各组中的总酸与相应商业酵母差异性不显著(|t|<t(0.05,2)=4.303)。综合优选菌的各发酵指标与商业酵母比较分现,优选菌与商业酵母VL1、RC212、C2C有着相似的优良发酵特性。
2.2.2 感官特性评价

表4 葡萄酒感官品尝结果Table 4 Sensory evaluation of wine fermented by selected strains
品尝员对不同酒样的感官评价平均得分见表4。运用SPSS19.0数理分析统计软件对优选菌和商业酵母原酒品尝员得分在0.05显著水平进行t检验,查t检验临界值表得:t(0.05,10)=2.228。分析比较发现,各优选菌与商业酵母酒样之间感官特性均差异性不显著(|t|<t(0.05,10)= 2.228),且H02的2010赤霞珠、霞多丽与E22的2010赤霞珠与2011霞多丽的感官得分要分别高于对应商业酵母RC212、VL1和C2C。由此得出结论,优选菌株与商业酵母VL1、RC212、C2C在霞多丽、赤霞珠中的表现差异不显著,感官品质相当,即具有类似于商业酵母的优良酿酒特性,具有发展成为商业酵母的潜在能力。
3 结 论
通过实验室酿造实验和菌株筛选,共获得2 株高产甘油且低产H2S的葡萄酒优良野生酵母菌株,分别为H02、E22,在实验室酿造实验中其甘油与H2S含量分别为(7.246±0.013)、(6.769±0.042)g/L与(0.187±0.104)、(0.195±0.117)μg/mL,甘油含量均高于阈值5.2 g/L,H2S含量均低于0.2 μg/mL。
在2010、2011年宁夏御马酒厂、山西戎子及甘肃莫高酒厂的小试发酵实验中,通过t检验分析结果发现,优选菌株与商业酵母VL1、RC212、C2C有着相似的优良发酵特性,且发酵酒样都符合中华人民共和国国家标准:GB 15037-2006规定的要求,优选菌具有甘油产量高、H2S产量低的特点且发酵特性良好,其表现得到厂家的认可。酒样综合感官评价的t检验分析结果显示,优选菌的感官评价结果和各自对应商业酵母VL1、RC212、C2C差异均不显著,感官品质相当,具有发展成为商业酵母的潜在能力。
[1] RANKINE B, BRIDSON D A. Glycerol in Australian wines and factors infl uencing its formation[J]. American Journal of Enology and Viticulture, 1971, 22(1): 6-12.
[2] OUGH C, FONG D, AMERINE M. Glycerol in wine: determination and some factors affecting[J]. American Journal of Enology and Viticulture, 1972, 23(1): 1-5.
[3] 薛军侠, 徐艳文, 裴颖芳, 等. 葡萄酒中酵母菌高产甘油的研究进展[J].微生物学杂志, 2008, 28(5): 77-82.
[4] 朱济义, 杜金华, 王秀菊, 等. 葡萄酒中甘油的生成及其影响因素[J].酿酒, 2010, 37(2): 23-26.
[5] RIBEREAU-GAYON J, PEYNAUD E, GUIMBERTEAU G. Formation des produils secondaires de la fermentation alcoolique en lonction de l’alimentation azotée des levures[J]. Comptes Rendus de Academie des Sciences (Paris), 1959, 248: 749.
[6] BOULTON R, SINGLETON V, BISSON L, et al. Principles and practices of winemaking[M]. New York: Chapman Hall, 1995, 166-168.
[7] DU Gang, ZHAN Jicheng, LI Jingyuan, et al. Effect of fermentation temperature and culture medium on glycerol and ethanol during wine fermentation[J]. American Journal of Enology and Viticulture, 2012, 63(1): 132-138.
[8] OMORI T, OGAWA K, UMEMOTO Y, et al. Enhancement of glycerol production by brewing yeast (Saccharomyces cerevisiae) with heat shock treatment[J]. Journal of Fermetation and Bioengineering 1996, 82(2): 187-190.
[9] OMORI T, OGAWA K, KAJIWARA Y, et al. A novel method for screening high glycerol- and ester-producing brewing yeasts (Saccharomyces cerevisiae) by heat shock treatment[J]. Journal of Fermentation and Bioengineering, 1997, 83(1): 64-69.
[10] BEROVIC M, HERGA M. Heat shock on Saccharomyces cerevisiae inoculum increases glycerol production in wine fermentation[J]. Biotechnology Letters, 2007, 29(6): 891-894.
[11] BERLOT M, BEROVIC M. Saccharomyces cerevisiae inoculum heat shock treatment-new method for enhanced glycerol production in wine[J]. Chemical and Biochemical Engineering Quarterly, 2011, 25(2): 241-245.
[12] 刘桂香, 余秉琦, 诸葛斌, 等. 酿酒酵母胞浆3-磷酸甘油脱氢酶的两个同工酶[J]. 微生物学通报, 2003, 30(5): 106-110.
[13] 赵有玺, 饶志明, 沈微, 等. 产甘油假丝酵母产甘油关键酶基因在酿酒酵母中的表达[J]. 中国生物工程杂志, 2006, 26(1): 38-41.
[14] KUTYNA D R, VARELA C, STANLEY G A, et al. Adaptive evolution of Saccharomyces cerevisiae to generate strains with enhanced glycerol production[J]. Applied Microbiology and Biotechnology, 2012, 93(3): 1175-1184.
[15] REMIZE F, ROUSTAN J, SABLAYROLLES J, et al. Glycerol overproduction by engineered Saccharomyces cerevisiae wine yeast strains leads to substantial changes in by-product formation and to a stimulation of fermentation rate in stationary phase[J]. Applied and Environmental Microbiology, 1999, 65(1): 143-149.
[16] ANDORRA I, BERRADRE M, ROZES N, et al. Effect of pure and mixed cultures of the main wine yeast species on grape must fermentations[J]. European Food Research and Technology, 2010, 231(2): 215-224.
[17] SPIROPOULOS A, TANAKA J, FLERIANOS I, et al. Characterization of hydrogen sulfide formation in commercial and natural wine isolates of Saccharomyces[J]. American Journal of Enology and Viticulture, 2000, 51(3): 233-248.
[18] RADLER F, SCHTITZ H. Glycerol production of various strains of Saccharomyces[J]. American Journal of Enology and Viticulture, 1982, 33(1): 36-40.
[19] 王春晓, 刘延琳. 酿酒酵母菌株发酵过程中硫化氢产率动态变化研究[J]. 酿酒科技, 2012(10): 43-45.
[20] PARK S K. Development of a method to measure hydrogen sulfide in wine fermentation[J]. Journal of Microbiology and Biotechnology, 2008, 18(9): 1550-1554.
Screening and Evaluation of Yeast Strains for Producing Wine Higher in Glycerol and Lower in Hydrogen Sulphide
GONG Xue1, JIANG Lu1, LIU Ning1, LIU Yanlin1,2,*
(1. College of Enology, Northwest A&F University, Yangling 712100, China; 2. Shaanxi Engineering Research Center for Wine and Viticulture, Yangling 712100, China)
In order to screen excellent yeast strains for improving the sensory quality of wine, 40 wild yeast strains were isolated from naturally fermented grapes grown in Xinjiang and Ningxia autonomous regions for laboratory-scale wine fermentation. H02 and E22 strains were screened as excellent strains for producing high-glycerol, low-hydrogen sulphide wine. Fermentation experiments for laboratory-scale production of wine (10 - 20 L) were conducted using the two strains in 2010 and 2011, respectively, for investigating their fermentation characteristics. The physical and chemical indexes of the resulting wines met the requirements of the Chinese national standard GB 15037-2006 for wine. In terms of sensory evaluation, there was no signifi cant difference (P > 0.05) between the two strains and commercial yeasts VL1, RC212 and C2C. These results indicate that the screened strains have excellent fermentation characteristics for wine production.
glycerol; grape wine; yeast; screen; wine-brewing
TS261.1
A
1002-6630(2015)19-0132-05
10.7506/spkx1002-6630-201519023
2013-11-10
“十二五”国家科技支撑计划项目(2012BAD31B07);国家现代农业(葡萄)产业技术体系建设专项(CARS-30-jg-3)
宫雪(1988-),女,硕士研究生,研究方向为葡萄酒分析检测及酿酒微生物。E-mail:gongxue@nwsuaf.edu.cn
*通信作者:刘延琳(1966-),女,教授,博士,研究方向为葡萄-葡萄酒及酿酒微生物。E-mail:yanlinliu@nwsuaf.edu.cn
