响应面法优化盐胁迫发芽苦荞富集γ-氨基丁酸的培养条件
2015-12-20朱云辉郭元新
朱云辉,郭元新
(安徽科技学院食品药品学院,安徽 凤阳 233100)
响应面法优化盐胁迫发芽苦荞富集γ-氨基丁酸的培养条件
朱云辉,郭元新*
(安徽科技学院食品药品学院,安徽 凤阳 233100)
为优化盐胁迫条件下发芽苦荞富集γ-氨基丁酸(γ-aminobutyric acid,GABA)的最优培养条件,在单因素试验的基础上,采用响应面法探讨NaCl浓度、发芽时间和发芽温度对发芽苦荞中GABA含量的影响。结果表明:发芽苦荞在盐胁迫条件下富集GABA的最佳培养条件为:NaCl浓度34 mmol/L、发芽时间5 d、发芽温度31 ℃,在此条件下发芽苦荞中GABA富集量为250.06 μg/g(以干质量计)。方差分析及验证实验显示,模型具有极显著的可靠性和拟合度(R2=0.961 1),可准确预测盐胁迫条件下苦荞发芽过程中GABA的富集量。
苦荞;发芽;盐胁迫;γ-氨基丁酸富集;响应面分析法
苦荞(Fagopyrum tataricum(L.)Gaertn)是一种蓼科荞麦属双子叶植物,又名鞑靼荞麦、乌麦,是我国传统优势小杂粮,在我国西北和西南等地区广有种植,作为营养丰富的食药两用作物,日益受到人们的推崇[1-3]。但苦荞含有蛋白酶抑制剂、植酸等抗营养因子,其营养价值还有待改善[4-5]。有研究表明,苦荞发芽后,氨基酸组成更加合理,可降低或消除抑制剂活性,并可富集γ-氨基丁酸(γ-aminobutyric acid,GABA)、黄酮类物质等功能性成分[2,4,6]。
GABA是一种四碳非蛋白质氨基酸,广泛存在于动植物体内,具有促进记忆、降压、改善脑机能、缓解焦虑和头痛等功能,从食品中获得GABA有促进人体健康的作用,因而富含GABA的食品开发备受科技工作者的重视[7-12]。GABA在高等植物中的合成主要来自GABA支路和多胺降解途径,起主导作用的酶分别为谷氨酸脱羧酶(glutamate decarboxylase,GAD,EC 4.1.1.15)和二胺氧化酶(diamine oxidase,DAO,EC 1.4.3.6)[13-14]。
当植物受到逆境胁迫时,可刺激GAD和DAO活性,继而促进GABA含量积累,其中盐胁迫是一种安全、便捷、环保的胁迫方式[15]。Bai Qingyun等[16]利用不同浓度的NaCl溶液对发芽粟谷进行胁迫处理,发现GABA含量最高可达到23.42 mg/100 g,是对照的1.48 倍。郭元新等[15]研究了NaCl浓度、培养时间和培养温度对大豆发芽富集GABA的影响,结果表明,优化出的最佳条件可使GABA含量较原料增加6.47 倍。但目前有关苦荞在发芽过程中利用NaCl胁迫富集GABA的研究还未见报道,其培养条件有待进一步探明。本研究利用响应面分析法优化盐胁迫条件下发芽苦荞富集GABA的最佳培养条件,以期为苦荞功能性食品的开发和苦荞产业的发展提供理论支持。
1 材料与方法
1.1 材料与试剂
苦荞(榆6-21),千粒质量22.4 g,2013年秋产自中国内蒙古自治区,购买后置于-20 ℃冰箱贮存备用。
GABA标品(纯度≥99.9%)、对二甲氨基苯磺酰氯(dabsyl chloride,DABS-CI,纯度99%) 美国Sigma公司;乙腈为色谱纯,NaCl等其他化学试剂均为分析纯。
1.2 仪器与设备
LHP-160型智能恒温恒湿培养箱 上海三发科学仪器有限公司;Agilent 1200液相色谱仪 美国安捷伦公司;KDC-160HR高速冷冻离心机 合肥科大创新股份有限公司;真空冷冻干燥系统 美国Labconce公司。
1.3 方法
1.3.1 GABA含量的测定
采用高效液相色谱法(high performance liquid chromatography,HPLC),条件参照Guo Yuanxin等[17]的方法,结果以干质量计。
1.3.2 单因素试验
取30 g苦荞种子用去离子水清洗后,用1%的次氯酸钠溶液消毒15 min,用去离子水冲洗至pH值中性,在去离子水中30 ℃浸泡4 h后,放入铺有两层滤纸的φ= 9 cm培养皿中,每个培养皿放置约100 粒种子,然后放入生化培养箱中30 ℃暗发芽,发芽相对湿度为85%~90%左右,期间每8 h喷中性的NaCl溶液或去离子水(对照)1 次。
单因素试验处理如下:1)样品分别用0、25、50、75、100 mmol/L的NaCl溶液胁迫处理,发芽温度30 ℃,培养4 d后取样测GABA;2)样品用上一步骤中所得的最佳胁迫NaCl浓度,进行胁迫处理,发芽温度30 ℃,分别培养0、2、4、6、8 d;3)样品用最佳胁迫NaCl浓度进行胁迫处理,分别置于15、20、25、30、35 ℃的培养箱内暗发芽,发芽时间为上一步骤中所得的最佳培养天数。试验结束后,用去离子水清洗发芽苦荞,用吸水纸吸干水分,冷冻干燥后去壳,粉碎至过80 目筛后待测。
1.3.3 响应面优化设计
在单因素试验的基础上,选择NaCl浓度、发芽时间、发芽温度3 个因素设计响应面试验,以苦荞GABA含量为响应值,优化出响应值与变量间的二次多项方程。
1.4 统计分析
试验设3 次重复,结果以±s表示。响应面设计及分析采用Design Expert软件处理。
2 结果与分析
2.1 NaCl浓度对发芽苦荞GABA富集的影响

图1 NaCl浓度对发芽苦荞GABA富集的影响Fig.1 Effect of NaCl content on GABA accumulation in germinated tartary buckwheat under salt stress
如图1所示,发芽4 d时,各浓度NaCl对发芽苦荞较对照均有显著影响(P<0.05),浓度在0~25 mmol/L变化时,GABA含量逐渐增加,在25 mmol/L的NaCl溶液胁迫时GABA含量达到最大,为247.22 μg/g,是对照组的1.39 倍。当浓度高于25 mmol/L时,GABA含量缓慢下降。
2.2 盐胁迫下发芽时间对发芽苦荞GABA富集的影响

图2 发芽时间对发芽苦荞GABA富集的影响Fig.2 Effect of germination time on GABA accumulation in germinated tartary buckwheat
如图2所示,不同发芽时间对苦荞富集GABA有显著影响(P<0.05)。当NaCl浓度为25 mmol/L时,胁迫组苦荞在发芽2~8 d时的GABA含量是相应对照组的1.23~1.39 倍,说明盐胁迫有利于GABA的富集。在盐胁迫条件下,发芽4 d时GABA含量达到最大,为246.80 μg/g,是0 d的2.44 倍,是对照的1.39 倍。
2.3 盐胁迫下发芽温度对发芽苦荞GABA富集的影响
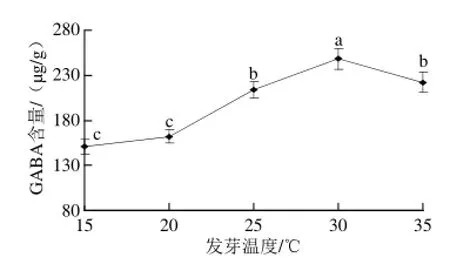
图3 盐胁迫条件下温度对发芽苦荞GABA富集的影响Fig.3 Effect of temperature on GABA accumulation in germinated tartary buckwheat under salt stress
如图3所示,盐胁迫浓度25 mmol/L、发芽4 d的培养条件下,随着温度的升高,发芽苦荞中的GABA含量逐渐增大,在30 ℃达到最大值248.06 μg/g,是15 ℃的1.65 倍,各处理温度间差异显著(P<0.05)。
2.4 Box-Behnken试验模型的建立与方差分析
响应面试验设计与结果见表1,利用Design Expert软件对数据进行多元回归拟合,获得描述GABA含量与自变量NaCl浓度、发芽时间和发芽温度的二次多项式如下,根据公式所得预测值见表1。


表1 Box-Behnken试验设计及结果Table 1 Box-Behnken design with predicted and experimental values of GABA content in germinated tartary buckwheat
方差分析表明(表2),模型的总决定系数为0.961 1,F约为19.20,P<0.01,说明模型达到极显著;模型的失拟性检验不显著(P>0.05),校正决定系数说明该模型能解释91.10%响应值的变化;比较模型的预测值和观察值(图4),二者具有极显著的相关性;模型的信噪比(RSN)为11.078,远大于4。综合所有统计分析特征值表明,模型与实际实验拟合度良好,试验误差小,可用来分析发芽苦荞GABA含量与各自变量之间的关系。

表2 回归方程各项的方差分析Table 2 Analysis of variance (ANOVA) for the regression equation

图4 GABA含量预测值和观察值之间的相关性Fig.4 Correlation between predicted and experimental values of GABA content
2.5 盐胁迫下发芽苦荞富集GABA含量的响应曲面分析及优化
根据回归方程(1)作出响应面图和等高线图,可分析各变量之间的变化关系。图5A表示当发芽温度固定在30 ℃时,NaCl浓度与发芽时间对发芽苦荞GABA富集量的影响。NaCl浓度与发芽时间的一次项(P<0.01)和二次项(P<0.01)对GABA的富集量有极显著的影响,NaCl浓度与发芽时间的交互作用显著(P<0.05)。在时间一定的条件下,GABA的含量随着NaCl浓度的升高先增加后降低,在33.99 mmol/L处有最高值,说明GABA含量受到NaCl胁迫的影响,且胁迫浓度达到33.99 mmol/L时有利于其富集GABA。Fougere等[18]研究表明,盐胁迫诱导紫花苜蓿根中氨基酸和碳水化合物大量合成,GABA含量也有不同程度的提高。盐胁迫下发芽大豆[14]和玉米幼苗中[19]GABA的富集量随着胁迫强度的增大而提升。陈惠等[20]认为0~40 mmol/L的NaCl处理提高了发芽蚕豆中GAD和DAO的活性,进而使发芽蚕豆中GABA含量升高。植物受到盐胁迫时,可使其细胞内Ca2+浓度提高,继而促进CaM转录水平提高,提高GAD活性,同时也可导致游离多胺含量的提升,DAO活性增强,这些变化均导致GABA的富集[16,21]。在盐浓度一定的条件下,发芽时间从0~5.06 d时,GABA含量快速提升,继续培养,GABA含量则出现下降趋势,表明培养5.06 d时有利于GABA的积累。

图5 各两因素交互作用对发芽苦荞GABA含量影响的响应面图Fig.5 Response surface diagrams for the effects of three factors on GABA accumulation in germinated tartary buckwheat
图5B显示了NaCl浓度和发芽温度对发芽苦荞GABA含量的影响。模型分析表明,NaCl浓度与温度的交互作用不显著(P>0.05)。在NaCl浓度一定的情况下,随着温度的升高,GABA含量随之增加,并在30.82 ℃时培养达到最大值,继续升高温度后,GABA含量缓慢下降。温度会影响酶蛋白的构象、酶与激活剂的亲和力及参与酶促反应功能团的解离等[22]。Zhang Hui等[21]的研究表明40 ℃是植物体内GAD活性达到最高时的温度,因种间差异,粟谷[22]富集GABA的最高温度为33 ℃,大豆[23]富集GABA的最适温度约为30.5~33.3 ℃,而米胚[24]和米糠[25]分别为40 ℃和41.3 ℃。较高的温度有利于刺激GAD活性从而达到GABA快速富集的目的,然而苦荞具有耐严寒、生性好阴冷的生长特性[3],当温度达到40 ℃(数据未显示)时反而不利于其生长,直至死亡。
由图5C可知,发芽温度与发芽时间的交互作用不显著(P>0.05)。随着发芽温度的升高和发芽时间的延长,GABA含量增加,但发芽温度过高和发芽时间过长都不利于苦荞中GABA的积累。
综上,根据响应面的试验结果,确定回归模型预测发芽苦荞富集GABA量的最佳培养条件为:NaCl浓度33.99 mmol/L、发芽时间为5.06 d、发芽温度30.82 ℃,预测的GABA最佳含量为252.28 μg/g。为考察模型的可靠性进行验证实验,考虑到实际操作的可行性,将发芽条件改进为:NaCl浓度34 mmol/L、发芽时间5 d、发芽温度31 ℃,得到的GABA含量为(250.06±10.15) μg/g,与理论值的相对误差较小,故可认为响应面优化盐胁迫富集发芽苦荞GABA的培养条件是有效可行的。
3 结 论
NaCl浓度和发芽时间均极显著地影响发芽苦荞富集GABA,发芽温度对GABA富集的影响显著,NaCl浓度与发芽时间的交互作用显著(P<0.05)。响应面优化发芽苦荞富集GABA的最佳培养条件为:NaCl浓度34 mmol/L、发芽时间5 d、发芽温度31 ℃,此条件下GABA的富集量为(250.06±10.15)μg/g,与理论值基本相符,说明所建模型是可靠的。研究表明,盐胁迫萌发处理可有效提高苦荞GABA的含量。
[1] 秦培友. 我国主要荞麦品种资源品质评价及加工处理对荞麦成分和活性的影响[D]. 北京: 中国农业科学院, 2012.
[2] 赵琳. 苦荞萌发期生理活性及其蛋白抗菌性的研究[D]. 上海: 上海师范大学, 2012.
[3] 朱云辉, 郭元新. 我国苦荞资源的开发利用研究进展[J]. 食品工业科技, 2014, 35(24): 360-365.
[4] 李晓丹. 苦荞胁迫萌发及功能性成分的研究[D]. 无锡: 江南大学, 2013.
[5] 张美莉, 张建艳, 胡小松. 萌发荞麦蛋白酶抑制剂活性变化及与蛋白消化率相关性研究[J]. 中国食品学报, 2006, 6(5): 34-39.
[6] 刘金福, 李晓雁, 孟蕊. 苦荞发芽过程中促进黄酮合成的因素初探[J].食品工业科技, 2006, 27(10): 106-108.
[7] A BDOU A M, HIGASHIGUCHI S, HORIE K, et al. Relaxation and immunity enhancement effects of γ-aminobutyric acid (GABA) administration in humans[J]. Biofactors, 2008, 26(3): 201-208.
[8] BAI Qingyun, CHAI Meiqing, GU Zhenxin, et al. Effects of components in culture medium on glutamate decarboxylase activity and gamma-aminobutyric acid accumulation in foxtail millet (Setaria italica L.) during germination[J]. Food Chemistry, 2009, 116(1): 152-157.
[9] LI Yang, BAI Qingyun, JIN Xinjiang, et al. Effects of cultivar and culture conditions on gamma-aminobutyric acid accumulation in germinated fava beans (Vicia faba L.)[J]. Journal of the Science of Food and Agriculture, 2010, 90(1): 52-57.
[10] YANG Runqiang, GUO Yuanxin, WANG Shufang, et al. Ca2+and aminoguanidine on γ-aminobutyric acid accumulation in germinatingsoybean under hypoxia-NaCl stress[J]. Journal of Food and Drug Analysis, 2015, 23(2): 287-293.
[11] 方嘉沁. 富γ-氨基丁酸胚芽大豆发芽工艺优化及其豆浆制品研究[D].南昌: 江西农业大学, 2012.
[12] 尹永祺, 吴进贤, 刘春泉, 等. 低氧胁迫下发芽玉米淀粉特性及高γ-氨基丁酸玉米饮料开发[J]. 食品科学, 2014, 35(6): 234-239. doi: 10.7506/spkx1002-6630-201406050.
[13] BOUCHE N, LACOMBE B, FROMM H. GABA signaling: a conserved and ubiquitous mechanism[J]. Trends in Cell Biology, 2003, 13(12): 607-610.
[14] SU Guoxing, YU Bingjun, ZHANG Wenhua, et al. Higher accumulation of γ-aminobutyric acid induced by salt stress through stimulating the activity of diarnine oxidases in Glycine max (L.) Merr. roots[J]. Plant Physiology and Biochemistry, 2007, 45(8): 560-566.
[15] 郭元新, 杨润强, 陈惠, 等. 盐胁迫富集发芽大豆γ-氨基丁酸的工艺优化[J]. 食品科学, 2012, 33(10): 1-5.
[16] BAI Qingyun, YANG Runqiang, ZHANG Lixia, et al. Salt stress induces accumulation of γ-aminobutyric acid in germinated foxtail millet (Setaria italica L.)[J]. Cereal Chemistry, 2013, 90(2): 145-149.
[17] GUO Yuanxin, CHEN Hui, SONG Yu, et al. Effects of soaking and aeration treatment on γ-aminobutyric acid accumulation in germinated soybean (Glycine max L.)[J]. European Food Research and Technology, 2011, 232(5): 787-795.
[18] FOUGERE F, RUDULIER D, STREETER J G. Effects of salt stress on amino acid, organic acid, and carbohydrate composition of roots, bacteroids, and cytosol of alfalfa (Medicago sativa L.)[J]. Plant Physiology, 1991, 96(4): 1228-1236.
[19] 周翔, 吴晓岚, 李云, 等. 盐胁迫下玉米幼苗ABA和GABA的积累及其相互关系[J]. 应用与环境生物学报, 2005, 11(4): 412-415.
[20] 陈惠, 杨润强, 李岩, 等. 氯化盐和激素对发芽蚕豆中γ-氨基丁酸富集的影响[J]. 南京农业大学学报, 2012(1): 119-124.
[21] ZHANG Hui, YAO Huiyuan, CHEN Feng, et al. Purification and characterization of glutamate decarboxylase from rice germ[J]. Food Chemistry, 2006, 101(4): 1670-1676.
[22] BAI Qingyun, FAN Gongjian, GU Zhenxin, et al. Effects of culture conditions on gamma-aminobutyric acid accumulation during germination of foxtail millet (Setaria italica L.)[J]. European Food Research and Technology, 2008, 228(2): 169-175.
[23] 郭元新. 盐和低氧胁迫下发芽大豆γ-氨基丁酸富集与调控机理研究[D].南京: 南京农业大学, 2011.
[24] 张晖. 米胚谷氨酸脱羧酶性质及其富集γ-氨基丁酸研究[D]. 无锡:江南大学, 2004.
[25] 张磊. 米糠中γ-氨基丁酸富集技术及保健饮料制作研究[D]. 南京:南京农业大学, 2008.
Optimization of Culture Conditions for Accumulating γ-Aminobutyric Acid (GABA) in Germinated Tartary Buckwheat under Salt Stress by Response Surface Methodology
ZHU Yunhui, GUO Yuanxin*
(College of Food and Drug, Anhui Science and Technology University, Fengyang 233100, China)
In order to optimize the culture conditions for γ-aminobutyric acid (GABA) production in germinated tartary buckwheat under salt stress, the effects of NaCl content, germination time and germination temperature on the accumulation of GABA during the germination of tartary buckwheat were explored by response surface methodology (RSM). Results showed that the optimal conditions with salt stress for GABA accumulation in germinated tartary buckwheat were determined as NaCl content of 34 mmol/L, germination time of 5 days and germination temperature of 31 ℃. Under the optimal conditions, the predicted highest GABA yield of 250.06 μg/g DW was obtained. Analysis of variance and validation experiments suggested that the proposed regression model was extremely signifi cant (P < 0.01) with R2of 0.961 1 and could accurately predict the accumulation of GABA in germinated tartary buckwheat under salt stress. This study can provide the theoretical basis for future development of GABA-rich tartary buckwheat-based foods.
tartary buckwheat; germination; salt stress; γ-aminobutyric acid (GABA) accumulation; response surface analysis
TS201.1
A
1002-6630(2015)19-0096-05
10.7506/spkx1 002-6630-201519017
2014 -12-12
安徽省自然科学基金项目(1308085MC32)
朱云辉(1991-),男,硕士研究生,研究方向为食品功能性成分的富集及品质控制。E-mail:zyh172926966@163.com
*通信作者:郭元新(1970-),男,教授,博士,研究方向为农产品加工及品质控制。E-mail:guoyuanxiner@163.com
