芹菜素对甲状腺癌BCPAP细胞生长及细胞周期的影响
2015-12-20赵俊杰俞惠新
孙 震 郑 婕 张 莉 赵俊杰 俞惠新
(1.江南大学食品学院,江苏 无锡 214122;2.江苏省原子医学研究所卫生部核医学重点实验室,江苏 无锡 214063;3.总后勤部军需物资油料部军需军事代表局,北京 100071)
甲状腺癌通常被认为是恶性程度较低的癌症,但近年来其发病率逐年走高[1],特别是乳头状细胞癌(PTC)。2006年,美国癌症学会声明甲状腺癌已经成为第六大女性最常被诊断出的癌症,而且其名次还在逐渐上升,虽然这与近年来的关注度增加有关,但也说明甲状腺癌这个一度被人们所轻视的癌症,其发生的普遍性是不容忽视的。虽然大多数的甲状腺癌是良性的,但仍有5%~20%的甲状腺癌是恶性的。甲状腺癌的高发情况也在1985年芬兰的连续常规尸检结果[2]中得到了印证:1/3的死于非甲状腺相关情形的逝者被检查出患有甲状腺癌,这种生前未被发现的甲状腺癌病情并没有直接导致他们的死亡,也说明低风险的甲状腺癌的发生率远比人们想象的要普遍得多。Londero等[3]对1996~2008年丹麦的乳头状甲状腺癌(PTC)发病率的调查中,也发现发病率的不断走高。在甲状腺癌中,乳头状甲状腺癌(papillary thyroid carcinomas,PTC)是最常见的类型[4],占比60%~80%;滤泡状甲状腺癌(follicular thyroid carcinomas,FTC)占比15%~25%;未分化甲状腺癌(anaplastic thyroid carcinomas,ATC)和髓样甲状腺癌(medullary thyroid cancers,MTC)共占比2%~5%。其中,PTC病人20年内的存活率高达99%,因此PTC通常被认为是一种低风险癌症[5]。
针对PTC常见的治疗方法通常是手术结合放射碘治疗[6]和(或)甲状腺激素抑制治疗,但是这些方法存在易产生并发症和抗性的问题。因此低毒性药物辅助化疗及摄碘被认为是有潜力的解决手段之一。目前,芹菜素被认为是极有潜力的一种低毒性药物[7],并因来源广、价格低等特点而备受关注。
芹菜素具有C6—C3—C6的类黄酮物质典型结构(见图1),广泛存在于常见的水果(如柑橘类、苹果、樱桃、葡萄等)、蔬菜(如洋葱、荷兰芹、绿花椰菜、甜椒、旱芹、大麦、番茄等)和饮品(茶、红酒)中[8,9]。芹菜素是以水果和蔬菜为主的膳食模式(如地中海饮食)的主要有效成分之一,这些有效成分被认为与此膳食模式群体中高血压、心血管疾病、肥胖、糖尿病及癌症的低发生率相关,其他黄酮类物质也有类似的研究结论[10]。除了抗 肿 瘤 作 用[11]外,芹 菜 素 还 具 有 抗 氧 化[12]、抗炎症、抗菌、抗诱变及抗病毒等功效,因其低毒性而被格外关注。体外研究[13]表明,芹菜素可诱导多种肿瘤细胞凋亡,影响细胞周期分布。但目前尚无关于芹菜素对乳头状甲状腺癌BCPAP细胞的研究。
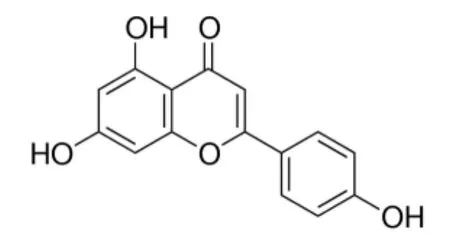
图1 芹菜素的化学结构Figure 1 The chemical structure of apigenin
本研究拟从芹菜素对乳头状甲状腺癌BCPAP细胞系的细胞毒性、生长抑制作用及其对细胞周期和凋亡的影响进行研究,并初步探讨其抗肿瘤作用机制。
1 材料和方法
1.1 试剂与药品
芹菜素:纯度≥97%,美国Sigma公司。芹菜素溶解于适量的二甲亚砜(DMSO),终浓度为100mmol/L,过滤除菌,-2℃冰箱密封避光保存;
二甲亚砜(DMSO):美国Sigma公司;
MTT(四氮唑噻唑兰,四甲基偶氮唑盐)、TUNEL试剂盒:碧云天公司;
BSA:上海生物工程公司;
RPMI 1640培养基:美国Gibco公司;
新生小牛血清(FBS):杭州四季青生物工程材料有限公司。
1.2 仪器与器材
细胞培养板:6/96孔,美国Corning公司;
酶标仪:μQuant型,美国Bio-Tek公司;
蛋白电泳仪:POWERPAC3000型,美国BIO-RAD公司;
倒置相差显微镜:TH4-200型,日本Olympus公司;
细胞培养箱:HEPA Class100型,美国Thermo公司;
双人单面净化工作台:SW-CT-2FD型,苏州净化设备有限公司;
高速冷冻离心机:Centrifuge 5415R型,德国Eppendorf公司;
流式细胞仪:FACSCanto型,美国BD公司。
1.3 试验方法
1.3.1 细胞株与细胞培养 人甲状腺癌细胞株BCPAP由江苏省原子医学研究所提供。BCPAP细胞接种于含10%(V/V)FBS的RPMI1640培养基中,培养箱温度为37℃,CO2含量5%,饱和湿度下培养,BCPAP细胞为圆形,呈贴壁生长,孵育1~2d后用0.25%胰蛋白酶消化液消化传代,选对数生长期的细胞进行试验。
1.3.2 MTT法检测芹菜素对BCPAP细胞增殖的抑制作用
取对数生长期的BCPAP细胞,用0.25%胰蛋白酶消化制成单细胞悬液后进行细胞计数,在96孔板的每孔种入7 500个BCPAP细胞后,溶剂对照组培养于等体积的100 μmol/L DMSO完全培养基溶液中;给药组分别在不同浓度的芹菜素完全培养基中孵育24h,其浓度依次为12.5,25.0,50.0,100.0μmol/L,每个浓度设6个复孔。24h作用结束后,加入40μL浓度为2mg/mL的MTT,在37℃下作用4 h显色,去除上清液后每孔加100μL的DMSO,微量振荡器震荡5min,使结晶完全溶解,通过酶标仪在550nm波长下检测得吸光值数据,试验重复3次。另外,细胞中加入相同浓度(50μmol/L)芹菜素,分别培养24,48,72h后,按照上述方法测得芹菜素对BCPAP细胞作用不同时间下的吸光值。按式(1)计算细胞增殖抑制率,拟合后求IC50值。
1.3.3 PI单染法检测芹菜素对BCPAP细胞周期的影响
取对数生长期的BCPAP细胞,以3×105mL-1的密度接种于6孔板中,细胞贴壁后弃去完全培养基,用PBS轻轻地荡洗1次,换为无血清的RPMI 1640培养基饥饿培养24 h。药物作用组芹菜素的给药浓度分别为12.5,25.0,50.0μg/mL,溶剂对照组给予等体积的50μg/mL二甲亚砜(DMSO)。培养24h后,胰蛋白酶消化,1 000r/min离心5 min,用70%的预冷乙醇使细胞悬浮固定,置4℃存放15 min,再次离心收集细胞,加入500μL含50μg/mL溴化乙锭(PI)、50μg/mL RNase A、0.1%Triton X-100的 PBS,常温避光孵育15min;直接用流式细胞仪以标准程序检测分析,每组试验重复3次,结果用ModFit软件分析。
1.3.4 Western blot法检测芹菜素对BCPAP细胞周期Cdc25蛋白表达的影响 取对数期的BCPAP细胞,经胰酶消化,重悬后接种到6孔板中,3×105个/孔,37℃培养过夜。不同浓度芹菜素(12.5,25.0,50.0μmol/L)刺激,同时设置50μmol/L的DMSO溶剂对照组。24h后,收集细胞,8 000 r/min离心4min,弃上清,加入适宜体积的细胞裂解缓冲液[150mmol/L NaCl,1%NP-40,0.02%NaN3,10μg/mL PMSF,50mmol/L Tris—HCl(pH 8.0)],同时加蛋白酶和磷脂酶抑制剂各0.5mL/tube,吹散均匀,置于-70℃冰箱反复冻融3次,12 000r/min离心5min,取上清。BCA法测定蛋白浓度。将定量好的蛋白液按适宜浓度分装入PCR管,按1︰5(V︰V)加入6×上样缓冲液,沸水煮5min。将准备好的样品按预期顺序加入到胶板孔道中,经10%SDS—PAGE凝胶电泳,湿法转膜,硝酸纤维素膜室温下置于含5%脱脂牛奶的TBST缓冲液中封闭1h,孵育适宜浓度的指定抗体,4℃摇床过夜,次日用TBST缓冲液清洗3次,每次5min,再在室温下孵育HRP标记的指定二抗1h,Ecl法化学发光后在成像仪中拍照记录结果,并对条带的灰度值进行比较分析。
1.3.5 统计学处理 所有数据均来自于3次以上独立试验结果的平均值,计量数据以Mean±SEM表示。使用Student’t-test比较两组间差异,*P<0.05代表差异具有显著性,**P<0.01代表差异具有高度显著性。
2 结果与分析
2.1 芹菜素对BCPAP细胞生长的影响
2.1.1 芹菜素浓度对BCPAP细胞生长的影响 BCPAP细胞经12.5,25.0,50.0,100.0μmol/L的芹菜素作用24h后,用MTT法检测细胞的生长活力,结果见图2。由图2可知,在浓度较低的情况下,芹菜素对BCPAP细胞增殖抑制作用较弱,在12.5μmol/L浓度下,其细胞存活率仍保持85.15%;随芹菜素剂量的增高,BCPAP细胞的存活率呈明显下降趋势。

图2 MTT法检测不同浓度的芹菜素对BCPAP细胞的生长抑制作用Figure 2 Different concentration of apigenin inhibits BCPAP cell viability by MTT assay
MTT法是基于活细胞线粒体中存在的琥珀酸脱氢酶能使MTT还原为不溶于水的蓝紫色结晶甲瓒(formazan)的原理。在一定细胞数范围内,MTT吸光值与细胞数成正比,以溶剂对照组的吸光值为空白值进行计算与分析。MTT法检测不同浓度的芹菜素给药24h后,对BCPAP细胞的生长呈明显抑制作用,药物作用24h的IC50值为40.65μmol/L。
2.1.2 芹菜素作用时间对BCPAP细胞生长的影响 采用MTT法检测浓度分别为12.5,25.0,50.0μmol/L的芹菜素给药24,48,72h后BCPAP细胞的生长状态,结果见图3。
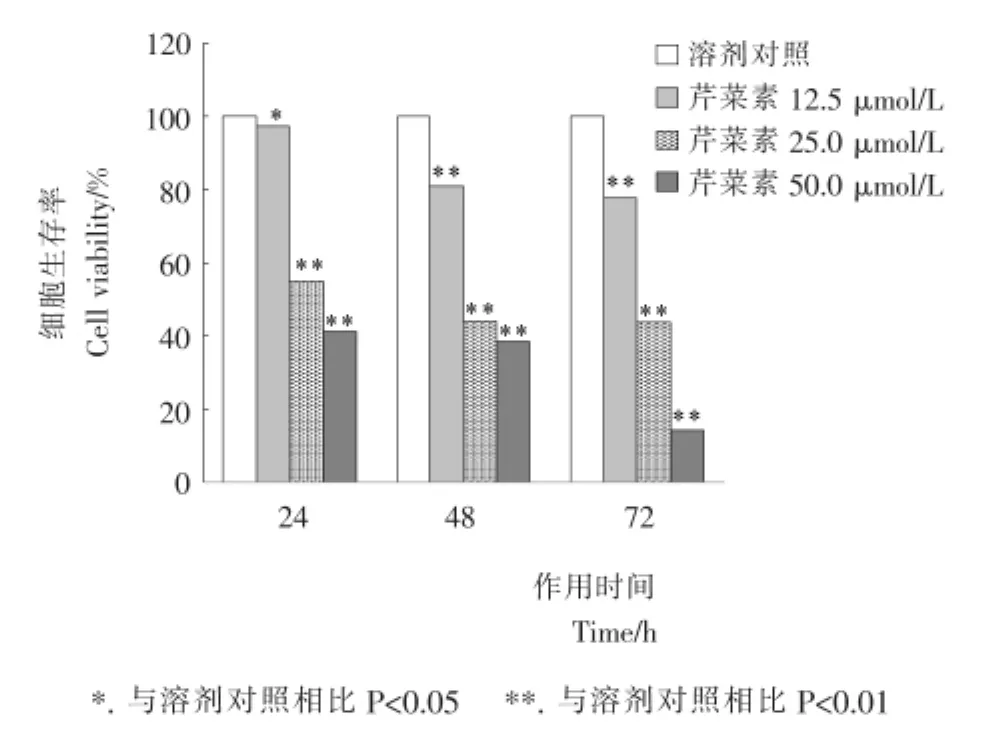
图3 MTT法检测不同作用时间下芹菜素对BCPAP细胞的生长抑制作用Figure 3 Apigenin inhibits BCPAP cell viability for different time by MTT assay
由图3可知,随着芹菜素作用时间的延长,BCPAP细胞的生长均有不同程度的抑制。其中,50μmol/L的芹菜素对BCPAP细胞作用24,48,72h后,其细胞存活率分别为41.2% ,38.56%,13.99%。
MTT检测结果表明,BCPAP细胞增殖的抑制率与芹菜素浓度及作用时间密切相关,且不同药物浓度与对照组间细胞抑制率有显著性差异(P<0.05或P<0.01)。
2.2 芹菜素作用BCPAP细胞后的形态学变化
不同浓度芹菜素与BCPAP细胞共培养24h后,在明场下用相差显微镜观察,对BCPAP细胞形态学改变进行观察、记录并分析,其形态学变化见图4。
由图4可知,与对照组相比,药物作用组的细胞形态有明显差异。芹菜素对BCPAP细胞作用之后,BCPAP细胞数目不断减少,细胞皱缩程度不断加深,贴壁性变差。
2.3 芹菜素对BCPAP细胞周期的影响
经不同浓度芹菜素处理的BCPAP细胞,在PI染色后使用流式细胞仪进一步检测分析,以探讨芹菜素对BCPAP细胞生长抑制的机理,结果见图5。
由图5可知,虽然在DNA组直方图上没有出现典型的凋亡细胞峰(亚G1峰,图5),结合图6细胞周期所占百分比来看,经芹菜素给药后,BCPAP细胞G2/M期所占比例随给药浓度的增加不断增大,G0/G1期所占比例则不断减少,可据此推测细胞周期停滞在G2/M期而无法顺利进行,从而导致细胞发生凋亡并最终死亡。
细胞生长受到抑制常与细胞周期进程的改变有关。已有一些研究[14]表明芹菜素在一些细胞系中可以诱导发生细胞周期阻滞。真核细胞中存在一些检测点来调控细胞分裂周期,包括G1检测点、G2检测点和中期检测点。G2检测点位于G2期的最后,它关系着有丝分裂M期的触发起点。

图4 芹菜素浓度对BCPAP细胞形态学的影响(×200)Figure 4 The effects of different concentration of apigenin to BCPAP cells on morphology(×200)
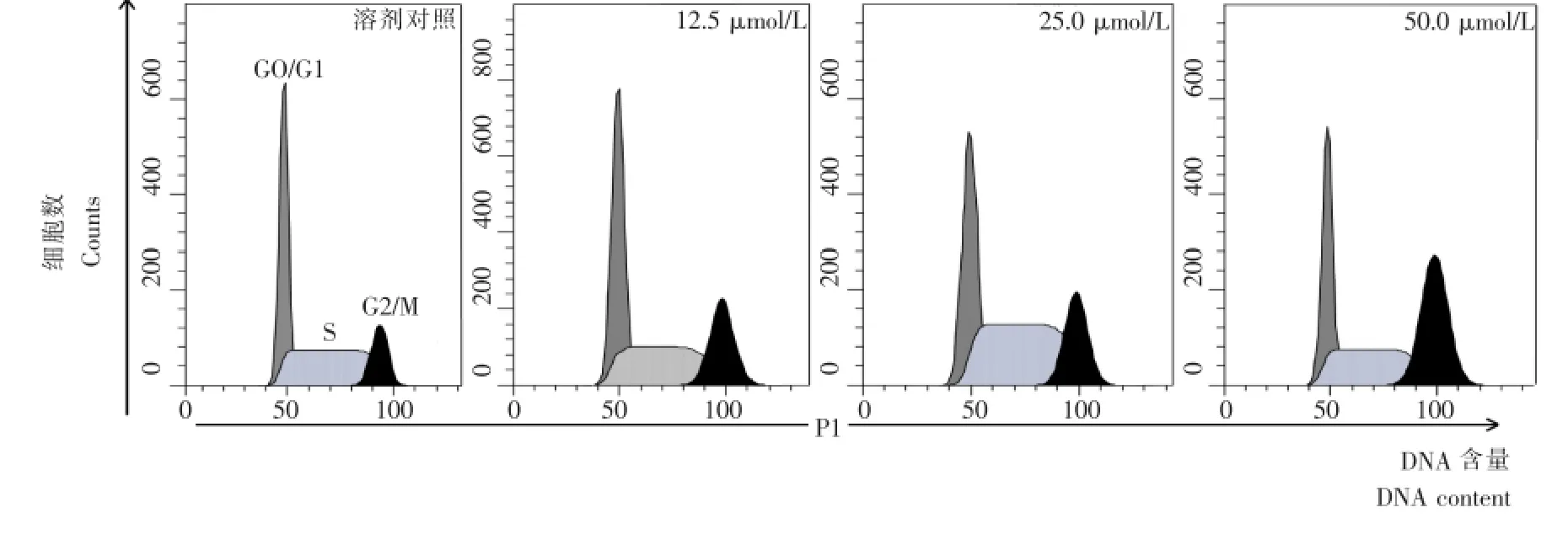
图5 芹菜素浓度对BCPAP细胞周期分布影响的流式直方图Figure 5 Representative flow cytometry histograms of different concentration of apigenin BCPAP to cells on cell cycle

图6 芹菜素浓度对BCPAP细胞周期分布影响的定量分析柱状图Figure 6 Bar graphs of quantitative analysis of different concentration of apigenin to BCPAP cells on cell cycle
2.4 芹菜素对BCPAP细胞Cdc25蛋白表达的影响
在细胞周期的调控中起核心作用的是Cdk/cyclin复合物,其活性受多种因子的调控,Cdc25等可以使Cdk/cyclin去磷酸化而活化,进而利于细胞周期顺利通过G2检测点[15,16]。在细胞生长周期中G2/M期主要受CDK1激酶调控,CDK1激酶(即有活性的MPF)是由P34cdc2蛋白和细胞周期蛋白cyclin B组成[14]。CDK1蛋白本身不具有蛋白激酶的活性;当cyclin A/B含量积累到一定值时,两者相互结合成复合体,结合cyclin的CDK1被Wee1将Thr14和Tyr15磷酸化,并被CDK激活激酶将Thr161磷酸化。在M期,Wee1的活性下降,cdc25使CDK1的Thr14和Tyr15去磷酸化,其激酶活性才能表现出来[17],Cdc2活性的缺失直接导致细胞周期无法顺利进行,因而出现G2/M期阻滞现象。而且Cdc25也参与DNA损伤所引起的检测点应答,故试验结果中的阻滞有可能是芹菜素引发DNA损伤导致的结果,BCPAP细胞增殖受到明显抑制可能是凋亡级联反应引起的。
Cdc25蛋白对控制细胞有丝分裂进入M期和通过G 2/M期检测点具有重要的作用[14],研究证明Cdc25在多种癌症中呈现出过表达状态。图7所示为不同浓度的芹菜素对BCPAP细胞中Cdc25蛋白表达的Western blot条带和光密度值分析结果。由图7可知,在芹菜素的作用下,BCPAP细胞中Cdc25蛋白的表达量随药物浓度的升高而明显下降,表明细胞中Cdk/cyclin复合物活性降低,此现象是细胞G 2/M期阻滞的标志,进而使细胞增殖速度减慢。
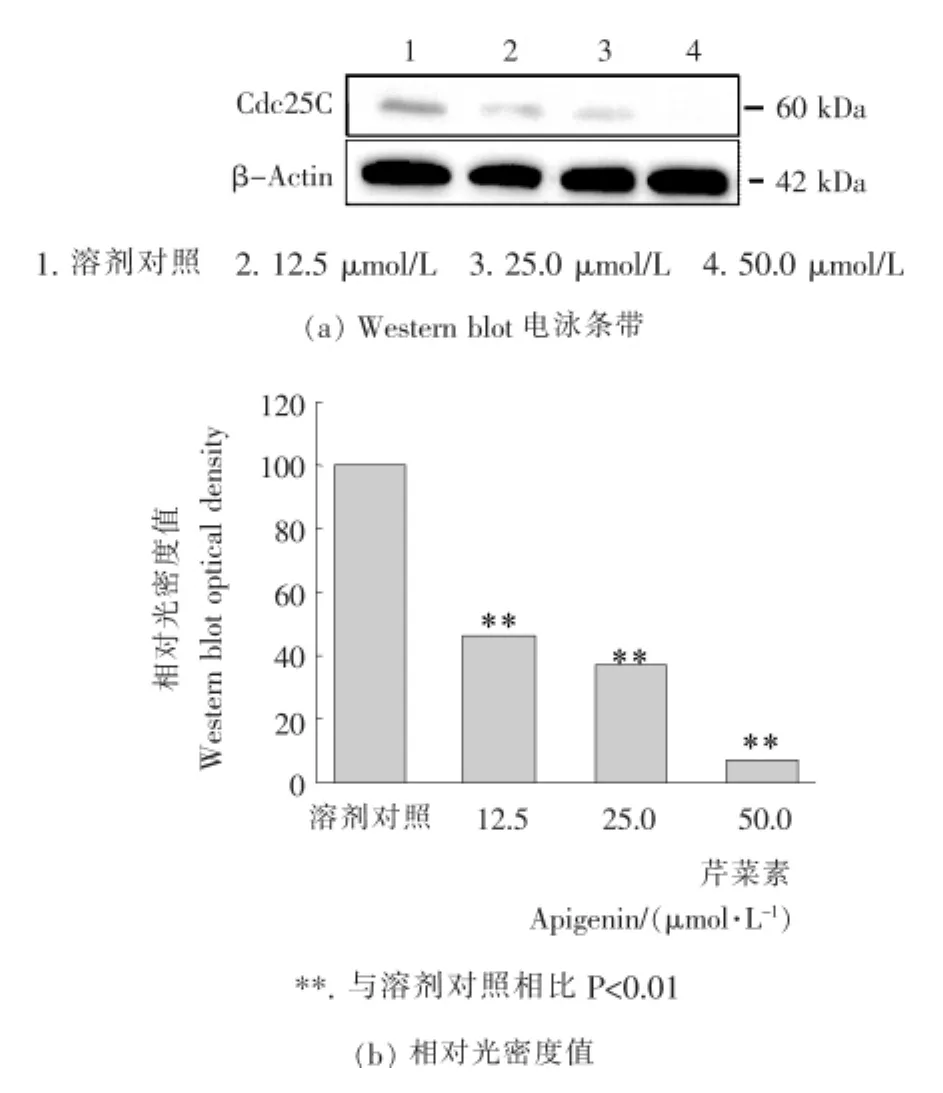
图7 Western blot法检测不同浓度芹菜素对BCPAP细胞Cdc25蛋白表达的影响Figure 7 The effects of different concentration of apigenin to BCPAP cells on the expression of Cdc25
3 结论
本研究通过MTT法检测显示:芹菜素的浓度对BCPAP细胞毒性有明显剂量和时间依赖性;明场图片表明芹菜素给药组对BCPAP细胞形态和数目的影响明显强于对照组,对照组的细胞数目多且细胞圆润饱满,芹菜素给药组的细胞数目少且皱缩漂浮,表明芹菜素对BCPAP细胞生长有抑制作用;流式细胞仪检测表明芹菜素给药后,BCPAP细胞的细胞周期有明显影响,使细胞周期阻滞在G2/M期,能加速诱导细胞发生程序性死亡。
综上所述,芹菜素能抑制甲状腺癌细胞的增殖和生长,其抑制机制可能使BCPAP细胞生长停滞在G2/M期并诱导细胞凋亡,其确切的抑癌机制还有待进一步的研究证实。
1 Kilfoy Briseis A,Zheng Tong-zhang,Holford Theodore R,et al.International patterns and trends in thyroid cancer incidence[J].Cancer Causes Control,2009,20(5):525~531.
2 Harach H,Franssila,Wasenius.Occult papillary carcinoma of the thyroid.A"normal"finding in Finland[J].A Systematic Autopsy Study.Cancer,1985,56(3):531~538.
3 Londero S C,Krogdahl A K,Bastholt L.Papillary thyroid carcinoma in Denmark 1996~2008:An investigation of changes in incidence[J].Cancer Epidemiology,2013,37(1):1~6.
4 Ersen A,Durak M G,Canda T,et al.Warthin-like papillary carcinoma of the thyroid:a case series and review of the literature[J].Turk Patoloji Derg,2013,29(2):150~155.
5 Brito J P,Hay I D,Morris J C.Low risk papillary thyroid cancer[J].British Medical Journal,2014,348(3 045):1~10.
6 Al-Shakhrah I A.Radioprotection using iodine-131for thyroid cancer and hyper-thyroidism:a review[J].Clinical Journal of Oncology Nursing,2008,12(6):905~912.
7 Choudhury D,Ganguli A,Dastidar D G,et al.Apigenin shows synergistic anticancer activity with curcumin by binding at different sites of tubulin[J].Biochimie,2013,95(6):1 297~1 309.
8 Tong Xin,Pelling J.Targeting the PI3K/AKT/mTOR axis by apigenin for cancer prevention[J].Anticancer Agents Med.Chem.,2013,13(7):971~978.
9 Balasubramanian S,Eckert R L.Keratinocyte proliferation,differentiation,and apoptosis-differential mechanisms of regulation by curcumin,EGCG and apigenin[J].Toxicol Appl Pharmacol,2007,224(3):214~219.
10 Batra P,Sharma A K.Anti-cancer potential of flavonoids:recent trends and future perspectives[J].3Biotech,2013,3(6):439~459.
11 Patel D,Shukla S,Gupta S.Apigenin and cancer chemoprevention:Progress,potential and promise(Review)[J].International Journal of Oncology,2007,30(1):233~245.
12 Akhavan M,Jahangiri S,Shafaghat A.Studies on the antioxidant and antimicrobial activity and flavonoid derivatives from the fruit of Trigonosciadium brachytaenium (Boiss.)Alava[J].Industrial Crops and Products,2015,63(1):114~118.
13 Singh R P,Agarwal R.Mechanisms of action of novel agents for prostate cancer chemoprevention[J].Endocr Relat Cancer,2006,13(3):751~778.
14 Meeran S M,Katiyar S K.Cell cycle control as a basis for cancer chemoprevention through dietary agents[J].NIH Public Access,2008,13(1):2 191~2 202.
15 Wu Guo-yi,Xu Li-nan,Lin Nan,et al.UCN-01induces S and G2/M cell cycle arrest through the p53/p21waf1or CHK2/CDC25Cpathways and can suppress invasion in human hepatoma cell lines[J].BMC Cancer,2013,13(167):1~9.
16 Park K I,Park H S,Nagappan A,et al.Induction of the cell cycle arrest and apoptosis by flavonoids isolated from Korean Citrus aurantium L.in non-small-cell lung cancer cells[J].Food Chemistry,2012,135(4):2 728~2 735.
17 Chang Chi-chang,Hung Chao-ming,Yang Yun-ru,et al.Sulforaphane induced cell cycle arrest in the G2/M phase via the blockade of cyclin B1/CDC2in human ovarian cancer cells[J].Journal of Ovarian Research,2013,6(41):1~7.
