胎次和泌乳阶段对荷斯坦奶牛血液乳成分前体物及泌乳相关激素含量的影响
2015-12-20韩英东潘晓花辛海瑞熊本海
韩英东 杨 亮 潘晓花 辛海瑞 熊本海
(中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193)
奶牛乳的合成受血液中乳成分前体物及血液中神经内分泌因子的共同调控,这些泌乳相关的血液指标影响机体的物质代谢及能量代谢,进而影响乳品质,因此研究血液中相关因子的变化规律,可以揭示泌乳奶牛在不同胎次和泌乳阶段泌乳性能变化规律,为乳合成和分泌调控提供依据。血液中游离氨基酸及小肽、β-羟丁酸(β-hydroxybutyrate,BHBA)、长链脂肪酸、葡萄糖(glucose,GLU)等营养成分是乳成分的重要前体物质(milk component precursor,MCP),乳腺选择性从血液中摄取乳成分前体物,在乳腺腺泡的分泌细胞中合成乳蛋白、乳脂肪、乳糖。另外,血液中神经内分泌因子在乳成分的合成过程中具有重要的调节作用,目前研究比较透彻的泌乳相关的激素有生长激素 (growth hormone,GH)、皮 质 醇 (cortisol,COR)、胰岛素(insulin,INS)、催乳素(prolactin,PRL)、孕酮(pregnendione,PRG)、甲状腺素(thyroxine,T4)等[1-4]。研究发现,胎次、泌乳阶段都会影响乳成分,同样的因素也会影响正常奶牛的血液指标。然而,已经发表的血液指标范围并没有把奶牛和肉牛区分开来[5-6],且血液指标值多集中在发情期和围产期这样的特殊生理期[7-8]。对奶牛整个泌乳期泌乳相关血液指标的研究还比较少。本研究通过研究不同胎次和泌乳阶段的奶牛血液乳成分前体物和泌乳相关激素含量的变化,旨在帮助奶牛养殖者在个体和群体水平上监测奶牛健康、识别异常情况,同时为进一步研究泌乳的调节机制提供参考。
1 材料与方法
1.1 试验动物与饲养管理
选用健康1~4胎荷斯坦奶牛60头,其中一胎牛23头(日均产奶量20 kg以上)、二胎牛16头、三胎牛11头、四胎牛10头(多胎次奶牛上一胎次日均产奶量在25 kg以上)。统一饲喂全混合日粮(total mixed ration,TMR),其营养水平满足我国《奶牛饲养标准》(NY/T 34—2004)[9]。TMR 组成及营养水平见表1。试验奶牛采取散栏式饲喂,不同泌乳期的奶牛使用相同的TMR,但通过自由采食量的不同满足对营养需要量的差异。每天分别于07:00和19:00饲喂TMR,按每天每头奶牛提供45 kg TMR,并保证奶牛每天至少20 h能采食到TMR。每天挤奶2次(04:30和15:30),饲喂及挤奶时间外试验牛只散放于运动场中,自由饮水,牛舍及运动场每天打扫2次,保证牛舍及运动场卫生。
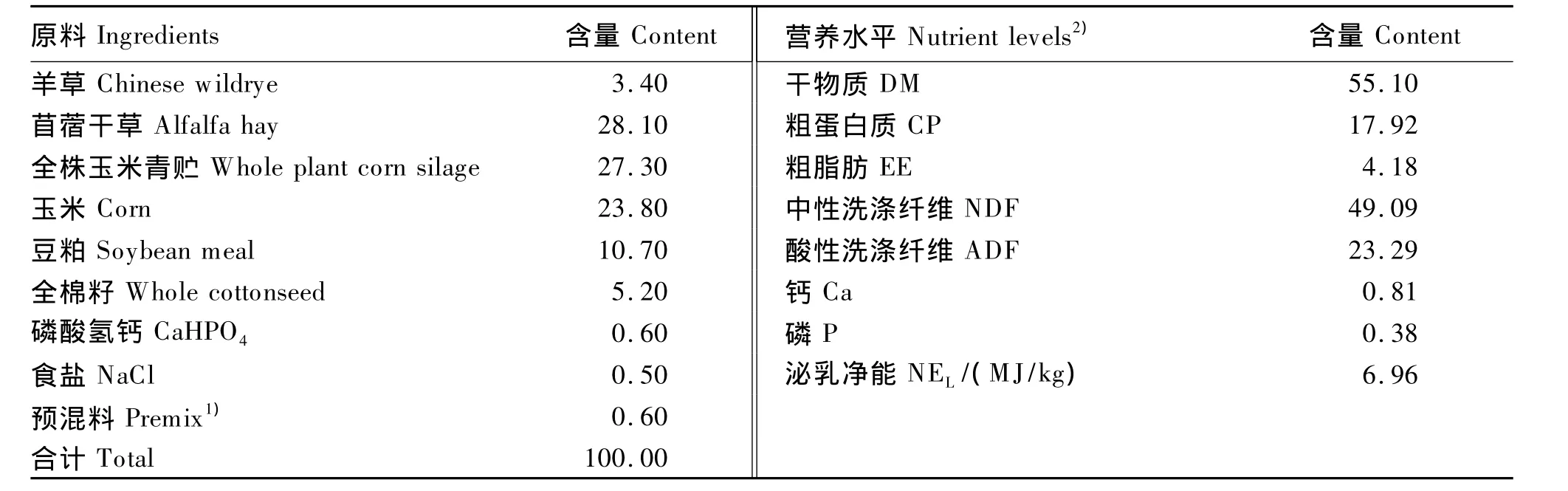
表1 全混合日粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the TMR(DM basis) %
1.2 样品的采集与测定
试验时间为2013年9月17日至2014年1月3日,共108 d。每30 d测定1次产奶量并采集乳样,由北京奶牛中心测定乳成分。血样每15 d采集1次,于晨饲之前利用真空采血管采集尾根静脉血9 mL,并记录采样日期,奶牛当日的泌乳天数(DIM)。采集的血样与3 000 r/min离心15~20 min,吸取血清分装于 1 mL离心管中,于-20℃保存,待检。
1.3 检测指标与方法
所有血液指标的检测均送至北京中同蓝博临床检验所检测,指标有GLU、甘油三酯(triglyceride,TG)、非酯化脂肪酸(non-esterified fatty acid,NEFA)、BHBA、总 氨 基 酸 (total amino acids,T-AA)5 种乳成分前体物及 T4、GH、COR、INS、PRL、PRG 6种激素。具体检测方法见表2。
1.4 数据处理与分析
各血液指标置信区间的计算采用采用国际医学联合会(The International Federation of Clinical Chemistry)的推荐程序[10]。首先,去掉每个血液变量的离群值和超过平均值3个标准差的值。然后,利用Proc Univeriate(SAS 9.2)进行正态分布检验并计算峰度值(kurtosis)和偏度值(skewness)以检验分布的不对称性和峰度。Shapiro-Wilk试验W值≥0.98的变量,认为是符合正态分布,其他非正态变量在进行分析之前,要进行对数转变。
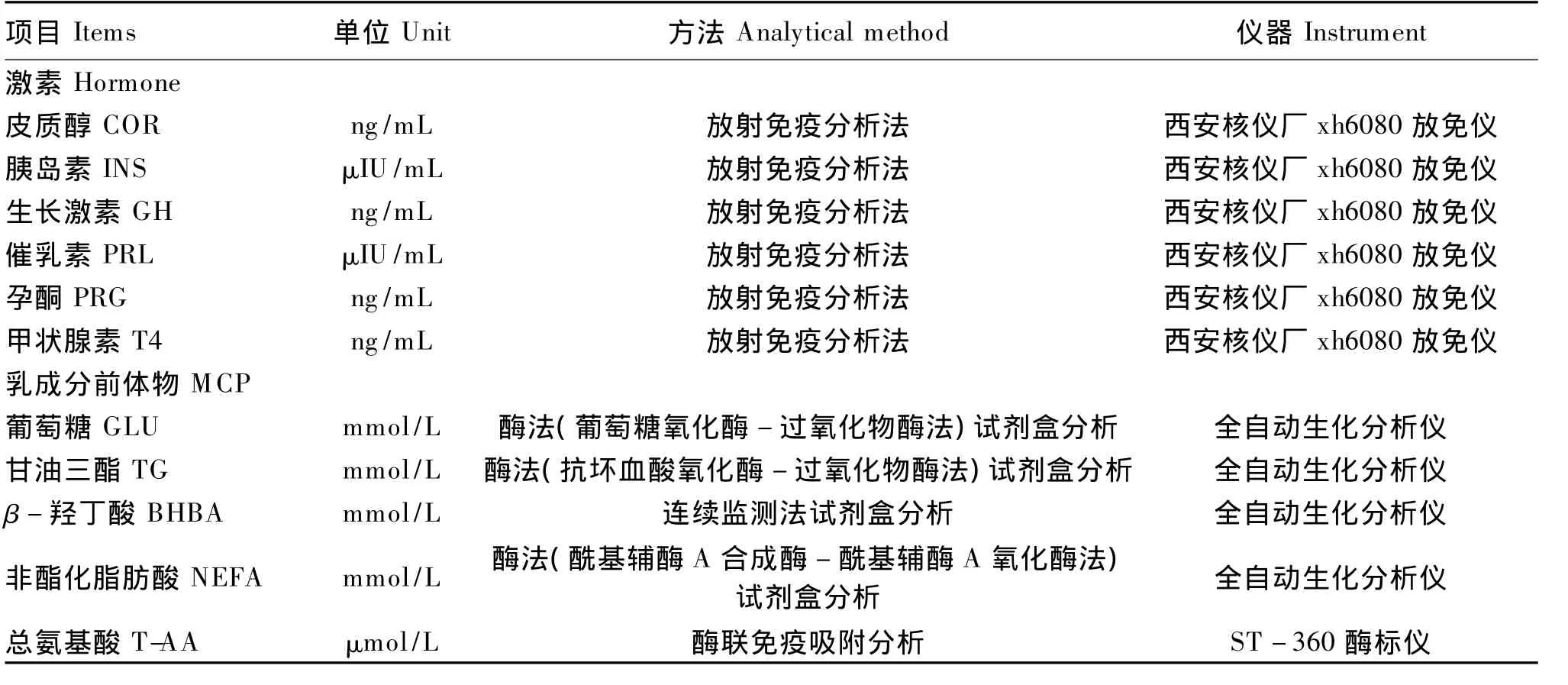
表2 血液指标的单位、分析方法、检测仪器Table 2 Units,analytical methods and instruments of blood parameters
符合正态分布和经过对数转化的数据利用Proc Mixed(SAS 9.2)线性模型评估胎次、泌乳阶段的固定效应,并采用Duncan氏法进行多重比较,结果以平均值±标准差(mean±SD)表示。数据处理结果见表3。
2 结果
2.1 血液指标数据整理
由表3可知,血液 COR、GH、T4和 BHBA含量符合正态分布,其他指标经对数转变后可用于Proc Mixed分析。
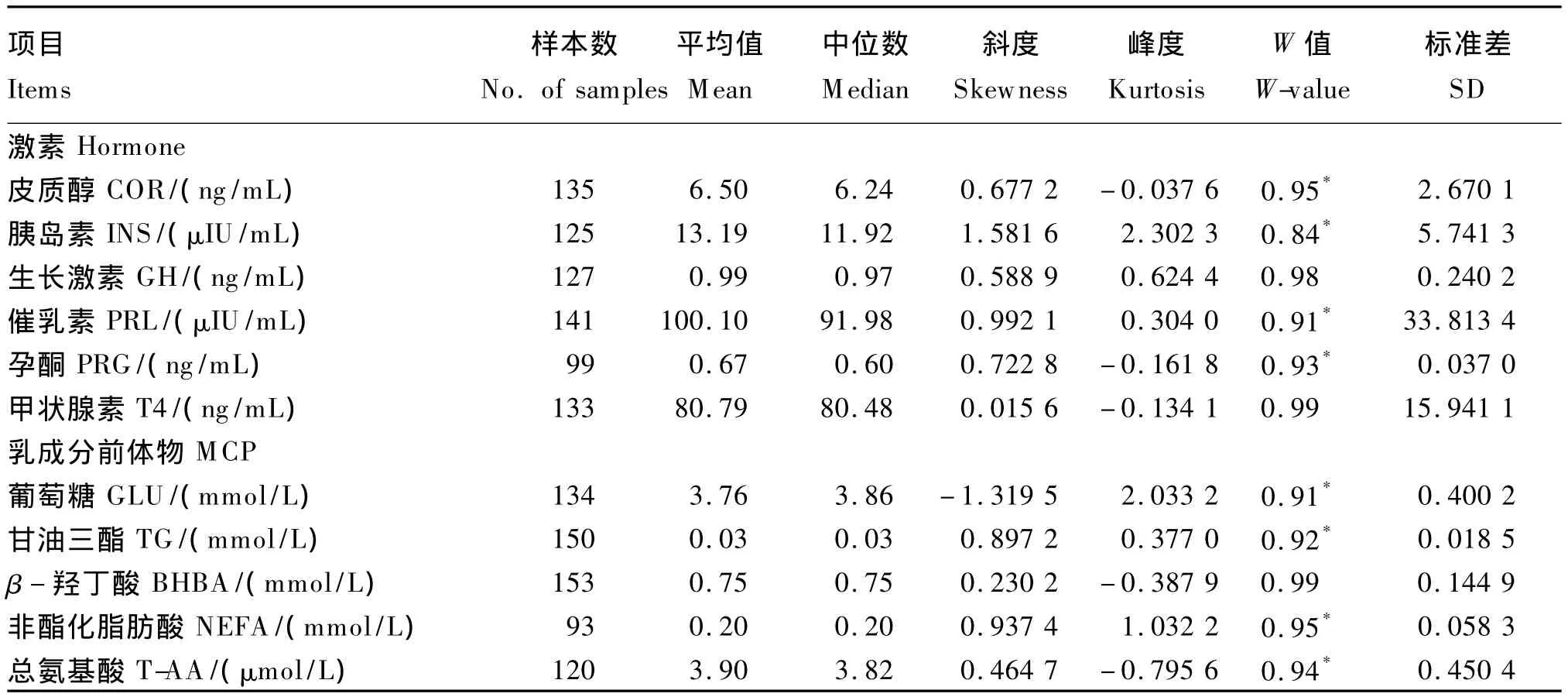
表3 血液指标:去除异常值的样本数、平均值、中位数、斜度、峰度、W值和标准差Table 3 Blood parameters:No.of samples after outlier deletion,mean,median,skewness and kurtosis,W-value and SD
2.2 胎次对奶牛血液乳成分前体物及泌乳相关激素含量的影响
由表4可知,不同胎次对泌乳奶牛血液中INS含量有显著的影响(P<0.05),三胎、四胎奶牛血液中INS含量高于一胎奶牛INS含量,其中显著高于一胎奶牛(P<0.05);不同胎次对泌乳奶牛血液中PRL含量有显著的影响(P<0.05),二胎、三胎奶牛血液中的PRL含量显著高于四胎奶牛(P<0.05)。胎次对奶牛血液中COR、GH、PRG、T4及5种乳成分前体物含量无显著的影响(P>0.05)。
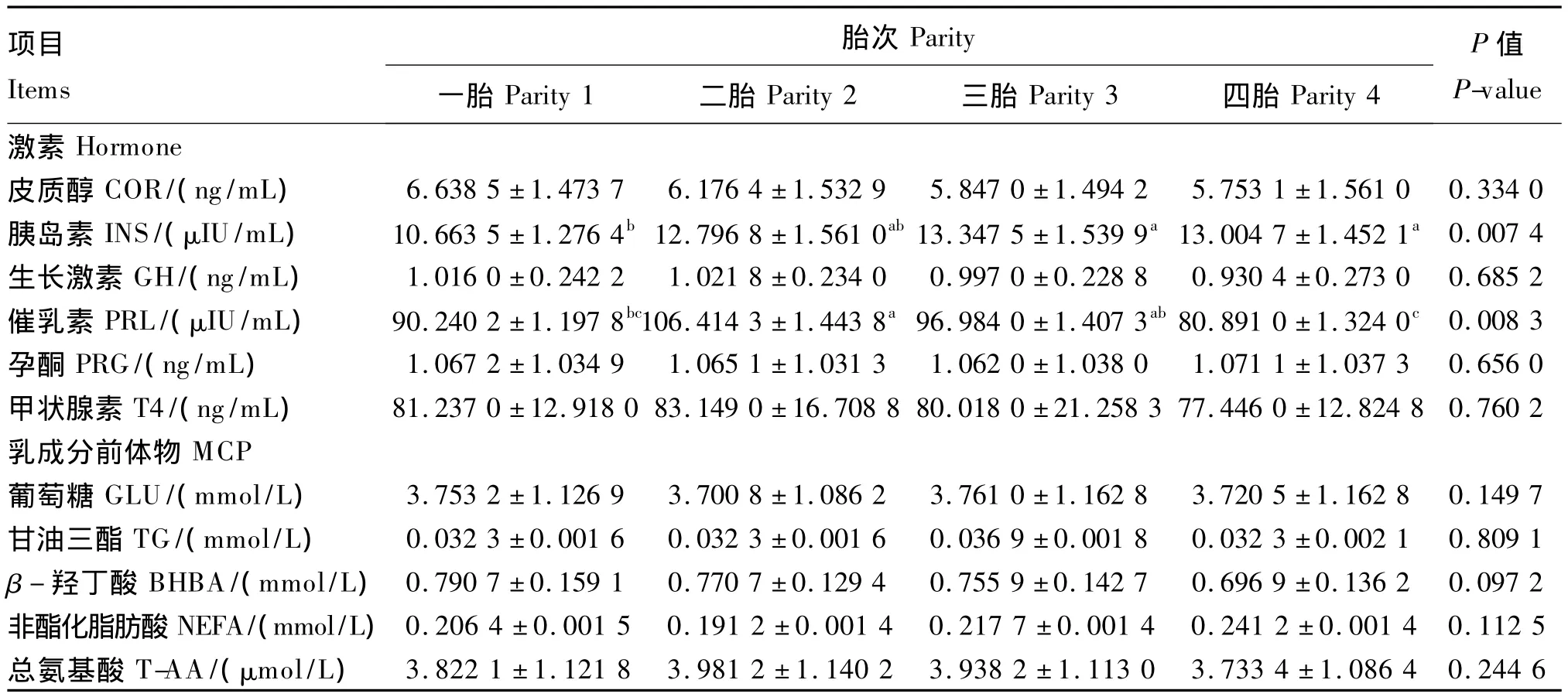
表4 胎次对奶牛血液乳成分前体物及泌乳相关激素含量的影响Table 4 Effects of parities on blood contents of MCP and hormone related to lactation of dairy cows
2.3 泌乳阶段对奶牛血液乳成分前体物及相关激素含量的影响
由表5可知,泌乳阶段对奶牛血液中COR、INS、GH、PRG、T4含量均有显著的影响(P<0.05)。随着泌乳时间的延长,COR含量呈现降低的趋势,泌乳中期、后期显著低于泌乳前期和高峰期(P<0.05);GH含量呈现递增的趋势,泌乳后期显著高于前3期(P<0.05);PRG含量泌乳早期和高峰期显著低于泌乳中期和后期(P<0.05),且在泌乳中期和后期维持一个较高的水平;T4含量泌乳早期显著低于其他3期(P<0.05)。经产和初产奶牛产奶量均随泌乳时间延长逐渐下降,与血液中COR、GH、PRG、T4含量变化趋势未见一致性(图1)。
由表5可知,泌乳阶段对血液中GLU、BHBA、NEFA及T-AA含量有显著的影响(P<0.05),对血液中的 TG含量无显著影响(P>0.05)。随着泌乳时间的延长,血液中GLU含量呈现递增的趋势,泌乳早期显著低于其他3期(P<0.05),泌乳高峰期显著低于泌乳中期和后期(P<0.05);BHBA含量在泌乳早期显著高于其他泌乳时期(P<0.05);NEFA含量呈现递减的趋势,泌乳早期显著高于其他3期(P<0.05),泌乳高峰期显著高于泌乳中期和后期(P<0.05);T-AA含量泌乳中期显著高于其他泌乳时期(P<0.05)。乳蛋白含量和血液T-AA和GH含量的变化趋势基本一致(图2)。乳脂肪含量和血液 NEFA、COR、GH和BHBA含量的变化趋势基本一致(图3)。乳糖含量和血液GLU、GH含量的变化趋势基本一致(图4)。
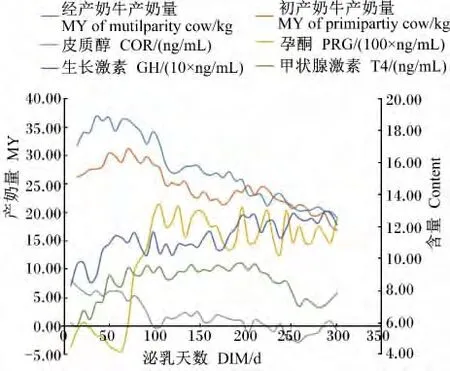
图1 产奶量与血液COR、T4、GH、PRG含量的变化趋势Fig.1 The changing trends of MY and blood COR,T4,GH and PRG contents
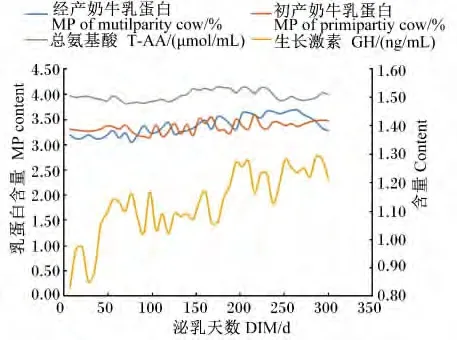
图2 乳蛋白和血液T-AA、GH含量的变化趋势Fig.2 The changing trends of MP,and blood T-AA and GH contents
3 讨论
3.1 胎次对奶牛血液乳成分前体物及泌乳相关激素含量的影响
不同胎次之间奶牛的产奶能力、乳成分及血液指标具有很大的差异。奶牛的产奶能力随胎次的增加而发生规律性的变化。在正常饲养管理条件下的荷斯坦牛的产奶量高峰值出现在五胎左右,在此之前,奶牛的产奶量呈逐胎次上升的趋势,此后,奶牛的产奶量呈依胎次下降的趋势。不同胎次的奶牛乳成分的含量会有显著的不同,熊本海等[11]研究发现乳中干物质、蛋白质以及乳糖含量从第4胎开始显著下降,而体细胞数在第4胎开始显著上升,奶损失量也随胎次显著增加。同样,奶牛的血液组成随胎次增加而发生变化。Cozzi等[12]研究表明血液中的总蛋白、球蛋白、肌酐酸含量和碱性磷酸酶、谷氨酰转肽酶、肌酸激酶活性在初产牛和多胎次牛之间有差异。Doornenbal等[13]研究表明肉牛血液中尿素氮、总蛋白、胆红素含量和天冬氨酸转氨酶、乳酸脱氢酶的活性随年龄的增加而增加,钙和磷含量随年龄(0~10岁)的增加而降低。
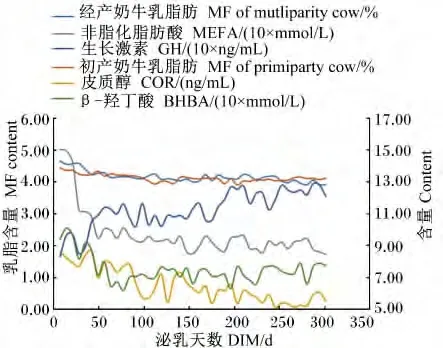
图3 乳脂肪和血液NEFA、COR、GH和BHBA含量的变化趋势Fig.3 The changing trends of MF,and blood NEFA,COR,GH and BHBA contents
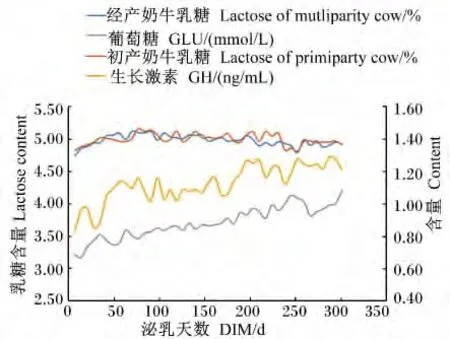
图4 乳糖和血液GLU、GH含量的变化趋势Fig.4 The changing trends of lactose,and blood GLU and GH contents
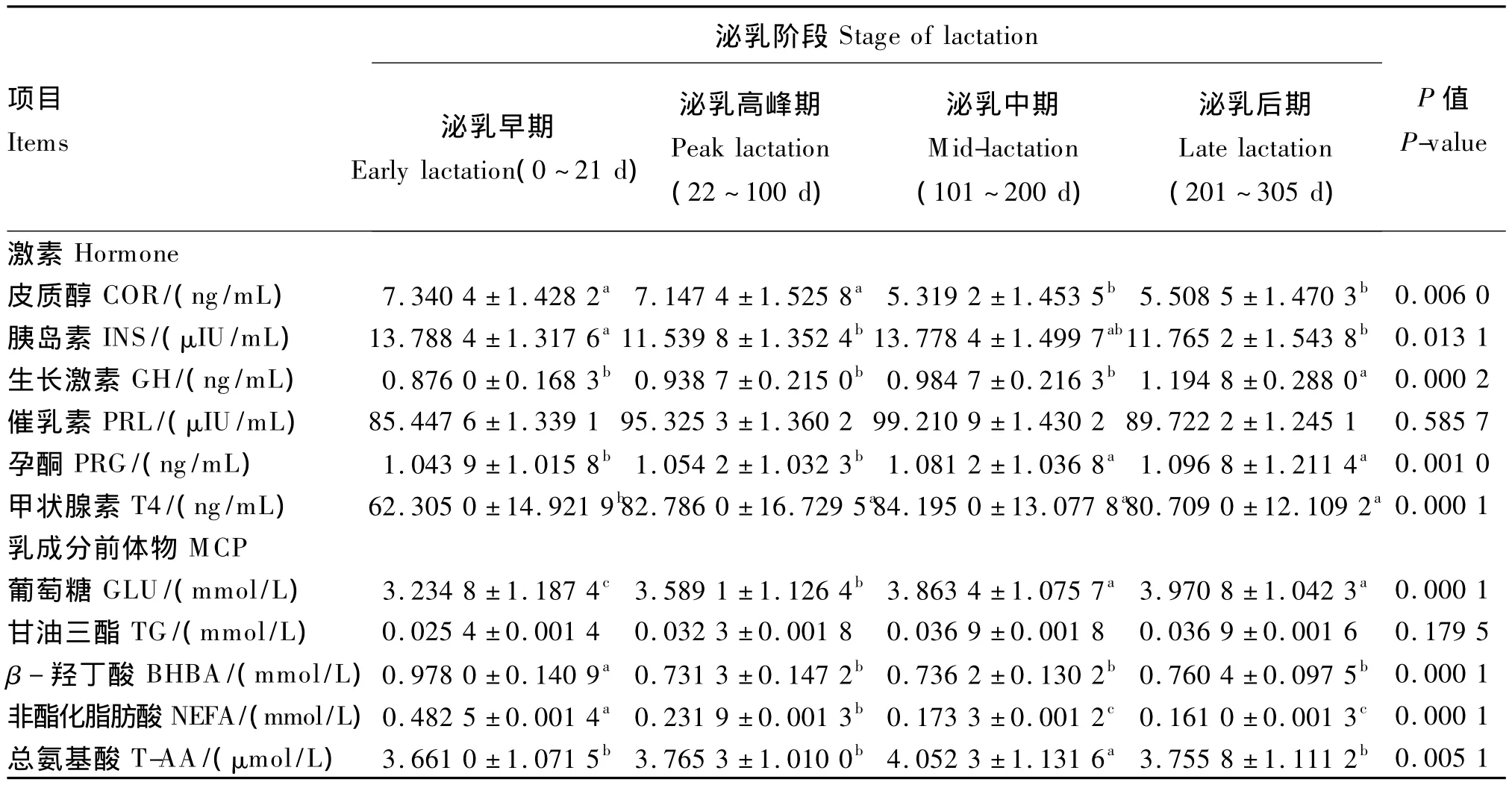
表5 泌乳阶段对奶牛血液乳成分前体物及相关激素含量的影响Table 5 Effects of stage of lactation on blood contents of MCP and hormone related to lactation of dairy cows
本研究发现不同胎次对泌乳奶牛血液中PRL含量有显著的影响,二胎、三胎奶牛血液中的PRL含量高于四胎奶牛血液中的PRL含量。PRL是脊椎动物腺垂体的PRL细胞合成分泌的一种肽类激素,主要作用是促进乳腺生长发育、发动和维持泌乳。PRL含量的高峰对于整个泌乳的启动过程特别是全乳分泌的启动非常重要。体外研究表明,在INS和COR存在的情况下PRL能够诱导乳蛋白的分泌。与促进乳腺发育的机制相似,PRL与它的受体结合能够启动生乳反应,随后一连串的生物反应也被启动,并最后影响基因转录以及对乳蛋白分泌进行调节[14-15]。胎次对泌乳奶牛血液中INS含量有显著的影响,三胎、四胎奶牛血液中INS含量高于一胎奶牛。INS是由胰岛β细胞分泌的一种蛋白质激素,是机体内唯一降低血液GLU的激素,同时促进糖原、脂肪、蛋白质的合成。INS参与调节糖代谢,控制血液GLU平衡。机体的能量状况对INS含量影响较大,是反映体内能量状况的一种激素。研究表明,增加血液中INS含量则提高产奶量,明显增加了乳腺血流量[16-17]。而在本研究中发现胎次对血液中乳成分前体物含量并没有显著的影响,而不同胎次之间的乳成分是有差别的[18]。因此奶牛产奶性能及乳成分含量随胎次发生变化的原因可能是血液中的激素含量的不同,引起机体新陈代谢和乳腺生理功能的变化,但具体的作用机制还有待进一步的研究。
3.2 泌乳阶段对奶牛血液乳成分前体物及相关激素含量的影响
奶牛的整个泌乳期产奶量有较大变化,母牛产犊后,在正常情况下产奶量逐日增加,到产后42~70 d出现最高日产奶量,若按泌乳月计算,约在第2个泌乳月产奶量出现最高峰。此后3~5个月为平稳期,高产奶牛其曲线基本不变,6~10个月为泌乳后期,高产奶牛产奶量下降得很少或不下降。研究表明,奶牛泌乳期间体内代谢过程变化剧烈,并且在血液指标上得以反应。王小龙等[19]发现血液中的谷草转氨酶、谷丙转氨酶、肌酸磷酸激酶活性和无机磷、总蛋白、总胆红素含量在妊娠后期、泌乳早期与泌乳晚期均有较大的变化。Cozzi等[12]研究发现血液中的 NEFA、天冬氨酸转氨酶、谷氨酰转肽酶、肌酸激酶、胆固醇的含量泌乳早期和中期之间有显著的差异。
本研究发现泌乳阶段对血液指标乳成分前体物中的GLU、BHBA、NEFA及T-AA含量有显著的影响,对血液中TG含量无影响。GLU是乳腺上皮细胞合成乳糖的主要前体物,乳腺主要通过从血液摄取GLU合成乳糖。研究发现,乳腺对GLU的摄取受到血液GLU含量的直接影响。本研究发现血液中的GLU在4个泌乳阶段含量呈现依次递增,与Cozzi等[12]的研究结果不一致,且乳糖含量与血液GLU含量变化趋势不一致。Cant等[20]和 Zhao 等[21]研究结果说明增加血液 GLU含量将会增加乳腺对其的摄取量,引起乳糖的合成量增加,但机体可通过调节乳腺血流速度控制GLU的摄取。本研究发现整个泌乳期乳脂含量变化趋势和乳脂前体物BHBA、NEFA的变化趋势基本一致。BHBA是酮体的主要成分,约占酮体的70%,奶牛养殖者用血液中的BHBA来作为诊断亚临床酮病的一项指标[22]。但是血液中的BHBA含量受饲喂时间,饲喂次数及饲粮组成的影响[23]。NEFA含量的高低是检测奶牛能量负平衡的标志[24]。在泌乳早期,NEFA含量反映了动员脂肪储备来弥补奶牛吸收营养和泌乳所需营养物质之间的不平衡[24-25]。在泌乳中期 NEFA含量相对较低,因为奶牛能量代谢正平衡及奶牛重新补充动员的机体储备[26]。T-AA含量泌乳中期高于其他泌乳时期,可能是奶牛自身为了调节泌乳初期氨基酸供给的不足,动用贮存于组织间的易动性蛋白质的氨基酸,增加供给量。研究认为,增加进入乳腺的氨基酸含量可促进乳蛋白质的生成[27-28]。本研究发现血液GLU含量泌乳前期显著低于其他阶段,而BHBA和NEFA含量显著高于其他阶段,原因是围产期奶牛能量供应不足,需动用体脂供应能量。
泌乳阶段对奶牛血液指标中GH、COR、PRG、T4、GH含量均有显著的影响。GH是腺垂体分泌的一种具有种属特性的蛋白质激素,是调节动物生长发育和三大代谢过程的一个重要内分泌因子。牛GH主要调节机体物质代谢,促进GLU吸收及碳水化合物和脂肪的分解,调节核酸与蛋白质的合成,提高饲料的转化率。对于反刍动物,GH可增加乳汁的生成,这种作用是否通过进入乳房的营养物质流量间接发生,还是直接作用于腺泡上皮细胞发生还不清楚。研究表明,当给泌乳奶牛注射外源性GH时,则能够明显提高乳腺组织氨基酸的摄取速度及乳腺的血流量,最终使产奶量增加[29]。此外,GH还可能具有使泌乳期奶牛体内的营养物质重新分配的作用,这有利于动员体内营养物质对产奶过程的供应[30]。本研究发现GH的变化趋势和产奶量的趋势并不一致,T4含量在泌乳后期有下降的趋势,可能是因为GH促进泌乳需要其他激素的协同作用。Kahl等[31]研究表明甲状腺激素对GH和PRL促进乳腺生乳也是必需的。COR是奶牛主要的内源性糖皮质激素,其基本功能是促进乳腺腺泡系统分化发育。本研究发现COR含量在泌乳早期较高,可能是因为糖皮质激素所诱导的细胞分化是PRL促进乳蛋白合成的前提条件[32]。PRG在孕激素中活性最高,黄体分泌的PRG能抑制泌乳的启动。PRG主要作用是促进乳腺小叶及腺泡的发育,在雌激素刺激乳腺导管发育的基础上,使得乳腺充分发育。
1个泌乳周期中,乳腺泌乳功能受多种因素影响,其调控机理尚不清楚,现有研究表明,多种激素及其受体与泌乳及乳腺的生长、分化和退化密切相关,整个泌乳期奶牛血液中乳成分前体物含量的高低也是影响产奶量及乳成分的重要因素,其作用机制有待于进一步的研究。
4 结论
① 不同胎次之间泌乳奶牛血液中INS、PRL含量有极显著的差异,而血液中COR、GH、PRG、T4及5种乳成分前体物乳成分前体物含量无显著的差异。胎次之间的产奶量及乳成分含量的差异可能与血液中激素含量有关,与乳成分前体物含量无关。
②不同的泌乳阶段之间奶牛血液指标中COR、GH、PRG、T4含量均有显著的差异,泌乳阶段对血液乳成分前体物中的GLU、BHBA、NEFA及T-AA有显著的影响,对TG含量无显著影响。泌乳早期和高峰期奶牛血液指标变化较剧烈,容易发生各种代谢疾病,应重点监测。
[1] FLINT D J,GARDNER M.Evidence that growth hormone stimulates milk synthesis by direct action on the mammary gland and that prolactin exerts effects on milk secretion by maintenance of mammary deoxyribonucleic acid content and tight junction status[J].Endocrinology,1994,135(3):1119-1124.
[2] LACASSE P,LOLLIVIER V,DESSAUGE F,et al.New developments on the galactopoietic role of prolactin in dairy ruminants[J].Domestic Animal Endocrinology,2012,43(2):154-160.
[3] MENZIESK K,LEE H J,LEFÈVREC,et al.Insulin,a key regulator of hormone responsive milk protein synthesis during lactogenesis in murine mammary explants[J].Functional & Integrative Genomics,2010,10(1):87-95.
[4] CHILLIARD Y,DELAVAUD C,BONNET M.Leptin expression in ruminants:nutritional and physiological regulations in relation with energy metabolism[J].Domestic Animal Endocrinology,2005,29(1):3-22.
[5] RUSSELL K E,ROUSSEL A J.Evaluation of the ruminant serum chemistry profile[J].Veterinary Clinics of North America:Food Animal Practice,2007,23(3):403-426.
[6] KADZERE C T,MURPHY M R,SILANIKOVE N et al.Heat stress in lactating dairy cows:a review[J].Livestock Production Science,2002,77(1):59-91.
[7] OSPINA P A,NYDAM D V,STOKOL T,et al.Associations of elevated nonesterified fatty acids andβhydroxybutyrate concentrations with early lactation reproductive performance and milk production in transition dairy cattle in the northeastern United States[J].Journal of Dairy Science,2010,93(4):1596-1603.
[8] QUIROZ-ROCHA G F,LEBLANC S J,DUFFIELD T F,et al.Reference limits for biochemical and hematological analytes of dairy cows one week before and one week after parturition[J].Canadian Veterinary Journal:La Revue Veterinaire Canadienne,2009,50(4):383-388.
[9] 中国奶业协会.NY/T 34—2004奶牛饲养标准[S].北京:中国农业出版社,2005.
[10] SOLBERG H E.Approved recommendation(1987)on the theory of reference values.Part 5.Statistical treatment of collected reference values.Determination of reference limits[J].Clinica Chimica Acta,1987,170(2/3):S13-S32.
[11] 熊本海,易渺,杨琴,等.中国北方荷斯坦奶牛乳成分及相关指标的季节性与胎次变化规律研究[J].畜牧兽医学报,2013,44(1):31-37.
[12] COZZI G,RAVAROTTO L,GOTTARDO F,et al.Short communication:reference values for blood parameters in Holstein dairy cows:effects of parity,stage of lactation,and season of production[J].Journal of Dairy Science,2010,94(8):3895-3901.
[13] DOORNENBAL H,TONG A K W,MURRAY N L.Reference values of blood parameters in beef cattle of different ages and stages of lactation[J].Canadian Journal of Veterinary Research-Revue Canadienne de Recherche Vétérinaire,1988,52(1):99-105.
[14] FREEMAN M E,KANYICSKA B,LERANT A,et al.Prolactin:structure,function,and regulation of secretion[J].Physiological Reviews,2000,80(4):1523-1631.
[15] TUCKER H A.Hormones,mammary growth,and lactation:a 41-year perspective[J].Journal of Dairy Science,2000,83(4):874-884.
[16] BARBER M C,TRAVERS M T,FINLEY E,et al.Growth-hormone-prolactin interactions in the regulation of mammary and adipose-tissue acetyl-CoA carboxylase activity and gene expression in lactating rats[J].Biochemical Journal,1992,285(Pt 2):469-475.
[17] BASSETT N S,CURRIE M J,KLEMPT M,et al.The effects of ovine placental lactogen and bovine growth hormone on hepatic and mammary gene expression in lactating sheep[J].Growth Hormone & IGF Research,1998,8(6):439-446.
[18] SEVI A,TAIBI L,ALBENZIO H,et al.Effect of parity on milk yield,composition,somatic cell count,renneting parameters and bacteria counts of Comisana ewes[J].Small Ruminant Research,2000,37(1/2):99-107.
[19] 王小龙,切·玛克鲁.对围产期乳牛某些血液生化成分变化的研究[J].中国畜牧兽医杂志,1993(7):16-17.
[20] CANT J P,TROUT D R,QIAO F,et al.Milk synthetic response of the bovine mammary gland to an increase in the local concentration of arterial glucose[J].Journal of Dairy Science,2002,85(3):494-503.
[21] ZHAO F Q,KEATINGA F.Expression and regulation of glucose transporters in the bovine mammary gland[J].Journal of Dairy Science,2007,90S:E76-E86.
[22] GRÜNWALDT E G,GUEVARA J C,ESTÉVEZ J C,et al.Biochemical and haematological measurements in beef cattle in Mendoza plain rangelands(Argentina)[J].Tropical Animal Health and Production,2005,37(6):527-540.
[23] BLUM J W,KUNZ P,LEUENBERGER H,et al.Thyroid hormones,blood plasma metabolites and haematological parameters in relationship to milk yield in dairy cows[J].Animal Science,1983,36(1):93-104.
[24] VAN KNEGSEL A T,VAN DEN BRAND H,GRAAT E A,et al.Dietary energy source in dairy cows in early lactation:metabolites and metabolic hormones[J].Journal of Dairy Science,2007,90(3):1477-1485.
[25] GRUMMER R R.Nutritional and management strate-gies for the prevention of fatty liver in dairy cattle[J].The Veterinary Journal,2008,176(1):10-20.
[26] WALTERS A H,PRYOR A W,BAILEY T Let al.Milk yield,energy balance,hormone,follicular and oocyte measures in early and mid-lactation Holstein cows[J].Theriogenology,2002,57(2):949-961.
[27] PURDIEN G,TROUT D R,POPPI D P,et al.Milk synthetic response of the bovine mammary gland to an increase in the local concentration of amino acids and acetate[J].Journal of Dairy Science,2008,91(1):218-228.
[28] 孙满吉.阴外动脉灌注乙酸盐,氨基酸和葡萄糖对奶山羊乳腺营养物质和乳成分影响的研究[R].呼和浩特:内蒙古农业大学,2008.
[29] WINTERMANTEL T M,BOCK D,FLEIG V,et al.The epithelial glucocorticoid receptor is required for the normal timing of cell proliferation during mammary lobuloalveolar development but is dispensable for milk production[J].Molecular Endocrinology,2005,19(2):340-349.
[30] DAVIS S R,GLUCKMAN P D,HART I C,et al.Effects of injecting growth hormone or thyroxine on milk production and blood plasma concentrations of insulin-like growth factorsⅠandⅡin dairy cows[J].Journal of Endocrinology,114(1):17-24.
[31] KAHL S,CAPUCO A V,BITMA N J.Serum concentrations of thyroid hormones and extrathyroidal thyroxine-5’-monodeiodinase activity during lactation in the rat[J].Experimental Biology and Medicine,1987,184(2):144-150.
[34] BAUMAND E.Bovine somatotropin:review of an emerging animal technology[J].Journal of Dairy Science,1991,75(12):3432-3451.
