肠道菌群对仔鸡肠道发育、黏膜形态和免疫器官发育的影响
2015-12-20吴娟娟赖水明涂小丽朱年华
吴娟娟 赖水明 潘 珂 涂小丽 朱年华
(江西农业大学动物科技学院,江西省动物营养重点实验室,南昌 330045)
动物肠道内栖息着大量的微生物称为肠道菌群(intestinal flora),它们在促进宿主食物消化、营养吸收、刺激免疫系统发育和抵御外来病菌侵入等方面起着重要作用[1]。仔鸡孵出后48~60 h,乳酸菌在嗉囊、十二指肠急增形成菌群优势,4日龄,仔鸡盲肠中乳酸菌占被检测到细菌总数的25%[2],7 日龄,乳酸菌在整个小肠形成优势[3]。有关动物肠道菌群功能的研究大多集中在小鼠上,并以无菌动物为模型[4]。国内外使用无菌鸡作为“悉生(gnotobiotic)动物”模型已进行了不少研究。Salter等[5]用无菌鸡为模型研究了正常鸡和无菌鸡对蛋白质消化和尿酸排泄的差异。Drew等[6]研究了蛋氨酸和羟基蛋氨酸的消化能力的差异。大量研究证实无菌鸡已是一种有潜力用于菌群代谢试验的动物模型。大量研究证实,选择鸡作为无菌动物模型,不仅因为其饲养过程简单,进化史及成长背景优良,还因为其在孵化之前我们就能判断其父母代是否达无菌状态[7]。为探讨肠道菌群与宿主之间的潜在关系,本实验室通过无菌隔离器放置千级实验室内进行仔鸡饲养21 d后,对鸡排泄物通过 GB/T 14926.41—2001方法进行检测后,并未发现检测菌,说明“无菌鸡”模型建立成功,为本次试验提供条件。本试验采用3台隔离器,通过添加单一鸡源性乳酸菌或混合菌(盲肠内容物),旨在研究其对仔鸡肠道发育、黏膜结构与免疫器官发育的影响,揭示肠道菌群与宿主的关系,为调控肠道菌群提供理论基础,同时为肠道微生物的功能研究摸索出一种新的研究方法。
1 材料与方法
1.1 试验材料
试验所用无特定病原体(SPF)种蛋购置于北京梅里亚维通实验动物有限公司,经消毒后放无菌实验室的孵化器中孵化。
无菌饲粮:按NRC(2004)鸡营养需要配制,其饲粮组成及营养水平见表1,配制好后采用钴-60辐射源照射,并经检测无菌。
乳酸菌发酵液:为鸡源性乳酸菌,由江西农业大学动物营养点提供,经中国科学院微生物所经鉴定为嗜酸乳杆菌(L.acidophilus);配料前用MRS液体培养基发酵后备用。
盲肠内容物:无菌取21日龄普通肉鸡盲肠内容物用灭菌生理盐水稀释后入无菌饲粮中。
1.2 试验动物与饲粮
1.2.1 肉鸡悉生动物模型的建立
选用来自SPF鸡场即将孵化SPF种蛋60枚,先进行无菌化处理后放入无菌隔离器内充入无菌空气,而后置孵化器内进行孵化,孵化出生后放入无菌隔离器内饲养。饲粮经钴-60照射灭菌做成无菌饲粮,自来水经高压灭菌锅121℃灭菌21 min做成无菌饮用水;饲粮、水分别由灭菌筒经隔离器的传递仓对接送入;空气由高压灭菌后再过滤介质传入隔离器内[8]。无菌仔鸡饲养3周后,隔离器内仔鸡存活8只以上,同时通过检查肠道(粪便)内无细菌存在,即悉生动物模型建立成功。
1.2.2 试验动物分组及饲养
本次试验根据饲喂饲粮的不同分为3个组:饲喂无菌饲粮作为对照组(CT组);饲喂无菌饲粮和嗜酸乳杆菌(配制的饲粮中活菌数大于1×106CFU/g)作为乳酸菌组(LB组);饲喂无菌饲粮和鸡盲肠内容物(盲肠内容物添加量0.1%)作为盲肠内容物组(CC组)。本次试验选用来自SPF鸡场的爱拔益加(AA)鸡种蛋60枚,无菌化处理后入塑料隔离器并放入无菌孵化器内进行孵化,孵化出生后,随机分3组分别放入无菌隔离器内饲养,基础饲粮为玉米-豆粕型饲粮。

表1 基础饲粮组成及营养水平(风干基础)Tabe 1 Composition and nutrient levels of basal diet(air-dry basis) %
1.3 饲养管理
试验在江西农业大学动物营养重点实验室无菌实验室进行。所有鸡只在无菌隔离器内(无菌隔离器经检测洁净度可达100级)饲养。在试验开始前1周无菌室及隔离器用甲醛和高锰酸钾进行彻底熏蒸消毒,舍内温度、湿度和光照按常规饲养管理要求控制。整个饲喂期间自由采食和饮水,饲喂期为21 d。
1.4 测定指标及方法
1.4.1 各肠段生长发育
于仔鸡出生后7、14日龄从各组取4只鸡屠宰,试验结束时(21日龄)从每个组随机取6羽试验鸡进行屠宰,小心分离出十二指肠、空肠、回肠、盲肠、直肠,并用软尺准确量取各段长度,同时计算各肠段的长度系数(即该肠段长度占整个肠道长度百分比)。
1.4.2 屠宰指标及免疫器官指数
于饲喂结束后从每个组随机取6羽试验鸡先进行空腹称活重然后屠宰,去毛、头、脚称取胴体重,开膛后将头、脚、心脏、肝脏去掉后称取全净膛重,剥离胸肌肉、肝脏、脾脏、胸腺和法氏囊称重。根据以上结果计算屠宰率,全净膛率,胸肌率及肝脏、脾脏、胸腺、法氏囊指数。
1.4.3 小肠黏膜形态结构
取十二指肠、空肠、回肠段,用10%甲醛固定液固定,常规苏木精-伊红(HE)染色后制成5μm石蜡切片,观察绒毛形态,计算绒毛高度、隐窝深度及绒毛高度/隐窝深度(V/C)。
1.5 数据处理与统计
试验数据处理采用Excel 2003,试验结果分析采用SPSS 17.0中的one-way ANOVA程序进行方差分析,用Duncan氏法多重比较,结果以平均值±标准误(SE)表示。以P<0.05为显著水平。
2 结果
2.1 不同菌群对仔鸡肠道发育的影响
由表2可知,与CT组相比,饲喂乳酸菌可显著降低7日龄的盲肠长度系数(P<0.05),饲喂盲肠内容物可显著降低7、14、21日龄的盲肠长度系数(P<0.05);饲喂乳酸菌和盲肠内容物可一定程度提高各阶段空肠长度系数,其中在7日龄呈显著性提高(P<0.05);饲喂盲肠内容物仅在7日龄时呈显著降低十二指肠长度系数(P<0.05);饲喂乳酸菌和盲肠内容物仅在7日龄呈显著提高回肠长度系数(P<0.05)。直肠长度系数在各组间差异均不显著(P>0.05)。
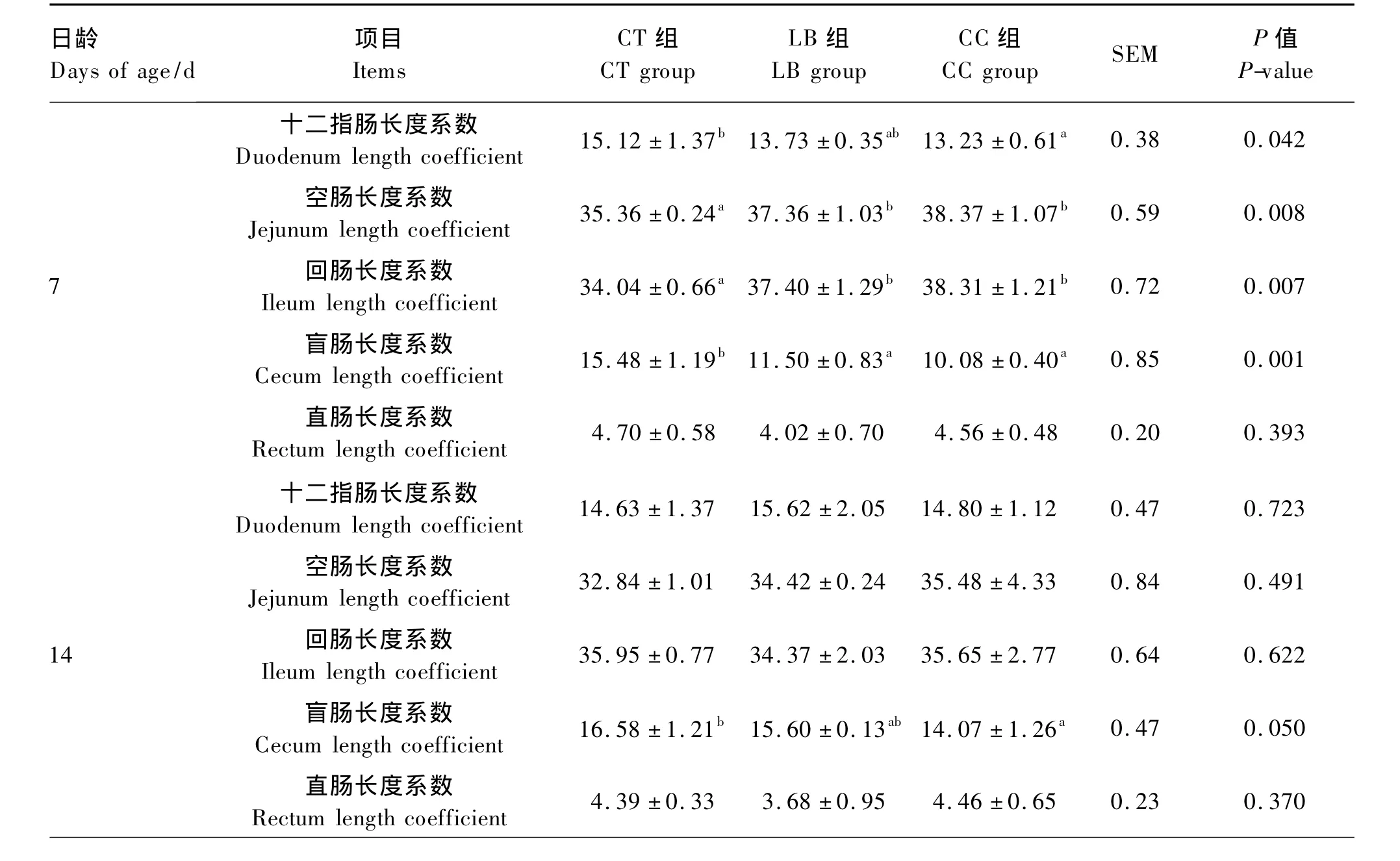
表2 肠道菌群对各肠段生长发育的影响Table 2 Effects of intestinal flora on the growth and development of intestine of chicks %

续表2
不同日龄各组仔鸡盲肠大小见图1,从中可看出,无菌鸡盲肠发达,肠道菌群可抑制盲肠发育。并且盲肠内容物也存在明显变化,饲喂乳酸菌和盲肠内容物的仔鸡盲肠细长且富有弹性,剪开肠道可发现内容物黏稠,CT组的盲肠肥大且壁薄,剪开肠道可发现内容物稀且充满气泡。

图1 各阶段仔鸡盲肠解剖图Fig.1 The various stages of chicken cecal dissections
2.2 不同肠道菌群对仔鸡屠宰指标的影响
由表3可知,与CT组相比,饲喂乳酸菌和盲肠内容物对仔鸡21日龄的鸡胴体重、屠宰率和胸肌率均无显著差异(P>0.05);LB组的全净膛率却显著高于CC组(P<0.05)。
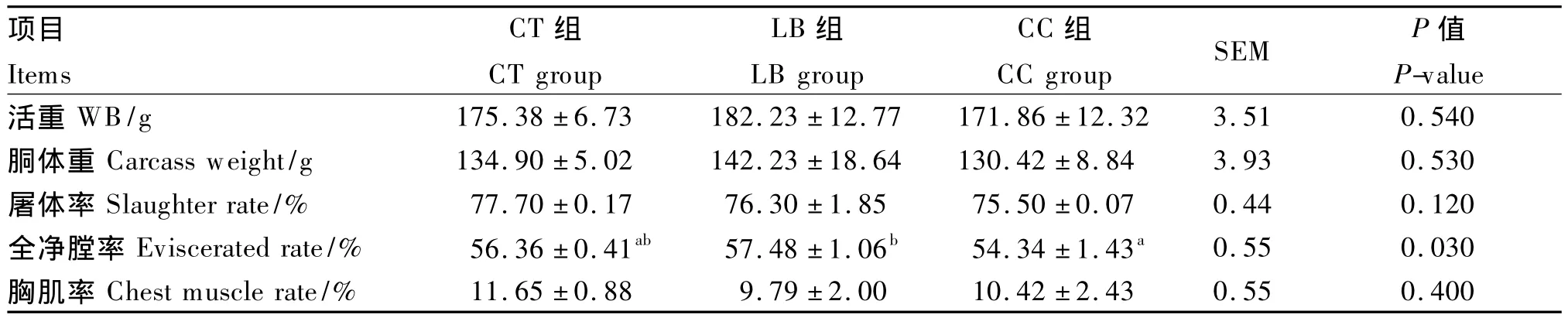
表3 不同肠道菌群对21日龄仔鸡屠宰指标的影响Table 3 Effects of different intestinal flora on 21-day-old chicks slaughter Indexes
2.3 不同肠道菌群对仔鸡免疫器官指数的影响
不同肠道菌群对仔鸡免疫器官指数的影响见表4,从中可看出,与CT组相比,肠道菌群显著提高仔鸡的脾脏指数(P=0.010),由CT组的0.13%提高到0.16% ~0.17%;对仔鸡肝脏指数、胸腺指数和法氏囊指数虽略有提高,但差异不显著(P>0.05)。
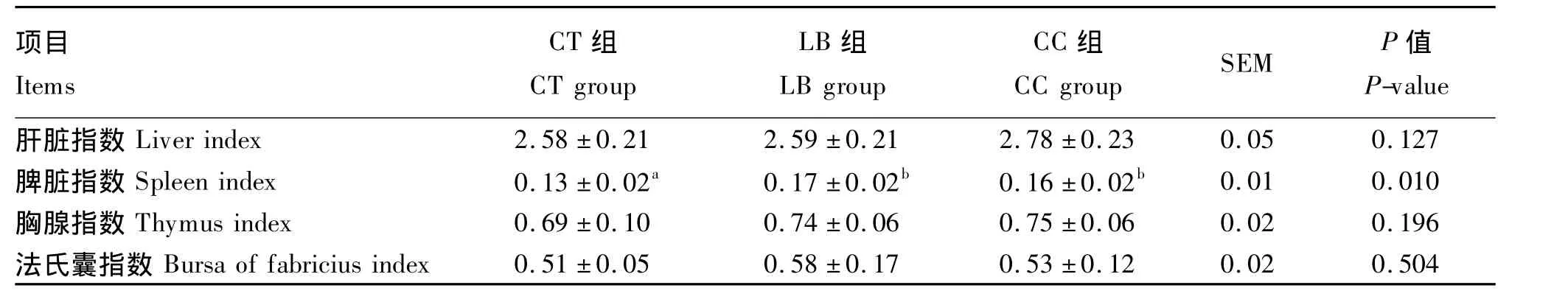
表4 不同肠道菌群对仔鸡免疫器官指数的影响Table 4 Effects of different micro flora on immune organ indexes of chicks %
2.4 不同肠道菌群对仔鸡小肠黏膜形态结构的影响
不同处理对仔鸡十二指肠黏膜形态结构见表5,由表中可看出,与CT组相比,饲喂乳酸菌和盲肠内容物仔鸡的十二指肠绒毛高度增加,但差异不显著(P>0.05),饲喂盲肠内容物仔鸡的十二指肠隐窝深度显著降低(P<0.05)。对回肠的相关黏膜形态结构没有产生显著的影响(P>0.05)。2个试验组的仔鸡十二指肠的V/C分别高出CT组39.67%和45.84%(P<0.05);2个试验组空肠 V/C分别高出 CT 组21.6%和19.7%(P=0.010);LB 组的回肠V/C与CT组相比无显著差异(P>0.05),而CC组仅高出CT组13.75%(P>0.05)。由此可以得出,饲喂乳酸菌和盲肠内容物后,小肠段V/C的相对差异主要体现在十二指肠和空肠部位。

表5 不同肠道菌群对仔鸡小肠黏膜形态结构的影响Table 5 Effects of different microflora on mucosal morphology structure in the intestine of chicks
不同处理对仔鸡十二指肠黏膜形态显微照见图2,可以看出,LB组和CC组的十二指肠绒毛比CT组绒毛更细、更长且清晰有光泽;LB组十二指肠绒毛比CC组绒毛要稍长、稍稀疏一些。

图2 十二指肠黏膜形态显微照片Fig.2 The microphoto of small intestinal mucosa morphology(10×)
3 讨论
3.1 “无菌动物”模型建立的意义
无菌动物是指饲养在无菌屏障系统(无菌隔离器)中,用现有方法不能检出任何微生物(包括酵母和真菌)及寄生虫的动物[9]。无菌动物的产生和发展已有近百年历史,自Cohendy于1908年首次成功进行了无菌鸡的饲养,1944年Luckey和Lakey进行了无菌鸡饲粮营养的研究;1948年美国Lobund小组成功饲养的无菌鸡,并产卵和孵化出新一代雏鸡;1937年Balzam使用无菌鸡对B族维生素缺乏症及鸡体内能否合成,对B族维生素发现起了重大作用,同时也推动了无菌动物培养的发展[4]。Drew 等[6]利用无菌鸡研究了蛋氨酸和羟基蛋氨酸的消化能力的差异。利用无菌动物研究肠道微生物对宿主健康与营养物质吸收利用的关系,抗生素作用机理与替代有重要的理论和实践意义。
3.2 肠道菌群对仔鸡肠道发育的影响
物肠道的生长发育直接影响动物生长和健康状况,肠道微生物菌群的建立显示了肠道菌群可能参与宿主肠道的发育[10]。肠道菌群对鸡消化器官影响已有不少报道,陈佳等[11]研究发现用乳酸菌培养物饲喂肉鸡后,21日龄时,试验组小肠长度小于对照组。雷燕[12]研究发现益生菌能降低肉鸡肠道长度,可改善肠道形态。
利用无菌动物研究肠道微生物对动物肠道发育的影响最为客观和明显。Reyniers等[13]研究发现无菌鸡小肠重量要显著低于常规鸡,主要原因是其黏膜固有层变薄。Gordon等[14]研究发现无菌鸡的小肠发育程度不如常规鸡归结于其黏膜表面积减少。Abrams等[15]研究证实与常规小鼠相比,无菌鼠的小肠重量、长度均显著降低。Bartizal等[16]的研究发现无菌沙鼠的盲肠较发达于饲喂肠道菌群后的沙鼠。本研究发现,饲喂乳酸菌和盲肠内容物可一定程度提高7日龄十二指肠长度,显著提高空肠、回肠长度,结果与前人研究结果基本一致。
无菌动物的盲肠比普通动物大得多,在鼠、兔和鸡都一致,这也被认为是无菌动物的标志[17]。Wostmann等[18]报道的无菌鼠盲肠比普通常规动物要大5~6倍,无菌鸡盲肠达体重的6% ~10%;其后发现无菌动物盲肠体积增大可能与盲肠内容物的氧化还原电位密切相关,盲肠内存在较多的碱性反应,其 pH 升高 1.0[19]。Phillips 等[20]进一步证明,无菌豚鼠的盲肠之所以肥大是因为其内容物中含有较多的阳性的氧化还原电位。而无菌鸡盲肠肥大具体原因还有待更深一步的研究。
3.3 肠道菌群对仔鸡免疫器官指数的影响
机体免疫器官指数是衡量机体免疫功能的初步指标,免疫器官的发育状况直接反映出机体的免疫应答水平[21]。家禽免疫器官(法氏囊、脾脏、胸腺等)的重量是评价营养素对家禽免疫力影响的重要指标。脾脏作为重要的淋巴器官,也是机体最大的外周免疫器官,是产生致敏淋巴细胞和抗体的场所之一,同时具有造血、滤血、清除衰老细胞和微生物等功能。肠道菌群与宿主长期处于共生状态,主要参与生物拮抗(防御感染)、营养吸收与代谢、免疫系统发育等[22]。曹海宁等[23]研究表明正常肠道菌群在促进免疫系统发育,维持正常免疫功能,协同拮抗病原菌入侵方面发挥着重要作用。李志川等[24]研究表明肠道菌群不仅对肠道黏膜免疫系统的发育和激活有重要作用,同样对肠道外全身免疫系统也有重要作用。
无菌动物由于没有肠道微生物的刺激,网状内皮系统发育缓慢,脾脏缩小,无三级滤泡,网状内皮细胞功能降低,Coates[25]研究指出无菌鸡的肾脏、脾脏、甲状腺明显小于常规鸡。而本试验仅发现无菌鸡脾脏较小,而对肝脏、胸腺、法氏囊指数没有产生显著的影响。Gordon等[26]发现无菌鸡心脏小、血量变少,血红细胞计数和血细胞压积增大。另有相关报道指出无菌鸡血管和肌肉对肾上腺素的敏感性显著降低[27]。脾脏具有造血、滤血、清除衰老细胞和微生物等功能,我们不难推测出上述结果均有可能与脾脏相关。从本试验发现,添加肠道菌群脾脏指数显著提高,说明肠道菌群可刺激免疫系统发育,促进脾脏的生长,在一定程度上加强机体免疫力。
3.4 肠道菌群对仔鸡小肠黏膜形态结构的影响
小肠作为仔鸡营养成分吸收的主要场所,在营养物质消化吸收过程中发挥着重要作用。小肠绒毛作为肠黏膜结构的重要组成部分,其高度的变化直接影响小肠消化、吸收营养物质的能力。Caspary[28]报道指出绒毛高度的增加会促使小肠接触营养物质的面积增大,从而增强小肠对营养物质的吸收。隐窝是肠上皮细胞分化的部位,其深度反映了隐窝细胞的增殖率和成熟度,隐窝变浅分泌功能增强,反之亦然。V/C综合反映小肠的功能状况,其下降表明小肠消化、吸收功能下降[29]。Awad 等[30]发现在饲粮中添加益生菌与合生元可显著增加35日龄肉鸡空肠、回肠的绒毛高度和V/C,体重也有显著提升。Rask等[31]研究发现,单一定植菌的悉生小鼠或无菌小鼠与普通小鼠比较,后者能通过上调小肠黏膜上皮主要组织相容性复合体的表达,进而促进小肠黏膜形态结构的完整。
早先Reyniers等[13]发现无菌动物小肠重量变轻,其原因是小肠黏膜组织较薄,绒毛表面积显著减少;Abrams等[15]也发现无菌动物肠道黏膜细胞具有较低的代谢更新率。Guent等[32]报道普通鼠的十二指肠和回肠表皮细胞有丝分裂指数较无菌鼠高,这可能是因肠道菌群所致,虽然其机理尚不明确[33]。本次研究结果与前人结果基本一致,说明肠道菌群刺激肠道组织形态和肠道黏膜发育。
4 结论
①肠道菌群能促进仔鸡前期(7日龄)的空肠和回肠的发育;无菌鸡盲肠发育较快,其肠道长度系数要显著高于有菌鸡。
②肠道菌群提高仔鸡十二指肠和空肠的绒毛高度,降低隐窝深度,影响营养物质吸收。
③肠道菌群促进仔鸡脾脏的发育,提高机体免疫力。
[1] APAJALAHTI J.Comparative gut microflora,metabolic challenges,and potential opportunities[J].The Journal of Applied Poultry Research,2005,14(2):444-453.
[2] AMIT-ROMACH E,SKLAN D,UNI Z.Microflora ecology of the chicken intestine using 16S ribosomal DNA primers[J].Poultry Science,2004,83(7):1093-1098.
[3] 王爱萍,张改平,张存信,等.不同日龄雏鸡消化道内乳杆菌自然分布状况研究[J].中国兽医杂志,2001,37(6):16 -17.
[4] GORDON H A,PESTI L.The gnotobiotic animal as a tool in the study of host microbial relationships[J].Bacteriological Reviews,1971,35(4):390 -429.
[5] SALTER D N,COATES M E,HEWITT D.The utilization of protein and excretion of uric acid in germfree and conventional chicks[J].British Journal of Nutrition,1974,31(3):307 -318.
[6] DREW M D,VAN KESSEL A G,MAENZ D D.Absorption of methionine and 2-hydroxy-4-methylthiobutoanic acid in conventional and germ-free chickens[J].Poultry Science,2003,82(7):1149 -1153.
[7] REYNIERSJA,TREXLER PC,ERVIN R F,et al.A complete life-cycle in the“Germ-free” Bantam Chickèn[J].Nature,1949,163(4132):67 - 68.
[8] 李纪平,邵世义,马振强,等.SPF猪过渡饲养试验[J].当代畜牧,2005(3):8 -10.
[9] FULLER R.The routine microbiological control of germfree isolators[M]//COATES M E,CORDON H A,WOSTMANN B S.The germfree animal in research.New York:Academic Press,1968:37 -45.
[10] YAN F,POLK D B.Commensal bacteria in the gut:learning who our friends are[J].Current Opinion in Gastroenterology,2004,20(6):565 -571.
[11] 陈佳,王彩铃,程曙光,等.乳杆菌培养物对肉鸡肠道菌群及形态的影响[J].饲料研究,2008(6):20-22.
[12] 雷燕.益生菌对肉鸡生产性能、消化道生理及肠道微生物区系的影响[D].硕士学位论文.雅安:四川农业大学,2009.
[13] REYNIERS J A,WAGNER M,LUCKEY T D,et al.Survey of germ-free animals:the white Wyandotte Bantam and white Leghorn chicken[R].Lobund Reports No.3.Notre Dame.versity Press,1960.
[14] GORDON H A,BRUCKNER-KARDOSSE.Effect of normal microbial flora on intestinal surface area[J].American Journal of Physiology Published,1961,201(1):175-178.
[15] ABRAMS G D,BAUER H,SPRINZ H.Influence of the normal flora on mucosal morphology and cellular renewal in the ileum.A comparison of germ-free and conventional mice[J].Laboratory Investigation,1963,12:355 -364.
[16] BARTIZAL K F,WOSTMANN B S,WAGNER M.Distribution and effects of a defined six-member murine-derived microflora in gnotobiotic gerbils[J].Applied and Environmental Microbiology,1984,47(4):746-751.
[17] PLEASANTS J R.Characteristics of the germfree animal[M]//COATESM E,GORDON H A,WOSTMANN B S.The germfree animal in research.London:Academic Press,1968:113 -125.
[18] WOSTMANN B S,BRUCKNER-KARDOSS E.Oxidation-reduction potentials in gecal contents of germfree and conventional rats[J].Experimental Biology and Medicine,1966,121(4):1111 -1114.
[19] WOSTMANN B S,BRUCKNER-KARDOSS E,KNIGHT P L,Jr.Cecal enlargement,cardiac output,and O2consumption in germfree rats[J].Experimental Biology and Medicine,1968,128(1):137 -141.
[20] PHILLIPS B P,WOLFE P A.The use of germfree guinea pigs in studies on the microbial interrelationships in amoebiasis[J].Annals of the New York A-cademy of Sciences,1959,78(1):308 -314.
[21] 曹贵彬,易凤珍,游金明,等.陈皮苷制剂对爱拔益加肉鸡生长性能、免疫器官指数及小肠黏膜形态结构的影响[J].动物营养学报,2014,26(3):710-717.
[22] 熊德鑫.肠道微生态制剂与消化道疾病的防治[M].北京:科学出版社,2008:20-49.
[23] 曹海宁,周昌宁.肠道菌群与儿童免疫[J].当代医学,2011,17(26):24 -26.
[24] 李志川,郑跃杰.肠道菌群及免疫[J].中国实用儿科杂志,2010(7):507-510.
[25] COATES M E.The germ-free animal in research[M].London:Academic Press,1968.
[26] GORDON H A,WOSTMANN B S,BRUCKNERKARDOSS E.Effects of microbial flora on cardiac output and other elements of blood circulation[J].Experimental Biology and Medicine,1963,114(2):301-304.
[27] GORDON H A,KOKAS E.A bioactive pigment(“alpha pigment”)in cecal contents of germ-free animals[J].Biochemical Pharmacology,1968,17(11):2333-2347.
[28] CASPARY W F.Physiology and pathophysiology of intestinal absorption[J].The American Journal of Clinical Nutrition,1992,55(1):299S -308S.
[29] 韩正康.家畜营养生理学[M].北京:农业出版社,1993:16-17.
[30] AWAD W A,GHAREEB K,ABDEL-RAHEEM S,et al.Effects of dietary inclusion of probiotic and synbiotic on growth performance,organ weights,and intestinal histomorphology of broiler chickens[J].Poultry Science,2009,88(1):49 -56.
[31] RASK C,EVERTSSON S,TELEMO E,et al.A full flora,but not monocolonization by Escherichia coli or lactobacilli,supports tolerogenic processing of a fed antigen[J].Scandinavian Journal of Immunology,2005,61(6):529 -535.
[32] GUENET JL,SACQUET E,GUENEAU G,et al.Action of total microflora of the rat on mitotic activity of Lieberkuhn’s crypts[J].Comptes rendus hebdomadaires des séances de l'Académie des sciences.Série D:Sciences naturelles,1970,270(25):3087 -3090.
[33] LESHER S,WALBURG H E,Jr,SACHER G A,Jr.Generation cycle in the duodenal crypt cells of germfree and conventional mice[J].Nature,1964,202(4935):884-886.
