GROβ在结直肠癌肿瘤血清中的表达与临床病理相关性研究
2015-12-20郑敏孙思进高红军郑朝旭岳志刚周艳秋胡万宁
郑敏 孙思进 高红军 郑朝旭 岳志刚 周艳秋 胡万宁
·临床研究与应用·
GROβ在结直肠癌肿瘤血清中的表达与临床病理相关性研究
郑敏①孙思进②高红军③郑朝旭②岳志刚③周艳秋③胡万宁①
目的:探讨生长相关癌基因产物β(growth-related gene product β,GROβ)用于结直肠癌诊断潜在的可能性。方法:收集123例结直肠癌、88例健康对照及125例非肿瘤患者外周血清,ELISA法分析GROβ的含量;免疫发光法分析CEA及CA19-9的含量。统计分析不同临床特征结直肠癌之间GROβ的差异;ROC曲线评估GROβ、CEA和CA19-9诊断结直肠癌的敏感度和特异度。结果:结直肠癌血清GROβ浓度(中位数96.15 pg/mL)明显高于健康对照组(中位数43.28 pg/mL,P<0.01)和非肿瘤患者(中位数57.30 pg/mL,P<0.01)。GROβ水平与肿瘤TNM分期(P<0.01)及浸润深度均呈正相关(P<0.05),与肿瘤分化程度、肿瘤栓塞、淋巴结转移、肿瘤病理类型及性别无关。GROβ检测结直肠癌的敏感度和特异度分别为56.1%(69/123)和95.31%(203/213)。将GROβ、CEA和CA19-9阳性样本叠加后,诊断Ⅰ期结直肠癌的敏感度为22.2%(4/18),诊断Ⅱ期结直肠癌的敏感度为66.7%(26/ 39)。GROβ的ROC曲线下面积(0.834)高于CEA(0.739)和CA19-9(0.676)。结论:血清GROβ浓度可能是一个有效的结直肠癌检测指标。
GROβ 结直肠癌 生物标志物 CEA CA19-9
全球每年有超过60万人死于结直肠癌[1],中国人结直肠癌发病率增长迅速[2-3]。临床常用肿瘤标记物CEA及CA19-9[4-5]诊断结直肠癌的敏感度较低[6]。生长相关癌基因(growth-related oncogene,GRO)表达产物GROβ参与血管生成、肿瘤发生、转移及肿瘤与白细胞间的相互作用等一系列过程[7-13]。本研究对结直肠癌血清中GROβ表达进行检测;比较不同临床病理特征的结直肠癌血清GROβ浓度;评估GROβ、CEA及CA19-9诊断结直肠癌的能力。研究表明联合三项指标有助于提高结直肠癌诊断的敏感度。
1 材料与方法
1.1 对象
结直肠癌患者组血清123例(123个术前血清样本,66个术后血清样本),男性86例,女性37例,中位年龄(57.7±10.5)(24~80)岁。肿瘤临床分期按照第七版国际抗癌联盟TNM的恶性肿瘤分级标准进行[14]。66例患者肿瘤位于结肠,57例患者肿瘤位于直肠。术后血清样本在手术两周后收集(表1)。健康对照组88例,中位年龄(40.2±9.6)(26~59)岁,其中<50岁67例(76.1%),≥50岁21例(23.9%);男性54例(61.4%),女性34例(38.6%)。经腹部超声检查、X线检查、血常规检查和生物化学检查,确定无恶性肿瘤。非肿瘤疾病患者组125例,中位年龄(63.8±14.5)(25~94)岁,其中<50岁20例(16%),≥50岁105例(84%);男性59例(47.2%),女性66例(52.8%),经常规查体、血液检查、CT及结肠镜检查确定无恶性肿瘤,但每位患者至少患有一种器质性疾病。参与者均签订知情同意书。
1.2 方法
1.2.1 ELISA测定GROβ 用GROβ ELISA试剂盒(Peprotech,Rocky Hill,NJ,USA)检测血清GROβ含量。将100 μL的抗GROβ抗体与PBS缓冲液混合配成终浓度为0.25 μg/mL,包被96孔微孔板,室温过夜;PBS/0.05%(w/v)Tween-20(PBST,pH 7.4)漂洗微孔板;封闭液室温封闭1 h;每孔加入100 μL血清,室温孵育2 h。同时,用100 μL不含抗体的PBST缓冲液作为阴性对照,用100 μL混合健康血清作为质控品。经过4次PBST漂洗后,加入100 μL兔抗人GROβ抗体(稀释至终浓度0.25 μg/mL),室温孵育2 h;加入亲和素-辣根过氧化物酶-标记的抗抗体(1:2 000),室温孵育30 min。PBST漂洗4次,每微孔加入100 μL ABTS液体,室温放置至颜色充分形成。用650 nm光源对Stat Fax 2100酶标仪(Awareness Technology,Inc.,Palm City,FL,USA)进行波长校正,405 nm光源下测量每个微孔吸光度。每5min观察1次显色情况,持续15min,最终获得可信度更高的标准曲线。零浓度微孔O.D.读数不超过0.2个单位,最高标准浓度O.D.读数不超过1.4个单位。
1.2.2 免疫发光法测定CEA与CA19-9含量 用全自动免疫分析仪(Architect i2000,Abbott Diagnostics Division)测定血清CEA与CA19-9的含量(免疫发光法)[15]。目前CA19-9与CEA推荐的临界值分别为37 U/mL和5 ng/mL。为尽可能减少批内变异,用同一批号试剂在1天内完成实验,分别用两种浓度不同的质控进行质量控制,并使用Westgard规则判断结果可靠性[16]。

表1 结直肠癌患者术前和术后临床参数 n(%)Table 1 Clinical parameters of the patients with colorectal cancer before and after operation n(%)
1.3 统计学分析
GROβ浓度分布特点用Kolmogorov-Smirnov正态性检验进行分析。非参数Mann-Whitney U-试验(分析两组间的差异)与Kruskal-Wallis非参数试验(分析3组及以上的组间差异)确定不同肿瘤临床病理特征患者血清GROβ水平差异。统计分析使用SPSS 16.0软件包(Windows版,Chicago,IL,USA)。用χ2或Fisher确切概率法检验术前血清GROβ、CEA和CA19-9诊断结直肠癌敏感度的差异。P<0.05为有统计学差异。受试者工作特征(receiver operating characteristic,ROC)曲线分析GROβ、CEA和CA19-9的诊断敏感度和特异度。
2 结果
2.1 结肠癌患者与对照组血清GROβ水平
本实验用ELISA法测定402份血清标本(结直肠癌患者组术前标本123例,术后66例标本,健康对照组88例,非肿瘤患者对照组125例)。结直肠癌组患者中,术前患者的血清GROβ浓度(25.56~721.09pg/mL;中位数96.15 pg/mL)显著低于术后浓度(30.35~542.44 pg/mL;中位数167 pg/mL;P<0.01,图1A)。结直肠癌患者术前GROβ浓度显著高于健康对照(浓度29.67~185.01 pg/mL;中位数43.28 pg/mL;P<0.001)及非肿瘤疾病患者组(浓度12.79~246.54 pg/mL;中位数57.30 pg/mL;P<0.01,图1A)。
2.2 不同临床特征的结直肠癌血清GROβ浓度比较
本研究通过比较不同临床特征的结直肠癌患者血清GROβ浓度,评估了血清GROβ浓度与其临床参数相关性。主要临床参数包括TNM分期、淋巴结转移、肿瘤栓塞、肿瘤分化程度、浸润深度、肿瘤类型以及患者性别。不同临床分期结直肠癌患者GROβ浓度的中位数分别为:Ⅰ期:77.45(27.18~110.71)pg/mL;Ⅱ期:118.44(25.56~295.4)pg/mL;Ⅲ期:105.37(40.86~721.09)pg/mL;Ⅳ期:92.81(27.09~266.28)pg/mL。不同TNM分期血清GROβ浓度有统计学差异(P=0.014)。Ⅱ期(P=0.001)与Ⅲ期(P=0.009,图1B)的患者血清GROβ浓度均显著高于Ⅰ期患者GROβ浓度。Ⅲ期与Ⅳ期患者GROβ浓度并无显著性差异(P= 0.715)。另外,GROβ浓度与肿瘤浸润深度显著相关,腹膜浸润患者的血清GROβ浓度(中位数119.78 pg/mL;浓度25.56~330.89 pg/mL)明显高于肌肉层浸润患者(中位数90.15 pg/mL;浓度27.18~266.28 pg/mL;P= 0.015)及结肠周围脂肪浸润患者的浓度(中位数71.66 pg/mL;浓度27.09~721.09 pg/mL,图1C)。然而,高分化肿瘤患者的GROβ浓度(中位数83.66 pg/mL;浓度40.86~319.82 pg/mL)与中度分化肿瘤患者(中位数99.18 pg/mL;浓度25.56~330.89 pg/mL)及低分化肿瘤患者(中位数97.83 pg/mL;浓度27.09~721.09 pg/mL;图1D)之间无显著性差异。血清GROβ浓度与肿瘤栓塞有无(P=0.711,图1E)、淋巴结是否转移(P=0.500,图1F)、肿瘤病理分型(P> 0.05,图1G),以及患者性别(P=0.691,图1H)均无统计学相关。
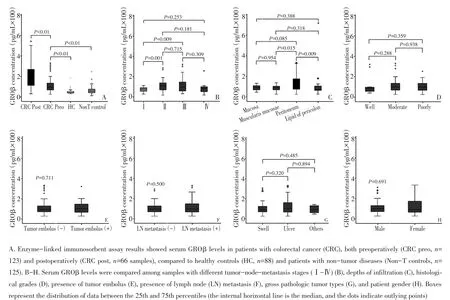
图1 血清GROβ水平与结直肠癌临床病理特征的关系Figure 1 Relationship between GROβ concentration and clinicopathological parameters of colorectal cancer
2.3 GROβ、CEA、CA19-9诊断结直肠癌的敏感度和特异度评价
123例结直肠癌患者术前血清标本检测结果显示,42.3%(52/123)的结直肠癌CEA浓度升高,17.1%(21/123)的结直肠癌CA19-9浓度升高。对照组中,9.4%(20/213)的患者CEA浓度升高,5.2%(11/213)的患者CA19-9升高。CEA诊断Ⅰ期和Ⅱ期结直肠癌的敏感度分别为16.7%(3/18)和46.1%(18/39)。CA19-9诊断Ⅰ期和Ⅱ期结直肠癌的敏感度分别为5.6%(1/18)和12.8%(5/39)。本研究中,213份对照样本的GROβ浓度分布属于非正态分布(P<0.05),无法直接取平均值和标准差确定正常参考范围。因此设定105 pg/mL为临界值,95%的样本都在临界值的范围以内。血清GROβ诊断的敏感度及特异度分别为56.1%(69/123)和95.31%(203/213)。GROβ诊断的敏感度显著高于CEA(P=0.041)和CA19-9(P<0.01)。GROβ诊断Ⅰ期和Ⅱ期结直肠癌的敏感度分别为5.6%(1/18)与41%(16/39)。对于诊断Ⅰ期(P= 0.603)和Ⅱ期(P=0.820)结直肠癌方面,GROβ与CEA之间无显著性差异。但在诊断Ⅱ期结直肠癌方面,GROβ的敏感度显著高于CA19-9(P=0.01)。当将GROβ、CEA和CA19-9三组数据汇集在一个表格并将阳性样本叠加后,诊断Ⅰ期结直肠癌的敏感度为22.2%(4/18),诊断Ⅱ期结直肠癌的敏感度为66.7%(26/39)(表2)。用受试者工作特征曲线比较评估GROβ、CEA和CA19-9判别结直肠癌的能力。GROβ、CEA和CA19-9的曲线下面积分别为0.834、0.739和0.676(图2)。

表2 GROβ、CEA及CA19-9联合诊断Ⅰ期和Ⅱ期结直肠癌Table 2 Combination of GROβ with CEA and CA19-9 for diagnosing stageⅠandⅡcolorectal cancers

图2 受试者工作特征(ROC)曲线分析显示GROβ、CEA和CA19-9的诊断效能Figure 2 Analysis of receiver operating characteristics(ROC)curves in⁃dicated the efficacy of GROβ,CEA,and CA19-9
3 讨论
本研究首次论证了结直肠癌患者血清GROβ浓度显著高于健康人群以及非肿瘤疾病患者。我们还发现血清GROβ浓度与结直肠癌TNM分期和浸润深度两个临床参数有关。表明GROβ在判断结直肠癌发病进程方面有一定的价值。
目前,TNM分期是临床医生用于评估肿瘤负荷及预测预后的主要依据。研究发现Ⅱ期与Ⅲ期结直肠癌患者血清中GROβ水平显著高于Ⅰ期患者(P< 0.01)。一些患者在肠壁穿透后被确诊有腹膜转移,其血清GROβ浓度出现上升趋势,这可能反映了肿瘤细胞增殖与转移能力增强。然而,相比肿瘤位于黏膜层的患者,肿瘤位于黏膜肌层的患者血清GROβ水平并无显著上升。该结果表明肿瘤分期的改变与肿瘤浸润深度相关,但与血清GROβ水平无关。然而,当肿瘤细胞从黏膜肌层渗透入腹膜后,血管新生变为很重要的分子过程。有趣的是,血清GROβ水平在这一阶段发生显著升高,这说明了GROβ在血管发生与血管生成发面发挥重要功能[17]。
肿瘤转移至小肠外的患者血清GROβ水平明显低于肿瘤转移至腹膜的患者。这一结果表明GROβ可能通过刺激免疫细胞与肿瘤细胞之间复杂的相互作用来起始并促进不同阶段的结直肠癌细胞转移。这一过程中相互作用的具体细节有待后续研究。
肿瘤的病理组织分化程度是另一个与肿瘤发展与预后相关的重要指标[18]。然而,本研究显示血清GROβ水平与该参数之间并无显著联系(P>0.05)。研究发现结直肠癌患者手术后的血清GROβ浓度显著高于术前浓度。浓度的增加表明GROβ可能在组织切除后的再生方面发挥重要作用,这一结果也与之前的研究相符[19]。
许多实验报道了GROβ的表达与炎症反应及肿瘤生长过程中血管生成之间的相关性[8,20-21]。然而,多数对GROβ表达的研究仅局限于肿瘤组织与细胞水平,除一篇食管鳞状细胞癌的研究外[13],尚未见关于患者血清GROβ水平的相关研究。本实验中,共分析了123例结直肠癌患者血清GROβ水平并将其诊断能力与两个广泛应用的诊断标记物CA19-9及CEA[22]进行比较。ROC曲线下面积高于0.7,表明该指标有一定的诊断价值[23]。GROβ的ROC曲线下面积为0.834,高于CEA(0.739)和CA19-9(0.676),因此可以认为GROβ作为判断结直肠癌的指标具有一定的意义。尽管本实验样本数量有限,但发现GROβ诊断结直肠癌的敏感度56.1%(69/123)高于CEA 42.3%(52/ 123)和CA19-9 17.1%(21/123)。
Ⅰ期与Ⅱ期结直肠癌患者可以通过肿瘤切除改善预后。联合GROβ、CEA以及CA19-9三项指标,对Ⅰ期结直肠癌诊断准确率从16.7%(3/18)提升至22.2%(4/18),对Ⅱ期结直肠癌诊断准确率从46.1%(18/39)提升至66.7%(26/39)。然而,单独使用GROβ对Ⅰ期与Ⅱ期结直肠癌进行诊断的敏感度略低于CEA。结果表明联合使用GROβ、CEA及CA19-9可以有效提升诊断的敏感度。不足在于该研究中早期结直肠癌患者数量有限。
综上所述,GROβ可能具有原癌基因产物的功能,参与肿瘤的发生、发展与转移过程。由于本研究统计数据有限,需要更多的大样本、多中心的研究对GROβ在诊断方面的敏感度与特异度进行验证,未来GROβ可能成为新的肿瘤标记物与免疫治疗的新靶点。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2] Center MM,Jemal A,Ward E.International trends in colorectal cancer incidence rates[J].Cancer Epidemiol Biomarkers Prev, 2009,18(6):1688-1694.
[3] Sung JJ,Lau JY,Young GP,et al.Asia pacific consensus recom⁃mendations for colorectal cancer screening[J].Gut,2008,57(8): 1166-1176.
[4] Shibutani M,Maeda K,Nagahara H,et al.Significance of cea and ca19-9 combination as a prognostic indicator and for recurrence monitoring in patients with stage ii colorectal cancer[J].Antican⁃ cer Res,2014,34(7):3753-3758.
[5] Hara M,Sato M,Takahashi H,et al.Accuracy of monitoring se⁃rum carcinoembryonic antigen levels in postoperative stage iii colorectal cancer patients is limited to only the first postoperative year[J].Surg Today,2011,41(10):1357-1362.
[6] Duffy MJ,van Dalen A,Haglund C,et al.Tumour markers in colorectal cancer:European group on tumour markers(egtm) guidelines for clinical use[J].Eur J Cancer,2007,43(9):1348-1360.
[7] Lee HJ,Song IC,Yun HJ,et al.Cxc chemokines and chemokine receptors in gastric cancer:From basic findings towards therapeu⁃tic targeting[J].World J Gastroenterol,2014,20(7):1681-1693.
[8]Wang B,Hendricks DT,Wamunyokoli F,et al.A growth-relat⁃ed oncogene/cxc chemokine receptor 2 autocrine loop contributes to cellular proliferation in esophageal cancer[J].Cancer Res,2006, 66(6):3071-3077.
[9] Kavandi L,Collier MA,Nguyen H,et al.Progesterone and cal⁃citriol attenuate inflammatory cytokines cxcl1 and cxcl2 in ovari⁃an and endometrial cancer cells[J].J Cell Biochem,2012,113(10): 3143-3152.
[10]Doll D,Keller L,Maak M,et al.Differential expression of the che⁃mokines gro-2,gro-3,and interleukin-8 in colon cancer and their impact on metastatic disease and survival[J].Int J Colorectal Dis,2010,25(5):573-581.
[11]Oue E,Lee JW,Sakamoto K,et al.Cxcl2 synthesized by oral squamous cell carcinoma is involved in cancer-associated bone destruction[J].Biochem Biophys Res Commun,2012,424(3):456-461.
[12]Gupta V,Yeo G,Kawakubo H,et al.Mullerian-inhibiting sub⁃stance induces gro-beta expression in breast cancer cells through a nuclear factor-kappab-dependent and smad1-dependent mechanism[J].Cancer Res,2007,67(6):2747-2756.
[13]Dong QM,Zhang JQ,Li Q,et al.Clinical significance of serum ex⁃pression of grobeta in esophageal squamous cell carcinoma[J]. World J Gastroenterol,2011,17(21):2658-2662.
[14]Obrocea FL,Sajin M,Marinescu EC,et al.Colorectal cancer and the 7th revision of the TNM staging system:review of changes and suggestions for uniform pathologic reporting[J].Rom J Mor⁃phol Embryol,2011,52(2):537-544.
[15]Erden G,Barazi AO,Tezcan G,et al.Biological variation and ref⁃erence change values of ca 19-9,cea,afp in serum of healthy indi⁃viduals[J].Scand J Clin Lab Invest,2008,68(3):212-218.
[16]Westgard JO,Groth T.Design and evaluation of statistical control procedures:Applications of a computer"Quality control simula⁃tor"Program[J].Clin Chem,1981,27(9):1536-1545.
[17]Verbeke H,Struyf S,Laureys G,et al.The expression and role of cxc chemokines in colorectal cancer[J].Cytokine Growth Factor Rev,2011,22(5-6):345-358.
[18]Derwinger K,Kodeda K,Bexe-Lindskog E,et al.Tumour differ⁃entiation grade is associated with tnm staging and the risk of node metastasis in colorectal cancer[J].Acta Oncol,2010,49(1):57-62.
[19]Ren X,Carpenter A,Hogaboam C,et al.Mitogenic properties of endogenous and pharmacological doses of macrophage inflamma⁃tory protein-2 after 70%hepatectomy in the mouse[J].Am J Pathol,2003,163(2):563-570.
[20]Vandercappellen J,Van Damme J,Struyf S.The role of cxc che⁃mokines and their receptors in cancer[J].Cancer Lett,2008,267 (2):226-244.
[21]Charo IF,Ransohoff RM.The many roles of chemokines and che⁃mokine receptors in inflammation[J].N Engl J Med,2006,354(6): 610-621.
[22]Mitsuyama Y,Shiba H,Haruki K,et al.Carcinoembryonic anti⁃gen and carbohydrate antigen 19-9 are prognostic predictors of colorectal cancer with unresectable liver metastasis[J].Oncol Lett, 2012,3(4):767-771.
[23]Lin JK,Lin CC,Yang SH,et al.Early postoperative cea level is a better prognostic indicator than is preoperative cea level in predict⁃ing prognosis of patients with curable colorectal cancer[J].Int J Colorectal Dis,2011,26(9):1135-1141.
(2015-03-30收稿)
(2015-05-10修回)
(编辑:杨红欣)

郑敏 专业方向为消化系统肿瘤临床诊治和基础研究。
E-mail:18611699225@163.com
2015诺贝尔奖获得者医学峰会暨国际肿瘤研究高峰论坛在津召开
5月9日-10日,“2015诺贝尔奖获得者医学峰会暨国际肿瘤研究高峰论坛”在天津隆重举行。本届大会由中国抗癌协会、哈佛大学医学院麻省总医院肿瘤研究中心、诺贝尔奖得主国际科学交流协会共同主办,天津医科大学肿瘤医院、北京大学肿瘤医院等单位联合承办。大会主题是“肿瘤研究的前沿和方向”。此次大会邀请到Jack W.Szostak、Thomas C.Südhof等5位诺贝尔奖获得者,10位中美两国院士,1500余名国内外专家学者参加。除了大会特邀报告,还设立了胃癌、肺癌与生物治疗、乳腺癌、肿瘤治疗新技术等4个分会场,百余名国内外知名专家做学术报告,与会代表从肿瘤基础研究到临床诊疗技术的发展等各个方面进行讲座与互动讨论,开展了一场高层次、跨学科、前瞻性的国际学术交流活动。
分会场专题讲座是此次大会的重要内容,包括胃癌、肺癌与生物治疗、乳腺癌、肿瘤治疗新技术等四个分会场,涉及肿瘤基础研究、临床、护理及康复等诸多方面。国内外数十位知名专家学者,就相关专业最新的研究成果进行了深入而广泛的交流、沟通,这将促进国内外肿瘤领域学术交流和分支学科的发展。
本次大会的成功举办,对推动世界范围内癌症基础与临床研究的对接、提升世界范围内的癌症诊治水平有着重要意义。作为最大的发展中国家,中国和西方发达国家相比,肿瘤防治面临的形势非常严峻。中国和世界都亟需一场高端、深度的对话,来探讨未来肿瘤防控所面对的共同挑战,本次学术交流活动,为中国提供一个与世界最先进医学技术水平对话的交流平台。
——本刊编辑部
Correlation between serum GROβ expression and clinicopathological characteristics of colorectal cancer
Min ZHENG1,Sijin SUN2,Hongjun GAO3,Zhaoxu ZHENG2,Zhigang YUE3,Yanqiu ZHOU3,Wanning HU1
1Tangshan People's Hospital&Tangshan Cancer Hospital of Hebei United University,Tangshan 063001,China;2Department of Abdominal Surgery,Cancer Institute and Hospital,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100021,China;3Clinical Laboratory,General Hospital of China Coal Industry Ministry,Beijing 100028,China
Wanning HU;E-mail:rmyy_hwn@163.com
Objective:To confirm the potential of growth-related gene product β(GROβ)as a biomarker for colorectal cancer. Methods:Serum GROβ levels in 123 subjects with colorectal cancer,88 healthy controls,and 125 subjects with other diseases were measured using enzyme-linked immunosorbent assay.Serum levels of carcinoembryonic antigen(CEA)and carbohydrate antigen 19-9 (CA19-9)in all subjects were measured using immunoluminometric assay.Statistical analyses were conducted to determine the associations between serum GROβ levels and clinical parameters for colorectal cancer.The receiver operating characteristic(ROC)curves of GROβ,CEA,and CA19-9 were analyzed.Results:The serum GROβ levels were higher in patients with colorectal cancer(median= 96.15 pg/mL)than in the healthy controls(median=43.28 pg/mL,P<0.01)and in patients with other diseases(median=57.30 pg/mL,P< 0.01).The serum GROβ levels in patients with colorectal cancer were positively correlated with the tumor-node-metastasis staging(P< 0.01)and depth of infiltration(P<0.05),but not with the histological grade,tumor embolus,lymph node metastasis,gross pathologic tumor type,or gender of the patients.The sensitivity and specificity of the assay for serum GROβ were 56.1%(69/123)and 95.31%(203/ 213),respectively.The diagnostic sensitivity was 22.2%(4/18)for stage I and 66.7%(26/39)for stage II when the data of GROβ were combined with the data of CEA and CA19-9.The ROC curve constructed with the data of GROβ(0.834)was larger than that constructed with the data of CEA(0.739)or CA19-9(0.676)for discriminating colorectal cancer from the matched controls.Conclusion:These preliminary results indicated that the serum GROβ level could be a useful biomarker for colorectal cancer diagnoses.
GROβ,colorectal cancer,biomarker,CEA,CA19-9
10.3969/j.issn.1000-8179.20150371
①河北联合大学附属唐山市人民医院,唐山市肿瘤医院(河北省唐山市063001);②中国医学科学院北京协和医学院肿瘤医院;③煤炭总医院
胡万宁 rmyy_hwn@163.com
