红檵木腋芽高效快繁研究
2015-12-19张党权郑玉娟龚建平陈丽莉周文化何含杰覃杰明
陈 容,张党权,郑玉娟,龚建平,陈丽莉,周文化,何含杰,覃杰明
(1.中南林业科技大学 a.经济林培育与保护省部共建教育部重点实验室; b.林业生物技术湖南省重点实验室;c.经济林培育与利用湖南省2011协同创新中心,湖南 长沙 410004;2.湖南省澧县树大园林有限公司,湖南 澧县 415513)
红檵木腋芽高效快繁研究
陈 容1a-c,张党权1a-c,郑玉娟1a-c,龚建平2,陈丽莉1a-c,周文化1a-c,何含杰1a-c,覃杰明1a-c
(1.中南林业科技大学 a.经济林培育与保护省部共建教育部重点实验室; b.林业生物技术湖南省重点实验室;c.经济林培育与利用湖南省2011协同创新中心,湖南 长沙 410004;2.湖南省澧县树大园林有限公司,湖南 澧县 415513)
为给红檵木组织培养与工厂化育苗提供技术参考,分别以红檵木2年生茎段和当年生茎段为外植体,通过优化红檵木腋芽的丛生芽诱导与增殖、生根与移栽方案,最终建立了以腋芽为基础的红檵木高效快繁体系。结果表明:红檵木茎段腋芽丛生芽诱导与增殖的最佳培养基配方分别为MS+6-BA 1.3mg/L+NAA 0.2mg/L和MS+6-BA 1.2mg/L+IBA 0.07mg/L+Vc 5.0mg/L;丛生芽生根的最佳培养方案为:选取高度在1.0~3.0cm之间的植株,将其接种到3/4MS+IBA 4mg/L 的培养基当中;生根组培苗的最佳移栽方案为:炼苗1周后,将其移栽到珍珠岩∶蛭石∶腐殖土=1∶1∶3的基质中。
红檵木;腋芽;丛生芽;高效快繁
红檵木又称红花檵木Loropetalum chinensevar.rubrum,为金缕梅科檵木属植物。红檵木最初是从湖南省浏阳市大围山引种而来的野生植株,并被鉴定为檵木的变种[1],发展至今已有近百年的栽培历史。红檵木具有生态适应能力强、颜色艳丽、花期长、耐修剪、易造型等优点,且具有很高的观赏价值。开展红檵木组织培养的研究,特别是红檵木再生技术、快繁技术的研究,有助于红檵木的工厂化育苗与转基因应用。为给红檵木组培工厂化育苗与转基因研究提供技术参考,本项目组已建立红檵木愈伤组织高效再生体系[2],同时开展以红檵木茎段为外植体,对其腋芽的丛生芽诱导、增殖、生根及生根丛生芽的移栽方案进行优化,以建立高效的红檵木快繁体系。
1 材料与方法
1.1 外植体的表面灭菌
采取含有多个腋芽的红檵木短枝条,去除叶片,洗净后进行表面消毒处理。由于红檵木茎段的木质化程度不同,其表面携带的微生物量也有较大的差异,故表面消毒时间的长短也大不相同。分别选取当年生和2年生的红檵木茎段作为外植体,先用75%的酒精处理45 s,再分别用适量的0.1%和0.2%的升汞进行2次消毒处理,消毒处理方式与处理结果见表1。消毒完毕后,将外植体用0.1 mol/L的氯化钙溶液浸泡处理1 min。
1.2 腋芽诱导丛生芽
以MS为基本培养基,设计了9组分别含有不同浓度6-BA和NAA植物激素的腋芽诱导丛生芽培养基(见表2)。将表面消毒后的红檵木枝条切成长为1.5cm、带有1~2个腋芽的茎段,接种至腋芽诱导丛生芽培养基中,每组接种50个茎段,于光照培养室中培养,培养温度为(25±1)℃,光照强度为2 000 lx,光照时间为12 h/d,一个月后统计各试验组的出芽情况。
1.3 丛生芽的增殖培养
以MS为基本培养基,设计25组分别含有不同浓度6-BA和IBA植物激素的丛生芽增殖培养基(见表3)。将新长出的腋芽切下,转入丛生芽增殖培养基中进行增殖培养,培养温度为(25±1)℃,光照强度为2 000 lx,光照时间为12 h/d,观察并记录丛生芽的生长情况。
1.4 丛生芽的壮苗培养
丛生芽在增殖培养过程中其茎秆往往较细,不利于生根移栽,因此需要将丛生芽转入不含激素的MS培养基中进行壮苗培养。培养温度为(25±1)℃,光照强度为2 000 lx,光照时间为12 h/d,待植株长到一定高度后再进行生根诱导培养。
1.5 丛生芽的生根诱导
将在壮苗培养基中生长良好的红檵木小苗转入生根培养基中,设计10组以1/2MS和3/4MS为基本培养基、含有不同浓度IBA的生根培养基(见表4)。先在黑暗条件下培养3 d,然后转入光照条件下培养,培养温度为(25±1)℃,光照强度为2 000 lx,光照时间为12 h/d。接种30 d后,统计各生根植株的株高、根数、最长根长及最短根长。
1.6 组培苗的移栽
将含有生根植株的培养瓶转入室外,旋松瓶口使其逐渐适应外界的温度和光照,一周之后取出红檵木小苗,先放入含有0.1%的多菌灵稀释液中进行消毒处理,用清水清洗后再转入苗盘中,苗盘中铺满经高温灭菌冷却后的基质,该基质的成分为腐殖土∶蛭石∶珍珠岩=3∶1∶1。接种完后用透明塑料薄膜盖住苗盘,并定期给红檵木小苗喷施叶面肥,30 d后统计其存活率。
2 结果与分析
2.1 红檵木腋芽的高效表面灭菌
外植体接种培养15 d后,分别对不同处理的茎段进行观察,并统计相应的污染率、褐化率及存活率,结果见表1。表1表明,选用当年生茎段作为外植体的消毒效果比2年生茎段的消毒效果要好。经2次HgCl2消毒处理后,以0.1% HgCl2处理后的污染率比0.2% HgCl2的高,但其褐化率却比0.2% HgCl2的低,并且消毒时间过长或过短都不能达到有效控制污染率和褐化率的效果。因此,红檵木外植体的高效表面消毒处理方案为:采用当年生的幼嫩茎段,以75%的酒精漂洗外植体45 s,然后以0.1%的 HgCl2消毒2次,每次消毒处理3 min。
2.2 红檵木丛生芽的高效诱导
将消毒后的红檵木幼嫩茎段转入丛生芽诱导培养基中,光照培养1周后开始出芽,其状态如图1A所示,一个月后统计各个不同激素组合处理的出芽情况,结果如表2。由表2可知,红檵木丛生芽的诱导率最高可达86%,因此,最高效的丛生芽诱导培养基为:MS+6-BA 1.3mg/L+ NAA 0.2mg/L。
2.3 红檵木丛生芽的高效增殖
将诱导出的丛生芽转入增殖培养基中,定期观察并记录丛生芽的出芽天数、增殖系数和产生愈伤组织的情况,结果分别如图1B和表3所示。分析结果表明,较高的6-BA浓度能够促进丛生芽的产生,丛生芽的最短出芽时间为14 d,而高浓度的 6-BA和IBA相互作用的结果是能极大提高丛生芽的增殖系数,其增殖系数最高可达15.00;同时,当丛生芽增殖情况较好时其产生的愈伤组织相对较少,当丛生芽增殖较慢或较少时则愈伤组织会大量产生。因此,红檵木丛生芽的高效增殖培养基为:MS+6-BA 1.2mg/L+IBA 0.07mg/L+Vc 5.0mg/L。
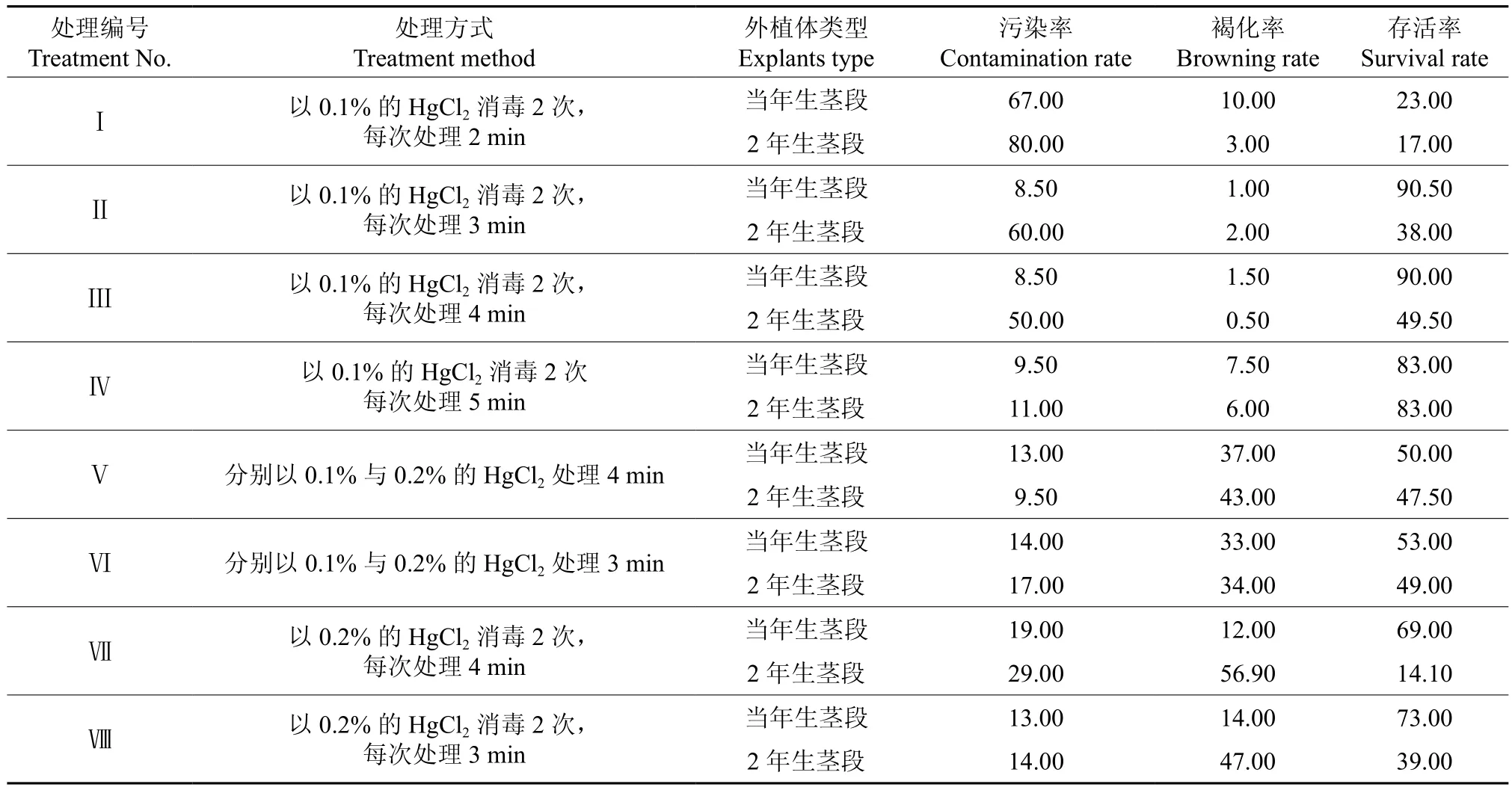
表1 红檵木外植体表面消毒处理方式与处理结果Table 1 Method and result of surface disinfection of explants in L. chinense var. rubrum %

表2 不同激素组合的培养基对红檵木丛生芽的诱导情况Table 2 Induction status of multiple shoots in L. chinense var. rubrum under different hormone combinations
2.4 红檵木丛生芽的高效生根
将丛生芽接种至生根培养基中进行生根诱导,对接种时及生根诱导一个月后丛生芽生根植株的株高进行统计,结果分别见表4和表5。根据对生根植株的数量、根数、最短根长和最长根长等指标的统计数据,得到最佳生根激素配比方案(表6),并了解到生根诱导过程中植株的生长变化情况和生根数量与平均最长根长和最短根长之间的关系(表7)。
由表4可知,丛生芽的高度在1.0~3.0cm之间时其更容易生根,此类丛生芽占其总数的80.07%;而高于不能生根的株高为4.0cm的丛生芽所占百分比。低浓度的IBA更能促进株高为0.0~2.0cm的植株生根;而当IBA的浓度大于3mg/L时,2.0cm以上植株的生根率更高。同时,在相同的激素浓度下,3/4MS的培养基更能促进3~4cm高的植株生根。
由表4可知,在生根诱导30天后,植株高度仍然集中在1.0~3.0cm之间,此类植株占其总数的73%;但是,0.0~1.0cm高的植株所占百分比却减少了,4.0cm以上的植株仅占其总数的6%,而株高为3.0~4.0cm的植株所占百分比也增加了5%。这一结果充分说明,丛生芽在生根的过程中伴有植株长高的现象。
由表6可知,高浓度IBA的生根率高,低浓度IBA的生根率低,当IBA浓度达到4mg/L时,生根率最高可达82%;而1/2MS 和3/4MS对红檵木丛生芽生根率的影响都不大。
由表7可知,根数与根长之间存在密切的联系。当根数为偶数时,最长根长均值均大于1cm;当根数达到10条以上时,其最长根长均值最大。而根数对最短根长均值的影响情况如下:当根数在10条以下时,最短根长均值的变化不大,在0.27cm上下浮动;而当根数达到10条时,最短根长均值达到0.5cm,但是,当根数超过10条时,最短根长均值又开始变小,回到0.21cm。
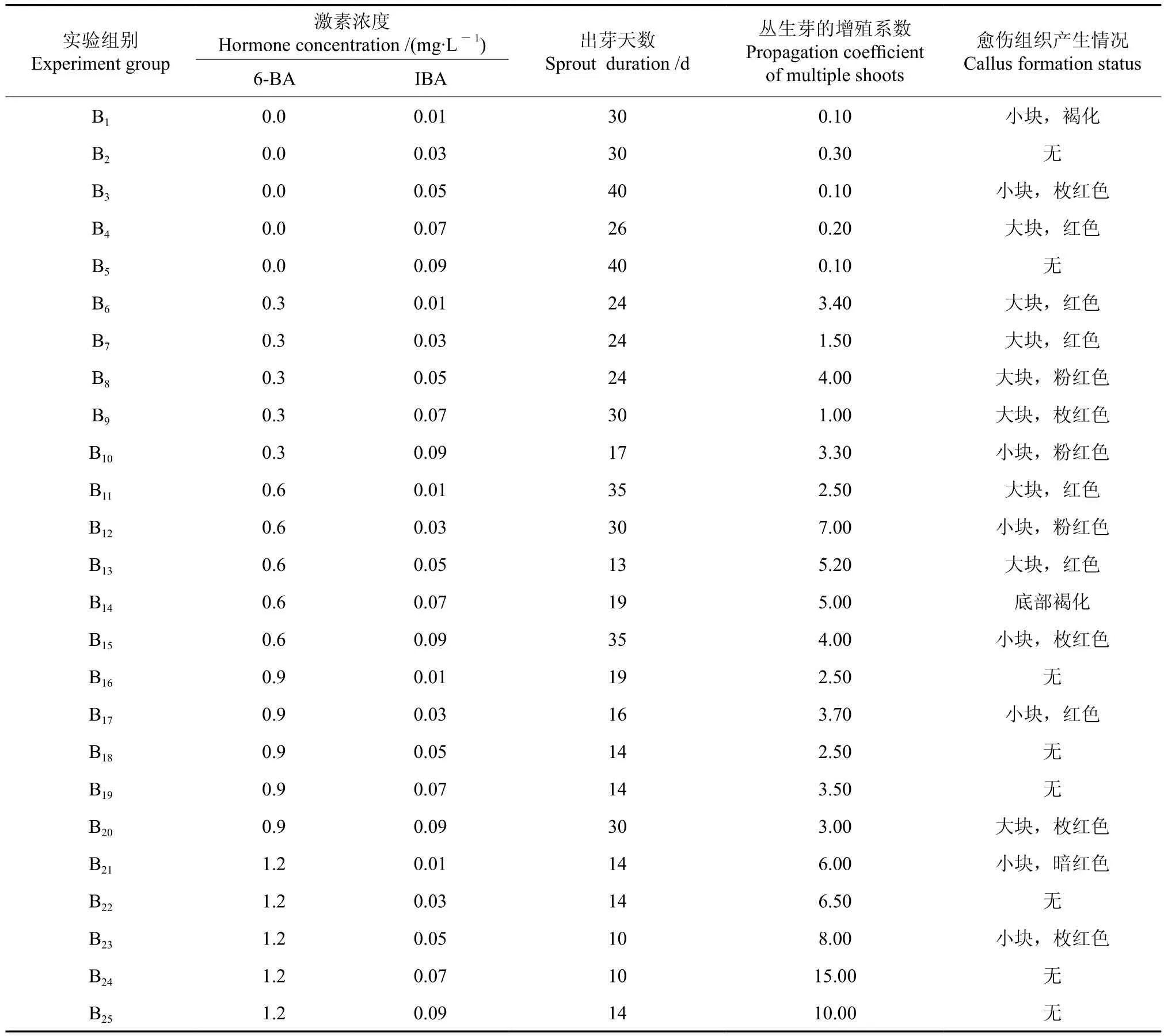
表3 红檵木丛生芽的高效增殖情况Table 3 High-efficient multiplication status of multiple shoots in L. chinense var. rubrum
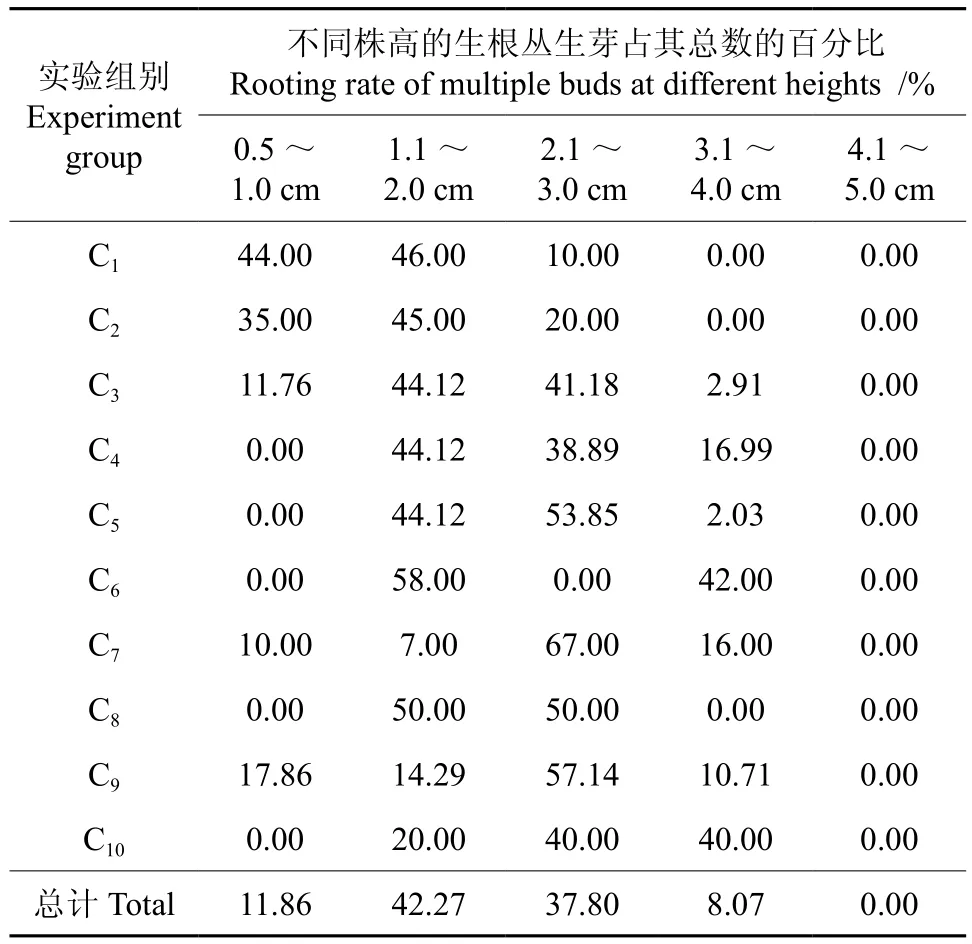
表4 刚接种时不同株高的生根丛生芽占其总数的百分比Table 4 Rooting rate of multiple buds at different heights after inoculated

表5 接种30 d后不同株高的生根丛生芽占其总数的百分比Table 5 Rooting rate of multiple buds at different heights after inoculated 30 days
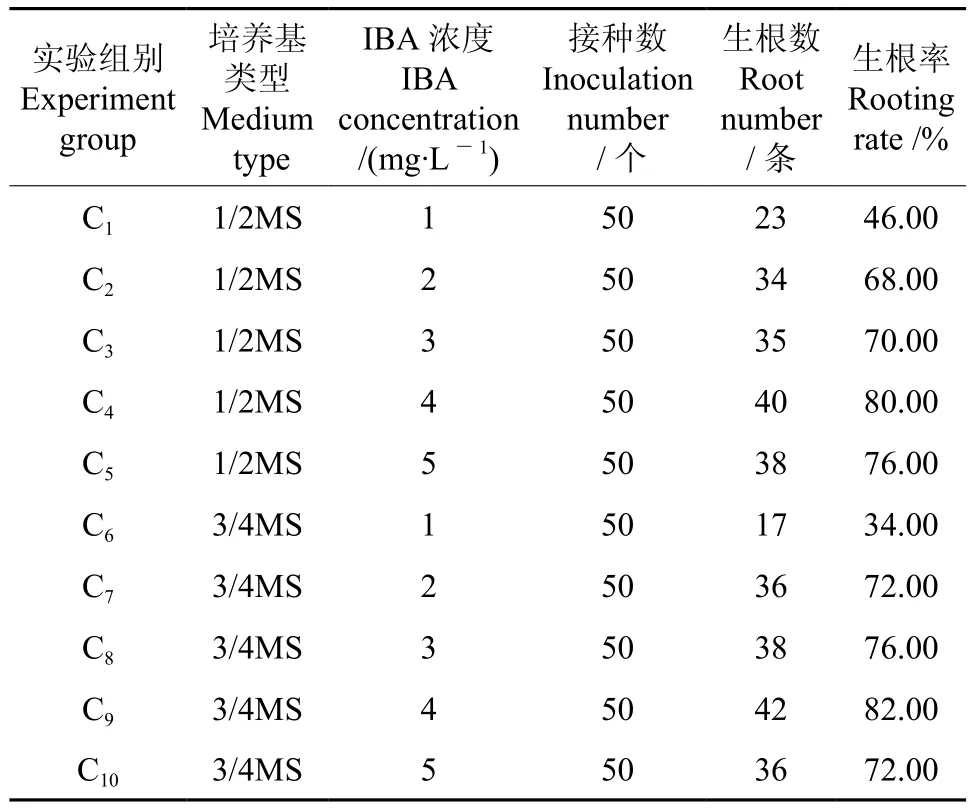
表6 红檵木丛生芽在不同激素和培养基组合下的生根率Table 6 Rooting rate of multiple buds in L. chinense var. rubrum under different hormone and medium combinations
综上所述,红檵木丛生芽的高效生根培养方案为:选取高度在1.0~3.0cm之间的植株,将其接种到3/4MS+IBA 4mg/L 的培养基当中。
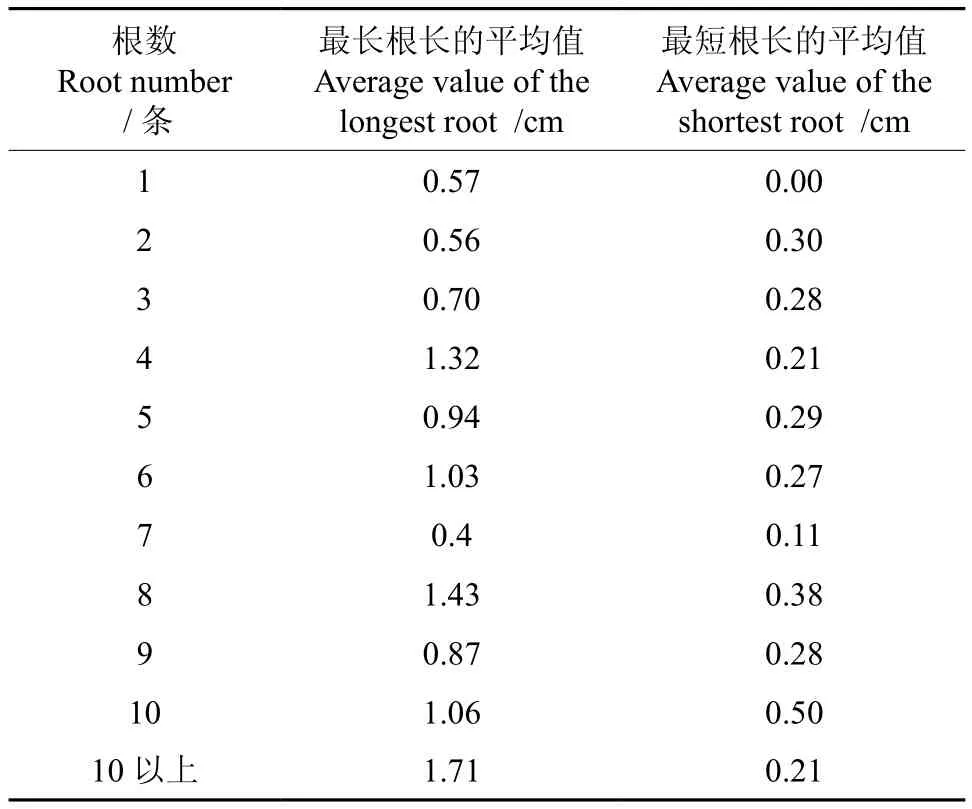
表7 红檵木生根不定芽的根数与根长的关系Table 7 Relationship of root number and root length of rooting adventitious buds in L. chinense var.rubrum
2.5 红檵木组培苗的高效移栽
对生长状况良好的生根丛生芽进行炼苗,并将其移栽到珍珠岩∶蛭石∶腐殖土= 1∶1∶3的基质中,一个月后仍能够很好地生长,其生长状态如图1D所示,其存活率达到80%以上。
3 结论与讨论
3.1 影响腋芽诱导丛生芽的因素分析

图1 高效快繁红檵木的生长状态Fig. 1 Growth status of L. chinense var. rubrum in the high-ef fi cient and rapid propagation system
影响腋芽诱导丛生芽的因素主要来源于腋芽的活性和外源激素的类型及浓度的大小。在外植体的选取过程中,2年生茎段的木质化程度比当年生茎段的木质化程度要大,表面消毒困难,诱导产生丛生芽所需时间更长;而当年生茎段对升汞更加敏感,消毒时间短而且腋芽启动时间较短。此外,外植体的取材时间和所选茎段的部位对腋芽的萌动也有较大的影响[3-4]。实验中发现,初春时采取的外植体更容易出芽,出芽时间最短的只需3 d就能长出新芽,而在其他时间采取的外植体其萌发时间都在1周以上。将来源于同一枝条的茎尖和茎段同时接种到同一组培瓶中,茎段更容易长出丛生芽。这一结果与吴向明[5]研究的结果相似。能促进腋芽产生丛生芽的外源激素主要是6-BA[6], 6-BA和NAA的协同作用[7]也能促进腋芽产生丛生芽。实验中还发现,在一定浓度范围内,6-BA对腋芽的促进作用不大,但其与低浓度NAA的相互作用却能使丛生芽的诱导率有较大的波动。因此,最高效的丛生芽诱导培养基可选为:MS+6-BA 1.3mg/L+NAA 0.2mg/L。
3.2 影响丛生芽增殖的因素分析
丛生芽的增殖主要受外源激素种类和浓度的控制,6-BA能够促进不定芽的形成和增殖,但是高浓度的6-BA会使器官的稳定分化能力下降[8],并且6-BA长时间对植物外植体的作用也会促进酚类化合物的合成,刺激多酚氧化酶的活性,从而导致愈伤组织易发生褐变而死亡。因此,寻找到合适的6-BA的浓度及适当添加Vc[9]、PVP[10]等抗氧化剂能有效改善这些情况。同时,由于6-BA与IBA的协同作用效果明显优于6-BA 与NAA的协同作用效果[11],因此,在红檵木丛生芽的增殖培养实验中,选用了低浓度的IBA与6-BA,设计了25个激素组合,最终得到的红檵木丛生芽高效增殖的培养基为:MS+6-BA 1.2mg/L+IBA 0.07mg/L+Vc 5.0mg/L。
3.3 影响丛生芽生根的因素分析
影响丛生芽生根的因素,除了培养基的类型和外源激素的种类及浓度外,还有丛生芽的株高和丛生芽增殖培养的时间。实验结果证明,IBA的浓度对生根有很大影响[12],高浓度IBA的生根率高,而低浓度IBA的生根率低。当培养基为3/4MS 、IBA浓度达到4mg/L时,生根率最高可达82%。同时,在接种时选择高度在1.0~3.0cm之间的丛生芽,其更容易生根,因此,增殖培养的时间不能过长。增殖培养的时间越长植株越高,木质化程度越高,就越不容易生根,进而影响生根的数量和根的活性。
3.4 影响组培苗移栽成活率的因素分析
由于丛生芽是长时间生长在无菌和恒温的环境中的,将其突然转入自然环境中生长便很难存活,所以炼苗阶段显得尤为重要。炼苗时逐步旋松瓶口,让丛生芽逐渐适应外界的空气和温度,移栽后成活率会大幅提高。同时,生长基质的成分和配比对根的生长也有重要影响,实验结果证明,蛭石∶珍珠岩∶腐殖土= 1∶1∶3的基质很适合丛生芽根的进一步生长。除此之外,生根诱导培养时间的长短和移栽后期的水肥管理对移栽成活率也会有较大的影响。实验中发现,生根诱导培养超过2个月后,丛生芽的根尖开始逐步变黑直到整个根部褐化失去活性,这样的丛生芽移栽后其成活率极低。而不定芽在移栽后仍然十分脆弱,其叶片容易失水,若不能及时补充水肥,也很难保证移栽苗的成活率。因此,炼苗处理、基质的成分、丛生芽生根诱导培养时间的长短及后期的水肥管理都是影响组培苗成活率的关键因素。
[1]侯伯鑫,程政红,林 峰,等.湖南古树名木资源及保护现状[J].中国城市林业,2005,(3):72-74.
[2]陈 容,郑玉娟,张党权,等. 红檵木高效再生体系的建立[J].中南林业科技大学学报,2015,35(4):40-45.
[3]毕方铖,谭晓风,张智俊,等.油茶离体培养诱导再生植株的研究[J].经济林研究,2004,22(2):5-9.
[4]孙小兵,郭素娟.成龄板栗组培快繁体系的建立及影响因素的研究[J].中南林业科技大学学报,2015,35(4):51-55.
[5]吴向明,章志红.红花檵木组织培养[J].中国新技术新产品,2009, 36(2):41 - 43.
[6]刘叶蔓,向云亚,谢果珍.杜仲带腋芽茎段组织培养的研究[J].中南药学,2011,9(2):110-113.
[7]Ebida AI, Hu CY. In vitro morphogenetic responses and plant regeneration from pepper (Capsicum annuumL cv Early California Wonder) seedling explants[J].Plant Cell Rep, 1993,13(2): 107 - 110.
[8]曹 昆,李 霞.木本植物组织培养不定芽诱导研究进展[J].江苏林业科技,2008,35(5):43-48.
[9]林丽媛,韩小娇,陈益存, 等.山鸡椒的愈伤组织诱导及植株再生[J].植物生理学报,2013,49(10):1047-1052.
[10]张日清,刘海龙,汪灵丹,等.榉树组培芽继代增殖的影响因素[J].经济林研究,2013,31(3):54-58.
[11] 胡能兵,张子学,崔广荣, 等.6-BA与IBA及NAA的不同组配对彩色辣椒子叶不定芽分化的影响[J].安徽农学通报,2006,12(5):216.
[12]王晓明.灰毡毛忍冬新品种ISSR分子标记及组织培养的研究[D].长沙:中南林业科技大学,2012:61-62.
High-ef fi cient and fast propagation of axillary buds inLoropetalum chinensevar.rubrum
CHEN Rong1a-c, ZHANG Dang-quan1a-c, ZHENG Yu-juan1a-c, GONG Jian-ping2, CHEN Li-li1a-c, ZHOU Wen-hua1a-c,HE Han-jie1a-c, QIN Jie-ming1a-c
(1.a. Key Laboratory of Cultivation and Protection for Non-Wood Forest Trees, Ministry of Education; b. Hunan Provincial Key Laboratory of Forestry Biotechnology; c. Cooperative Innovation Center of Cultivation and Utilization for Non-Wood Forest Trees of Hunan Province, Central South University of Forestry & Technology, Changsha 410004, Hunan, China;2. Hunan Lixian Shuda Garden Co. Ltd., Lixian 415513, Hunan, China)
In order to provide a technical reference for tissue culture and factory seedling ofLoropetalum chinensevar.rubrum, using biennial and annual stems as explants, the high-ef fi cient and fast propagation system ofL. chinensevar.rubrumwas established, through optimizing the protocol of induction, multiplication, rooting and transplanting of multiple shoots of axillary bud inL. chinensevar.rubrum.The results showed that the optimal mediums for multiple shoots induction and multiplication were MS+6-BA 1.3mg/L+NAA 0.2mg/L and MS+6-BA 1.2mg/L+IBA 0.07mg/L+Vc 5.0mg/L, respectively. The optimal program for rooting of multiple shoots was choosing the buds at 1.0-3.0cm height and inoculating to the medium of 3/4 MS+IBA 4mg/L. And the optimal program for transplanting of rooting tissue culture seedling was domesticating the buds for a week and then transplanting them into a kind of matrix with perlite, vermiculite and humus soil (1∶1∶3).
Loropetalum chinensevar.rubrum; axillary buds; multiple shoots; high-ef fi cient and fast propagation
S687
A
1003—8981(2015)04—0096—06
10.14067/j.cnki.1003-8981.2015.04.017
2014-10-31
国家林业公益性行业科研专项(201204610);湖南省科技计划重点项目(2014FJ2004)。
陈 容,硕士研究生。
张党权,教授,博士,博士研究生导师。E-mail:zhangdangquan@163.com
陈 容,张党权,郑玉娟,等.红檵木腋芽高效快繁研究[J].经济林研究,2015,33(4):96-101.
[本文编校:伍敏涛]
